垂体后叶注射液中升压素效价测定的不确定度评定
谢 鹏 宁 玲 田 婧 张 赞 吴超权 黄 宪 林 昊
垂体后叶注射液中升压素效价测定的不确定度评定
谢 鹏 宁 玲 田 婧 张 赞 吴超权 黄 宪 林 昊
(广西壮族自治区食品药品检验所,广西 南宁 530012)
目的:建立垂体后叶注射液中升压素效价测定的不确定度评定的方法。方法:建立评定垂体后叶注射液中升压素效价测定的模型,分析其测定不确定度的影响因素,并对各分量进行量化分析,计算扩展不确定度。结果:垂体后叶注射液中升压素效价的影响值排序为:微量注射器药液注射过程>供试品溶液的配制>标准品溶液的配制>血压反应的测定过程>环境温度>标准品的纯度。垂体后叶注射液中升压素效价的扩展不确定度为0.2414 IU/mL,其效价可表示为(5.7822±0.2414)IU/mL,为标示量的(96.37±4.02)%。结论:该方法适用于垂体后叶注射液中升压素效价测定的不确定度评定,为优化实验过程,提高实验结果的可靠性提供参考。
垂体后叶注射液;升压素;效价;不确定度
引言
垂体后叶注射液主要成分是升压素和缩宫素,可收缩动脉和静脉血管而发挥止血作用,其主要用于肺、支气管出血(如咯血)、消化道出血(呕血、便血),并适用于产科催产及产后收缩子宫、止血等,对于腹腔手术后肠道麻痹亦有功效,尚对尿崩症有减少排尿量之作用[1,2]。垂体后叶注射液收载于《中华人民共和国药典》2020年版第二部,其效价的评估采用生物效价测定法对升压素和缩宫素的效价进行测定,标准规定以升压素计,其效价应为标示量的87%~115%,且每1 mg蛋白中升压素效价不得少于4.0单位;且缩宫素与升压素的效价比值应为0.9~1.7[3]。其中升压素的效价测定采用大鼠进行试验,该方法属于经典的生物测定方法,由于生物测定的干扰因素校多、影响较大,所测结果的真实性存在一定的争议,特别是当检验结果处于标准规定边缘时就很难准确判定其是否符合标准的要求。不确定度含义是指由于测量误差的存在,对被测量值的不能肯定的程度,即表明该结果的可信赖程度,不确定度愈小,所述结果与被测量的真值愈接近,质量越高,水平越高,其使用价值越高;不确定度越大,测量结果的质量越低,水平越低,其使用价值也越低。不确定度评定是通过对实验过程各个环节引入的不确定度进行评估,以分析各因素对测定结果的影响。用对观测列进行统计分析的方法来评定标准不确定度,称为不确定度A类评定;用不同于对观测列进行统计分析的方法来评定标准不确定度,称为不确定度B类评定;B类评定方法应用相当广泛。测量不确定度对于提高检测数据的可靠性、准确判断测量结果临界值、确认适合的方法以及实验室质量和风险控制等方面均具有重要意义。特别是当检验检测的结果处于标准规定的边缘值时,引入不确定度参数对评定分析方法的可靠性和测量结果的准确性就更加重要[4,5]。本研究参考GB/T 27418-2017和JJF 1059-1999《测量不确定度评定和表示》、CNAS-CL07:2011《测量不确定度的要求》和相关的文献[6,7],对垂体后叶注射液中升压素效价测定的不确定度进行量化评价,建立了垂体后叶注射液中升压素效价测定的不确定度的评定方法,以优化实验过程,提高实验结果的可信程度。
1 仪器与试药
1.1 仪器
Biopac16通道生理记录仪(普升科技有限公司);CPA223S电子天平(德国赛多利斯sartorius公司);VORTEX周围振荡器(德国艾卡IKA公司)。
1.2 试药
赖氨酸升压素标准品(中国食品药品检定研究院,批号150525-201301,4 IU/支);垂体后叶注射液(安徽宏业药业有限公司,批号200977,规格:1 mL∶6IU),甲磺酸酚妥拉明注射液(上海旭东海普药业有限公司,批号D190308);氯化钠注射液(回音必集团江西东亚制药有限公司,批号2019102115);肝素钠注射液(江苏万邦生化医药集团有限责任公司,批号51901108)。
2 方法与结果
2.1 升压素效价测定
2.1.1 标准品储备液的制备
取赖氨酸升压素标准品2支,精密加入氯化钠注射液8.00 mL使其溶解混匀,即得浓度为1.0 IU/mL的溶液,作为标准品储备液。
2.1.2 标准品供试液的制备
分别取标准品储备液0.8 mL、0.5 mL至5 mL容量瓶中,用氯化钠注射液稀释定容至刻度,即得浓度为0.16 IU/mL、0.10 IU/mL的溶液,作为标准品的高(s2)浓度稀释液和低(s1)浓度稀释液。
2.1.3 供试品储备液的制备
精密量取垂体后叶注射液(标示量为6 IU/mL)0.833 mL至5 mL容量瓶中,用氯化钠注射液稀释定容至刻度,即得1.0 IU/mL的溶液,作为供试品储备液。
2.1.4 供试品供试液的制备
分别取标准品储备液0.8 mL、0.5 mL至5 mL容量瓶中,用氯化钠注射液稀释定容至刻度,即得浓度为0.16 IU/mL、0.10 IU/mL的溶液,作为标准品的高(t2)浓度稀释液、低(t1)浓度稀释液。
2.1.5 样品效价测定
按照2020版《中华人民共和国药典》中的升压素生物测定法来测定垂体后叶注射液中升压素的效价。取健康、无伤、合格、体重在300 g以上的成年雄性SD大鼠,腹腔注射乌拉坦1 g/kg进行麻醉后,固定于保温手术台上,分离气管,必要时气管插管,以保证呼吸的通畅性。在一侧股静脉插入静脉插管,供注射药液用,按体重每100 g注入肝素溶液50 IU。然后剥离一侧颈动脉,插入与血压换能器相连的动脉插管,在血压换能器与插管通路中充满氯化钠注射液,并于动脉插管中注入适量的肝素抗凝,全部手术完成后,将血压换能器与调节到适当的高度,打开动脉夹,开启多道生理信号采集处理系统,记录血压。从股静脉插管中缓缓注入交感神经阻断药甲磺酸酚妥拉明溶液0.1 mg/100 g体重,每次注射甲磺酸酚妥拉明后立即注入适量氯化钠注射液将药液冲入,隔5 min~10 min后待血压恢复至极限,用同样的剂量再注射一次,共注射2次。待血压稳定后即可进行药液注射,每次药液的注射速度基本相同,每次药液的注射体积为0.1 mL,并于每次注射后立即注入适量氯化钠注射液。在前一次注射的反应基本稳定以后进行下一次注射,相邻两次注射的间隔时间为15 min。标准品稀释液和供试品稀释液各取高低两个剂量(S1,S2,T1,T2)为一组,按随机区组设计的次序轮流注入每组四个剂量,重复4组。第一组注射顺序为:S1,S2,T1,T2, 第二组注射顺序为:S2,T1,T2,S1, 第三组注射顺序为:T1,T2,S1,S2,第四组注射顺序为:T2,S1,S2,T1, 测量给药后的收缩压与给药前的收缩压差值作为反应值,照生物检定统计法(《中国药典》2020年版四部通则1431)中的量反应平行线测定法计算效价及实验误差。实验中,高低剂量的比值不得大于1∶0.6,且剂量要求为低剂量能引起血压升高,高剂量不致使血压升高达到极限值。标准规定本品效价应为标示量的87%~115%,本法的可信限率(FL%)不得大于20%,且直线回归、剂间有非常显著性差异,偏离平行不显著,可靠性检查即通过,测得的效价结果才可成立。
2.1.6 可靠性检验与效价计算
本实验采用《中国药典》生物检定统计程序BS2000量反应平行线2.2法按随机区组设计计算效价和实验误差。大鼠血压反应值结果见表1,可靠性检测结果见表2。
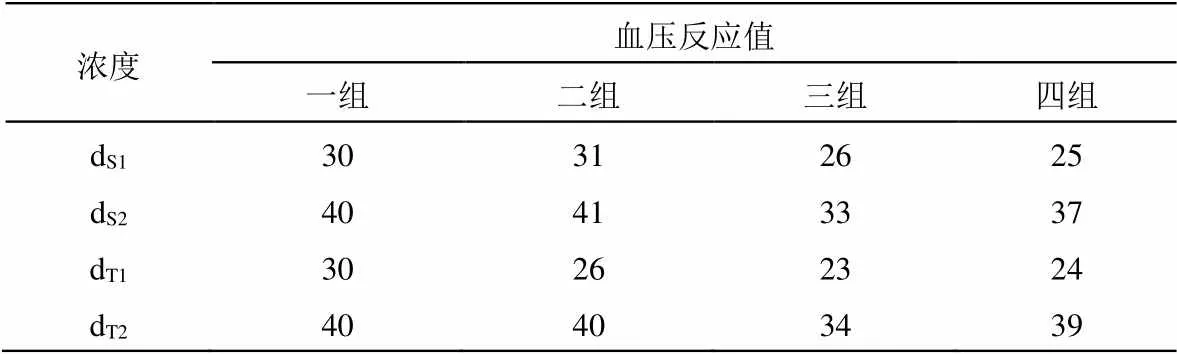
表1 大鼠血压反应值测定结果(mmHg)
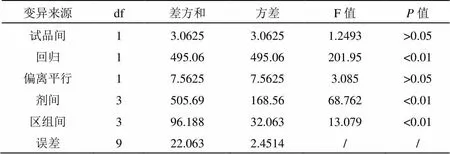
表2 可靠性检测结果
由表2可知,该实验剂间及回归显著(<0.01),偏离平行不显著(>0.05),可靠性检验通过,效价结果成立。垂体后叶注射液中升压素的标示效价为6 IU/mL,本试验中采用的剂间比为0.625,根据量反应平行线2.2法计算得效价PT=5.7822 IU/mL,测得效价的可信限率为FL=7.6023%。则垂体后叶注射液中升压素效价与标示量的比值=5.7822/6×100%=96.37%,属于标准规定的87%~115%的范围,该样品符合标准规定。
2.2 测量不确定度评定
2.2.1 不确定度的来源及其分析
根据量反应平行线测定随机区组设计2.2法的计算公式得测量数学模型如下:
PT=AT×s2/T2×antilg(IV/W)
V=1/2×(T1+T2-S1-S2)
W=1/2×(T2-T1+S1-S1)
式中,AT为估计效价,s2为标准品稀释液高浓度,为供试品稀释液高浓度,I为剂间比的对数值,T1为四组低浓度供试品稀释液引起的血压反应值总和,T2为四组高浓度供试品稀释液引起的血压反应值总和,S1为四组低浓度标准品稀释液引起的血压反应值总和,S1为四组高浓度标准品稀释液引起的血压反应值总和。
由计算公式及具体试验过程可得出,升压素效价测定过程中引入的不确定度与多方面的因素有关,包括标准品的纯度,配制标准品溶液及供试品溶液所用的移液器、定容器具,药液注射过程,血压反应值的测定过程等。
2.2.2 升压素效价测定过程中各分量不确定度评定
(1)标准品纯度引入的相对标准不确定度U(S)。
赖氨酸升压素标准品由中国食品药品检定研究院提供,其纯度为99.50%,按矩形分布计算,即k=√3,则U(S)=5×10-4/√3=0.0002887。
(2)标准品溶液配制引入的相对标准不确定度U(s)。
10 mL和1 mL移液器的容量允许误差分别为±0.060 mL和±0.010 mL[8],5 mL容量瓶的容量允许误差为±0.020 mL[9],按三角分布计算,即k=√6。
标准品储备液制备过程:使用10 mL移液器精密加入氯化钠注射液8.00 mL,其引入的相对标准不确定度为0.060/(8.0×√6)=0.003062;
ds2制备过程:使用1 mL移液器量取标准品储备液0.8 mL,其引入的相对标准不确定度为0.010/(0.8×√6)=0.005103;加入5 mL容量瓶定容,其引入的相对标准不确定度为0.020/(5.0×√6)=0.001633;s2制备过程中的合成不确定度=√(使用1 mL移液器量引入的不确定度2+使用5 mL容量瓶引入的不确定度)=√(0.0051032+0.0016332)=0.005358。
s1制备过程:使用1 mL移液器量取标准品储备液0.5 mL,其引入的相对标准不确定度为0.010/(0.5×√6)=0.008165;加入5 mL容量瓶定容,其引入的相对标准不确定度为0.020/(5.0×√6)=0.001633;s1制备过程中的合成不确定度=(使用1 ml移液器量引入的不确定度2+使用5 mL容量瓶引入的不确定度)=√(0.0081652+0.0016332)=0.008327。
则标准品溶液配制引入的合成不确定度U(s)=√(标准品储备液制备过程的相对标准不确定度2+s2制备过程中的合成不确定度2+s1制备过程中的合成不确定度2)=√(0.0030622+0.0053582+0.0083272)=0.01036。
(3)供试品溶液配制引入的相对标准不确定度U(t)。
1 mL移液器的容量允许误差为±0.010 mL,5 mL容量瓶的容量允许误差为±0.020 mL,按三角分布计算,即k=√6。
供试品储备液制备过程:使用1 mL移液器精密量取垂体后叶注射液(标示量为6 IU/mL)0.833 mL,其引入的相对标准不确定度为0.010/(0.833×√6)=0.004901;加入5 mL容量瓶定容,其引入的相对标准不确定度为0.020/(5.0×√6)=0.001633;供试品储备液制备过程合成不确定度=√(使用1 mL移液器量引入的不确定度2+使用5 mL容量瓶引入的不确定度2)=√(0.0049012+0.0016332)=0.005166。
t2制备过程:使用1 mL移液器量取标准品储备液0.8 mL,其引入的相对标准不确定度为0.010/(0.8×√6)=0.005103;加入5 mL容量瓶定容,其引入的相对标准不确定度为0.020/(5.0×√6)=0.001633;t2制备过程中合成不确定度=√(使用1 mL移液器量引入的不确定度2+使用5 mL容量瓶引入的不确定度2)=(0.0051032+0.0016332)=0.005358。
t1制备过程:使用1 mL移液器量取标准品储备液0.5 mL,其引入的相对标准不确定度为0.010/(0.5×√6)=0.008165;加入5 mL容量瓶定容,其引入的相对标准不确定度为0.020/(5.0×√6)=0.001633;t1制备过程合成不确定度为√(0.0081652+0.0016332)=0.008327。
供试品溶液配制引入的合成不确定度U(t)=√(供试品储备液制备过程合成不确定度2+t2制备过程中合成不确定度2+t1制备过程合成不确定度2)=√(0.0051662+0.0053582+ 0.0083272)=0.01116。
(4)微量注射器药液注射过程引入的相对标准不确定度U(Z)。
100 uL微量注射器的容量允许误差为±0.003 mL,按三角分布计算,即k=√6。使用100 uL微量注射器进行注射,注射体积为0.1 mL,则其引入的相对标准不确定度为U(Z)=0.003/(0.1×√6)=0.01225。
(5)血压反应的测定过程引入的相对标准不确定度U(B)。
f总=mk-1=4×4-1=13;f剂间=k-1=4-1=3;f区组间=m-1=4-1=3;f误差=f总-f剂间-f区组间=7;
t=2.37;s2=2.4514
V=1/2(T1+T2-S1-S2);W=1/2(T2-T1+S2-S1);
U(B)=Sm/√m=0.01459/√4=0.007295
式中,k为总剂量数,m为测量次数,f总为总自由度,f剂间为剂间自由度,f区组间为区组间自由度,f误差为误差自由度,t为t值表查询所得,s2为误差的方差值,T1为供试品低剂量血压反应值总和,T2为供试品高剂量血压反应值总和,S1为标准品低剂量血压反应值总和,S2为标准品高剂量血压反应值总和。
(6)环境温度引入的相对标准不确定度U(T)。
实验环境温度为(20±3)℃,溶剂水的体积膨胀系数为2.1×10-4℃-1,按矩形分布计算,即k=√3,则环境温度引入的相对标准不确定度U(T)=3×2.1×10-4/√3=0.0003637。
2.2.3 合成相对标准不确定度计算U合成
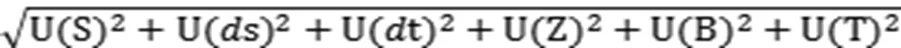
2.2.4 扩展不确定度U扩展
根据升压素生物测定结果可知,样品的效价为5.7822 IU/mL,测量结果的合成相对标准不确定度U合成为0.02087,则样品效价的合成标准不确定度为5.7822×0.02087=0.1207 IU/mL。在没有特殊要求的情况下,按照国际惯例,取扩展因子k=2,测量结果的扩展不确定度U扩展=2×0.1207 IU/mL=0.2414 IU/mL。因此,垂体后叶注射液中升压素效价可表示为(5.7822±0.2414)IU/mL,为其标示量的(96.37±4.02)%。
3 讨论
根据2020年版《中华人民共和国药典》(二部)要求,垂体后叶注射液中升压素效价应为标示量的87%~115%,可信限率(FL%)不得大于20%,本实验中测得的效价为标示量的96.37%,效价的可信限率为FL=7.6023%。生物测定方法的误差较大,本研究通过对标准品的纯度、所用的移液器和定容器具、药液注射过程、血压反应值的测定过程等不确定度进行评价,得出垂体后叶注射液中升压素效价的扩展不确定度为0.2414 IU/mL,则该批垂体后叶注射液中升压素效价为5.5408 IU/mL~6.0236 IU/mL,为标识量的92.34%~100.40%,符合药典规定值,为合格检品。通过对升压素效价测定的不确定度分析可知,影响生物效价的因素很多,尽管每个分量对效价的影响程度不同,但多个分量的影响值均较大,与化学分析中不确定度的评定值相比,生物分析的不确定度值要更大。本研究对垂体后叶注射液中升压素效价测定的不确定度进行评定,其影响程度由大到小的排序为:微量注射器药液注射过程>供试品溶液的配制>标准品溶液的配制>血压反应的测定过程>环境温度>标准品的纯度。
4 结论
由上述影响程度结果可知,供试品溶液及标准品溶液配制过程中引入的误差较大,为减少配制过程中引入的不确定度,可通过减小溶液配制体积,并根据所取液体的体积选择量程范围适宜的移液工具和容量工具。不确定度的评价分析有助于加深对实验影响因素的认识,从而优化实验操作细节,降低不确定度数值,提高实验的准确性和可靠性。
[1] 张营,杜益,潘余睿智,等. 垂体后叶注射液含量HPLC法和生物效价测定法等效性研究[J]. 药物分析杂志,2018,38(10): 1830-1836.
[2] 薛洪宝,胡锐,常华兰,等. 垂体后叶素质量控制标准及不良反应分析[J]. 甘肃医药,2019,38(10): 929-933,940.
[3] 国家药典委员会. 中华人民共和国药典2020年版: 二部[M]. 北京: 中国医药科技出版社,2020.
[4] 戴青,韩宁宁,王轩,等. 管碟法测定硫酸安普霉素效价的不确定度评定[J]. 中国兽药杂志,2021,55(3): 25-29.
[5] 刘婷婷,张捷,王尊文. 整体法评估药品中需氧菌计数检验结果的不确定度[J]. 中国药事,2021,35(1): 74-78.
[6] JJF 1059-1999. 测量不确定度的评定与表示[S]. 北京: 中国标准出版社,1999.
[7] GB/T 27418-2017. 测量不确定度评定和表示[S]. 北京: 中国标准出版社,2017.
[8] JJG 646-2018. 移液器检定规程[S]. 北京: 中国标准出版社,2018.
[9] GB/T 12810-1991. 实验室玻璃仪器玻璃量器的容量校准和使用方法[S]. 北京: 中国标准出版社,1991.
Evaluation of Uncertainty in the Titer Determination of Vasopressin in Posthypophysis Injection
Objective: To establish a method of the uncertainty evaluation of the potency of vasopressin in posthypophysis injection. Method: Model for potency of vasopressin in posthypophysis injection was established to analyze the influential factors of uncertainty. The uncertainty components were quantitatively analyzed and the expanded uncertainty was calculated. Results: The order of the influence value of vasopressin titer in posthypophysis injection was as follows: process of microsyringe injection> preparation of test solution> preparation of standard solution> determination of blood pressure> ambient temperature> the purity of standard. The expanded uncertainty of the potency of vasopressin in posthypophysis injection was 0.2414 IU/ml and the potency of was (5.7822±0.2414) IU/mL, equivalent to (96.37±4.02)% of the labeled amount. Conclusion: This method can be used to evaluate the uncertainty evaluation of the potency of vasopressin in posthypophysis injection, which provides reference for optimizing the experiment and improving the reliability of the results.
posthypophysis injection; vasopressin; titer; uncertainty
R97
A
1008-1151(2022)08-0094-04
2022-06-17
谢鹏(1990-),女(瑶族),广西壮族自治区食品药品检验所主管药师,硕士,研究方向为药品检验检测。
林昊(1981-),男,广西壮族自治区食品药品检验所主管药师,研究方向为药品检验检测。

