珊瑚骨骼生长与地球化学组成
康慧凌, 陈雪霏, 邓文峰, 韦刚健
珊瑚骨骼生长与地球化学组成
康慧凌1, 2, 3, 4, 陈雪霏1, 2, 3*, 邓文峰1, 2, 3, 韦刚健1, 2, 3
(1. 中国科学院 广州地球化学研究所, 同位素地球化学国家重点实验室, 广东 广州 510640; 2. 中国科学院深地科学卓越创新中心, 广东 广州 510640; 3. 南方海洋科学与工程广东省实验室(广州), 广东 广州 511458; 4. 中国科学院大学, 北京 100049)
造礁珊瑚对环境变化极为敏感, 在气候变化与人类活动的多重胁迫下, 全球珊瑚礁在近几十年急剧退化。然而, 也正是这种环境敏感性使得珊瑚具有记录海水物理化学条件变化的能力, 成为研究海洋气候环境变化的重要载体。珊瑚骨骼中的Sr/Ca、Li/Mg、B/Ca、Ba/Ca、δ18O以及δ11B等地球化学指标, 被广泛应用于重建海水温度、降雨、pH值、陆源输入以及上升流等环境信息。但需要注意的是, 珊瑚骨骼的地球化学组成受控于环境变化的同时, 也受到珊瑚及共生虫黄藻的生命过程即所谓的“生命效应”的影响。因此, 厘清“生命效应”对珊瑚骨骼地球化学组成和环境记录重建的影响, 对于准确重建海洋气候环境变化至关重要。本文系统回顾了近三十年来常用的珊瑚地球化学指标, 对其原理及存在的“生命效应”进行总结, 并归纳了团块状造礁珊瑚的生长模式、骨骼三维结构与微结构特征, 及其同珊瑚地球化学替代指标间的关联。结合对珊瑚生长与“生命效应”的理解,以及对珊瑚微区地球化学信号的解读, 本文进一步阐述了珊瑚生长对地球化学信号的影响。
造礁珊瑚; 地球化学指标; 生命效应; 珊瑚生长; 骨骼微结构
0 引 言
海洋中奇伟瑰丽的大型生物建造——珊瑚礁, 为近25%的海洋生物提供了栖息之地, 拥有丰富的生物多样性和极高的生产力, 被誉为“蓝色沙漠中的绿洲”。珊瑚礁还能够抵御海浪对近岸的侵蚀, 有天然的防浪护岸功能, 并在渔业、旅游业、医药等方面具有重要的经济价值(余克服, 2018), 是宝贵的海洋资源。然而, 珊瑚对环境变化十分敏感。在气候变化和人类活动的多重胁迫下, 珊瑚礁的生存承受着巨大的威胁和挑战(IPCC, 2021)。海水温度升高会迫使珊瑚驱赶与其共生的虫黄藻, 失去五彩缤纷的颜色和主要的能量来源, 造成珊瑚白化的现象; 海水pH值下降可能导致珊瑚的钙化能力减弱, 从而无法维持珊瑚礁的持续生长(Glynn, 1993; Hoegh- Guldberg, 1999; Hughes et al., 2017; Kubota et al., 2017)。因此, 近几十年来全球珊瑚礁都经历着严重的退化, 大规模珊瑚白化事件发生的频率不断增加, 许多海域造礁珊瑚的覆盖率和钙化速率均在持续下降(Hughes and Tanner, 2000; De’ath et al., 2009, 2012; Cantin et al., 2010; Chen et al., 2021)。但是, 也正是珊瑚对环境的高度敏感性, 赋予了它记录海洋环境变化的能力, 使之成为与陆地上树轮、冰芯、黄土等同样重要的古气候研究载体, 为我们打开了认识海洋环境演变的时空之门(Gagan et al., 2000)。
造礁珊瑚是珊瑚礁生态系统最主要的生物建造者。它能够高效快速地利用海水中的Ca2+与溶解无机碳(dissolved inorganic carbon, DIC: HCO− 3、CO2− 3与CO2), 迅速沉淀形成文石质的碳酸钙(CaCO3)骨骼, 即珊瑚礁的主要成分。在珊瑚钙化时, 海水中的一些其他元素(如Sr、Mg、Ba、B、Pb、Mn、Cu、Zn等)与CaCO3发生共沉淀, 从而进入到矿物晶格中。虽然这些元素仅以微量的成分存在于珊瑚骨骼中(被称为珊瑚骨骼中的微量元素; minor elements, Me), 但是它们与Ca的比值(Me/Ca), 或者其同位素组成(如δ11B), 均对海水环境变化十分敏感, 是珊瑚古气候研究中重要的环境替代指标。自20世纪70年代以来, 基于珊瑚骨骼的地球化学替代指标得到了广泛关注, 例如: Sr/Ca、Mg/Ca、Li/Mg、B/Ca、U/Ca、Ba/Ca、δ18O和δ11B等。这些替代指标可用于反演珊瑚生长时的海水温度、盐度、陆源输入、上升流以及海水pH值等的变化情况(Lea et al., 1989; Beck et al., 1992; Hemming and Hanson, 1992; Hemming et al., 1998; McCulloch et al., 2003; Pelejero et al., 2005; Cahyarini et al., 2008; Gagan et al., 2012; D’Olivo et al., 2018; Chen et al., 2020)。除了记录环境信息之外, 珊瑚骨骼也能直观地提供其自身的钙化生长历史, 例如珊瑚骨骼的密度、线性生长率以及钙化速率的变化情况(Barnes and Lough, 1993)。这些从珊瑚岩心获取的钙化生长历史, 是叠加海洋环境短期和长期变化的综合结果, 能够最真实地反映珊瑚自身对环境变化的响应, 因此可以帮助我们更准确、全面地认识造礁珊瑚在气候变化胁迫下的自我调节和适应能力, 以及珊瑚与环境的协同演变机制。而在实现这一目标时, 珊瑚骨骼中的地球化学记录可以作为非常重要的桥梁, 因为它能够提供目前所缺乏的海水温度和酸度等环境信息的长期演变记录, 帮助我们更精准地解析海洋升温和酸化对造礁珊瑚的影响。
但需要注意的是, 珊瑚的地球化学替代指标除了受环境因素控制外, 也受到珊瑚及其共生虫黄藻生物活动的影响(Cohen et al., 2002; Cohen and Gaetani, 2011; Gaetani et al., 2011; Trotter et al., 2011)。因此利用这些替代指标重建的环境记录可能呈现出超过正常海水环境波动的变化幅度, 并且相同环境下的不同珊瑚样品所重建的环境记录也可能存在一定差异。这些现象可能是生物个体本身所导致, 因此常被归因为“生命效应”(Gaetani and Cohen, 2006; Cohen and Gaetani, 2011; Trotter et al., 2011; Sadler et al., 2014), 干扰我们对珊瑚重建记录的解读。具体来说, 导致“生命效应”的生物过程包括(但不限于): 珊瑚的钙化速率、新陈代谢活动、生物体内各种离子的被动和主动运输(图1a、b)以及骨骼结构等。这些生命过程对不同地球化学替代指标的影响也存在差异(McConnaughey, 1989; Cohen et al., 2002; Reynaud et al., 2007; Trotter et al., 2011; Kuffner et al., 2012; McCulloch et al., 2012, 2017; Reed et al., 2021)。通常, 珊瑚的钙化速率越快, 沉淀过程中δ18O的动力学效应越显著, Me/Ca的瑞利分馏程度越强, 从而使得快速钙化形成的骨骼δ18O值偏低, Sr/Ca与Ba/Ca值(分配系数D>1,DMe/Ca=(Me/Ca)文石/ (Me/Ca)海水)偏低, 而Mg/Ca值偏高(D<1)(图1c) (McConnaughey, 1989; Reynaud et al., 2007; Kuffner et al., 2012)。此外, 珊瑚CaCO3骨骼的沉淀并非直接发生在海水中, 而是在现有骨骼与上覆珊瑚虫细胞之间的半封闭环境(钙化流体, calcifying fluid, cf)中, 海水成分可以通过主动或被动运输进入该位置, 并且钙化流体组成也受到珊瑚自身及共生藻类新陈代谢活动的影响, 从而与海水有系统性差别(Trotter et al., 2011; McCulloch et al., 2012), 这也是影响珊瑚骨骼与无机文石地球化学组成差异的关键因素。此外, 珊瑚骨骼存在特殊的微结构, 不同结构单元的地球化学组成具有显著差异, 其对海水环境的敏感度或者响应也有明显差别。常规来说, 珊瑚古气候重建时需要选取岩心切片样品的最大生长轴进行取样和地球化学分析, 因此骨骼宏观结构的复杂性以及岩心打钻的随机性都可能会限制取样路径的质量, 从而影响地球化学记录的可靠性(Reed et al., 2021)。而珊瑚骨骼微结构的地球化学组成, 涉及这一时间尺度上不同区域或结构单元在沉淀时间与环境上的差别, 从而也受到钙化速率与生命新陈代谢等因素的影响。
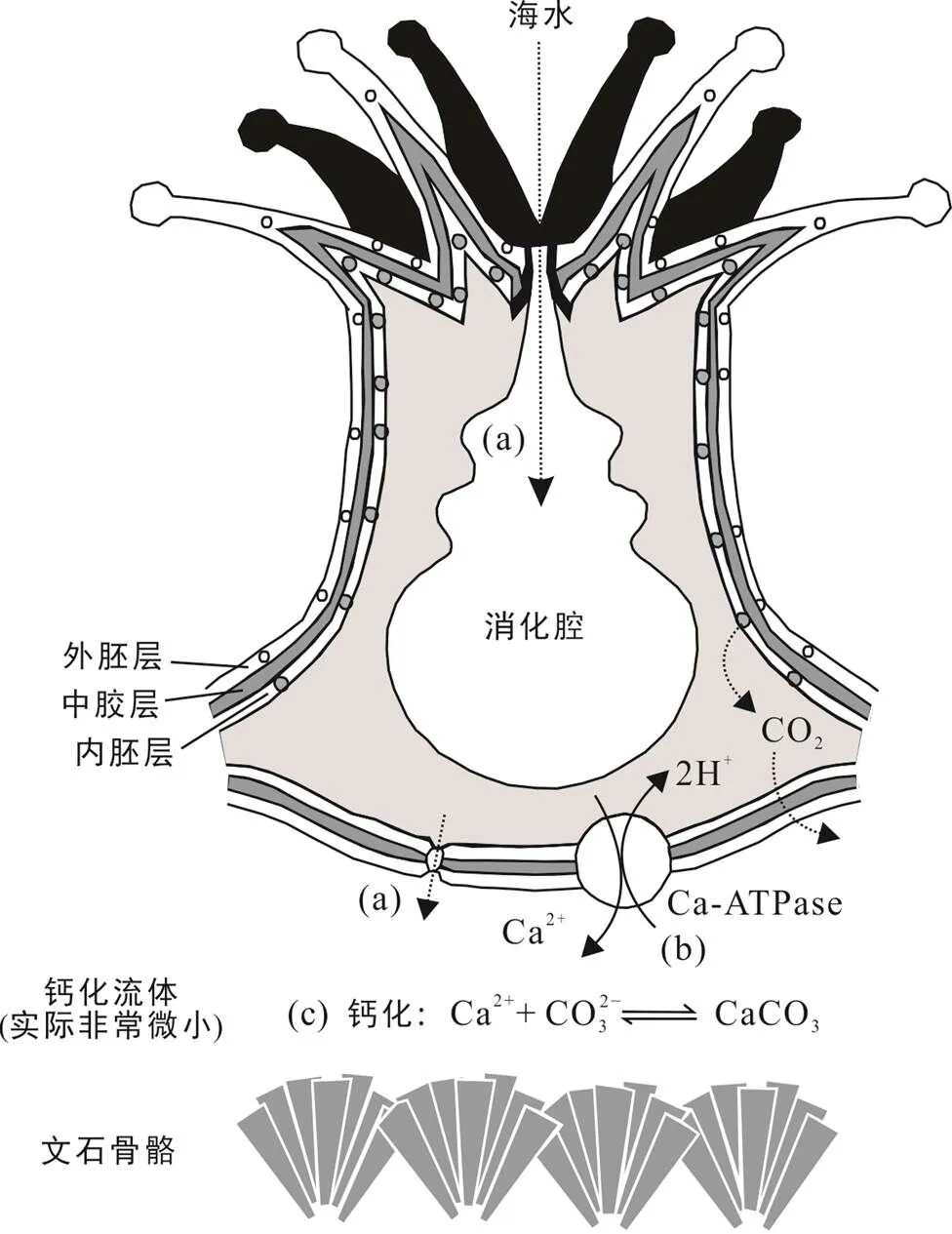
(a) 被动运输(海水扩散): Ca2+、Mg2+、Sr2+、Li+、Ba2+、U2+、B(OH)− 4、CO2− 3、HCO− 3、CO2、B(OH)3; (b) 主动运输: 使钙化流体Ca2+、Sr2+、pH、总碱度(TA)、DIC、CO2− 3、饱和度(Ω)上升; (c) 钙化过程中的瑞利分馏: 使骨骼Sr、Ba等(KD>1)下降, Mg、Li、U等(KD<1)上升。
为了更好地理解珊瑚生长与地球化学替代指标之间的关联, 本文总结了大型块状珊瑚(常用于珊瑚古气候研究)的生长模式与骨骼结构, 系统性回顾了常用的珊瑚地球化学指标, 探讨了“生命效应”的具体机制及其对地球化学替代指标的影响, 并归纳总结了前人对珊瑚微区的地球化学研究(不限于大型块状珊瑚), 从珊瑚地球化学取样的角度提出指导建议, 有助于更准确地提取和理解赋存于珊瑚骨骼的气候环境变化信息。
1 珊瑚生长的宏观与微观特征
1.1 珊瑚骨骼的宏观结构及其对地球化学取样的影响
珊瑚骨骼生长具有周期性, 它如同树轮可作为“古生物时钟”, 这也是其能够记录古环境变化的关键(Hudson et al., 1976)。大型造礁珊瑚(如滨珊瑚)骨骼的年密度带是其生长年周期性的直接证据(图2a、c)。在野外进行岩心取样后, 切割得到平整的珊瑚薄板, 再对珊瑚薄板进行X射线(或γ射线)照射, 可获得明亮条带(高密度)与暗条带(低密度)相间的图像(以X光负片为例), 它们体现了不同季节所形成骨骼的密度差异。虽然高、低密度条带和季节的对应关系在不同海域并不统一, 冬季高密度条带模式与夏季高密度条带模式均有报道(Lough and Barnes, 1997; Mitsuguchi et al., 2003; Kayanne et al., 2006; Sazzad et al., 2010; Al-Rousan, 2012), 但无须置疑的是, 相邻的一条高密度带和一条低密度带代表珊瑚骨骼一年的生长量。然而并非任意珊瑚薄板样品都能呈现出清晰的年密度带, 这取决于珊瑚岩心的取样方向以及珊瑚骨骼的三维结构。一个珊瑚虫单独形成的骨骼被称为珊瑚单体(corallite), 大量珊瑚单体从中心向外呈辐射状排列堆积形成珊瑚礁。在生长初期, 珊瑚的表面可以维持相对平坦的状态, 直到约50~80 mm高, 其表面开始变得不平或形成凸起; 从平行生长方向的剖面看, 每一个凸起内珊瑚单体排列成扇形, 被称为珊瑚扇(corallites fans); 相邻凸起之间则会形成低槽(Darke and Barnes, 1993; Lough and Barnes, 1997; Zhang and Yu, 2008)。Darke and Barnes (1993)论述了珊瑚礁体生长的具体过程, 并提供了有助于理解珊瑚礁体生长的解析图。在珊瑚扇向上与向外生长过程中, 凸起的顶部比侧面具有更多的空隙, 容许新的珊瑚虫嵌入, 旧珊瑚虫形成的珊瑚单体逐渐位于凸起之间的低槽, 进而被挤压; 相应地, 低槽处的珊瑚单体形状小且不规则, 体壁也较薄。

(a)、(c) 具有清晰年密度条带的西沙滨珊瑚样品; (b)、(d) 年密度条带内不可见细条纹与可见细条纹的情况; (e)、(f)、(g) 扫描电镜下不同空间尺度的珊瑚骨骼表面形貌; (g) 可见钙化中心。
在团块状珊瑚的不同位置、沿不同方向进行岩心钻取, 获得珊瑚薄板的X射线图像、生长参数以及地球化学分析结果可能不一致。当钻取岩心的方向与珊瑚生长方向垂直或具有很大的角度时, 珊瑚薄板的X射线图像可能几乎没有年密度条带, 这类样品不适宜获取生长参数与地球化学指标的时间序列。当岩心方向与珊瑚生长方向一致或夹角很小时, 样品会呈现出足够清晰的年密度条带; 若岩心恰好经过最大生长轴, 这是最理想的样品, 若年密度条带趋于平行, 垂直年密度带进行取样, 测得的Sr/Ca、Ba/Ca、δ18O以及δ11B等地球化学记录也能够反映环境信息(Reed et al., 2021)。当岩心与珊瑚生长方向一致, 但经过了珊瑚凸起之间的低槽, 样品虽然具有清晰的年密度带, 但沿此路径获得的地球化学数据, 可能受到珊瑚生长过程的扰动而畸变, 不能真实地记录海水环境的变化(Reed et al., 2021)。相比于同时期理想的骨骼取样路径, 珊瑚生长低槽的骨骼密度偏低, Sr/Ca与Ba/Ca值偏高, Mg/Ca值偏低(Alibert and Kinsley, 2008; Reed et al., 2021)。究其原因, 可能是由于珊瑚在形成骨骼生长低槽时的沉淀速率慢, 瑞利分馏弱, 使得骨骼中Sr/Ca、Ba/Ca值偏高(D>1), Mg/Ca值偏低(D<1)(Gaetani and Cohen, 2006; Cohen and Gaetani, 2011; Reed et al., 2021)。选择理想的样品以及取样路径, 是开展珊瑚地球化学研究的基本前提。
1.2 珊瑚骨骼微结构
在一些珊瑚骨骼X射线图像中, 年密度条带内还存在若干清晰的细条纹(图2d), 体现了珊瑚生长的月周期; 但是, 由于X光片是具有一定厚度的三维珊瑚骨骼薄片中许多层骨骼结构的二维体现, 并非所有的珊瑚X光片都具有细条纹(图2b、d), 并且细条纹的数量也很难统一; 细密度条带与X射线(或γ射线)在同一平面以及生长速率相对快的珊瑚薄片, 其X射线图像具有更清晰的细条纹(Buddemeier, 1974)。在更短的时间尺度月、周乃至日上, 珊瑚骨骼的生长似乎非常复杂, 为这一尺度上的地球化学取样带来难度。因此, 有必要了解微观尺度下珊瑚骨骼的结构特征以及形成机制。
Cuif and Dauphin (2005)提出的造礁石珊瑚骨骼生长两阶段模型认为珊瑚细胞外胚层在第一阶段快速分泌文石以及有机质, 形成微结构的基本架构, 这一部分被称为钙化中心(centers of calcification, COCs)、快速积聚层(rapid accretion deposits, RADs)或早期矿化带(early mineralization zones, EMZs), 其延伸方向通常与珊瑚垂向生长轴的方向平行; 第二阶段为骨骼的侧向加厚过程, 即纤维状文石晶体以垂直或半垂直于早期矿化带延伸方向的角度,围绕早期矿化带区域生长, 这一部分被称为增厚层(thickening deposits, TDs)或增厚纤维(thickening fibers)(Cuif et al., 1999; Cuif and Dauphin, 2005; Nothdurft and Webb, 2007)。微米尺度上“EMZs”和“fibers”两阶段矿化的循环进行, 使得珊瑚骨架得以形成与增厚(Nothdurft and Webb, 2007)。珊瑚骨骼的基本结构有: 珊瑚杯(calice)、体壁(wall; theca)、隔壁(septum, 复数septa)、底板(basal plate)、鳞板(dissepiment)、轴柱(columella)以及表面小刺(spine)等(图3; Nothdurft and Webb, 2007; Xie and Wei, 2008; Zhang and Yu, 2008; Ye et al., 2013; Geng et al., 2017)。珊瑚外胚层最先形成底板, 再从底板边缘向上延伸形成体壁, 底板与体壁围绕形成珊瑚杯; 珊瑚杯内部的垂直分隔板被称为隔壁; 横向分隔板为鳞板, 是珊瑚细胞组织随骨骼垂向生长而抬升形成的; 隔壁在单个珊瑚杯中心聚合而成的纵向骨骼为轴柱; 鳞板与隔壁之间的空腔被称为隔间腔(inter-septal space)(Nothdurft and Webb, 2007; Xie and Wei, 2008; Zhang and Yu, 2008; Ye et al., 2013; Geng et al., 2017)。珊瑚骨骼年密度带内的细条纹可能指示了生长的月周期, 这与鳞板有所关联(Barnes and Lough, 1993; DeCarlo and Cohen, 2017)。目前的研究主要认为鳞板的形成与珊瑚组织层每月的向上抬升有关, 对于滨珊瑚而言, 最新形成的鳞板总是位于珊瑚外胚层的底部, 月亮的盈缺可能是新生鳞板形成的诱因(DeCarlo and Cohen, 2017)。这并非没有根据, 珊瑚的大规模产卵也是发生在满月后的几个夜晚, 可能与月亮对黄昏光线“蓝移”现象的影响有关: 黄昏时分, 太阳辐射经过大气层的路径长度增加, 臭氧层越来越多地吸收长波长的光, 使得天光逐渐蓝移(红光、绿光、蓝光的波长逐渐变短); 而月光比直射阳光的波长更长, 因而能够影响黄昏的蓝移现象, 其影响程度在满月前后变化非常迅速, 因为日落时的月亮在月相渐圆时位于地平线以上, 而在月相渐亏时低于地平线, 并且也有研究表明珊瑚对光谱的蓝色区域异常敏感(Gorbunov and Falkowski, 2002; Sweeney et al., 2011; Kaniewska et al., 2015)。滨珊瑚组织层的向上抬升遵循月相周期(太阴月或朔望月, 完全看不到月亮的一天被称为“朔日”, 满月那天为“望日”), 珊瑚细胞组织的厚度在望日前一两天达到峰值, 在望日后的一两天骤降20%, 可能是因为满月诱发组织细胞底部向上抬升, 形成新的鳞板(Rotmann and Thomas, 2012; DeCarlo and Cohen, 2017)。因此, 鳞板间距可用于代表珊瑚骨骼的月生长率, 这有助于建立珊瑚的高分辨率年代模型, 并且对于年密度带不清晰的珊瑚, 也具有很重要的参考意义(DeCarlo and Cohen, 2017)。珊瑚骨骼年密度条带的形成, 也可能与鳞板间距具有一定的关联, 窄(宽)的鳞板间距, 常对应着高(低)的骨骼密度(DeCarlo and Cohen, 2017)。此外, 近年来受到关注的珊瑚骨骼中异常的高密度“压力带”(high-density “stress band”), 可能与异常低的鳞板间距有关, 或者对应着鳞板数量的减少, 通常反映了环境热压力对珊瑚骨骼线性生长的扰动(Barkley and Cohen, 2016; Mallela et al., 2016; DeCarlo and Cohen, 2017)。
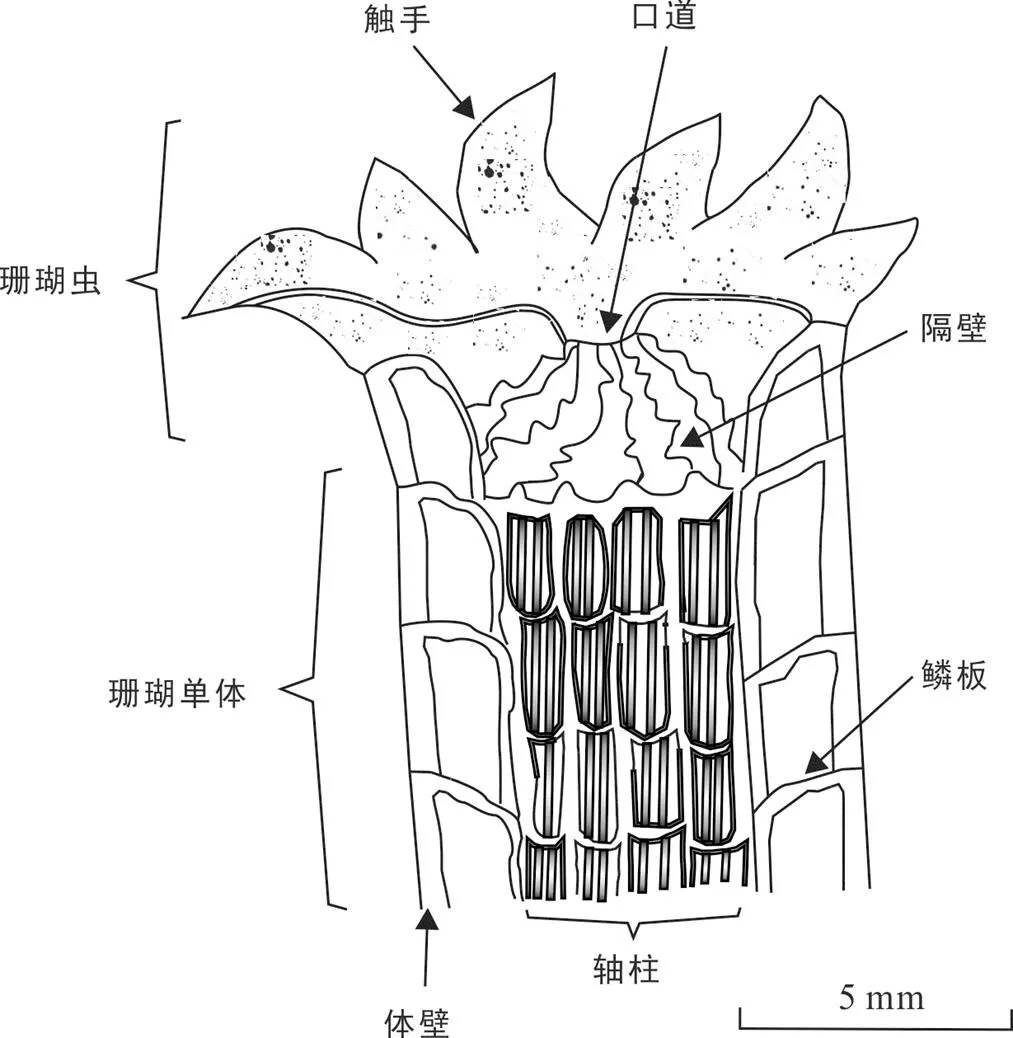
图3 珊瑚虫和珊瑚单体的基本结构(据Tsuyoshi et al., 2006)
2 珊瑚地球化学替代指标
2.1 温度地球化学指标
与Ca同一主族的Sr元素, 其离子半径与Ca2+接近, 常会按比例替代Ca2+进入到珊瑚CaCO3骨骼中, 因此其与Ca的比值(Sr/Ca), 受控于海水的Sr/Ca值以及其在文石与海水之间的分配系数。Sr与Ca在海洋中的滞留时间均高于106年, 这使得海水Sr/Ca值在长时间内是恒定的, 而Sr/Ca的分配系数主要受温度控制(Gaetani and Cohen, 2006)。因此, 珊瑚骨骼中的Sr/Ca值与温度存在线性负相关, 被广泛应用于热带海洋古温度的重建(Gagan et al., 2000; DeLong et al., 2013; Zinke et al., 2014)。
O同位素也是地球化学经典的温度替代指标(Allison and Finch, 2010; Gagan et al., 2012)。虽然同位素温度计的基本前提是平衡分馏, 而珊瑚骨骼的δ18O并未与周围海水的δ18O达到平衡, 明显亏损18O, 但Weber and Woodhead (1972)通过对44个珊瑚种属的研究, 建立了珊瑚骨骼δ18O与海水温度之间的温度方程, 肯定了两者之间良好的线性关系, 开拓了δ18O温度计在珊瑚古气候重建的应用。除了与温度相关, 珊瑚δ18O也与周围海水的δ18O有关, 从而受到蒸发、降水、径流输入以及冰川循环等过程的影响(Gagan, 1998; Gagan et al., 2000; Guilderson et al., 2001)。因此, 结合Sr/Ca值重建而得的温度, 将温度对骨骼δ18O的贡献扣除, 得到的剩余δ18O(residual δ18O, 定义为Δδ18O), 可作为海水δ18O的替代指标, 常应用于降水、表层海水盐度(sea surface sanity, SSS)以及陆源输入的重建(Gagan, 1998; Gagan et al., 2000; Deng et al., 2009)。
在早期研究中, Mg/Ca值也被用作温度替代指标(Mitsuguchi et al., 1996; Fallon et al., 2003; Reynaud et al., 2007; Wei et al., 2009)。与Sr/Ca值不同, 珊瑚骨骼中的Mg/Ca值与温度正相关, 是瑞利分馏导致(Gaetani and Cohen, 2006; Cohen and Gaetani, 2011)。海水对钙化流体的更新补充是分批次、不连续的, 在每一批次钙化流体的骨骼沉淀过程中, 元素在骨骼与流体之间的分配遵循瑞利过程: 随着文石的沉淀, 残余流体越来越富集Mg(DMg/Ca≈0.001), 因此更晚期沉淀的文石中Mg/Ca值相对高(Cohen and Gaetani, 2011)。沉淀速率越快, 瑞利分馏越强, 并且升温促进文石沉淀, 因此珊瑚骨骼的Mg/Ca值与温度正相关(Cohen and Gaetani, 2011)。基于这一解释, 我们似乎可以认为对于Mg/Ca值而言, 温度通过作用分配系数而对Mg进入骨骼这一过程产生的影响较为微弱, 这可能是因为DMg/Ca太小。此外, 珊瑚骨骼中Mg的进入受到较强的生理控制, 并且其在珊瑚碳酸钙晶体中的赋存形态也存在争议(Mitsuguchi et al., 2003; Meibom et al., 2004)。因此, 在更清楚地了解Mg在文石骨骼中的赋存状态和机制之前, 需要谨慎应用Mg/Ca值重建古温度。基于Mg/Ca温度计的缺陷, 近年有学者提出新型的Li/Mg温度计(Montagna et al., 2014)。由于Li+和Mg2+具有相似的离子半径和分配系数, 二者进入文石晶体的方式基本是类似的, 它们在骨骼中的分布也可能受到相接近的生理与物理化学控制。因此, 珊瑚骨骼的Li/Mg值能够一定程度地去除瑞利分馏与生理控制的效应, 从而更准确地反映温度变化(Hathorne et al., 2013; Montagna et al., 2014; Fowell et al., 2016; Marchitto et al., 2018)。根据不同类型的珊瑚(热带浅水珊瑚和深海珊瑚) Li/Mg值和海水温度, 目前已建立了一条Li/Mg-SST(sea surface temperature)的普适方程(Cuny-Guirriec et al., 2019), 但这一方程的应用性仍需要进一步的评估。
鉴于Sr/Ca值在珊瑚骨骼与海水之间的分配也同样受到瑞利分馏的控制, 近年也有学者提出利用U/Ca值来扣除由于钙化结晶所导致的瑞利分馏的影响, 因而将Sr/Ca与U/Ca值结合作为一种新的温度计, 即珊瑚Sr-U温度计, 来提高温度重建的可靠性(DeCarlo et al., 2016; Ross et al., 2019)。温度与Sr/Ca值呈负相关关系是毋庸置疑的, 因为无论是通过影响分配系数还是瑞利分馏(DSr/Ca≈1.2), 升温都使得骨骼Sr/Ca值减小(Cohen and Gaetani, 2011)。一直以来, 虽然珊瑚骨骼的Sr/Ca值能够可靠地反映温度的变化趋势, 但对绝对温度的重建还需要谨慎斟酌, 因为不仅珊瑚骨骼与无机文石之间具有Sr/Ca值对温度敏感度的系统差异, 不同珊瑚个体的Sr/Ca-温度方程也存在些微差异(Cohen et al., 2002; Corrège, 2006; Cohen and Gaetani, 2011; Gaetani et al., 2011)。沉淀速率作为瑞利分馏效应的直接因素, 是引起珊瑚Sr/Ca温度计“生命效应”的重要缘由。钙化流体中CO2− 3的变化能够很大程度地反映沉淀速率的变化, 因此, 将[CO2− 3]cf考虑在内, 有助于绝对温度的重建。DeCarlo et al. (2015)通过无机文石沉淀实验认为文石中的U/Ca值随着[CO2− 3]上升而下降, 而与pH值、温度无关, 因此前人报道的珊瑚U/Ca值与温度、pH值等变量的关系, 可能是这些因素对[CO2− 3]影响的间接体现。联用Sr/Ca与U/Ca值建立的珊瑚Sr-U温度计, 不仅在一定程度上削弱了“生命效应”, 也能够更加准确地获得年际与年代际尺度上的绝对温度, 但需要注意的是, 这一指标更适合用于年分辨率以上的温度重建(DeCarlo et al., 2016; Ross et al., 2019)。
2.2 硼同位素体系–钙化流体碳酸系统组成
Hemming and Hanson (1992)研究发现珊瑚骨骼中的δ11B与海水硼酸根离子B(OH)− 4的δ11B基本一致, 认为海水中的B主要以B(OH)− 4这一赋存状态进入了珊瑚骨骼, 从而δ11Bcoral可以代表海水中的δ11Bborate; 并且, 海水中B的两种形态B(OH)− 4和B(OH)3的存在比例受pH值控制, 因此, 利用δ11Bcoral可以重建海水pH(pHsw)值。近年的关于B在碳酸钙中赋存状态的谱学研究和第一性原理计算均支持珊瑚骨骼中的B主要以B(OH)− 4存在(Mavromatis et al., 2015; Balan et al., 2016)。但进入珊瑚骨骼中的B(OH)− 4的同位素组成会受到钙化流体pH(pHcf)值的影响, 因此δ11Bcoral所反映的主要是pHcf值的信息。由于珊瑚自身的生理调控, pHcf值相比于pHsw值具有系统性的上调(ΔpH = pHcf– pHsw), 并且ΔpH值在不同种珊瑚之间也存在系统性差异, 前人针对不同种属珊瑚, 分别建立了pHcf值与pHsw值的经验转换公式, 从而可重建pHsw值的历史记录(Trotter et al., 2011; McCulloch et al., 2012)。值得一提的是, 目前尚未有系统性的实验数据来评估同种珊瑚(不同亚种或个体之间)ΔpH值的差异性, 并且pHcf值也并非线性地随着pHsw值而变化(Wall et al., 2016); 因此对于根据δ11Bcoral值重建得到的pHsw值历史记录, 虽然其演变的长期趋势与速率是可靠的, 但其绝对值与真实的pHsw值之间可能存在一定程度的偏差。根据实测pHsw值对δ11Bcoral-pHsw进行校正, 有助于提高重建pHsw值历史记录绝对值的可靠性。目前存在的器测pHsw值记录十分稀少且时间跨度短(约40 a), 仅局限于太平洋与大西洋的几个站点(Hawaii Ocean Time-series, HOT; Bermuda Atlantic Time-series Study, BATS; European Station near the Canary Island, ESTOC; Carbon Retention in a Colored Ocean, CARIACO)(Bates et al., 2014), 现有的关于δ11Bcoral-pHsw长期记录的研究更多地关注其演变趋势与变化(Pelejero et al., 2005; Wei et al., 2009; Shinjo et al., 2013; Liu et al., 2014; D’Olivo et al., 2015, 2019; Goodkin et al., 2015; Wei et al., 2015; Kubota et al., 2017; Fowell et al., 2018; Wu et al., 2018; Chen et al., 2019;; Kang et al., 2021)。但珊瑚骨骼δ11B值是目前重建海洋pH值历史记录的主要研究手段, 特别是年际–年代际–百年–千年的记录, 因此仍需要进一步的研究来提高这一方法的准确性和精度。
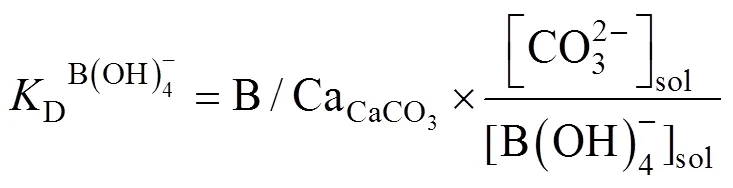
钙化流体中pH值与DIC的上升, 使得其中的文石饱和度(Ωar)显著提高(可达15~25, 海水Ωar为3~4), 这也是珊瑚钙化速率明显高于海水化学条件下无机碳酸盐沉淀速率的主要原因(McCulloch et al., 2017)。早期的研究认为[Ca2+]cf基本恒定, 并在此基础上结合δ11B与B/Ca值计算得到钙化流体的Ωar。然而近年来的研究通过拉曼光谱这一技术, 可直接估测珊瑚骨骼形成时钙化流体的Ωar, 进而反算得到[Ca2+]cf, 结果表明[Ca2+]cf并不稳定, 其变化可能与钙化流体的碳酸系统组成有关(DeCarlo et al., 2017, 2018; Ross et al., 2018)。珊瑚自身对内部钙化流体pH值、DIC以及[Ca2+]的生理调控是复杂且灵活的, 反映了其对周围海洋环境变化的敏感性与适应潜力, 而这一性质存在种间乃至个体差异, 因此也对珊瑚礁生态系统在未来的种群结构与生物多样性有深远影响(Fabricius et al., 2011; McCulloch et al., 2012)。
2.3 Ba/Ca、Mn/Ca、Y/Ca与REEs指示陆源输入与区域过程
珊瑚骨骼的Ba/Ca值常用于反映海洋环境中的陆源输入或海洋上升流(Wolgemuth and Broecker, 1970; Lea et al., 1989; McCulloch et al., 2003)。由于具有相近的离子半径, Ba也可以替代Ca的方式进入文石晶体中(DBa/Ca≈2.3)。与Sr、Mg等元素类似, Ba进入珊瑚骨骼的过程也会受到温度、沉淀速率以及瑞利分馏效应的影响, 但由于海水中的Ba含量不是稳定的, 特别是在近岸或者上升流发育的区域, 洋流或河流输入会引起远大于其他因素的海水Ba含量的剧烈变化, 因此珊瑚骨骼Ba/Ca值主要记录周围海水环境的Ba/Ca值变化(邓文峰, 2007; Cohen and Gaetani, 2011)。河流以悬浮物或表面络合物的形式携带大量的Ba, 并在入海河口处遇到高盐度海水时, 由于高离子强度的水环境, 而发生Ba的解吸附, 使得近岸海域的Ba/Ca值升高, 并被珊瑚、有孔虫等钙质生物记录下来(McCulloch et al., 2003; Brenner et al., 2017; Chen et al., 2020)。此外, Ba作为海洋中的营养盐型痕量金属元素, 其垂向分布呈现出深层水极大值型。表层海水的生物活动活跃, 因此Ba常以BaSO4的形式沉积或被结合到碳酸盐中, 从而含量较低; 当生物死亡后, 部分生源物质通过颗粒沉降输送到深层水, 发生再矿化而释放出Ba, 使得深层水的Ba含量高(Wolgemuth and Broecker, 1970; Lea et al., 1989; Millero, 2013)。因此, 珊瑚骨骼的Ba/Ca值也能够指示海水上升流。
Mn、Y以及稀土元素(REEs)在入海河口表现出与Ba类似的解吸附过程, 因此珊瑚骨骼中的Mn/Ca、Y/Ca值以及REEs也能够指示陆源输入(Sholkovitz, 1993; Fallon et al., 2002; Chen et al., 2015; Lewis et al., 2018)。而除了陆源输入外, 其他一些因素也会对这些指标产生影响。对于Mn/Ca值而言, 区域性的气候事件(如热带气旋和降雨等)、初级生产力、上升流以及突发性事件(如火山喷发、人类活动污染等)都可能是珊瑚骨骼中Mn/Ca值的控制因素(Shen and Sanford, 1990; Shen et al., 1991; Grove et al., 2013; 陈雪霏, 2017; Lewis et al., 2018)。近岸环境高浓度溶解与颗粒态REEs的来源很可能是陆地风化的表层土, 因此珊瑚骨骼中的REEs对于大陆风化作用也具有一定的指示意义(Sholkovitz et al., 1999; Fallon et al., 2002)。
3 珊瑚骨骼微结构的地球化学特征
分析仪器、分析技术与取样工具的进步, 促进了微区研究的发展(Rollion-Bard et al., 2003; Juillet- Leclerc et al., 2009; Allison and Finch, 2010; Zou et al., 2018, 2021; Chalk et al., 2021)。相比于毫米尺度, 微米尺度上的珊瑚骨骼元素与同位素组成更不均一(Rollion-Bard et al., 2003; Meibom et al., 2004; Juillet-Leclerc et al., 2009)。Rollion-Bard et al. (2003)对约2 cm长的滨珊瑚骨骼样品进行了微米尺度的δ18O测定, 发现其变化幅度高达10‰; Allison and Finch (2010)在20~30 d生长时期的珊瑚骨骼上观察到, 微米分辨率上滨珊瑚骨骼的δ18O值变化高于2‰, 并且认为该现象并非由海水温度变化引起的, 因为δ18O与Sr/Ca值并不相关。Rollion-Bard et al. (2003)发现珊瑚骨骼微区的δ18O与δ11B有关, 认为pHcf值主导钙化流体中的H2CO3、HCO− 3以及CO2− 3的相对比例(三者的δ18O值不一致), 并控制CO2通过水合作用与羟基化作用生成HCO− 3的比例, 从而导致珊瑚骨骼的δ18O值不均一(Johnson, 1982)。微米尺度上珊瑚骨骼不同区域δ11B值的差异, 或者说pHcf值的不同, 很可能来自共生虫黄藻昼夜光合作用的差异, 这一因素同时也通过影响钙化率而引起δ18O动力学效应, 这两种作用过程均属于珊瑚的“生命效应” (Rollion-Bard et al., 2003)。
进一步的研究发现, 珊瑚骨骼“EMZs”与“fibers”之间具有系统性的元素与同位素组成差异, 其原因可能是沉淀时间、沉淀环境以及结晶方式等的差异(McConnaughey, 2003; Rollion-Bard et al., 2003; Meibom et al., 2004; Juillet-Leclerc et al., 2009)。“EMZs”的δ18O值相对低, 较为均一, 而“fibers”的δ18O值比“EMZs”高, 且变化范围高达5‰(Juillet-Leclerc et al., 2009)。珊瑚骨骼“EMZs”与“fibers”之间的δ18O值差异, 可能归因于二者迥异的沉淀过程。虽然目前关于“EMZs”与“fibers”形成机制的认识仍存在争议和不确定性, 但普遍认为珊瑚外胚层在第一阶段迅速形成“EMZs”,对应着最初的“瞬时沉淀”, 这时碳酸钙的18O与母液最不平衡, 因此具有最低的δ18O值并且相对均一; “EMZs”形成后, “fibers”逐渐沉淀从而对骨骼框架进行增厚, 期间CO2的水合反应与羟基化反应逐渐趋于平衡, 使得“fibers”的δ18O值高于“EMZs”, 且变化范围大(McConnaughey, 2003; Rollion-Bard et al., 2003; Juillet-Leclerc et al., 2009)。此外, Meibom et al. (2004)发现, Sr含量从“fibers”到“EMZs”逐渐增高, 而“EMZs”的Mg含量比“fibers”至少高一个数量级, 并且Mg含量在“fibers”区域呈现出与骨骼微结构相对应的层状分布。Mg进入珊瑚骨骼的方式以及赋存形态还不十分明确, 被笼统地认为受到强烈的生理控制, 并且Mg与S都被观察到在“fibers”呈层状分布, Mg由此被认为与富S有机物共同影响着矿物晶型结构(Meibom et al., 2004, 2008; Reynaud et al., 2007)。珊瑚骨骼“EMZs”与“fibers”中Sr/Ca值的差异, 可能与二者的形成时间不同有关。“EMZs”的Sr/Ca值与无机成因文石以及非光合作用珊瑚的Sr/Ca值类似(本文中提及的主要是与虫黄藻共生的珊瑚), 并且“EMZs”与无机成因文石的Sr/Ca-温度校准线的斜率接近, 而“fibers”的Sr/Ca值更低, 并且Sr/Ca-温度校准线斜率绝对值也更高, 说明对于与虫黄藻共生的珊瑚而言, 其骨骼的“EMZs”主要形成于夜晚(生物活动影响较小), 而“fibers”在白天形成(Cohen et al., 2001; Cohen and McConnaughey, 2003)。白天温度更高, 形成的骨骼Sr/Ca值偏低, 这是毋庸置疑的; 光合作用可促进钙化速率, 从而通过瑞利分馏引起Sr/Ca值下降, 并且这一过程与温度相关, 使得Sr/Ca-温度校准线的斜率绝对值更大。此外, Ca2+-ATPase酶在白天光照下被激活, 主动运输Ca2+, 使得骨骼中Sr/Ca值下降,也可能是引起“EMZs”与“fibers”之间Sr/Ca值差异的原因(Ferrier-Pages et al., 2002; Cohen and McConnaughey, 2003)。基于珊瑚骨骼的“EMZs”与“fibers”分别形成于夜晚与白天这一推论, 白天虫黄藻光合作用引起的pHcf值与钙化率升高, 显然也不同程度地影响着骨骼中的元素与同位素组成。因此, 在白天形成的“fibers”, 其地球化学组成更容易受到“生命效应”的影响。相较之, 在夜晚形成的“EMZs”似乎能更准确反映周围海水环境的变化, 这对于珊瑚地球化学的高分辨率取样具有重要的指导意义: 从“EMZs”区域取样能够一定程度地减弱“生命效应”的影响(Tsuyoshi et al., 2006; Sadler et al., 2014)。
珊瑚骨骼的体壁、隔壁以及轴柱等不同的结构之间, 也存在元素与同位素的差异。Juillet-Leclerc et al. (2009)除了对鹿角珊瑚骨骼的“EMZs”与“fibers”进行δ18O的对比, 还测定了体壁与隔壁的δ18O值, 发现体壁的δ18O值大部分处于“EMZs”的δ18O值范围, 因此认为体壁主要由“EMZs”组成, 而隔壁则由相当的“EMZs”与“fibers”构成。类似地, Giry et al. (2010)发现体壁要比隔壁与轴柱更亏损18O、Sr与13C, 并考虑到体壁更高的密度, 认为这是钙化速率快慢所导致的元素与同位素差异。然而, Chalk et al. (2021)利用LA-MC-ICP-MS对珊瑚骨骼薄片进行元素与同位素的二维面扫描测试成像, 发现体壁的δ11B值总体要比轴柱的δ11B值更高, 这与前人提出的“体壁主要由‘EMZs’组成”, 以及“‘EMZs’主要在夜晚形成”等观点不能相洽。Chalk et al. (2021)并没有局限于体壁是否主要由“EMZs”组成, 而是根据测得的体壁更高的δ11B与B/Ca值, 表明了体壁形成时更高的pHcf值与[CO2− 3]cf, 这恰恰是体壁相比于轴柱更高的密度所需的沉淀条件。鉴于不同研究的观察结果还不能相洽, 这可能是由于取样测样方式、测定的空间分辨率与范围以及珊瑚种属不一致所导致, 也说明当前对珊瑚生长以及骨骼微区地球化学的研究还十分有限, 缺乏准确的认识。对于骨骼微结构的体壁、隔壁以及轴柱等结构是否与“EMZs”、“fibers”具有一定的对应关系, 我们目前还不能下定论, 需要更进一步的研究。并且, 骨骼不同结构的元素与同位素组成差异, 说明其沉淀条件存在差异, 这可能涉及珊瑚对不同钙化位置的调控机制, 例如体壁与轴柱对应的不同pHcf值、[CO2− 3]cf与Ωcf。以此延伸思考, 在当今海洋酸化的背景下, 珊瑚骨骼体壁与轴柱所对应的钙化流体性质如何变化, 将会影响珊瑚骨骼的微结构、生长方式甚至骨骼密度, 这也是值得进一步研究探讨的问题(Chalk et al., 2021)。总而言之, 关于珊瑚骨骼生长以及微区地球化学特征的研究还任重道远, 并且这与珊瑚昼夜节律有很重要的关系, 可能是认识珊瑚对环境适应性的关键环节, 将有助于进一步解析珊瑚钙化机制及其对环境变化的响应。
4 结 语
珊瑚骨骼中的地球化学信号记录了大量的环境信息, 但需要注意的是, 它同时也受到珊瑚生命过程的影响。本文总结了宏观与微观尺度上大型块状造礁珊瑚的生长模式与骨骼结构, 并对常用珊瑚地球化学指标的原理及“生命效应”进行了简要阐述, 归纳了珊瑚骨骼微区上的元素与同位素特征。期待能为后续珊瑚地球化学研究的取样与分析提供一定的指导, 有助于更准确地提取珊瑚骨骼中所记录的环境信息, 更好地认识年际–年代际–百年时间尺度上气候环境的演变规律, 并且也能更准确地分析气候环境变化对珊瑚礁的影响和理解珊瑚与环境的协同演变机制。
致谢:本论文受中国科学院广州地球化学研究所青促会小组特邀撰稿, 以期总结近十年来珊瑚地球化学的研究进展, 同时庆祝中国科学院青年创新促进会成立十周年。中国科学院南海海洋研究所陈天然研究员和另一位匿名审稿专家对本文提出了宝贵的修改意见, 提升了文章质量, 在此表示衷心感谢!
陈雪霏. 2017. 造礁珊瑚新型元素和同位素体系研究及其对生物活动的记录. 广州: 中国科学院广州地球化学研究所博士学位论文: 33–34.
邓文峰. 2007. 南海北部中全新世气候演变的珊瑚地球化学记录. 广州: 中国科学院广州地球化学研究所博士学位论文: 11.
余克服. 2018. 珊瑚礁科学概论. 北京: 科学出版社: 39–45.
Al-Rousan S. 2012. Skeletal extension rate of the reef buildingcoralspecies from Aqaba and their environmental variables., 4(9): 731–739.
Alibert C, Kinsley L. 2008. A 170-year Sr/Ca and Ba/Ca coral record from the western Pacific warm pool: 1. What can we learn from an unusual coral record?:, 113, C04008.
Allison N, Finch A A. 2010. The potential origins and palaeoenvironmental implications of high temporal resolution δ18O heterogeneity in coral skeletons., 74(19): 5537–5548.
Balan E, Pietrucci F, Gervais C, Blanchard M, Schott J, Gaillardet J. 2016. First-principles study of boron speciation in calcite and aragonite., 193(15): 119–131.
Barkley H C, Cohen A L. 2016. Skeletal records of community-level bleaching incorals from Palau., 35(4): 1407–1417.
Barnes D J, Lough J M. 1993. On the nature and causes of density banding in massive coral skeletons., 167(1): 91–108.
Bates N R, Astor Y M, Church M J, Currie K, Dore J E, Gonzalez-Davila M, Lorenzoni L, Muller-Karger F, Olafsson J, Santana-Casiano J M. 2014. A time-series view of changing surface ocean chemistry due to ocean uptake of anthropogenic CO2and ocean acidification., 27(1): 126–141.
Beck J W, Edwards R L, Ito E, Taylor F W, Recy J, Rougerie F, Joannot P, Henin C. 1992. Sea-surface temperature from coral skeletal strontium/calcium ratios., 257(5070): 644–647.
Brenner L D, Linsley B K, Dunbar R B. 2017. Examining the utility of coral Ba/Ca as a proxy for river discharge and hydroclimate variability at Coiba Island, Gulf of Chirquí, Panamá., 118(1): 48–56.
Buddemeier R W. 1974. Environmental controls over annual and lunar monthly cycles in hermatypic coral calcification // Proceedings of the Second International Symposium on Coral Reefs. Brisbane: Great Barrier Reef Committee: 259–267.
Cahyarini S Y, Pfeiffer M, Timm O, Dullo W-C, Schönberg D G. 2008. Reconstructing seawater δ18O from paired coral δ18O and Sr/Ca ratios: Methods, error analysis and problems, with examples from Tahiti (French Polynesia) and Timor (Indonesia)., 72(12): 2841–2853.
Cantin N E, Cohen A L, Karnauskas K B, Tarrant A M, McCorkle D C. 2010. Ocean warming slows coral growth in the Central Red Sea., 329(5989): 322–325.
Chalk T B, Standish C D, D’Angelo C, Castillo K D, Milton J A, Foster G L. 2021. Mapping coral calcification strategiesfrom in situ boron isotope and trace element measurementsof the tropical coral., 11(1), 472.
Chen T R, Li S, Zhao J X, Feng Y X. 2021. Uranium-thoriumdating of coral mortality and community shift in a highly disturbed inshore reef (Weizhou Island, northern South China Sea)., 752, 141866.
Chen X F, D’Olivo J P, Wei G, McCulloch M. 2019. Anthropogenic ocean warming and acidification recorded by Sr/Ca, Li/Mg, δ11B and B/Ca incoral from the Kimberley region of northwestern Australia.,,, 528: 50–59.
Chen X F, Deng W F, Wei G J, McCulloch M. 2020. Terrestrial signature in coral Ba/Ca, δ18O, and δ13C records from a macrotide-dominated nearshore reef environment, Kimberley region of northwestern Australia.:, 125(3), e2019JG005394.
Chen X F, Wei G J, Deng W F, Liu Y, Sun Y L, Zeng T, Xie L H. 2015. Decadal variations in trace metal concentrations on a coral reef: Evidence from a 159 year record of Mn, Cu, and V in acoral from the northern South China Sea.:, 120(1): 405–416.
Cohen A L, Gaetani G A. 2011. Ion partitioning and the geochemistry of coral skeletons: Solving the mystery of the vital effect // Prieto M, Stoll H M. Ion Partitioning in Ambient-Temperature Aqueous Systems. Budapest: Eotvos University Press: 377–397.
Cohen A L, Layne G D, Hart S R, Lobel P S. 2001. Kinetic control of skeletal Sr/Ca in a symbiotic coral: Implications for the paleotemperature proxy., 16(1): 20–26.
Cohen A L, McConnaughey T A. 2003. Geochemical perspectives on coral mineralization., 54(1): 151–187.
Cohen A L, Owens K E, Layne G D, Shimizu N. 2002. The effect of algal symbionts on the accuracy of Sr/Ca paleotemperatures from coral., 296(5566): 331–333.
Corrège T. 2006. Sea surface temperature and salinity reconstruction from coral geochemical tracers.,,, 232(2–4): 408–428.
Cuif J P, Dauphin Y. 2005. The two-step mode of growth in the Scleractinian coral skeletons from the micrometre to the overall scale., 150(3): 319–331.
Cuif J P, Dauphin Y, Gautret P. 1999. Compositional diversity of soluble mineralizing matrices in some resent coral skeletons compared to fine-scale growth structures of fibres: Discussion of consequences for biomineralization and diagenesis., 88(3): 582–592.
Cuny-Guirriec K, Douville E, Reynaud S, Allemand D, Bordier L, Canesi M, Mazzoli C, Taviani M, Canese S, McCulloch M, Trotter J, Rico-Esenaro S D, Sanchez- Cabeza J-A, Ruiz-Fernández A C, Carricart-Ganivet J P, Scott P M, Sadekov A, Montagna P. 2019. Coral Li/Mg thermometry: Caveats and constraints., 523: 162–178.
D’Olivo J P, Ellwood G, DeCarlo T M, McCulloch M T. 2019. Deconvolving the long-term impacts of ocean acidification and warming on coral biomineralisation., 526, 115785.
D’Olivo J P, McCulloch M T, Eggins S M, Trotter J. 2015. Coral records of reef-water pH across the central Great Barrier Reef, Australia: Assessing the influence of river runoff on inshore reefs., 12(4): 1223– 1236.
D’Olivo J P, Sinclair D J, Rankenburg K, McCulloch M T. 2018. A universal multi-trace element calibration for reconstructing sea surface temperatures from long-livedcorals: Removing ‘vital-effects’., 239: 109–135.
Darke W M, Barnes D J. 1993. Growth trajectories of corallites and ages of polyps in massive colonies of reef-building corals of the genus., 117(2): 321–326.
De’ath G, Fabricius K E, Sweatman H, Puotinen M. 2012. The 27-year decline of coral cover on the Great Barrier Reef and its causes., 109(44): 17995–17999.
De’ath G, Lough J M, Fabricius K E. 2009. Declining coral calcification on the Great Barrier Reef., 323(5910): 116–119.
DeCarlo T M, Cohen A L. 2017. Dissepiments, density bands and signatures of thermal stress inskeletons., 36(3): 749–761.
DeCarlo T M, Comeau S, Cornwall C E, McCulloch M T. 2018. Coral resistance to ocean acidification linked to increased calcium at the site of calcification.-, 285(1878), 2018054.
DeCarlo T M, D’Olivo J P, Foster T, Holcomb M, Becker T, McCulloch M T. 2017. Coral calcifying fluid aragonite saturation states derived from Raman spectroscopy., 14(22): 5253–5269.
DeCarlo T M, Gaetani G A, Cohen A L, Foster G L, Alpert A E, Stewart J A. 2016. Coral Sr-U thermometry., 31(6): 626–638.
DeCarlo T M, Gaetani G A, Holcomb M, Cohen A L. 2015. Experimental determination of factors controlling U/Ca of aragonite precipitated from seawater: Implications forinterpreting coral skeleton., 162: 151–165.
DeLong K L, Quinn T M, Taylor F W, Shen C C, Lin K. 2013. Improving coral-base paleoclimate reconstructions by replicating 350 years of coral Sr/Ca variations.,,, 373: 6–24.
Deng W F, Wei G J, Li X H, Yu K F, Zhao J X, Sun W D, Liu Y. 2009. Paleoprecipitation record from coral Sr/Ca and delta18O during the mid Holocene in the northern South China Sea., 19(6): 811–821.
Fabricius K E, Langdon C, Uthicke S, Humphrey C, Noonan S, De’ath G, Okazaki R, Muehllehner N, Glas M S, Lough J M. 2011. Losers and winners in coral reefs acclimatized to elevated carbon dioxide concentrations., 1(3): 165–169.
Fallon S J, McCulloch M T, Alibert C. 2003. Examining water temperature proxies incorals from the Great Barrier Reef: A cross-shelf comparison., 22(4): 389–404.
Fallon S J, White J C, McCulloch M T. 2002.corals as recorders of mining and environmental impacts: MisimaIsland, Papua New Guinea., 66(1): 45–62.
Ferrier-Pages C, Boisson F, Allemand D, Tambutte E. 2002. Kinetics of strontium uptake in the scleractinian coral., 245: 93–100.
Fowell S E, Foster G L, Ries J B, Castillo K D, de la Vega E, Tyrrell T, Donald H K, Chalk T B. 2018. Historical trends in pH and carbonate biogeochemistry on the Belize Mesoamerican Barrier Reef System., 45(7): 3228–3237.
Fowell S E, Sandford K, Stewart J A, Castillo K D, Ries J B, Foster G L. 2016. Intrareef variations in Li/Mg and Sr/Ca sea surface temperature proxies in the Caribbean reef-building coral., 31(10): 1315–1329.
Gaetani G A, Cohen A L. 2006. Element partitioning during precipitation of aragonite from seawater: A framework for understanding paleoproxies., 70(18): 4617–4634.
Gaetani G A, Cohen A L, Wang Z, Crusius J. 2011. Rayleigh-based, multi-element coral thermometry: A biomineralization approach to developing climate proxies., 75(7): 1920–1932.
Gagan M K. 1998. Temperature and surface-ocean water balance of the Mid-Holocene Tropical Western Pacific., 279(5353): 1014–1018.
Gagan M K, Ayliffe L K, Beck J W, Cole J E, Druffel E R M, Dunbar R B, Schrag D P. 2000. New views of tropical paleoclimates from corals., 19(1–5): 45–64.
Gagan M K, Dunbar G B, Suzuki A. 2012. The effect of skeletal mass accumulation inon coral Sr/Ca and δ18O paleothermometry., 27(1), PA1203.
Geng T N, Yao X M, Zhang Y, Xie X L, Cui M, Lin D M. 2017. Skeletal microstructure observations and calcification process analysis of two species of., 36(1): 56–64.
Giry C, Felis T, Kölling M, Scheffers S. 2010. Geochemistry and skeletal structure of, implications for coral-based climate reconstruction.,,, 298(3): 378–387.
Glynn P W. 1993. Coral reef bleaching: Ecological perspectives., 12(1): 1–17.
Goodkin N F, Wang B S, You C F, Hughen K A, Grumet-Prouty N, Bates N R, Doney S C. 2015. Ocean circulation and biogeochemistry moderate interannual and decadal surface water pH changes in the Sargasso Sea., 42(12): 4931–4939.
Gorbunov M Y, Falkowski P G. 2002. Photoreceptors in the cnidarian hosts allow symbiotic corals to sense blue moonlight., 47(1): 309– 315.
Grove C A, Zinke J, Peeters F, Park W, Scheufen T, Kasper S, Randriamanantsoa B, McCulloch M T, Brummer G J A. 2013. Madagascar corals reveal a multidecadal signature of rainfall and river runoff since 1708., 9(2): 641–656.
Guilderson T P, Fairbanks R G, Rubenstone J L. 2001. Tropical Atlantic coral oxygen isotopes: Glacial-interglacial sea surface temperatures and climate change., 172(1): 75–89.
Hathorne E C, Felis T, Suzuki A, Kawahata H, Cabioch G. 2013. Lithium in the aragonite skeletons of massivecorals: A new tool to reconstruct tropical sea surface temperatures., 28(1), 10.
Hemming N G, Guilderson T P, Fairbanks R G. 1998. Seasonal variations in the boron isotopic composition of coral: A productivity signal?, 12(4): 581–586.
Hemming N G, Hanson G N. 1992. Boron isotopic compositionand concentration in modern marine carbonates., 56(1): 537–543.
Hoegh-Guldberg O. 1999. Climate change, coral bleaching and the future of the world’s coral reefs., 50(8): 839–866.
Hudson J H, Shinn E A, Halley R B, Lidz B. 1976. Sclerochronology: A tool for interpreting past environments., 4(6): 361–364.
Hughes T P, Kerry J T, Álvarez-Noriega M, Álvarez-Romero J G, Anderson K D, Baird A H, Babcock R C, Beger M, Bellwood D R, Berkelmans R, Bridge T C, Butler I R, Byrne M, Cantin N E, Comeau S, Connolly S R, Cumming G S, Dalton S J, Diaz-Pulido G, Eakin C M, Figueira W F, Gilmour J P, Harrison H B, Heron S F, Hoey A S, Hobbs J-P A, Hoogenboom M O, Kennedy E V, Kuo C-y, Lough J M, Lowe R J, Liu G, McCulloch M T, Malcolm H A, McWilliam M J, Pandolfi J M, Pears R J, Pratchett M S, Schoepf V, Simpson T, Skirving W J, Sommer B, Torda G, Wachenfeld D R, Willis B L, Wilson S K. 2017. Global warming and recurrent mass bleaching of corals., 543(7645): 373–377.
Hughes T P, Tanner J E. 2000. Recruitment failure, life histories, and long-term decline of Caribbean corals., 81(8): 2250–2263.
IPCC. 2021. Climate Change 2021: The Physical Science Basis. Contribution of Working Group I to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change. New York: Cambridge University Press: 163–164.
Johnson K S. 1982. Carbon dioxide hydration and dehydration kinetics in seawater., 27(5): 849–855.
Juillet-Leclerc A, Reynaud S, Rollion-Bard C, Cuif J P, Dauphin Y, Blamart D, Ferrier-Pagès C, Allemand D. 2009. Oxygen isotopic signature of the skeletal microstructures in cultured corals: Identification of vital effects., 73(18): 5320–5332.
Kang H L, Chen X F, Deng W F, Wang X J, Cui H, Liu X, Cai G Q, Zeng T, Zhao J X, Wei G J. 2021. Skeletal growth response ofcoral to long-term ocean warming and acidification in the South China Sea.:, 126(10), e2021JG006423.
Kaniewska P, Alon S, Karako-Lampert S, Hoegh-Guldberg O, Levy O. 2015. Signaling cascades and the importance of moonlight in coral broadcast mass spawning., 4, e09991.
Kayanne H, Iijima H, Nakamura N, McClanahan T R, Behera S, Yamagata T. 2006. Indian Ocean Dipole index recorded in Kenyan coral annual density bands., 33(19), L19709.
Kubota K, Yokoyama Y, Ishikawa T, Suzuki A, Ishii M. 2017. Rapid decline in pH of coral calcification fluid due to incorporation of anthropogenic CO2., 7(1), 7694.
Kuffner I B, Jokiel P L, Rodgers K S, Andersson A J, Mackenzie F T. 2012. An apparent “vital effect” of calcification rate on the Sr/Ca temperature proxy in the reef coral.,,, 13(8), Q08004.
Lea D W, Shen G T, Boyle E A. 1989. Coralline barium records temporal variability in equatorial Pacific upwelling., 340(6232): 373–376.
Lewis S E, Lough J M, Cantin N E, Matson E G, Kinsley L, Bainbridge Z T, Brodie J E. 2018. A critical evaluation of coral Ba/Ca, Mn/Ca and Y/Ca ratios as indicators of terrestrial input: New data from the Great Barrier Reef, Australia., 237: 131–154.
Liu Y, Peng Z C, Zhou R J, Song S H, Liu W G, You C F, Lin Y P, Yu K F, Wu C C, Wei G J, Xie L H, Burr G S, Shen C C. 2014. Acceleration of modern acidification in the South China Sea driven by anthropogenic CO2., 4, 5148.
Lough J M, Barnes D J. 1997. Several centuries of variation in skeletal extension, density and calcification in massivecolonies from the Great Barrier Reef: A proxy for seawater temperature and a background of variability against which to identify unnatural change., 211(1): 29–67.
Mallela J, Hetzinger S, Halfar J. 2016. Thermal stress markersin Colpophyllia natans provide an archive of site-specific bleaching events., 35(1): 181–186.
Marchitto T M, Bryan S P, Doss W, McCulloch M T, Montagna P. 2018. A simple biomineralization model to explain Li, Mg, and Sr incorporation into aragonitic foraminifera and corals., 481: 20–29.
Mavromatis V, Montouillout V, Noireaux J, Gaillardet J, Schott J. 2015. Characterization of boron incorporation and speciation in calcite and aragonite from co-precipitation experiments under controlled pH, temperature and precipitation rate., 150: 299–313.
McConnaughey T. 1989.13C and18O isotopic disequilibrium in biological carbonates: I. Patterns., 53(1): 151–162.
McConnaughey T A. 2003. Sub-equilibrium oxygen-18 and carbon-13 levels in biological carbonates: Carbonate and kinetic models., 22(4): 316–327.
McCulloch M, Fallon S, Wyndham T, Hendy E, Lough J, Barnes D. 2003. Coral record of increased sediment flux to the inner Great Barrier Reef since European settlement., 421(6924): 727–730.
McCulloch M T, D’Olivo J P, Falter J, Holcomb M, Trotter J A. 2017. Coral calcification in a changing World and the interactive dynamics of pH and DIC upregulation., 8, 15686.
McCulloch M T, Falter J, Trotter J, Montagna P. 2012. Coral resilience to ocean acidification and global warming through pH up-regulation., 2(8): 623–627.
Meibom A, Cuif J P, Hillion F, Constantz B R, Juillet- Leclerc A, Dauphin Y, Watanabe T, Dunbar R B. 2004. Distribution of magnesium in coral skeleton., 31(23), L23306.
Meibom A, Cuif J P, Houlbreque F, Mostefaoui S, Dauphin Y, Meibom K L, Dunbar R. 2008. Compositional variationsat ultra-structure length scales in coral skeleton., 72(6): 1555–1569.
Millero F J. 2013. Chemical Oceanography. Boca Raton: CRC Press: 93–94.
Mitsuguchi T, Matsumoto E, Abe O, Uchida T, Isdale P J. 1996. Mg/Ca Thermometry in Coral Skeletons., 274(5289): 961–963.
Mitsuguchi T, Matsumoto E, Uchida T. 2003. Mg/Ca and Sr/Ca ratios ofcoral skeleton: Evaluation of the effect of skeletal growth rate., 22(4): 381– 388.
Montagna P, McCulloch M, Douville E, López Correa M, Trotter J, Rodolfo-Metalpa R, Dissard D, Ferrier-Pagès C, Frank N, Freiwald A, Goldstein S, Mazzoli C, Reynaud S, Rüggeberg A, Russo S, Taviani M. 2014. Li/Mg systematics in scleractinian corals: Calibration of the thermometer., 132: 288–310.
Nothdurft L D, Webb G E. 2007. Microstructure of common reef-building coral genera,,and: Constraints on spatial resolution in geochemical sampling., 53(1): 1–26.
Pelejero C, Calvo E, McCulloch M T, Marshall J F, Gagan M K, Lough J M, Opdyke B N. 2005. Preindustrial to modern interdecadal variability in coral reef pH., 309(5744): 2204–2207.
Reed E V, Thompson D M, Cole J E, Lough J M, Cantin N E, Cheung A H, Tudhope A, Vetter L, Jimenez G, Edwards R L. 2021. Impacts of coral growth on geochemistry: Lessons from the Galápagos Islands., 36(4), e2020PA004051.
Reynaud S, Ferrier-Pagès C, Meibom A, Mostefaoui S, Mortlock R, Fairbanks R, Allemand D. 2007. Light and temperature effects on Sr/Ca and Mg/Ca ratios in the scleractinian coral., 71(2): 354–362.
Rollion-Bard C, Chaussidon M, France-Lanord C. 2003. pH control on oxygen isotopic composition of symbiotic corals., 215(1): 275–288.
Ross C L, DeCarlo T M, McCulloch M T. 2019. Calibration of Sr/Ca, Li/Mg and Sr-U paleothermometry in branchingand foliose corals., 34(8): 1271–1291.
Ross C L, Schoepf V, DeCarlo T M, McCulloch M T. 2018. Mechanisms and seasonal drivers of calcification in the temperate coral Turbinaria reniformis at its latitudinal limits., 285(1879): 20180215.
Rotmann S, Thomas S. 2012. Coral tissue thickness as a bio-indicator of mine-related turbidity stress on coral reefs at Lihir Island, Papua New Guinea., 25(4): 52–63.
Sadler J, Webb G E, Nothdurft L D, Dechnik B. 2014. Geochemistry-based coral palaeoclimate studies and the potential of ‘non-traditional’ (non-massive) corals: Recent developments and future progression., 139: 291–316.
Sazzad M H, Wijaya A R, Tanaka K, Ohde S. 2010. Environmentaleffects on the stable carbon and oxygen isotopic compositions and skeletal density banding pattern ofcoral from Khang Khao Island, Thailand., 9(33): 373–382.
Shen G T, Campbell T M, Dunbar R B, Wellington G M, Colgan M W, Glynn P W. 1991. Paleochemistry of manganese in corals from the Galapagos Islands., 10(2): 91–100.
Shen G T, Sanford C L. 1990. Trace element indicators of climate variability in reef-building corals // Glynn P W. Elsevier Oceanography Series. Elsevier: 255–283.
Shinjo R, Asami R, Huang K F, You C F, Iryu Y. 2013. Ocean acidification trend in the tropical North Pacific since the mid-20th century reconstructed from a coral archive., 342: 58–64.
Sholkovitz E R. 1993. The geochemistry of rare earth elements in the Amazon River estuary., 57(10): 2181–2190.
Sholkovitz E R, Elderfield H, Szymczak R, Casey K. 1999. Island weathering: River sources of rare earth elements to the Western Pacific Ocean., 68(1): 39–57.
Sweeney A M, Boch C A, Johnsen S, Morse D E. 2011. Twilight spectral dynamics and the coral reef invertebrate spawning response., 214(5): 770–777.
Thompson D M. 2022. Environmental records from coral skeletons: A decade of novel insights and innovation., 13(1), e745.
Trotter J, Montagna P, McCulloch M, Silenzi S, Reynaud S, Mortimer G, Martin S, Ferrier-Pagès C, Gattuso J-P, Rodolfo-Metalpa R. 2011. Quantifying the pH ‘vital effect’ in the temperate zooxanthellate coral: Validation of the boron seawater pH proxy., 303(3–4): 163–173.
Tsuyoshi W, StÉPhanie R, Jean-Pierre C, Yannicke D. 2006. Variation of geochemical signals in coral skeletons: Environmental changes or biological processes?, 10(4): 359–374.
Wall M, Fietzke J, Schmidt G M, Fink A, Hofmann L C, de Beer D, Fabricius K E. 2016. Internal pH regulation facilitateslong-term acclimation of massive corals to end-of-century carbon dioxide conditions., 6, 30688.
Weber J N, Woodhead P M J. 1972. Temperature dependence of oxygen-18 concentration in reef coral carbonates., 77(3): 463–473.
Wei G J, McCulloch M T, Mortimer G, Deng W F, Xie L H. 2009. Evidence for ocean acidification in the Great Barrier Reef of Australia., 73(8): 2332–2346.
Wei G J, Wang Z B, Ke T, Liu Y, Deng W F, Chen X F, Xu J F, Zeng T, Xie L H. 2015. Decadal variability in seawater pH in the West Pacific: Evidence from coral delta B-11 records.:, 120(11): 7166–7181.
Wolgemuth K, Broecker W S. 1970. Barium in sea water., 8(5): 372–378.
Wu H C, Dissard D, Douville E, Blamart D, Bordier L, Tribollet A, Le Cornec F, Pons-Branchu E, Dapoigny A, Lazareth C E. 2018. Surface ocean pH variations since 1689 CE and recent ocean acidification in the tropical South Pacific., 9(1), 2543.
Xie L H, Wei G J. 2008. SEM studies on the microstructure ofcoral from the northern South China Sea: Implications for paleoclimate record reconstruction., 28(3): 1–8.
Ye C, Huang H, Zhang C L. 2013. Skeletal architecture and microstructure of calcifying coral., 32(2): 102–111.
Zhang J Y, Yu K F. 2008. Review on the study of coral skeletal growth., 54(3): 362–372.
Zinke J, Rountrey A, Feng M, Xie S P, Dissard D, Rankenburg K, Lough J M, McCulloch M T. 2014. Corals record long-term Leeuwin current variability including Ningaloo Nino/Nina since 1795., 5, 3607.
Zou J Q, Deng W F, Chen X F, Liu X, Guo Y R, Cai G Q, Xia X P, Yang Q, Zhang Y Q, Zeng T, Wei G J. 2021. Temperature control on high-resolution SIMS oxygen isotopic compositions incoral skeletons., 6(2): 129–141.
Zou J Q, Wei G J, Deng W F, Chen X F, Yang Q, Xia X P. 2018. Analysis of oxygen isotopic compositions of coral using Secondary Ion Mass Spectrometry., 47(3): 306–312.
Coral skeletogenesis and its influence on skeletal geochemistry
KANG Huiling1, 2, 3, 4, CHEN Xuefei1, 2, 3*, DENG Wenfeng1, 2, 3, WEI Gangjian1, 2, 3
(1. State Key Laboratory of Isotope Geochemistry, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, Guangdong, China; 2. CAS Center for Excellence in Deep Earth Science, Guangzhou 510640,Guangdong, China; 3. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, Guangdong, China; 4.University of Chinese Academy of Sciences, Beijing 100049, China)
Coral reefs have degraded rapidly due to climate change and anthropogenic activities. The vulnerability and sensitivity of corals to environmental changes make them unique archives for climate variability. The geochemical proxies, such as Sr/Ca, Li/Mg, B/Ca, Ba/Ca, δ18O, and δ11B, in coral skeletons are widely used to reconstruct paleo-environment changes, such as temperature, precipitation, pH, terrestrial input, and upwelling; however, geochemical signals within coral skeletons are also affected by biological processes, that is, the “vital effects”. Therefore, understanding the underlying mechanisms of these “vital effects” and the associated impacts on geochemical proxies is crucial for accurateenvironmental reconstruction. In this study, we systematically reviewed coral-based geochemical proxies and the related “vital effects”. Furthermore, in combination with the skeletogenesis andgeochemical analyses, we summarized the influence of coral growth on skeletal geochemistry.
scleractinian coral; geochemical proxy; vital effect; coral growth; skeletal microstructure
P735; P597
A
0379-1726(2022)04-0389-15
10.19700/j.0379-1726.2022.04.002
2021-10-28;
2022-03-28
中国科学院B类先导专项(XDB40010300)、南方海洋科学与工程广东省实验室(广州)人才团队引进重大专项(GML2019ZD0308)、国家自然科学基金项目(41803017)、广东省基础与应用基础研究基金(2019A1515010892)、“涂光炽优秀青年学者”项目和中国科学院青年创新促进会项目(2020352)联合资助。
康慧凌(1996–), 女, 博士研究生, 地球化学专业。E-mail: kanghuiling@gig.ac.cn
陈雪霏(1989–), 女, 副研究员, 主要从事珊瑚地球化学和古气候研究。E-mail: chenxf@gig.ac.cn

