术前白蛋白与碱性磷酸酶比值在胃癌根治术后患者预后中的预测价值
陈明干 龚庆豪 戴刚 张美峰 张捷
作者单位:200000 上海 上海交通大学医学院附属新华医院崇明分院普外科
胃癌是我国第二大常见癌症和第三大癌症相关死亡原因[1]。根治性胃切除术辅助化疗或放化疗是可切除胃癌常用的治疗方案,但术后易出现局部复发和远处转移,其中70%~80%的淋巴结阳性患者5年内复发或转移[2]。因此,准确评估胃癌患者术后的复发风险及预后具有重要意义。目前,用于评估胃癌患者预后的工具包括组织学分类、TNM分期以及基于TCGA的分子分类,但胃癌的分子分类方法复杂且昂贵,因此在临床实践中并未得到常规应用。既往研究证实炎症在癌症发生及进展过程中起着至关重要的作用[3-5]。肝脏是最大的实体免疫和代谢器官,也是胃癌转移的主要靶器官[4]。白蛋白与碱性磷酸酶比值(albumin to alkaline phosphatase ratio,AAPR)是一种新型的癌症患者预后指标,可反映全身炎症状况和营养状况,目前,在肾细胞癌、肺癌、乳腺癌和胆管癌等多种恶性肿瘤中已经发现AAPR低水平与患者不良预后相关[6-10]。但是,AAPR在胃癌中的作用尚未明确。本研究通过术前检测AAPR水平并评估其在胃癌根治术后患者预后中的价值,以期为胃癌的风险分层和临床决策提供信息。
1 资料与方法
1.1 研究对象
回顾性招募2014年6月至2019年11月在上海交通大学医学院附属新华医院崇明分院接受胃癌根治术的胃癌患者为研究对象。纳入标准:⑴经病理学确诊为胃癌;⑵接受胃切除术治疗。排除标准:⑴合并其他恶性肿瘤;⑵接受过新辅助化疗;⑶合并其他可能影响白蛋白(albumin,ALB)和碱性磷酸酶(alkaline phosphatase,ALP)水平的疾病如肝病、自身免疫性疾病或骨病等;⑷临床数据或随访数据不完整。本研究符合赫尔辛基宣言(2013年修订),且经本院伦理委员会批准(伦理批件号:201612368)。
1.2 数据收集
从医院数据库中收集患者术前信息,包括年龄、性别、ALB、ALP、东部肿瘤协作组(ECOG)体能状态(PS)、内镜检查结果、肿瘤部位、个人病史、胃切除术史和治疗过程。根据第八版TNM分期系统和病理信息重新评估分期[11]。AAPR的计算公式:AAPR=ALB/ALP。采用最大选择秩统计量计算AAPR的最佳截断值,并根据该值将患者分为高AAPR组和低AAPR两组。
1.3 研究结局及随访
所有患者术后均以电话或门诊方式进行随访,前3年每1~3个月随访1次,第4~5年每6个月随访1次,之后每年随访1次,随访患者生存情况,截至2020年12月。研究结局为无病生存期(disease-free survival,DFS)和总生存期(overall survival,OS),其中DFS定义为自术后第1日至患者复发、死亡或随访结束的时间;OS定义为术后第1日至死亡或随访结束的时间。
1.4 统计学方法
采用R 3.5.3(http://www.r-project.org)和IBM SPSS 25.0软件对数据进行统计分析。计量资料采用均数±标准差表示,组间比较采用独立样本t检验;分类变量以n(%)表示,组间比较采用χ2检验或Fisher切确概率法。采用Kaplan-Meier检验估计累积生存率,组间比较采用log-rank检验。采用Cox比例风险模型分析AAPR与DFS和OS的关联性,构建2个模型,其中模型1为单因素模型;模型2为多因素模型,校正年龄、性别、T分期、N分期、TNM分期、Lauren′s分期、血管侵犯、神经侵犯、贫血、HER2、部位、吸烟、饮酒、糖尿病、乙型肝炎、幽门螺杆菌和治疗等因素,计算风险比(HR)及95%可信区间(CI)。AAPR与TNM分期结合,构建AAPR-TNM系统用于预测DFS和OS,采用似然比检验(LRT)、AIC和C-index比较TNM和AAPR-TNM系统的预测能力,LRTχ2值越大,AIC值越小,C-index值越大,模型性能越高。本研究所有检验均为双侧,以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
2014年6月至2019年11月在本院共回顾性招募426例胃癌患者,根据排除标准排除了69例,最终纳入357例患者进行分析。357例患者的中位年龄为63岁(范围:23~79岁);男性267例,女性90例。最大选择秩统计量显示,AAPR最佳截断值为0.412。根据AAPR最佳截断值将患者分为高AAPR组(131例)和低AAPR组(226例)。两组患者的一般资料比较见表1。

表1 不同AAPR水平胃癌患者的一般资料[n(%)]Tab.1 Baseline characteristics of gastric cancer patients with different AAPR levels[n(%)]
2.2 AAPR水平与胃癌患者术后预后的关系
357例患者共中位随访46.5个月,其中复发65例,死亡39例。Kaplan-Meier生存分析结果显示,高AAPR组3年DFS率和3年OS率均高于低AAPR组(78.5%vs38.1%,log-rank χ2=49.652,P<0.001;87.2%vs51.1%,log-rank χ2=33.532,P<0.001),见图 1。采用Cox比例风险模型分析AAPR与DFS和OS的关系,模型1结果显示,与低AAPR患者相比,高AAPR患者的复发风险(HR=0.23,95%CI:0.14~0.38)和死亡风险(HR=0.20,95%CI:0.11~0.37)均较低;模型 2校正年龄、性别、T分期、N分期、TNM分期、Lauren′s分期、血管侵犯、神经侵犯、贫血、HER2、部位、吸烟、饮酒、糖尿病、乙型肝炎、幽门螺杆菌和治疗等因素后,结果显示,高 AAPR 是 DFS(HR=0.25,95%CI:0.15~0.42)和OS(HR=0.24,95%CI:0.13~0.39)的保护因素,见表2。
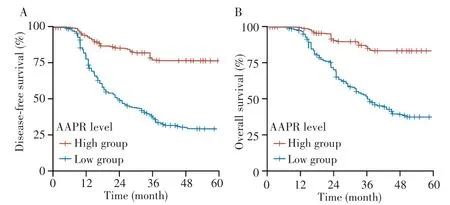
图1 不同AAPR水平胃癌患者的DFS和OS的生存曲线Fig.1 Survival curves of DFS and OS in gastric cancer patients with different AAPR levels

表2 AAPR与DFS和OS的关联性分析Tab.2 Association of AAPR to DFS and OS
2.3 AAPR-TNM系统在胃癌患者术后预后中的预测价值
在预测DFS方面,AAPR-TNM系统较TNM分期系统具有更大的χ2值、更小的AIC以及更高的C-index(均P<0.001);而在预测OS方面,AAPR-TNM系统亦较TNM分期系统具有更大的χ2值、更小的AIC以及更高的C-index(均P<0.001),见表3。以上结果表明AAPR-TNM系统在预测DFS和OS方面优于传统的TNM分期系统。
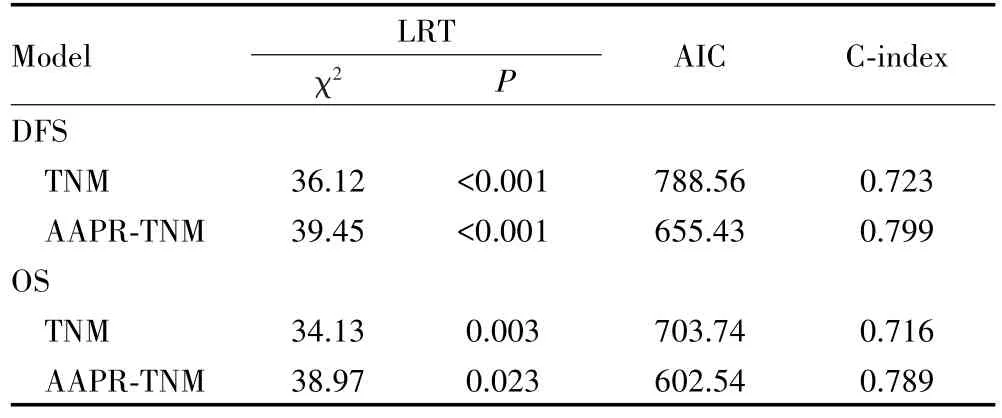
表3 不同预测系统的性能比较Tab.3 Performance comparison of different prediction systems
3 讨论
本研究分析了357例胃癌患者中AAPR的预后价值,并计算了AAPR的临界值,结果发现AAPR是接受胃癌根治术的胃癌患者的独立预后因素,且构建的AAPR-TNM系统较TNM分期系统具有更高的预后评估价值。
ALB是最丰富的血清蛋白,由肝细胞产生,主要参与DNA复制、细胞生长和对致癌物的抗氧化作用等生物过程[12]。研究表明,低ALB可反映患者营养不良和免疫力受损,以及对抗癌治疗的反应不敏感[13],其可作为结直肠癌、骨肉瘤、肝细胞癌和前列腺癌等预后预测的生物标志物[14-17]。而在胃癌中也有研究发现低ALB与患者预后不良有关[18]。ALP是一类含锌金属酶,可在碱性环境下使各种类型分子的磷酸单酯脱磷酸化,包括核苷酸、蛋白质和生物碱[19]。作为一种质膜结合糖蛋白,ALP通常局限于细胞表面,血清中仅释放微量ALP,但在肝细胞癌、肾癌等部分恶性肿瘤中ALP被重新激活和释放,损伤肝功能[20-21]。而在胃癌中,血清ALP高水平与其骨转移有关[22]。综上可见,ALB和ALP与多种癌症患者包括胃癌患者的预后密切相关。目前临床上常通过联合多项生物标志物预测患者预后。AAPR是基于ALB与ALP计算的用于评价癌症患者预后的一种新型指标。既往研究发现AAPR水平是可切除肝细胞癌的有效预后指标,且其预后预测能力高于单独的ALB或ALP[23]。此外,许多研究亦证实AAPR具有独立的预后价值,能更好地预测不可切除和可切除肿瘤患者的生存率[24-25]。本研究亦发现胃癌患者术前AAPR水平降低,其最佳临界值为0.437。多因素Cox回归分析发现术前AAPR是接受D2胃切除术胃癌患者的独立预后因素,即术前AAPR水平降低不仅与较差的DFS相关,而且与较差的OS相关。此外,本研究将AAPR和TNM分期结合构建一个新的AAPR-TNM系统,并采用LRT、AIC和C-index等指标比较TNM和AAPRTNM系统在DFS和OS方面的预测能力,结果发现AAPR-TNM系统在DFS和OS方面的预测效能均优于TNM分期系统,进一步证实AAPR在预测胃癌患者预后中的价值。
综上所述,本研究证实低AAPR可用于预测胃癌患者的不良预后,且联合TNM分期可进一步提高预测效能。然而,本研究仅是一项回顾性研究且样本量较小,结果仍需在大样本的前瞻性多中心研究中进行验证。

