北方黑土地花生根际丛枝菌根菌(AMF)分离鉴定及应用
王雪霏,曹哲,杨钥,周馨瞳,王子郡,邵文杰,周子恺,徐佳璐,孟令波,郑苗苗
北方黑土地花生根际丛枝菌根菌(AMF)分离鉴定及应用
王雪霏1,曹哲1,杨钥1,周馨瞳1,王子郡1,邵文杰1,周子恺1,徐佳璐2,孟令波1,郑苗苗1
(1. 哈尔滨学院 食品工程学院,黑龙江 哈尔滨 150001;2. 哈尔滨医科大学 口腔医学院,黑龙江 哈尔滨 150001)
采集黑龙江省种植花生区域的黑土土样,通过湿筛法从花生根际土样中分离纯化出AMF菌孢子,根据形态学特征和分子生物学进行鉴定,获得一株AMF菌,为株幼套球囊霉(),通过Single spore isolating方法完成AMF菌培养繁殖,孢子量350个/g,将获得的纯净孢子接种到以花生为宿主植物的盆钵中,进行扩大繁殖.AMF菌能够促进花生根系伸长生长,提高根系对N,P,K无机盐离子的吸收,而且还具有抗倒伏作用,提高了花生产量,同时提高花生的油脂含量,能使花生中油脂含量提高2.3%~2.7%.
AMF菌;东北四粒红花生;油脂
Arbuscular Mycorrhizal Fungi(AMF)菌是一种与植物根际共生关系的丛枝菌根真菌,主要包括木霉、球囊霉、地管囊霉等,能够促进植物根对N,P,K的吸收,对病毒、细菌均有抑制作用,对植物产生杀菌、抗菌、抗病、抗旱、抗寒、抗盐碱等作用[1-4].
AMF菌的主要作用是可改善植物的矿质营养,尤其是磷素营养;可提高植物在极端环境中的抗逆性;有助于植物抵御病原菌的侵害;能改善土壤团粒结构;促进作物的高产稳产、优质、高效.AMF菌在农业的可持续发展及生态保护等方面具有重要意义[5-6].AMF菌可以侵染植物根部与根部共生,进而发挥其主要作用.AMF优良菌株的分离筛选是AMF应用技术中的基础环节,一个优良的菌种需要有遗传方面的稳定性,能有效侵染目标植物,改善植物的营养状况或品质;在与土著菌和病原菌等其它微生物的生存竞争中占优势,而且要具备适应或抵抗不利和极端环境的能力[7-9].
花生营养价值丰富,富含油脂、各种维生素、亚油酸等,伴随我国花生制品加工企业的快速发展,花生原料已经不能满足现有市场需求[10].要解决当务之急,就要从本质上扩大生产规模,提高花生产量和营养物质的含量.其中最重要的是提高花生营养物质含量,解决这一问题的重要手段就是提高肥料功能和质量[11-14].
由于花生的各种营养成分含量对花生加工企业的效益指标影响甚大,因此,以花生作为原材料加工企业在收购花生时一直都把营养物质含量作为最主要的定价指标,花生营养物质含量低,使加工企业和花生种植户的利益都受到了严重的冲击[15].不仅挫伤了农民种花生的积极性,也造成了加工企业因缺少原料而导致开工不足[7]109.因此,AMF菌能够有效提高花生中营养物质含量是解决目前花生种植加工领域困境的主要办法.本研究从花生根际土样中分离纯化出AMF菌孢子,根据形态学特征和分子生物学进行鉴定,获得AMF菌株,通过Single spore isolating方法完成AMF菌扩大繁殖.
1 材料与方法
1.1 实验材料
花生根围土样15份,花生根系20根(黑龙江省双城市杏山镇农田).
Fungi Genomic DNA Extraction Kit基因组DNA提取试剂盒(Solarbio公司);Qiagen凝胶回收试剂盒(Qiagen公司);rTaq DNA聚合酶(宝日医生物技术有限公司);dNTP,无水乙醇(天根生化科技有限公司);蔗糖,维生素B6,维生素B1(哈尔滨迈科麦科技有限公司);乙酰丁香酮(上海振品化工有限公司);羧苄青霉素,磷酸二氢钾(河北鹏与生物科技有限公司);硫酸钾,硫酸锌,硫酸铜,硫酸锰,硫酸铁(山东腾飞生物科技有限公司);肌醇(哈尔滨迈科麦科技有限公司);烟酸(上海优选生物科技有限公司);甘氨酸(上海优选生物科技有限公司);Tris(北京博奥拓科技有限公司);Agar(北京兰杰柯科技有限公司);氢氧化钠(沧州刘氏化工有限公司);冰醋酸(山东旭晨化工科技有限公司);溴化乙锭(江苏西格玛电器有限公司).以上试剂均为分析纯.
1.2 实验方法
1.2.1土壤采集用铁锹除去土壤表层大块颗粒,在近花生根际附近向下挖15~20 cm,将整株花生根系挖出,放入无菌自封袋中,用干冰保存,带回实验室保存备用.
1.2.2AMF培养取保存土样30 g,采用湿筛法从中筛选AMF菌孢子,在电子显微镜下观察孢子数量,采用Single spore isolating方法挑选形态一致的孢子接种于花生植株根部,培养10~14周,获得大量纯净AMF菌孢子.
1.2.3AMF菌扩繁选取1~2 mm粒径碎石和建筑河砂,按体积比1∶1混合,通过高压蒸汽灭菌2~3h,冷却,装入消毒花盆中,取AMF菌孢子撒在花盆中,上面铺一层碎石河砂,将已经消毒的花生种子播种到花盆中,最后覆盖一层碎石河砂,将盆栽置于温室培养,定期浇灌,培养3~4个月,将收集的AMF菌搅拌到黑土和蛭石混合均匀的基质中,种植花生,待花生成熟后,收集盆中土壤样品,完成AMF菌的大量扩繁.
1.3 AMF菌鉴定
采用徒手切片将花生的根用碱解离-酸性孔雀绿染色法处理,利用光学显微镜观察侵染后的菌丝和孢囊.通过观察孢子的形状、大小、颜色等特征,并参照《真菌鉴定手册》确定AMF菌的种属[14]830.通过提取AMF菌孢子基因组DNA,进行PCR扩增18SrRNA基因片段,上游引物:5′-GTAGTTACATCGTTGACTC-3′,下游引物:5′-CTTGCGTCTACTCCGTTCAG-3′,得到的PCR产物通过琼脂糖凝胶电泳检测后,送至生工生物工程股份有限公司进行测序,将测序结果进行序列比对.
2 结果与分析
2.1 AMF菌形态观察
花生根部横切结果见图1.由图1可见,在花生根系中存在菌丝和孢囊结构,且菌丝体侵染根外层细胞后还引起根系表面明显隆起.因此,可以确定花生根际附近土壤中存在AMF菌.

图1 花生根部横切
2.2 AMF菌分子鉴定
AMF菌基因组DNA见图2.由图2可见,基因组DNA条带清晰.在PCR扩增中,获得产物约1 300 bp DNA片段,条带清晰且无其它杂质存在,可以进行测序(见图3).由生工生物工程股份有限公司测序得出有效序列长度为890 bp.将测序结果与NCBI数据库中相关序列进行比对,结果显示,AMF菌株与同源性最高,相似度为98%,并结合菌株AMF的形态观察,可初步鉴定菌株AMF为丛枝菌根真菌.

图2 AMF菌基因组DNA
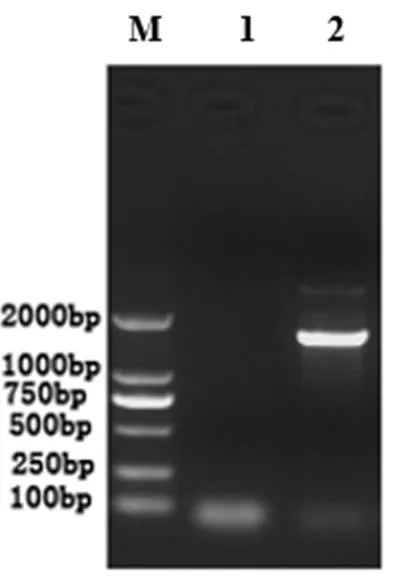
图3 PCR扩增结果
2.3 AMF菌对花生根系形态及干物质积累的影响
使用市售普通化肥(150 kg磷酸二氢钾 + 75 kg尿素)按当地习惯施肥,作为对照1.施加液体肥,稀释150倍后浇灌至土壤,作为对照2.将制备的AMF菌颗粒与对照2混合,作为实验组.在不同处理下,花生的根系形态指标方差分析结果见表1.由表1可见,在花生不同的生长发育时期中,总根长度、根平均直径、根表面积、根体积使用不同肥料处理,表现出不同程度的差异,且差异显著(<0.05),说明花生根系受不同肥料影响较大.其中实验组在结荚期和成熟期总根长度、根平均直径、根表面积、根体积提高较明显,促进了植株的生长发育,提高干物质累积量,增加产量.
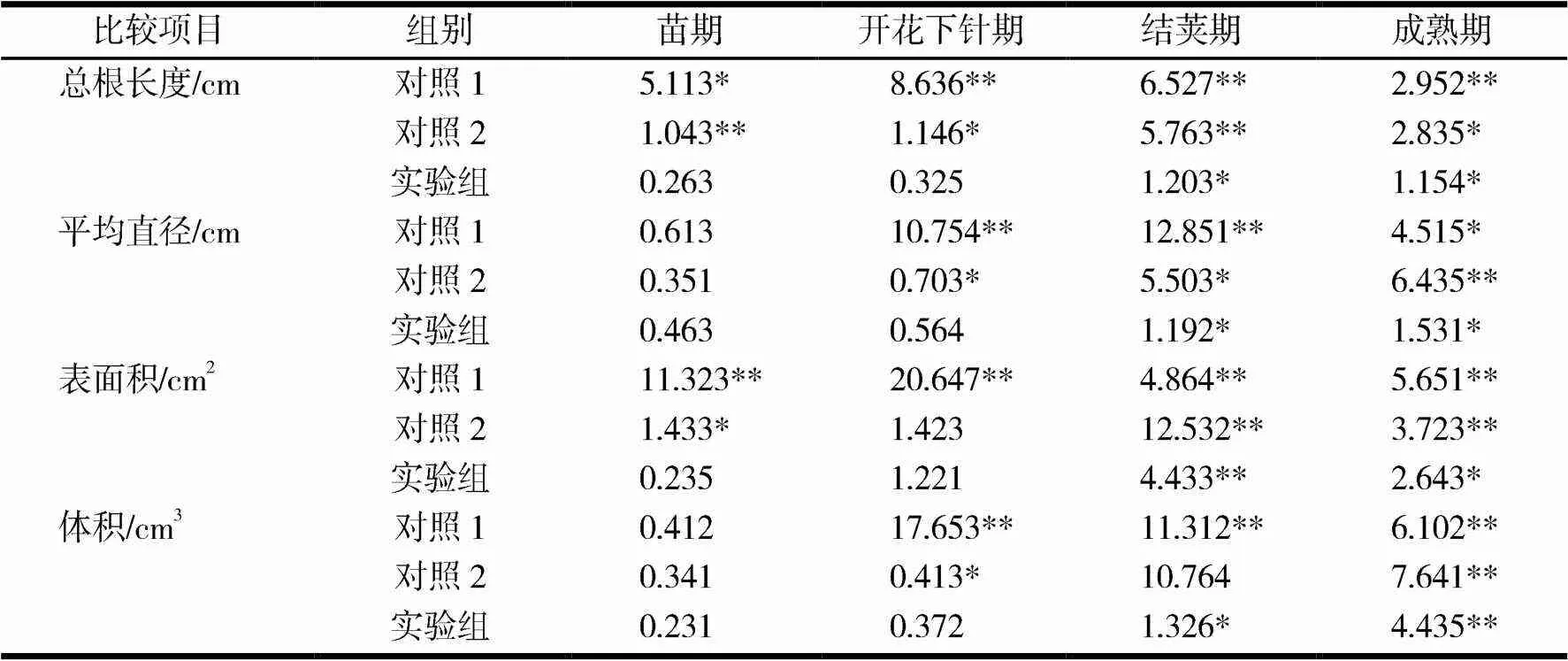
表1 不同处理花生根部形态指标方差分析
注:*表示在0.05水平显著;**表示在0.01水平显著.
不同处理花生在各生长阶段总根长度、根平均直径、根表面积、根体积、干物质量情况见表2.由表2可见,不同生长发育期总根长度、根平均直径、根表面积、根体积因使用不同的肥料而具有一定的差异,从苗期到结荚期不断增加,总根长度、根表面积在结荚期值最大,到了成熟期有下降;根平均直径、根体积在成熟期还会继续增加,在成熟期达到最大值.从实验数据得到,加入AMF菌的有机液体肥后,根体积增加较大,对花生植株抗倒伏能力的提高和固氮能力的增强具有重要作用.随着不同生长发育期干物质积累也在缓慢增加,开花期至结荚期增加显著,呈上升趋势,成熟期时达到积累最高峰.
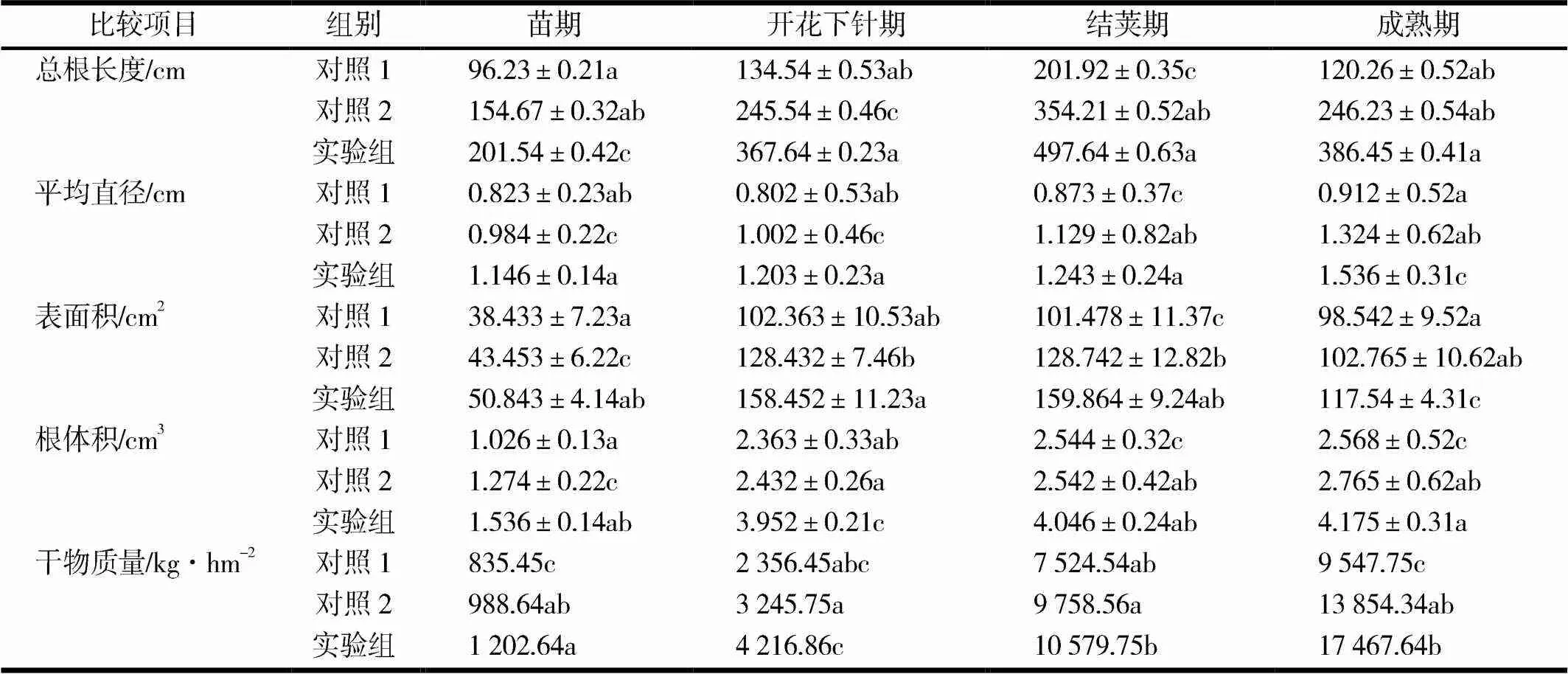
表2 不同处理花生在各生长阶段总根长度、根平均直径、根表面积、根体积、干物质量
注:数据为3次重复的平均值,小写字母表示0.05水平上差异显著性.
数据表明,加入AMF菌的有机液体肥能够促进根系伸长生长,提高根系对无机盐离子的吸收,而且还具有抗倒伏作用,提高了花生产量.
2.4 AMF菌对花生根系吸收营养物质的影响
2.4.1AMF菌对花生根系吸收N的影响不同处理花生在各生长阶段对N的吸收量见表3.由表3可见,花生从出苗到开花期,对养分N的吸收较少,随着花生生长发育的进行,对N的吸收量逐渐增加,在成熟期达到高峰,占总量40%以上.从不同处理间的差异上看,苗期对N吸收总量:实验组>对照1>对照2,结荚期和成熟期对N吸收总量:实验组>对照2>对照1.结果表明,加入AMF菌液体肥比当地习惯施肥、未加入AMF菌液体肥提高了花生根系对N的吸收量,AMF菌在施加一定量含N液体肥的基础上促进了花生的生长,但施N量过高也会影响AMF菌的侵染.AMF菌促进花生根系生长,发达的根系与AMF菌形成共生关系,土壤中的AMF菌丝能够促进对液体肥中氨基酸的吸收,加速有机N的矿化,AMF的菌丝与花生的根系形成菌丝网络,有效提高花生根部对N的吸收.
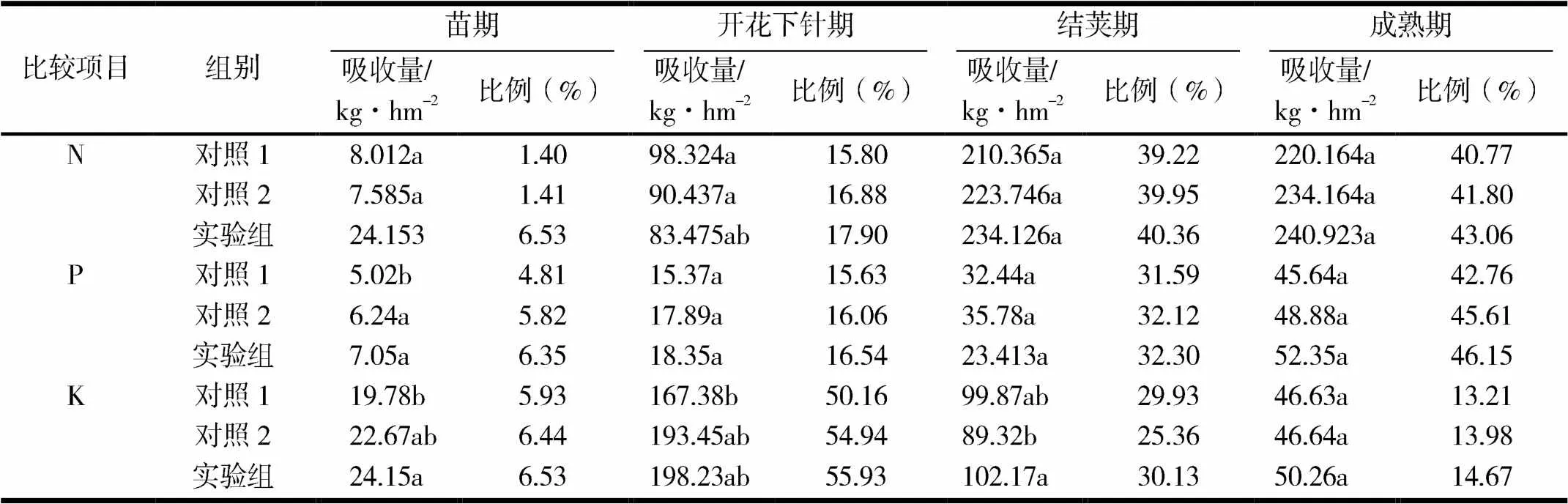
表3 不同处理花生在各生长阶段对N,P,K的吸收量
2.4.2AMF菌对花生根系吸收P的影响不同处理花生在各生长阶段对P的吸收量见表3.由表3可见,花生从出苗到开花期,对养分P的吸收较少,随着花生生长发育的进行,对P的吸收量逐渐增加,在成熟期达到高峰,占总量42%以上.从不同处理间的差异上看,苗期、开花期和成熟期对P吸收总量:实验组>对照2>对照1.结果表明,加入AMF菌液体肥比当地习惯施肥、未加入AMF菌液体肥提高了花生根系对P的吸收量,AMF菌能够促进花生根对液体肥中P的吸收,提高花生产量.AMF菌在施加一定量含P液体肥的基础上促进花生的生长,但施P量过高也会影响AMF菌的侵染.
2.4.3AMF菌对花生根系吸收K的影响不同处理花生在各生长阶段对K的吸收量见表3.由表3可见,花生在苗期对养分K的吸收量较少,不同处理下对K的吸收量仅占总吸收量的5.93%~6.53%.在进入开花下针期,对K的吸收量迅速增加,整个开花下针期对K吸收量占总量的50.16%~54.94%,为花生吸收K的最高峰时期.在结荚期和成熟期,吸收K的量逐渐减少,不同处理对K的吸收没有明显影响.加入AMF菌液体肥,能够促进花生根对液体肥中K的吸收,增加气孔导度,提高花生的光合速率,显著增加花生产量,尤其是花生中油脂的含量.
采用索式提取法测定对照1、对照2、实验组中花生油脂含量分别为18.35%,18.43%,18.85%.结果表明,加入AMF菌液体肥的油脂含量比当地习惯施肥油脂含量提高了2.7%,加入AMF菌液体肥的油脂含量比未加入AMF菌液体肥油脂含量提高了2.3%.因此,加入AMF菌液体肥能够显著提高花生中油脂含量,进而提高花生出油率.
3 结语
自发现AMF菌以来,人们对其分离筛选、形态、作用机理等领域进行了深入研究,证实丛枝菌根真菌已经与植物形成共生关系[15-16],这些共生体对植物的生长发育、维持物质循环和绿色生态农业具有深远意义.Alistair[17]等于2002年发现几种新的菌株,自然界中被人们发现的AMF菌数量较少,大多数AMF菌的分类地位和生理特性尚不明确.
本研究在花生根系中发现丛枝菌根真菌结构,通过对花生根际附近土壤筛选,获得AMF菌孢子,进行培养和大量扩繁;通过形态学鉴定发现AMF菌菌丝和孢子特征与特征相似;通过对18S rRNA基因测序发现AMF是.此外,有研究发现可以促进植物对萜类化合物(甾醇、类胡萝卜素、叶绿素、赤霉素、脱落酸、细胞分裂素)的积累,参与植物呼吸作用、光合作用并调节植物生长发育,在植物生命活动中具有重要作用[18].
AMF菌与液体肥混合施用时,可以与微量元素形成螯合物,增加微量元素向花生根部、叶部和其它部位运转的数量.调节常量元素与微量元素的比例,加强酶对糖分、营养物质、脂肪及各种维生素的合成运转[9]35.促进酶的活性,使多糖转化成可溶性单糖,使淀粉、营养物质、脂肪的合成积累增加,加速各种代谢初级产物从花生茎叶向根系输送,提高花生块根的产量,从而能够使花生增产40%~70%的同时,改善花生的品质.AMF菌还能减少无机化肥使用量,保护生态环境,可保护土壤水稳性团核结构的形成,调节土壤pH、水、肥、气、热状况,提高土壤的交换容量,增加花生对农药的抗药性.AMF菌加入肥料中,比一般肥料利用率高,可以减少化肥用量,降低肥料投入,减少施用化肥对环境造成的污染,有利于保护生态环境.
[1] Jerbi,Maroua,Labidi,et al,Contribution of Native and Exotic Arbuscular Mycorrhizal Fungi in Improving the Physiological and Biochemical Response of Hulless Barley(Hordeum vulgare ssp. nudum L.)to Drought[J].Journal of Soil Science and Plant Nutrition,2022,22:2187–2204.
[2] Qiao Yangui,Bai Yuxuan,She Weiwei,et al,Arbuscular mycorrhizal fungi outcompete fine roots in determining soil multifunctionality an microbial diversity in a desert ecosystem[J].Applied Soil Ecology,2022,6(17):171-180.
[3] 叶少萍,曾秀华,辛国荣,等.不同磷水平下丛枝菌根真菌(AMF)对狗牙根生长与再生的影响[J].草业学报,2013,22(1):46-52.
[4] 曾秀华,叶少萍,白昌军,等.接种丛枝菌根真菌(AMF)及施磷量对狗牙根抗旱性的影响[J].热带作物学报,2011,32(6):1069-1074.
[5] Bary F,Gange A C,Crane M,et al.Fungicide levels and arbuscular mycorrhizal fungi in golf putting greens[J].Journal of Applied Ecology,2005,42:171-180.
[6] 马放,刘贵祥,王立,等.AMF对早熟禾建植及氮、磷截留能力的强化作用[J].中国给水排水,2013,29(13):64-68.
[7] 康福丽,朱国政,林钰,等.AMF对金橘苗根围土壤酶活性及植株生长的影响[J].广西师范大学学报(自然科学版),2017,35(1):104-112.
[8] Peng Sili,Guo Tao,Liu Gangcai.The effects of arbuscular mycorrhizal hyphal networks on soil aggregations of purple soil in southwest China[J].Soil Biology and Biochemistry,2013,20(10):63-69.
[9] 孙秀秀,晋文娟,李衍素,等.两种捷克丛枝菌根真菌组合菌剂对设施黄瓜苗期生长的影响[J].中国蔬菜,2016,12(4):34-37.
[10] Gamper H A,Walker C,Schüssler A.Diversispora celata sp. nov:Molecular ecology and phylotaxonomy of an inconspicuous arbuscular mycorrhizal fungus[J].New Phytologist,2009,182(2):495-506.
[11] Mohan J E,Cowden C C,Baas P,et al.Mycorrhizal fungi mediation of terrestrial ecosystem responses to global change:Mini-review[J].Fungal Ecology,2014,15(3):3-19.
[12] Ricken B,Höfner W.Effect of arbuscular mycorrhizal fungi(AMF)on heavy metal tolerance of alfalfa(Medicago sativa L.)and oat(Avena sativa L.)on a sewage-sludge treated soil[J].Zeitschrift Fuer Pflanzenernaehrung Und Bodenkunde,1996,159(2):189-194.
[13] 梁雪飞,唐梦君,吕立新,等.三种丛枝菌根真菌对茅苍术的生长、生理及主要挥发油成分的影响[J].生态学杂志,2018,37(6):1871-1879.
[14] 王幼珊,刘润进.球囊菌门丛枝菌根真菌最新分类系统菌种名录[J].菌物学报,2017,36(7):820-850.
[15] 王发园,林先贵,周健民.丛枝菌根真菌分类最新进展[J].微生物学杂志,2005,16(3):41-45.
[16] Ijdo M,Cranenbrouck S,Declerck S.Methods for large-scale production of AM fungi:past,present,and future.[J].Mycorrhiza,2011,21(1):1-16.
[17] Alistair G Rust,Emmanuel Mongin,Ewan Birney,et al.Genome annotation techniques:new approaches and challenges[J].Drug Discovery Today,2002,7(11):S70-S76.
[18] Hiruma K,Kobae Y,Toju H.Beneficial associations between Brassicaceae plants and fungal endophytes under nutrient-limiting conditions:evolutionary origins and host-symbiont molecular mechanisms[J].Current opinion in plant biology,2018,44:145-154.
Isolation identification and application of inter-rhizosphere mycorrhizal fungi(AMF)from peanut in northern blackland
WANG Xuefei1,CAO Zhe1,YANG Yue1,ZHOU Xintong1,WANG Zijun1,SHAO Wenjie1,ZHOU Zikai1,XU Jialu2,MENG Lingbo1,ZHENG Miaomiao1
(1. School of Food Engineering,Harbin Institute,Harbin 150001,China;2. School of Dentistry,Harbin Medical University,Harbin 150001,China)
Black soil samples were collected from peanut growing areas in Heilongjiang Province,and AMF spores were isolated and purified from peanut inter-root soil samples by wet sieving method.According to morphological characteristics and molecular biology identification,one AMF strain was obtained as.The culture and reproduction of AMF was completed by single pore isolating method,and the spore amount was 350 pieces/g.The pure spores obtained were inoculated into a potted bowl with peanut as the host plant for expanded propagation.AMF can promote the elongation growth of peanut roots and improve the uptake of N,P and K inorganic salt ions by the roots.Moreover,it also has lodging resistance and improves peanut yield,at the same time,increasing the oil content of peanut can increase the oil content of peanut by 2.3%~2.7%.
AMF fungus;northeast four-grain red phlox;oil
1007-9831(2022)08-0071-06
Q93
A
10.3969/j.issn.1007-9831.2022.08.014
2022-04-18
黑龙江省大学生创新创业训练计划项目(202210234053);哈尔滨学院青年博士科研启动基金项目(HUDF2019103);黑龙江省博士后资助经费项目(LBH-Z18028)
王雪霏(2002-)女,黑龙江大庆人,在读本科生.E-mail:2479435077@qq.com
郑苗苗(1982-),女,黑龙江哈尔滨人,教授,博土,从事应用微生物研究.E-mail:miaomiao_0000@126.com

