镉胁迫下草地早熟禾离子吸收及生理响应特征分析
崔婷,王勇,吴万鑫,向航,马晖玲
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中⁃美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
土壤重金属污染可导致植物中毒并通过食物链危害人类健康[1]。Cd 是重要的重金属污染物之一,全世界每年约有3.0×104t Cd 被释放到环境中,其中1.3×104t 由人类活动引起[2]。中国在长期的工业生产和矿产开采活动中造成的重金属污染事件近年来逐渐凸显,为此,国务院批准首个重金属污染治理专项规划,重点防控镉(Cd)、铅(Pb)、汞(Hg)等重金属污染物,并强调优先考虑植物修复防治措施[3]。《土壤污染防治行动计划》实施以来,农用地土壤重金属污染得到初步遏制,“净土保卫战”取得初步成效,然而,部分地区土壤污染隐患依然突出[4]。
植物复杂的防御反应是其应对不利环境影响的关键,Cd 胁迫通常会激活一些信号网络,调控植物转录和代谢以抵御Cd 胁迫[5]。植物激素信号在响应外界胁迫方面通常具有积极作用。在Cd 胁迫下对玉米(Zea mays)根系的转录组分析发现,生长素信号通路相关基因显著富集,对生长素生物合成、运输和下游反应基因转录丰度的比较表明,这些基因在Cd 处理下有普遍的表达反应,Cd 处理导致玉米根系生长素(IAA)含量显著降低,而外源喷施IAA 可促进根系生长,增加Cd 吸收[6]。外源IAA 可显著增加油菜对Cd的吸收,同时促进Cd 从根部向地上运输[7]。Cd 胁迫通常导致植物生物量减少,抑制植物光合,降低矿质营养元素含量,并引起植物氧化应激,而施加外源赤霉素(GA3)可缓解这种抑制作用[8]。Cd2+具有较低的氧化活性,但由于Cd2+与其他二价阳离子在化学上的相似性,Cd2+通常会间接导致植物活性氧(ROS)代谢失衡,影响植物正常生长发育[9]。植物抗氧化酶系统是植物清除ROS 的重要途径,研究表明,Cd 胁迫处理黑麦草后,可溶性蛋白含量减少,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、丙二醛(MDA)含量均高于对照,而FeSOD,MnSOD,ChlCu/ZnSOD,Cyt Cu/ZnSOD,APX,GPX,GR 和POD 基因均上调表达[10]。另外,Cd 胁迫下,植物体内Cd 含量显著增加并抑制其对K、Ca、Mg、Cu、Fe、Zn 的吸收[11]。
草坪草因具有对Cd 极强的吸收效率、高度耐Cd能力和优良的遗传性状,在Cd 污染土壤修复方面具有极大的优势。Li 等[12]研究发现,草地早熟禾(Poa pra⁃tensis)可在Cd、Zn 污染土地上较好生长,表明草地早熟禾具有较强的Cd 耐受性。草地早熟禾分布广泛、生物量大、抗逆性强、根系发达,可以迅速覆盖地表,且在Cd 耐受性方面远高于超富集植物龙葵[13-14]。另一方面,草地早熟禾具有发达的不定根系统,短根茎可将疏丛紧密联系在一起,形成稠密网状,在无机离子吸收方面具有极大优势[13]。因此,利用草地早熟禾修复Cd 污染土壤在实际应用中具有深远意义。因此,研究Cd 胁迫下草地早熟禾的生理变化及草地早熟禾对Cd 的吸收和转运变,以期为Cd 污染草坪草土壤治理提供理论依据。
1 材料和方法
1.1 试验材料
以草地早熟禾品种午夜(Poa pratensiscv.Mid⁃night)为试验材料,种子由北京克劳沃草业技术开发中心提供。
1.2 试验设计与处理
草地早熟禾种子用蒸馏水过夜浸泡后用70%酒精浸泡1 min,20%次氯酸钠浸泡15 min,灭菌水冲洗5~6 次,晾干后均匀撒播在填装蛭石的育苗钵(8 cm×10 cm)中,出苗后间苗至30 株/钵,置于人工智能气候培养箱中培养,温度25 ℃/20 ℃,光周期16 h/8 h。每天喷洒蒸馏水至出苗两周后改用霍格兰德营养液浇灌,每3 天更换1 次营养液,继续培养45 d 后开始施加处理。
试验处理1:将预培养的幼苗施加不同Cd 浓度处理,根据前期预试验结果,将Cd 胁迫浓度梯度依次设置为0(CK)、1.0、1.5、2.0、2.5、3.0 mmol/L。处理7 d 后测定各项生理指标。处理21 d 后拍照并测定生长指标。
试验处理2:将预培养的幼苗施加0(CK)和1 mmol/L 处理,3 d 后测定其叶片激素含量,7 d 后测定其根系和叶片Ca2+、Mg2+、Zn2+含量并测定7、14、21、28 d 时根系和叶片中的Cd 含量。
1.3 指标测定
株高和根长:采用直尺测定。
叶片鲜重和根系鲜重:采用分析天平称量。
光合色素含量测定:取新鲜的草地早熟禾叶片0.2 g,用95%乙醇浸泡24 h 后,测定470,649 和665 nm 波长下的吸光度值并计算相关色素含量[15]。
蒸腾速率(Tr)、叶片气孔导度(Gs)、净光合速率(Pn)、胞间CO2浓度(Ci)采用GFS⁃3000 便携式光合测量仪测定。
SOD 活性测定:采用氮蓝四唑(NBT)光还原法测定[15]。POD 活 性 测 定:采 用 愈 创 木 酚 法 测 定[15]。CAT、APX 活性测定:采用过氧化氢还原法测定[15]。
植物激素含量测定:参照刘燕[16]的方法,取新鲜植物组织2 g,加入液氮研磨至粉末后加入20 mL 80%预冷的甲醇溶液,在避光摇床中提取4~6 h,转速180 r/min,4 ℃条件 下 浸提16~22 h,10 000 r/min 离心15 min,提取上清液并在残渣中加入10 mL 80%甲醇,涡旋仪混匀后超声波提取5 min,再次离心并合并上清液。将上清液在40 ℃下减压离心至20 mL,加入石油醚10 mL,充分摇匀后静置脱色10 min,弃去上层,再次加入石油醚10 mL,10 000 r/min 离心10 min,再次弃去上层,40 ℃减压浓缩至1/3,加10 mL 乙酸乙酯萃取2 次,合并上清液,并将上清液置于40 ℃减压浓缩至近干后加入2 mL 色谱甲醇复溶,经0.22 μm 有机滤膜过滤后在液相色谱仪中进行IAA、ABA、GA3、ZT 含量测定。
Ca2+、Cd2+、Mg2+、Zn2+浓度的测定:对不同处理的草地早熟禾根、叶片进行取样,放入烘箱105 ℃杀青15 min,70 ℃烘至恒重,将不同部位研碎成粉末,过100 目(0.15 mm)筛。准确称取0.2 g,重复4 次,放入50 mL 消化管,加入8 mL 消解试剂(HNO3∶H2O2=7∶1,v,优级纯),放入微波消解仪,控制温度:1)130 ℃,升温10 min,保温2 min;2)150 ℃,升温3 min,保温2 min;3)180 ℃,升温3 min,保温15 min。压力设定均为400 PSI。消解完成后用1% HNO3定容至50 mL容量瓶,保存。用火焰原子吸收分光光度计(AA-6800,岛津,日本)测定样品溶液中Ca2+、Cd2+、Mg2+、Zn2+的浓度。
1.4 数据处理
采用SPSS 19.0 进行数据分析,Microsoft Excel 2019 做图,数据用“平均值±标准误”表示。
2 结果与分析
2.1 Cd 胁迫对草地早熟禾生长的影响
1.0 mmol/L 浓度Cd 胁迫即可抑制草地早熟禾生长,随着Cd 浓度增加,抑制效果逐渐增强。当Cd 浓度达到2.5 mmol/L 时,草地早熟禾叶片变黄,株高显著降低,且生物量减少。同时,随着Cd 胁迫浓度增加,草地早熟禾株高、根长、叶片鲜重、根系鲜重均呈现逐渐降低的趋势,且对照与各处理差异显著(P<0.05)(图1)。
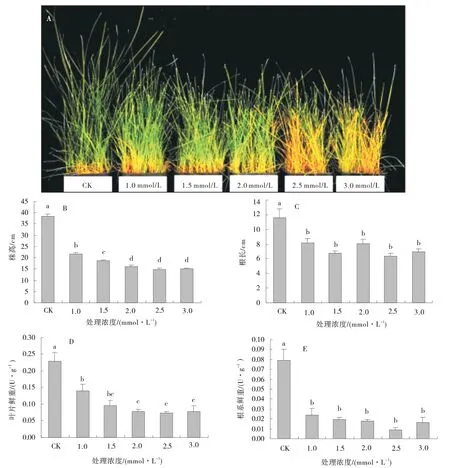
图1 Cd 胁迫处理下草地早熟禾株高、根长、叶片鲜重、根系鲜重Fig.1 Effects of Cd stress on height,root length,leaf fresh weight and root fresh weight of kentucky bluegrass
2.2 Cd 胁迫对草地早熟禾光合特性的影响
Cd 胁迫显著抑制草地早熟禾叶绿素a、叶绿素b、类胡萝卜素含量(P<0.05),叶绿素a/b 的值随着浓度增加亦显著降低(P<0.05)。同时,其蒸腾速率、气孔导度、净光合速率也在Cd 胁迫下显著降低(P<0.05),而Cd 胁迫下胞间二氧化碳浓度显著增加(P<0.05)。而施加Cd 后各浓度梯度之间蒸腾速率、气孔导度、净光合速率、胞间二氧化碳浓度未发生显著变化(P<0.05)(图2)。
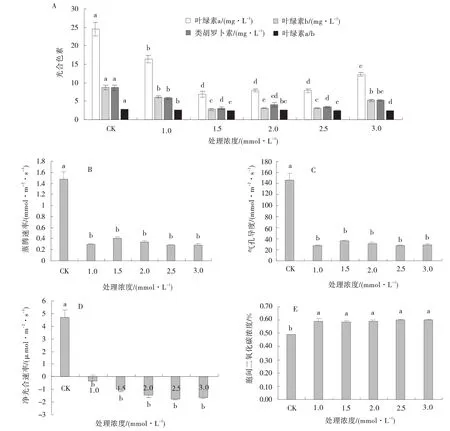
图2 Cd 胁迫处理下草地早熟禾光合色素含量、蒸腾速率、气孔导度、净光合速率、胞间二氧化碳浓度Fig.2 Effects of Cd stress on photosynthetic pigment content,transpiration rate,stomatal conductance,net photosynthetic rate,and intercellular carbon dioxide concentration of kentucky bluegrass
2.3 Cd 胁迫对草地早熟禾抗氧化酶活性的影响
Cd 胁迫下草地早熟禾根系中APX 活性显著低于CK(P<0.05)(图3⁃A)。叶片中(图3-B),CAT 活性随Cd 胁迫增加逐渐降低,3 mmol/L Cd 胁迫下叶片CAT 活性最低,比CK 降低90%,差异显著(P<0.05),而在根系中,Cd 胁迫下CAT 活性显著增加,1mmol/L Cd 胁迫根系CAT 活性增加幅度最大,比CK 增加2.37 倍,差异显著(P<0.05)(图3⁃B)。叶片POD 活性随Cd 胁迫增加逐渐降低,而根系中POD 活性表现出相反的趋势,3 mmol/L Cd 胁迫下根系POD活性增加至最大,比CK 增加40.92%,差异显著(P<0.05)(图3⁃C)。Cd 胁迫下SOD 活性表现出先增后降的趋势(图3⁃D),其中,1 mmol/L Cd 胁迫下叶片SOD 活性增至最大,2 mmol/L Cd 胁迫下根系SOD 活性增至最大,但与CK 相比,叶片SOD 活性增加21.83%,而根系SOD 活性降低17.42%,差异显著(P<0.05)。
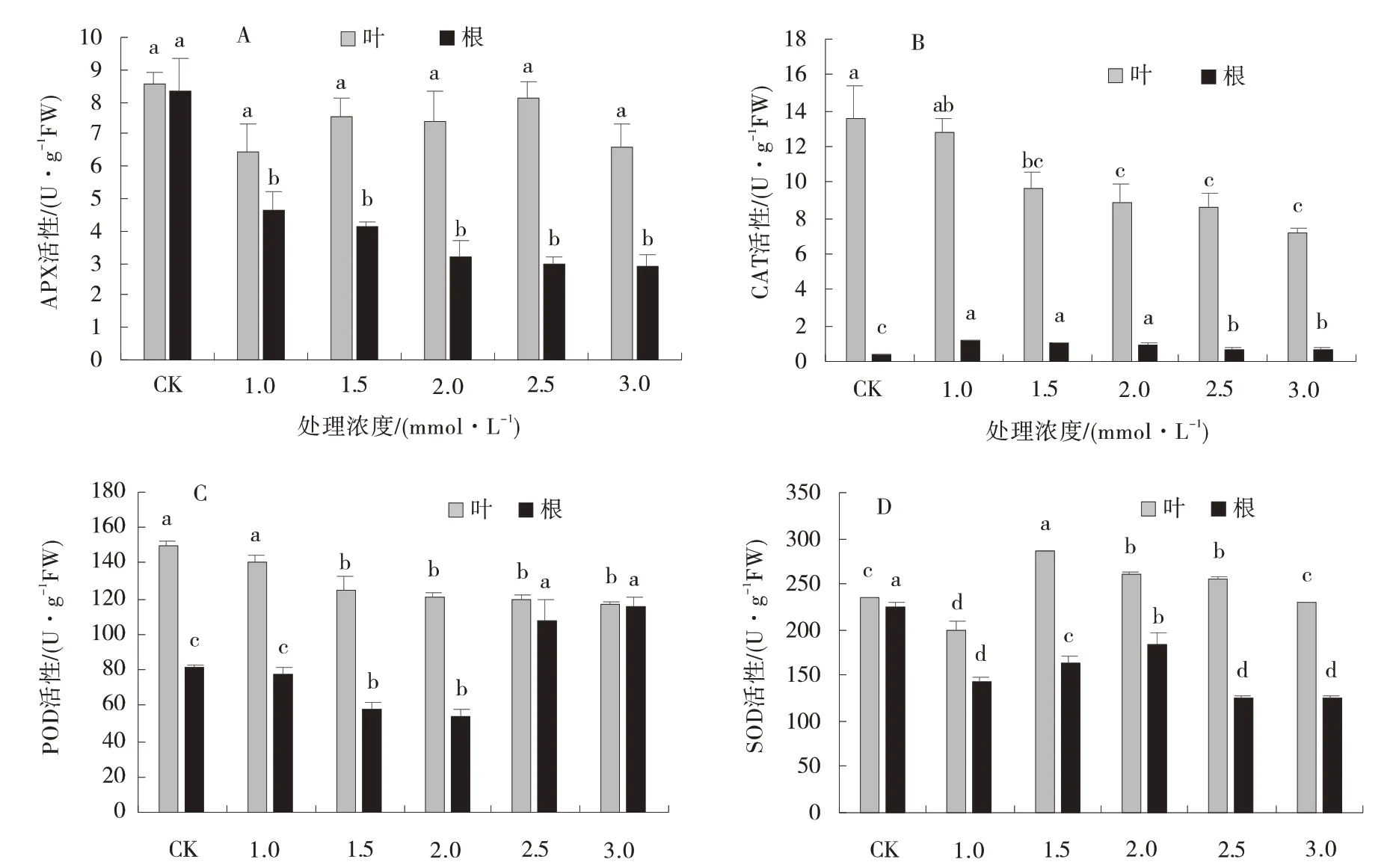
图3 Cd 胁迫处理下草地早熟禾APX、CAT、POD、SOD 活性Fig.3 Effects of Cd stress on APX,CAT,POD and SOD activities of kentucky bluegrass
2.4 Cd 胁迫对草地早熟禾叶片激素含量的影响
Cd 胁迫下草地早熟禾叶片IAA 和GA3含量显著降低(P<0.05),而ZT 含量显 著增加(P<0.05),ABA 含量变化差异不显著(P>0.05)。其中IAA 变化最为显著,与CK 相比,Cd 处理下叶片IAA 含量比CK 降低53.78%,差异极显著(P<0.01)(图4)。

图4 Cd 胁迫处理下草地早熟禾叶片IAA、GA3、ZT、ABA 含量Fig.4 Effects of Cd stress on IAA,GA3,ZT,and ABA content in leaves of kentucky bluegrass
2.5 Cd 胁迫对草地早熟禾二价阳离子吸收和转运的影响
草地早熟禾根系和叶片对Cd2+均有极显著的富集作用(P<0.01),且根系中Cd 含量明显高于叶片中Cd2+含量(图5⁃A)。根系和叶片Zn2+含量也发生极显著 变 化(P<0.01),分 别 比CK 降 低33.18% 和29.15%(图5⁃B)。Cd 胁迫下,草地早熟禾叶片Mg2+含量明显增加,而根系Mg2+含量明显降低,差异极显著(P<0.01)(图5⁃C)。而Cd 胁迫对草地早熟禾Ca2+含量未产生显著影响(图5⁃D)。

图5 Cd 胁迫处理下草地早熟禾叶片和根系Cd2+、Zn2+、Mg2+、Ca2+含量Fig.5 Effects of Cd stress on the content of Cd2+,Zn2+,Mg2+and Ca2+in the leaves and roots of kentucky bluegrass
3 讨论
高浓度Cd 胁迫通常导致植物失绿、萎蔫、抑制植物生长[17],这种毒害现象通常与Cd 在植物器官中的积累有关[18]。本研究中,随着Cd 胁迫浓度的增加,草地早熟禾也表现出抑制生长及萎蔫变黄等毒害现象。
Cd 在植物叶片中的积累通常会导致植物类囊体结构破坏,影响植物光合[19]。另一方面,Cd 通常在老叶中积累并破坏叶绿素结构,而新叶中叶绿素的生物合成也造成老叶中叶绿素合成受到抑制[20],同时,Cd胁迫导致对叶绿素生物合成酶活性的抑制和叶绿素酶促降解过程的激活[21]。研究认为,Cd 胁迫通过降低合成氨基乙酰丙酸合酶所需的谷氨酸盐的有效性[22],而氨基乙酰丙酸合酶是叶绿素合成过程中的关键酶[23]。Cd 处理下,草地早熟禾叶绿素a、叶绿素b、类胡萝卜素含量均显著降低,表明Cd 胁迫对草地早熟禾光合色素合成具有抑制作用。研究发现,蒸腾速率直接影响植物体内Cd 的转运[24],Liu 等[25]报道,植物茎中Cd 含量与蒸腾速率呈显著的正相关关系。本研究中,Cd 处理的草地早熟禾叶片蒸腾速率显著降低。报道指出,Cd 胁迫下,植物气孔导度随着Cd 浓度增加而降低,而气孔导度的降低通常伴随着光合速率的下降[26]。本试验中,Cd 胁迫导致草地早熟禾叶片气孔导度、净光合速率显著降低,而胞间二氧化碳浓度增加,表明Cd 胁迫对草地早熟禾光合作用具有严重的抑制作用。
Cd 胁迫通常会引起植物活性氧代谢失衡,植物自身拥有复杂的清除活性氧的途径,其中抗氧化酶途径是植物主要清除活性氧的途径[27-29]。有报道指出,胁迫条件下产生的超氧自由基可被SOD 歧化产生过氧化氢,过氧化氢可被APX、CAT 和POD 清除[30]。不同植物抗氧化酶活性在胁迫条件下的变化并非一致,郭 锋 等[31]研 究 发 现,Cd 胁 迫 下 西 葫 芦(Cucurbita pepo)抗氧化酶活性增加,类似的结果在张晓娟[32]对绿豆(Vigna radiata)的研究中也有报道。通常认为,轻度胁迫可促进植物抗氧化酶活性,而重度胁迫则抑制植物抗氧化酶活性[33]。本研究中,Cd 胁迫导致草地早熟禾叶片CAT、POD 活性降低,SOD 活性先增后降,而APX 活性无显著差异,可能是因为Cd 胁迫抑制草地早熟禾CAT 和POD 活性,草地早熟禾可在一定浓度的Cd 胁迫下提高SOD 的浓度以抵御Cd 毒害,而在根系中CAT、POD 和SOD 在Cd 胁迫下活性增加,APX 活性降低,而根系是草地早熟禾吸收Cd 的重要器官,根系中Cd 含量远高于叶片中Cd 含量(图5⁃A),证明在高浓度Cd 胁迫下,根系依旧可以通过调节部分抗氧化酶活性来抵御Cd 毒害。
细胞壁POD 的一些酸性同工酶通过H2O2催化单酚氧化聚合反应而木质化,POD 可降低细胞壁可塑性并增加其硬度,因此可控制细胞生长[34]。POD 可以通过影响3-吲哚乙酸(IAA)氧化酶活性来影响IAA 合成速率[5]。本研究中,Cd 胁迫导致叶片POD 活性下降,IAA 含量显著降低,这可能影响草地早熟禾的正常生长。GA 在控制细胞伸长和茎伸长中起着核心作用[35],有研 究 表 明,施加外 源GA3可 显 著 缓解大 豆(Glycine max)Cd 胁迫,并增加Cd 胁迫下大豆的生长速率和净同化率[36]。本研究中,Cd 胁迫处理的草地早熟禾叶片GA3含量显著低于CK,证明Cd 毒害同样影响GA3含量从而影响草地早熟禾生长和生理状态。细胞分裂素是参与植物多种生命过程的激素信号,玉米素(Zeatin,ZT)和其衍生物是细胞分裂素的重要组成部分,众多研究表明,细胞分裂素参与植物叶片衰老、促进分枝、促进茎和根的生长[37-39]。本研究中,Cd胁迫的草地早熟禾叶片ZT 含量显著高于CK,表明内源ZT 在草地早熟禾Cd 解毒方面可能具有积极作用。而ABA 含量在Cd 处理和对照间未发生显著变化。
Cd 是植物非必须营养元素,但土壤中的Cd 可通过钙(Ca)、铁(Fe)、锰(Mn)、锌(Zn)等必需二价阳离子转运蛋白进入植物根部,通过影响一些正常生命活动而对植物造成毒害作用[40]。金属阳离子易被根系中带负电的化合物吸引而较少的向上转移[41]。Mg 是参与植物光合作用的和呼吸作用的重要金属元素,参与活化磷酸变位酶和磷酸激酶,同时,在DNA 和RNA合成中也具有重要作用,植物缺乏Mg 可导致叶片黄化,严重影响叶绿素合成,抑制植物光合作用[42]。Ca通常作为第二信使参与植物抵御逆境胁迫反应,Cd 与Zn 化学相似性较高,Cd2+可影响Zn-Finger 转录因子活性,取代Zn2+,从而干扰转录机制[43],类似于这种机制,Cd 取代钙调蛋白中的Ca2+离子,引起细胞内钙水平变化,影响钙信号传导[44]。本研究中,草地早熟禾根系中富集更多的Cd,而Cd 胁迫后根系和叶片Zn2+含量显著降低,表明Cd 抑制草地早熟禾Zn2+吸收。Mg2+含量Cd 处理后叶片中显著增加而根系中Mg2+含量减少,表明Cd 胁迫导致更多的Mg2+向叶片运输,而Ca2+含量Cd 处理与CK 相比差异不显著,证明Cd毒害对Ca2+含量影响较小。
4 结论
Cd 胁迫可造成草地早熟禾生长抑制,且大部分Cd 富集在根部,Cd 吸收的同时影响Zn2+、Mg2+吸收和转运。Cd 毒害可抑制草地早熟禾光合作用,减少叶片IAA 和GA3含量,增加ZT 含量。抗氧化酶SOD、POD、CAT、APX 不同程度地参与草地早熟禾Cd解毒。

