水稻抗旱相关基因OsDR1的克隆、鉴定及表达分析
周立国,刘灶长,孔德艳,徐 凯,夏 辉,吴金红,罗利军
(上海市农业生物基因中心,上海 201106)
当前,我国农业用水占总淡水用量的70.4%,而水稻用水占农业用水的70%[1],而另一方面,我国淡水资源相对缺乏、分布不均,人均淡水占有量不到世界平均水平的1∕4,提高淡水资源的利用效率是必然选择[2]。上海市农业生物基因中心充分发掘利用陆稻资源,将其抗逆性导入水稻中,成功育成了以‘旱优73’‘WDR48’‘旱两优8200’等为代表的兼具水稻高产优质特性和旱稻节水抗旱特性的栽培稻品种新类型——节水抗旱稻(Water-saving and drought-resistance rice,WDR)。与传统水稻品种相比,WDR品种可节约50%以上淡水资源,在有效提高水稻水分利用效率的同时也保持了水稻高产优质特性,具有重要的社会意义和经济意义[3]。但是,目前关于水稻等农作物的节水抗旱机制缺乏系统性的研究,已有研究多集中在单个基因抗旱性能方面,无法在实际育种和大田生产中应用。
生物节律性包括近年生物钟、季节生物钟、近月生物钟和昼夜生物钟等,受长时期的环境影响而形成,又一定程度上独立于环境短时变化,依据内在基因震荡得到维持[4]。各生物中均有形成、维持、输出节律性功能的机制和基因,生物各生长发育过程都受到生物钟的影响[5-7]。依靠内在生物钟,植物对干旱缺水、光照等环境条件的响应具有一定前置性,故可快速响应干旱等非生物逆境胁迫[8-11]。
卤酸脱卤素酶(Haloacid Dehalogenase,HAD)参与生物节律性调控过程。卤酸脱卤素酶最初是在细菌中被发现并得名的,其广泛存在于动物、植物等真核生物及蓝细菌、钩端螺旋体等原核生物中[12]。含HAD结构域的蛋白质的整体序列相似性很小,这些蛋白质包含4个保守的序列基序[13-14],其中的帽子结构是由3个短的催化基序组成的核心催化结构域。根据帽子结构域的位置、结构以及折叠方式等的差异,可以将其划分为多个亚家族。大多数HAD蛋白参与磷酸基转移,包括磷酸酶、P型ATP酶、磷酸酯酶和磷酸转移酶[15],但是因HAD结构域蛋白氨基酸序列的多样性,各蛋白功能也复杂多样。在水稻中已鉴定出40种典型的HAD蛋白,还有更多的HAD类似结构蛋白未被鉴定出来[16]。HAD蛋白质的水解底物不同,植物中的HAD酶可分为蛋白磷酸酶、小分子磷酸酶、脱卤酶、磷酸酯酶和β-磷酸葡萄糖变位酶等,参与多种新陈代谢过程[17-18]。HAD家族蛋白还有可能与生物的昼夜节律响应有关,果蝇中的DREG-2蛋白拥有HAD类似的结构,具有磷酸酶活性,属于天冬氨酸-亲核水解酶亚家族即HAD1A家族,参与果蝇昼夜节律的生理调控[19-20]。
‘IRAT109’是优异陆稻资源,综合抗旱性强,包含众多的抗旱基因资源,同时也是诸多节水抗旱稻的骨干亲本。本研究通过干旱胁迫处理水稻‘IRAT109’筛选到干旱相关基因OsDR1,通过监测其表达特征分析其与水稻干旱胁迫的关系,旨在为水稻抗旱育种提供理论基础。
1 材料与方法
1.1 试验材料
利用旱稻品种‘IRAT109’(Oryza sativaL.ssp.japonica)进行转录谱分析和基因克隆,‘湘晴’(Oryza sativaL.ssp.japonica)为遗传转化的受体材料。大肠杆菌菌株为E.coliDH5α,农杆菌菌株为EHA105,所用载体见表1。

表1 载体信息Table 1 Vectors information
1.2 试验方法
1.2.1 水稻非生物逆境胁迫及激素处理
挑选健康饱满的‘IRAT109’种子,在正常水分管理条件下用1∕2浓度水稻培养液(参考国际水稻研究所营养液配方)培养至4叶期。
低温胁迫:把幼苗放入4℃光照培养箱,分别在处理0 h、0.5 h、1 h、3 h、20 h时取幼苗叶片。盐胁迫是分别将幼苗由水培液移入250 mmol∕L、500 mmol∕L NaCl水溶液中;甘露醇渗透胁迫是分别将幼苗由水培液移入100 mmol∕L、200 mmol∕L、500 mmol∕L甘露醇水溶液中;激素处理是分别将水稻苗根部浸入到含50μmol∕L、150μmol∕L脱落酸(ABA),100μmol∕L、200μmol∕L过氧化氢(H2O2),50μmol∕L、150μmol∕L甲基茉莉酸(Me-JA),0.5 mmol∕L、1.5 mmol∕L水杨酸(salicylic acid,SA)等培养液中;室温培养,并在处理0 h、1 h、2 h后取叶片样品。
1.2.2 苗期水稻在不同的光照及水分条件处理
水稻‘IRAT109’种子播入装满泥土的小桶中,正常水分条件下培养到4叶期,设置下列3种处理:自然光照下进行干旱处理(土壤含水量低于15%),自然断水直至植株开始出现卷叶;在正常水分条件下避光培养,取样检测前避光一个昼夜(24 h);对照处理,即自然光照下正常水分管理。取样时使用照度计测量光照强度,每个处理分别取3个生物重复样品。
1.2.3 Total RNA提取
RNA提取试剂为Trozol A+total RNA reagent(Invitrogen),试验方法参照试剂说明书。
1.2.4 实时定量PCR
实时定量PCR(qPCR)所用试剂为SYBR®Premix Ex TaqTM(Perfect Real Time),所用仪器为Applied Biosystems 7000 Real-Time PCR System。利用引物qDR1f和qDR1r,扩增OsDR1基因,片段长度为133 bp。以水稻Actin2基因为内参。引物信息详见表2。在基因扩增效率基本一致的情况下,利用相对定量的方法计算目标基因的相对表达量变化[21-22]。
1.3 RACE方法克隆目的基因
使用BD SMART RACE cDNA Amplification Kit,运用cDNA末端快速扩增法(5’-and 3’-rapid amplification of cDNA ends,RACE)获得OsDR1基因全长cDNA序列。以干旱处理后的苗期‘IRAT109’总RNA为模板,利用含有oligo dT(16)和特异接头序列的反转录引物逆转录获得cDNA。在反转录过程中加入5’RACE接头,MMLV反转录酶识别完整mRNA的帽子结构并将5’RACE接头转移到cDNA的5’末端,从而获得5’末端含有帽子结构和特异序列、3’末端含有oligo dT的完整cDNA。以上述cDNA为PCR模版,分别以3GSP1、3GSP2为基因特异引物,和3’RACE通用引物配对,进行两轮PCR扩增,将所得片断测序,获得包含DR1基因mRNA PolyA尾巴的3’端序列。分别以5GSP1、5GSP2为基因特异引物,和5’RACE通用引物配对,进行两轮扩增,通过克隆、测序,获得包含帽子结构的5’端序列。将所得的3’及5’端序列拼接,得到完整的OsDR1基因全长序列。引物信息详见表2。

表2 所用引物及序列Table 2 The primers and sequences
1.4 载体构建及遗传转化
利用末端含有内切酶识别序列的引物对D1f-BamHI∕D1r-SacI扩增OsDR1基因全长编码序列。用BamHI及SacI内切酶切除PCR片段和pBI121载体;用T4连接酶将OsDR1全长片断与之连接,替换GUS片断。用HindIII和EcoR I从pBI121-DR1载体内切下,并且琼脂糖凝胶电泳分离CaMV35S:DR1片段,连接到pCAMBIA1300多克隆位点相应位置,构成pCAMB1300:35S:DR1植物转化载体。将载体转入大肠杆菌DH5α,提取质粒,冰冻法转入农杆菌EHA105,采用农杆菌介导的遗传转化方法转化水稻‘湘晴’的愈伤组织。
1.5 转基因水稻田间抗旱表型鉴定
转基因水稻按照大田播种要求催芽播种,苗床上长至4叶期后移植到转基因抗旱大棚内种植。株行距为15 cm×15 cm,每株系种植4行,每行6穴,每穴1株,重复3次。正常水分管理下生长至6叶期开始断水,约15 d后即在8叶期形成干旱胁迫,记录水稻植株表型。
2 结果与分析
2.1 OsDR1基因cDNA全长序列及蛋白结构分析
根据干旱胁迫下基因表达芯片结果[23],对比水、旱环境下陆稻‘IRAT109’苗期叶片中差异表达基因,筛选到水稻抗旱相关基因(DT-relative gene)OsDR1,其在干旱条件下表达量显著提高,比正常水分下增加了近3倍。但该基因的翻译起始密码和终止密码序列未知,故通过RACE的方法得到了含有翻译起始密码子的5’端序列以及含有翻译终止密码子和poly A尾巴的3’端序列,拼接后获得了这一干旱相关基因全长的cDNA序列,其长度为902 bp,包含有完整的基因编码区(图1A)。将序列提交到NCBI数据库(Genbank:DQ103591),通过BLAST(https:∕∕blast.ncbi.nlm.nih.gov∕Blast.cgi)比对,发现OsDR1基因对应的基因号为LOC_Os07g46520.1;其对应的染色体DNA序列长度为2 892 bp,包含6个外显子和5个内含子。
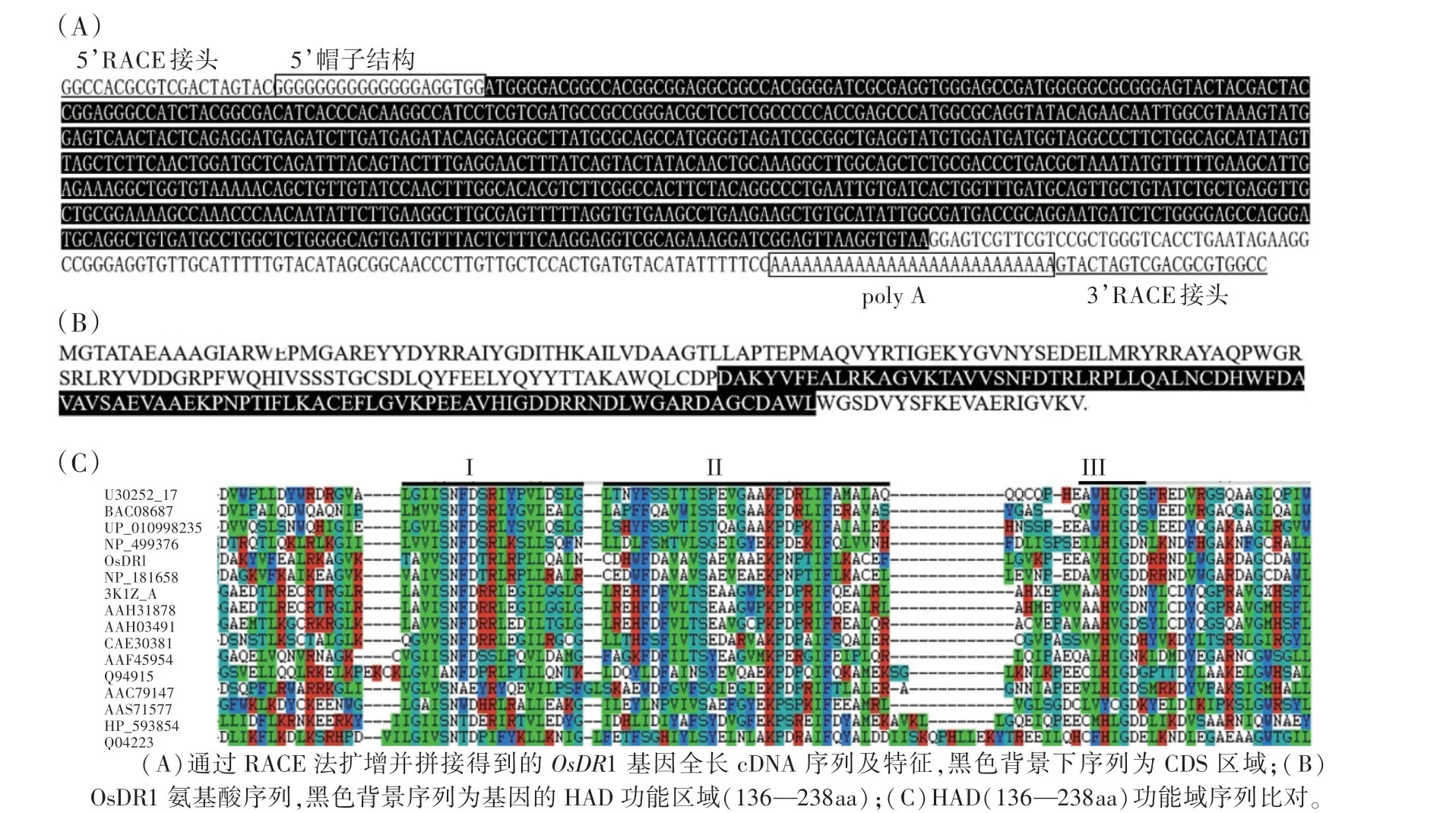
图1 OsDR1基因全长cDNA序列和编码氨基酸序列及HAD功能域示意图Fig.1 The cDNA and amino acids sequence with HAD domain of OsDR1 gene
根据OsDR1基因cDNA序列推导出其编码氨基酸序列(图1B)。OsDR1氨基酸序列包含一个HAD结构域,其中3个短催化核心保守区域构成帽子结构(图1C)。HAD结构域具有一定序列保守性,广泛存在于细菌、动物、植物等原核及真核生物中。通过BLAST比对发现OsDR1蛋白具有卤酸脱卤素酶类似功能域[19-20],归属于卤酸脱卤素水解酶超级蛋白家族,具有磷酰基转移酶活性。在Gramene数据库(http:∕∕www.gramene.org)中比对,其注释显示,OsDR1蛋白具有磷酸甘油磷酸酯酶活性,催化磷酸甘油磷酸基团的水解,促进甘油的积累,是乙醛酸和草酰乙酸代谢途径的关键酶类。
根据RACE测序及拼接结果,设计带有内切酶识别位点的基因特异扩增引物D1f-BamHI和D1r-SacI(表2),以‘IRAT109’cDNA为模板进行PCR扩增,扩增片段大小为892 bp(图2),包含完整的氨基酸编码区。经过测序和序列比对,扩增片段序列与RACE测序及拼接结果相同。

图2 PCR扩增克隆到的OsDR1片段Fig.2 Cloning of OsDR1
2.2 OsDR1基因受非生物逆境诱导表达
在4℃低温条件下苗期水稻OsDR1基因被诱导上升表达,3 h时表达量最大,随着处理时间的延长,OsDR1基因表达量开始下降(图3A)。在不同浓度甘露醇模拟干旱处理下,OsDR1基因上升表达,并且随着处理时间的增加,表达量也在增加;表达变化趋势与甘露醇的浓度无明显相关性;但是过高浓度、过长时间的甘露醇胁迫处理会降低OsDR1基因的上调表达(图3B)。图3C显示,OsDR1基因对盐胁迫也有反应,较长时间盐胁迫会诱导基因上升表达。综上,OsDR1基因表达受模拟干旱胁迫的诱导而呈现明显的上调表达趋势。
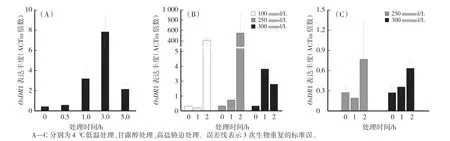
图3 逆境下苗期水稻地上部OsDR1相对表达量变化Fig.3 Relative expression of OsDR1 under water-stress at 4-leaves stage of rice
以qPCR方法检测OsDR1基因在经ABA、H2O2、JA、SA等激素处理的‘IRAT109’苗期植株中的表达情况。结果显示,低浓度的ABA对OsDR1基因表达的影响不明显,而高浓度ABA会在短时间内(1 h)上调OsDR1基因表达量(图4A);较长时间高浓度的H2O2处理会显著提高OsDR1基因表达(图4B);JA在能较短时间内诱导OsDR1基因上调表达,随后(2 h)回落到处理前水平(图4C);长时间高浓度的SA处理诱导OsDR1基因明显上调表达(图4D)。由此可知,OsDR1基因的表达受到ABA、H2O2、JA、SA激素的诱导而上调表达,其中,对长时间高浓度H2O2处理响应最显著。
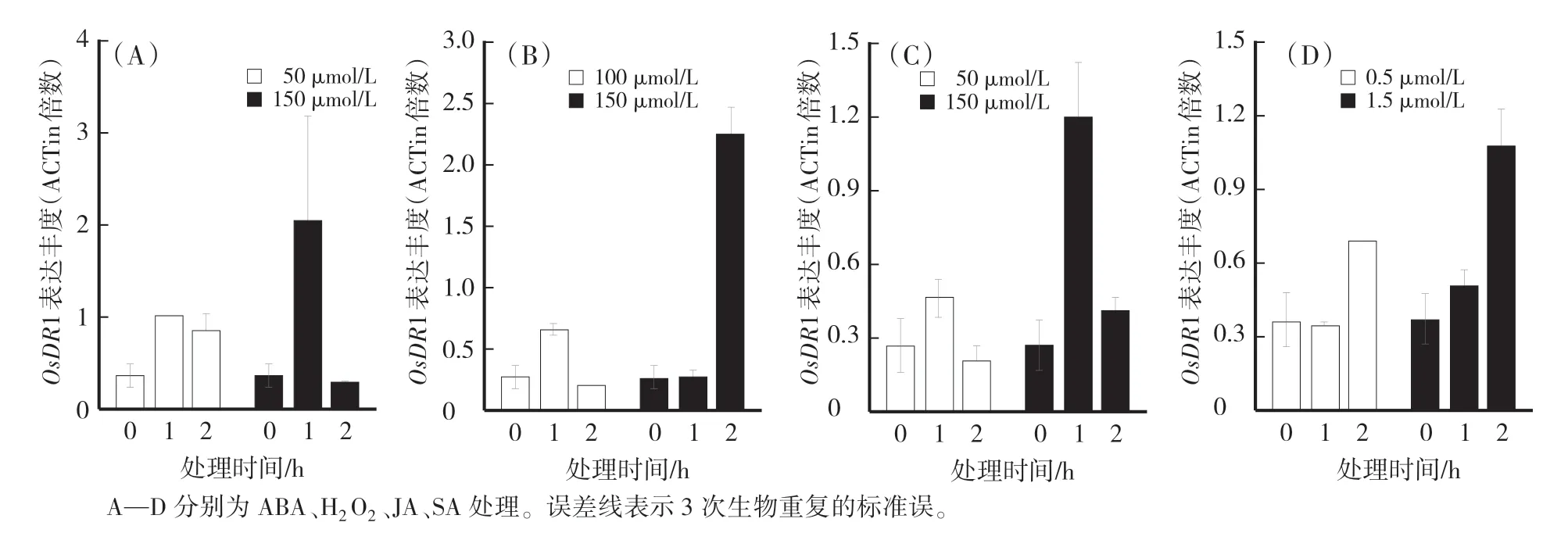
图4 水稻苗期施加植物激素后OsDR1相对表达量变化Fig.4 Relative expression of OsDR1 with plant hormones treatment at 4-leaf stage of rice
2.3 OsDR1基因呈节律性表达并受干旱胁迫诱导
根据实际测量结果,上海8月份4:00左右自然光照强度开始增加;6:00左右太阳升起,光照强度迅速增加。qPCR结果显示,在对照条件下(正常水分、自然光照)、干旱胁迫处理、遮光处理等3种不同环境条件下,水稻中OsDR1基因的表达丰度在一天中的整体变化趋势相同,即在4:00之后自然光照强度开始增加时迅速上升,6:00日出时到达最高点,之后随着光照强度增加而明显下降。由图5可知,首先,干旱处理下OsDR1基因表达量显著上调表达。正常光照条件下,干旱处理与正常水分下OsDR1基因mRNA表达最高值无显著差异。正常水分条件下水稻中OsDR1基因在6:00达到最高点,之后迅速下降,12:00到达最低水平;干旱胁迫诱导下,OsDR1基因表达长时间处于较高水平,直到12:00过后才开始迅速下降。即干旱延长了OsDR1基因高丰度表达的时间,使其总表达量显著增加。其次,在黑暗的条件下,水稻OsDR1基因的表达仍然呈现明显的与自然光照下相同的变化趋势,具有光诱导的节律表达特征。综上,OsDR1基因表达响应外界光照条件的变化而呈现节律性,并且受水稻本身的内在节律性机制调控。

图5 不同条件下OsDR1基因在水稻中的表达Fig.5 OsDR1 mRNA expression abundance under different conditions
2.4 转基因植株获得与阳性植株鉴定
转基因植株DNA经HindIII酶充分酶切,通过PCR扩增(Hptf、Hptr引物详见表2)获得抗潮霉素基因DNA片段,将其作为southern杂交的探针,检测T-DNA整合到T0代水稻基因组中的情况。从图6可知,转基因植株中均含T-DNA片段,其中3个株系只有1个拷贝,其他阳性植株含有2—3个拷贝;同时还检测到3个阴性转基因植株,可用作后续试验的阴性对照。
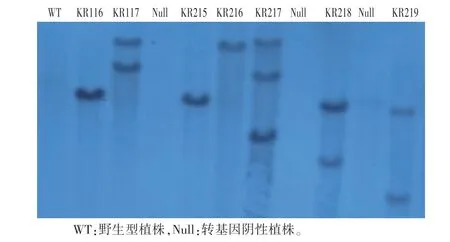
图6 OsDR1转基因T0植株的Southern blot分析Fig.6 Southern blot analysis of OsDR1 transgenic T0 plants
2.5 OsDR1基因增强水稻抗旱性
由图7可知,干旱胁迫条件下转基因阳性植株(KR215、KR117)生长状况良好,叶片挺拔、叶色嫩绿,植株生长量大;相比较下,转基因阴性植株在干旱胁迫下出现了叶片卷曲、干枯,叶色发白,植株生长受抑制等情况。表明水稻中超表达OsDR1基因改善了植株在水分缺乏情况下的生存状况,提高了对干旱胁迫的耐受性。

图7 超表达OsDR1基因水稻的抗旱表现Fig.7 Drought resistance performance of OsDR1 over-expression rice plant
3 讨论
3.1 OsDR1基因参与干旱等非生物逆境胁迫响应过程
在水稻苗期进行脱落酸(ABA)、茉莉酸、水杨酸和过氧化氢,以及甘露醇、盐、低温等非生物逆境胁迫,均能提高OsDR1基因在叶片中的表达。其中ABA介导的信号传递途径是植物非生物胁迫信号传递的核心途径,可以调控产生H2O2,控制气孔开闭,调控植物对干旱胁迫的响应[24-26]。OsDR1基因对ABA和H2O2处理都有响应,自然断水干旱及模拟干旱胁迫下水稻OsDR1基因表达量均显著上调,据此推断,OsDR1基因通过ABA和H2O2信号途径,参与水稻的干旱胁迫响应机制。
3.2 OsDR1蛋白分子功能分析预测
根据蛋白序列特征分析,OsDR1与DREG-2蛋白均属于卤酸脱卤素酶家族的HAD1A亚家族;实时定量分析结果显示,OsDR1基因的表达特征与果蝇DREG-2基因类似,均具有节律性。由此推测,OsDR1基因参与生物的昼夜节律调控[19-20]。
3.3 OsDR1基因增强水稻抗旱性的作用途径
水稻等植物抗旱性研究多是在实验室可控条件下,采用PEG等模拟干旱条件,或者小桶土培干旱胁迫等方式,在幼苗期、开花期等植物某一生长阶段进行抗性鉴定。其优点是简单、方便,试验结果稳定,但结果不能代表植物尤其是作物在田间的抗旱表现。本研究于抗旱大棚中通过自然断水产生干旱胁迫进行抗性鉴定,试验结果更能反应植株真实抗旱表现。本研究表明OsDR1基因具有大田环境条件下增强水稻抗旱性的潜在应用价值。
光照强度会影响植物的生长和发育,过强的光照破坏植株光合作用和呼吸作用,产生过氧化效应,使植株质膜稳定性及能量代谢等生化过程受到破坏[17-18]。OsDR1基因表达的节律变化揭示OsDR1基因表达与昼夜交替相关,在光照强度增加初期表达丰度剧烈增强,为随后的强光胁迫储备蛋白。据此推测,OsDR1基因能在一定程度上减轻强光照带来的负面效应。通过数据库搜索发现,OsDR1蛋白是一个磷酸甘油磷酸酯酶,有研究表明利用假单胞杆菌来源的磷酸甘油磷酸酯酶转化水稻,可提高水稻甘油含量,增强其对盐等非生物胁迫的耐受性[27]。该蛋白还可能参与植物的乙醛酸循环,为三羧酸循环提供物质基础,也预示其具有稳定水稻能量代谢的作用。综上,OsDR1蛋白通过提高水稻中甘油含量以及稳定能量代谢来增强水稻耐旱性。

