二乙基亚硝胺诱导大鼠原位肝癌模型及在TACE中应用研究
张利捷, 操焱焱, 李 卿, 张 鑫, 洪 伟, 郑传胜, 梁 斌
经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)联合免疫治疗是当前肝癌治疗的热点,其具体联合作用机制尚未明确[1-3]。我国肝癌患者大多伴随炎症-硬化-肿瘤的演变[4]。肿瘤可发生免疫逃逸,使得机体免疫系统无法发挥监视及杀伤作用[5],因此建立可模仿人类肝癌免疫学背景的动物模型尤为重要。 TACE 治疗常用动物模型主要包括兔VX2 移植瘤肝癌模型、肝炎病毒诱导的土拨鼠肝癌模型及二乙基亚硝胺(diethylnitrosamine,DEN) 诱导的大鼠原位肝癌模型,各有优劣[2]。 兔VX2 肝癌模型是由乳头瘤病毒诱导的间变性鳞癌,并不具备人类肝癌典型生物学特征[6];土拨鼠肝癌模型适合作为免疫学研究且适合TACE 操作,但成瘤时间往往需要数年,该类动物也较难获得[7];DEN 诱导的大鼠原位肝癌模型不仅具备人类肝癌损伤的病理改变,成瘤时间也相对较短,是较为理想的模型[8-9]。 但目前的研究尚缺乏该模型建造的系统性变化,如长时间、连续性影像和病理评估,无法满足TACE 治疗时机选择及疗效评价。 基于以上现状,本研究采取口服DEN 诱导大鼠原位肝癌模型,结合影像与病理检查,探索肝癌成瘤过程以及在该动物模型中进行TACE 操作的可行性,为开展进一步TACE 联合免疫治疗的动物实验提供有效的肝癌动物模型。
1 材料与方法
1.1 实验动物和模型建立
取雄性Sprague-Dawley(SD)大鼠60 只(华中科技大学同济医学院实验动物中心), 体质量160~180 g,分为肿瘤模型组(n=40)和TACE 应用组(n=20)。采用口服DEN 方法建立大鼠原位肝癌模型:将0.01%浓度DEN 加入大鼠饮水瓶,供其自由饮用[10]。
1.2 影像学检查
实验动物均行肝脏MRI 及肺部CT 检查。 采用2%戊巴比妥钠腹腔注射(0.3 mL/100 g)麻醉。 MRI扫描采用大鼠专用线圈, 扫描范围为膈顶至肝下缘,扫描序列及参数见表1。 肺部CT 扫描范围从胸骨入口至肋膈角,扫描参数:80 kVp, 400 mA,层厚0.67 mm,束宽40 mm,螺距1.048,旋转时间0.4 s。

表1 MRI 序列及参数
1.3 病理学检测
颈椎脱臼法处死大鼠, 取肝脏组织,0.9%氯化钠溶液冲洗,滤纸吸去水分。 选取肝脏肉眼变化明显的肝叶作为检测标本。标本固定于4%多聚甲醛,乙醇脱水,制作石蜡切片。 苏木精-伊红(HE)及Masson 染色操作参照文献[10]。 采集不同倍数图片加以分析。
1.4 荷瘤动物生存
排除诱导过程中死亡及处死的实验鼠后,余荷瘤大鼠以普通饮用水饲养,记录死亡情况,观察生存时间。
1.5 介入操作及评价
当MRI 证实大鼠肝肿瘤长径达到约0.5 cm后, 无菌条件下行开腹经胃十二指肠动脉逆行插管。 化疗药为阿霉素(浙江海正药业公司),剂量为1.6 mg/只(根据大鼠与人体药量换算得出)。 栓塞剂为聚乙烯醇栓塞微球(100~300 μm,苏州恒瑞医疗器械公司),麻醉方式同前。 介入操作方法:大鼠开腹经胃十二指肠动脉逆行插管, 以剑突为界向下3~4 cm 行利多卡因局部麻醉, 沿腹部白线正中切口剪开,固定十二指肠,分离肝总动脉、肝固有动脉及胃十二指肠动脉(图1①);在分离后的胃十二指肠动脉远端剪一斜口并引入导管(内径0.3 mm×外径0.6 mm,重庆思睿医疗仪器公司)(图1②);将动物转移至DSA 台,行经导管动脉造影,对比剂注入量约为0.5 mL,流率为0.3 mL/s,压力为100 psi,总对比剂体积为2.0 mL/kg,图像采集速度设定为7.5 帧/s,持续24 s;全程在DSA 监视下缓慢注入化疗药物和栓塞剂,栓塞终点为肿瘤前向血管近乎淤滞,复查造影示肿瘤染色消失;栓塞后退出导管,逐层关腹。 观察大鼠肝癌模型的动脉造影改变,记录介入技术成功率及围手术期动物死亡情况。

图1 TACE 操作示意图
TACE 成功定义为导管成功插入动脉, 打入足够药量的阿霉素,并经DSA 造影显示肿瘤血管栓塞完全。 TACE 术后3 d、7 d 分别处死实验动物,进行病理大体观及HE 染色,检测肿瘤坏死。
1.6 统计学分析
采用GraphPad Prism 7.0 版软件进行统计学分析及绘图。 数据以均值±标准差、中位数和范围、率的形式表示。
2 结果
2.1 肿瘤模型组
2.1.1 肿瘤模型影像表现 经MRI 和病理检测确认肿瘤造模成功后, 即停止用药。 第6 周行首次MRI 扫描时未观察到大鼠肝脏出现0.2 cm 结节;第7 周MRI 扫描时首次观察到12 只大鼠肝脏出现长T1 长T2 的结节信号影,边缘清晰,最长径均已达到0.2 cm,直径为(0.23±0.03) cm,肿瘤个数多为2(1,3)个,余肝脏部分信号不均一,呈硬化改变;第8 周时成瘤大鼠逐步增多,结节个数增多、直径增大,直径为(0.30±0.08)cm;第9、第10、第11、第12 周时结节直径分别为(0.39±0.09) cm、(0.45±0.16) cm、(0.52±0.21) cm、(0.60±0.23) cm;最后一次扫描时间为第17 周,肿瘤直径为(0.99±0.30) cm(图2①)。
2.1.2 成瘤率 当MRI 显示肿瘤直径达到0.2 cm时,诱导过程中4 只大鼠死亡,余36 只大鼠存活。相应中位时间为8(7,10)周。 成瘤率方面,第6 周MRI 扫描未见明显结节信号影;第7 周可见部分大鼠肝脏出现0.2 cm 肿瘤,共计12 只(33.3%,12/36);第8 周可见大量大鼠肝脏出现结节, 共计20 只(55.6%,20/36);第9 周成瘤大鼠26 只(72.2%,26/36); 第10 周所有大鼠肝脏均可见0.2 cm 结节影(100%,36/36)(图2②)。
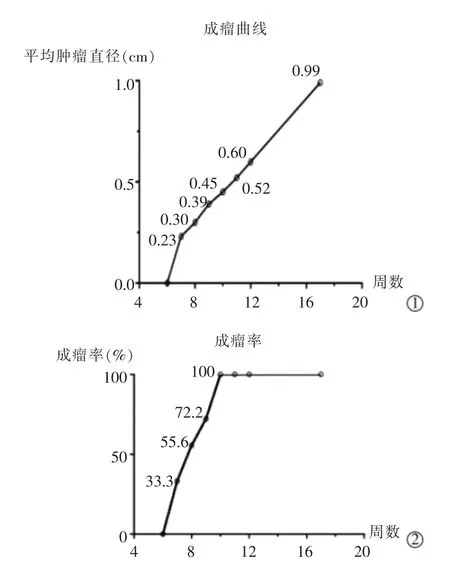
图2 诱导成瘤图
2.1.3 肿瘤模型病理表现 MRI 显示肝肿瘤直径达0.2 cm 时处死5 只大鼠行病理检查,大体观肝脏体积略增大,表面光滑,质地柔软,可见灰白色微小结节;HE 染色显示肝细胞水肿、液滴沉积,肝小叶内可见嗜酸性小体和炎性细胞浸润,肿瘤细胞胞质清晰,细胞核肥大深染,经病理科医生确认为肝癌结节;Masson 染色结果显示深蓝色的胶原纤维增多,胶原主要沉积在肝小叶周边,提示肝脏呈纤维化改变(图3①~④)。 MRI 显示肝肿瘤直径达0.5 cm 时另处死5 只大鼠,大体观肝脏体积略缩小,质地较硬,表面分布大量灰白色结节;HE 染色可见假小叶形成,正常肝小叶结构消失,周围包绕的纤维间隔内可见少许炎性细胞浸润,假小叶内肝细胞走行和排列紊乱,中央静脉缺如,可见大量深染、多核的肿瘤细胞;Masson 染色显示胶原纤维染色进一步加深,肝脏纤维化程度加重,可见出血性坏死,纤维化组织周围伴随淋巴单核细胞浸润灶(图3⑤~⑧)。

图3 肿瘤模型表现
2.1.4 肝外转移情况 本批大鼠累计观察到5 只发生肝外转移(图4),分别为肺转移、腹腔淋巴结转移、十二指肠种植转移、肾上腺转移及肾脏转移。
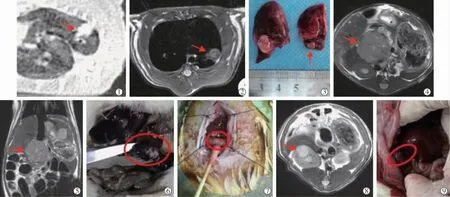
图4 诱导期间肝外转移
2.1.5 荷瘤大鼠生存时间观察 40 只大鼠诱导成瘤过程中死亡4 只,另处死10 只用于病理检测,余26 只用于观察生存。 经MRI 及病理确定成瘤后,大鼠逐步出现死亡。 第8 周时死亡2 只,第9 周时死亡2 只,第10 周时死亡1 只,至诱导后的第20 周全部死亡(图5)。
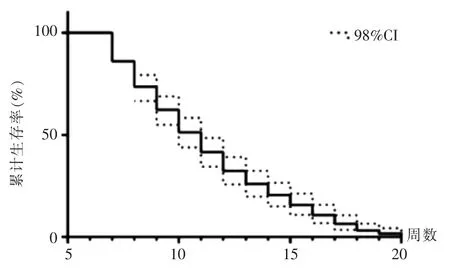
图5 大鼠生存曲线
2.2 TACE 应用组
2.2.1 肿瘤模型 本组20 只实验动物在DEN 诱导至肿瘤达0.5 cm 过程中死亡4 只, 余下16 只接受TACE 治疗。
2.2.2 技术成功率、DSA 表现及死亡率 1 只大鼠经胃十二指肠动脉逆行插管失败,2 只TACE 途中导管意外脱出且再次插入失败,1 只术中失血过量死亡,1 只因麻醉过量死亡,余11 只大鼠成功接受经导管动脉造影及TACE 治疗。TACE 技术成功为11/16,从皮肤切开到闭合的手术时间为(132±10)min。DSA证实该肝癌模型为富血供肿瘤,动脉早期可见肿瘤血管增多、紊乱,实质期可见结节状肿瘤染色,未见明显动脉-门静脉及动脉-静脉分流,栓塞后造影复查显示肿瘤供血动脉阻断,肿瘤染色消失(图6)。 TACE术中2 只大鼠死亡,术后观察期间1 只死亡(解剖发现大量腹水),TACE 相关死亡为3/16。
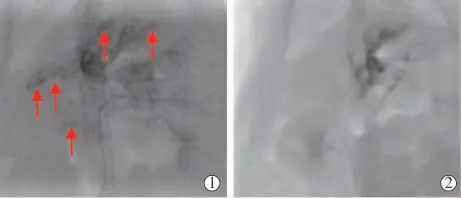
图6 TACE 栓塞效果示意图
2.2.3 肿瘤坏死 术后3 d 大鼠肝脏外观可见多发点状坏死,HE 染色显示肿瘤坏死率为(48.16±2.65)%;术后7 d 可见坏死灶进一步增多, 部分肝叶呈坏死改变,HE 染色显示肿瘤坏死率为(50.36±2.92)%(图7)。
3 讨论
DEN 常被用于诱导大鼠原位肝癌模型。主要优点在于诱导作用专一,常为肝细胞癌(约77%)[11-12]。通过P450 酶进行代谢催化形成DEN-DNA 加合物,发挥致癌性[13-14]。 此外,DEN 诱导活性氧(ROS)发生氧化应激,导致肝癌[15-16]。本研究中也体现出诱导早期肝细胞坏死、炎性细胞浸润,中期肝脏硬化以及晚期肿瘤形成的病理改变,相应的时间变化节点与既往文献报道基本一致[11,17-18]。
本模型成瘤规律因实验设计不同略有区别。Liu等[19]采用浓度为100 mg/L DEN 水溶液诱导16 周,所有实验鼠均成功出现肝癌。 Krishnan 等[20]首周腹腔注射2 次DEN(200 mg/kg),后连续注射7 d 停药,也在第14 周均造模成功。 但以上研究缺少造模过程动态监测,难以评判首次成瘤时间及不同阶段成瘤大小,无法满足介入操作要求。 本研究采取连续性肝脏MRI 扫描及病理检查,动态揭示模型成瘤全过程。在介入治疗方面,Gade 等[10]曾采用口服DEN 连续诱导, 最大肿瘤直径发展到0.5 cm 需至少3 个月。本研究发现, 肿瘤平均最大横经达到约0.5 cm 时虽为11~12 周,但此时大部分已超过0.5 cm,仅有个别仍为2~3 mm; 推测可能与其不均匀摄药量有关[13],这是该诱导方式不足之处。 因此,为达到最优介入操作效果,应早于12 周,最迟约在诱导后10 周左右行大鼠肝脏MRI 检查,以免肿瘤负荷过大,产生自发性坏死,影响操作及疗效评价。
本模型死亡率因实验设计不同也有所区别。 李笑岩等[11]采用口服DEN 诱导,最终死亡率为17.8%(24/135)。 周陈杰等[21]采用腹腔注射DEN 诱导,最终死亡率为33.0%。 朱艳志等[22]采用间断给予DEN方式诱导,实现了极低的死亡率(2.1%,1/48),但首次成瘤在诱导12 周后。 本研究中在诱导成瘤过程及肿瘤直径增大至0.5 cm 时累计死亡9 只,死亡率为22.5%(9/40),与以上研究相当。 可适当降低死亡率的方法如下:①保证大鼠饮水瓶足够洁净,减少大鼠发生感染概率。 ②定期更换大鼠垫料,减少氨气浓度;维持饲养房通风,保证光照。 ③如发现诱导期间大鼠死亡过多,可短暂停止诱导,更换普通水,给予大鼠恢复时间[23]。 本研究发现短暂(如2 周)停止诱导,不会影响最终成瘤情况。
本类模型肝外转移的报道相对较少。 Liu 等[24]采用1% DEN 水溶液持续灌胃, 在第20 周时观察到肺转移1 只,腹腔转移1 只(2/10)。朱艳志等[22]使用0.01% DEN 间断口服诱导, 观察到2 只肺转移(2/36),3 只肝外肿瘤(3/36),但未记录转移出现时间。 本研究中观察到肺转移、十二指肠种植转移、腹部淋巴结转移、肾上腺转移和肾转移各1 例。 结合既往文献及本研究结果,发现本模型肝外转移发生率较低,且转移部位及出现时间不固定。
本模型用于TACE 研究的优势体现在:①口服DEN 诱导重现了人类肝细胞癌的肝细胞损伤-肝硬化恶性进展的周期改变,实验大鼠出现了类似病理损伤; ②DSA 显示该模型肿瘤血管与人类肝细胞癌中所见肿瘤染色较为相似, 动脉期血管增多、紊乱,实质期结节染色;③TACE 操作引起的死亡率可随着术者操作水平和熟练度提升逐步降低,提高操作大鼠的存活率,证明该模型TACE 操作是可重复、安全的介入操作,为研究介入治疗效果动物模型的构建提供了更多选择[25-26];④TACE 操作实现了与既往报道[12]较为一致的肿瘤坏死率,且随着时间延长逐步提升。
本研究存在局限性, 模型成瘤时间虽较早,但满足介入治疗所需要求仍需在成瘤基础上等待肿瘤生长2 周左右;肿瘤多为散发,较难实现靶向栓塞; 模型受到所有啮齿动物模型所固有的限制,涉及生物等效性的推断和研究结果对人类肝细胞癌的适用性,仍有待进一步研究证实。
本研究采用影像与病理相结合方式, 揭示了DEN 诱导大鼠原位肝癌模型的肿瘤形成、生长、转移规律,以及肝脏背景损伤情况和动物生存时间,同时证实了采用开腹经胃十二指肠动脉逆行插管方法进行介入治疗的可行性,为开展进一步TACE 联合免疫治疗的动物实验提供有效的肝癌动物模型。

