血清miR⁃126、IGF⁃1水平与糖尿病前期人群结肠息肉发病的相关性
张慧慧 叶美霞 邓金凤 李鑫楠 陈赟 钟印芹★
结肠息肉是指从结肠粘膜表面突出到肠腔的息肉状病变,在未确定病理性质前均称为结肠息肉,通常分为非腺瘤性息肉和腺瘤性息肉[1]。糖尿病(diabetes mellitus,DM)前期人群血糖值较正常人高,但尚不符合确诊DM 的标准,此类人群不仅容易逐渐发展为2 型糖尿病,而且患结肠癌的风险相对较高[2]。目前认为大多数结肠癌患者是由结肠息肉演变而来,因此探讨DM 前期人群中结肠息肉发病的相关指标,早期发现并切除结肠息肉,对防治DM 前期患者结肠癌变具有积极意义。研究发现Ⅰ型DM 血管并发症患者血清微小RNA⁃126(miR⁃126)表达降低[3]。另有研究显示胰岛素样生长因子1(Insulin⁃like Growth Factor⁃1,IGF⁃1)调节的脑激素信号系统紊乱是DM 发生的关键因素之一[4]。由于miR⁃126、IGF⁃1 与DM 前期人群并发结肠息肉的关系尚不十分明确,因此本研究通过联合检测血清miR⁃126 与IGF⁃1 表达水平,探讨其与DM 前期人群结肠息肉发病的关系,以期为提高对DM 前期人群结肠息肉发病诊断的准确性、从而防止结肠息肉癌变提供参考。
1 资料与方法
1.1 研究对象
选取2017年11月至2021年3月于广州中医药大学深圳医院内分泌科治疗的673 例DM 前期患者,根据《中国癌症筛查及早诊早治指南(试行)》[5]规定,初筛出185 例结肠癌高危的DM 前期患者,遵医嘱完成全结肠镜检查者共169 例,其中88 例结肠黏膜病变中检出结肠息肉患者71 例作为DM 前期息肉组,结肠黏膜无病变者81 例作为DM 前期无息肉组。同期选取于本院腔镜中心进行全面健康体检且经75 g 口服葡萄糖耐量试验证实为糖耐量正常者140 例作为对照组,其中检出结肠息肉29 例作为正常息肉组,无结肠息肉111 例作为正常无息肉组。DM 前期人群纳入标准:①空腹血糖≥6.1 mmol/L 但<7.0 mmol/L 或餐后2 小时血糖≥7.8 mmol/L 但<11.1 mmol/L;②配合度高,已被告知研究过程并自愿参加本实验。排除标准:①高血压、心脏病、肝肾疾病等慢性病史;②脑部疾病、精神疾病;③吸烟、酗酒等不良生活习性者。本研究经院医学伦理委员会批准通过,受试者均签署知情同意书。
1.2 主要试剂与仪器
逆转录试剂盒(货号:KR116)购自北京天根生化有限公司;Prime ScriptTMRT reagent Kit(Perfect Real Time)(货号:RR037A)及Trizol 试剂(货号:JMS12279)均购自日本TaKaRa 公司;实时荧光定量PCR(Quantitative Real⁃time PCR,qRT⁃PCR)仪(型号:MiniAmp)购自赛默飞世尔科技(中国)有限公司;Human IGF⁃1 酶联免疫吸附法(enzyme⁃linked immunosorbent assay,ELISA)kit(HAKATA,HH⁃82⁃1)购自上海传秋生生物科技有限公司。
1.3 研究方法
1.3.1 血清样本的采集
所有受试人员空腹>8 h,均于清晨采集静脉血3 mL,置于促凝试管中,3 500 r/min 离心15 min,离心半径为15 cm,吸取血清标本置于Eppendrof管中,于-20℃冰箱保存待测。
1.3.2 血清miR⁃126 相对表达量测定
采用qRT⁃PCR 测定血清miR⁃126 相对表达量。从-20℃冰箱中取出血清样本,Trizol 试剂提取血清总RNA,异丙醇沉淀浓缩后,用75%酒精洗涤,干燥后加入100 μL DEPC 水,检测所得RNA 纯度及完整度。按照逆转录试剂盒说明书将RNA 逆转录为cDNA,产物置于-20℃保存。qRT⁃PCR 反应(反应体系10 μL):cDNA 模板4 μL,2×SYBR Green PCR Master Mix 5 μL,上下游引物各0.5 μL。由上海启因生物科技有限公司设计相应上下游引物,以U6为内参,序列见表1。反应条件:95℃变性5 min,循环1 次;95℃10 s、60℃20 s、72℃20 s,循环38 次,利用qRT⁃PCR 仪进行检测。根据各样本平均Ct 值,采用2⁃ΔΔCt法计算miR⁃126 相对表达量。

表1 qRT⁃PCR 引物序列Table 1 qRT⁃PCR primer sequences
1.3.3 血清IGF⁃1 表达水平测定
采用ELISA 法检测所有受试者血清中IGF⁃1 的表达水平,操作步骤严格按照试剂盒说明书进行。
1.4 结肠息肉的诊断及分类
由腔镜中心医技人员记录结肠镜下结肠息肉的检查结果,同时行息肉活检并将标本送病理学检查。在测量息肉直径时,若有多个息肉以直径最大的息肉作为代表。根据息肉的临床特点以及病理结果,将息肉分为高危息肉[息肉数量≥3 个和(或)高度增生不良和(或)绒毛状结构和(或)息肉直径≥1 cm]和低危息肉[息肉数量<3 个和(或)不伴有高度增生不良和(或)管状结构和(或)息肉直径<1 cm][6]。据此将DM 前期息肉组分为低危结肠息肉组和高危结肠息肉组。
1.5 统计学分析
采用SPSS 21.0 软件进行统计处理,计量资料以()表示,两组间采用t检验,多组间采用方差F检验,组间有差异进一步采用LSD⁃t检验;计数资料以n(%)表示,采用χ2检验;采用Pearson 法分析DM 前期结肠息肉患者血清中miR⁃126、IGF⁃1表达水平的相关性;绘制ROC 曲线分析血清miR⁃126、IGF⁃1 表达水平对DM 前期结肠息肉发病的诊断价值,曲线下面积比较行Z检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组一般资料比较
四组性别、年龄、体质指数、结肠癌家族史比较差异无统计学意义(P>0.05),正常无息肉组与正常息肉组空腹血糖比较差异无统计学意义(P>0.05),DM 前期无息肉组、DM 前期息肉组空腹血糖高于正常无息肉组与正常息肉组,DM 前期息肉组高于DM 前期无息肉组,差异均有统计学意义(P<0.05)。见表2。
表2 一般资料比较[(±s),n(%)]Table 2 Comparison of general data[(±s),n(%)]

表2 一般资料比较[(±s),n(%)]Table 2 Comparison of general data[(±s),n(%)]
注:与正常无息肉组比较,aP<0.05;与正常息肉组比较,bP<0.05;与DM 前期无息肉组比较,cP<0.05。
组别正常无息肉组正常息肉组DM 前期无息肉组DM 前期息肉组χ2/F 值P 值n 111 29 81 71男/女61/50 21/8 43/38 40/31 3.481 0.323年龄(岁)52.66±9.20 51.37±8.35 51.80±8.04 53.59±11.07 0.629 0.597体质指数(kg/m2)22.94±3.51 23.45±3.23 23.86±2.90 24.07±3.48 2.071 0.104空腹血糖(mmol/L)4.86±0.69 4.81±0.72 5.69±0.57ab 5.83±0.48abc 53.357<0.001结肠癌家族史25(22.52)9(31.03)20(24.69)19(26.76)1.048 0.790
2.2 四组血清miR⁃126、IGF⁃1 表达水平比较
血清miR⁃126、IGF⁃1 表达水平比较:DM 前期息肉组>DM 前期无息肉组>正常息肉组>正常无息肉组,差异有统计学意义(P<0.05)。见表3。
表3 四组血清miR⁃126、IGF⁃1 表达水平比较(±s)Table 3 Comparison of serum miR⁃126 and IGF⁃1 expression levels between the 4 groups(±s)
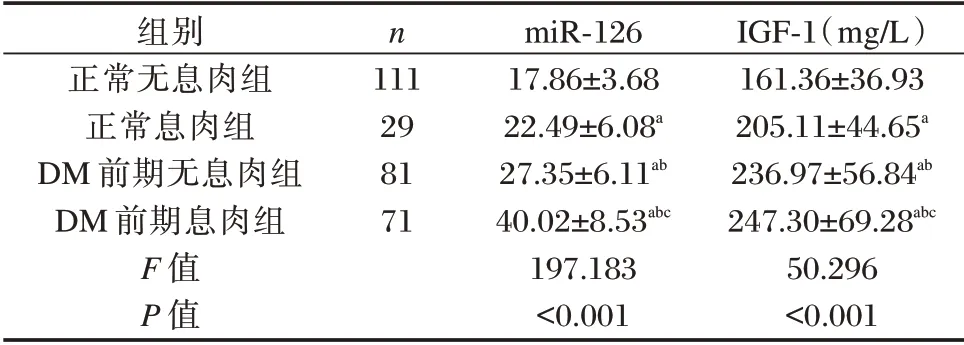
表3 四组血清miR⁃126、IGF⁃1 表达水平比较(±s)Table 3 Comparison of serum miR⁃126 and IGF⁃1 expression levels between the 4 groups(±s)
注:与正常无息肉组比较,aP<0.05;与正常息肉组比较,bP<0.05;与DM 前期无息肉组比较,cP<0.05。
IGF⁃1(mg/L)161.36±36.93 205.11±44.65a 236.97±56.84ab 247.30±69.28abc 50.296<0.001组别正常无息肉组正常息肉组DM 前期无息肉组DM 前期息肉组F 值P 值n 111 29 81 71 miR⁃126 17.86±3.68 22.49±6.08a 27.35±6.11ab 40.02±8.53abc 197.183<0.001
2.3 低危、高危结肠息肉组血清miR⁃126、IGF⁃1表达水平的比较
根据息肉的临床特点以及病理结果,将DM前期息肉组分为低危结肠息肉组(22 例)和高危结肠息肉组(49 例)。高危结肠息肉组患者血清miR⁃126、IGF⁃1 表达水平高于低危结肠息肉组,差异均有统计学意义(P<0.05)。见表4。
表4 低危、高危结肠息肉组血清miR⁃126、IGF⁃1 表达水平的比较(±s)Table 4 Comparison of serum miR⁃126 and IGF⁃1 expression levels between low⁃risk and high⁃risk colon polyp groups(±s)

表4 低危、高危结肠息肉组血清miR⁃126、IGF⁃1 表达水平的比较(±s)Table 4 Comparison of serum miR⁃126 and IGF⁃1 expression levels between low⁃risk and high⁃risk colon polyp groups(±s)
组别低危结肠息肉组高危结肠息肉组t 值P 值n 22 49 miR⁃126 32.72±7.00 43.30±9.22 4.791<0.001 IGF⁃1(mg/L)218.18±55.95 260.38±75.27 2.351 0.022
2.4 DM 前期结肠息肉患者血清中miR⁃126、IGF⁃1表达的相关性
Pearson 结果显示,DM 前期结肠息肉患者血清中miR⁃126 与IGF⁃1 表达水平呈正相关(r=0.447,P<0.05)。
2.5 血清miR⁃126、IGF⁃1 表达对DM 前期结肠息肉的诊断价值
ROC 曲线显示,血清miR⁃126 联合IGF⁃1 诊断DM 前期结肠息肉的曲线下面积明显高于两者单独诊断(Z=2.616、3.719,P<0.05)。见表5、图1。

表5 血清miR⁃126、IGF⁃1 表达对DM 前期结肠息肉的诊断价值Table 5 The diagnostic value of serum miR⁃126 and IGF⁃1 expression in colonic polyps in pre DM

图1 血清miR⁃126、IGF⁃1 表达对DM 前期结肠息肉的诊断价值Figure 1 The diagnostic value of serum miR⁃126 and IGF⁃1 expression in colonic polyps in pre DM
3 讨论
miRNA 是一个小型非编码RNA 家族,在调节血糖水平和DM 中起着至关重要的作用[7]。血浆miR⁃126 表达水平与某些血糖和脂质指数显著相关,可作为DM 生物标志物[8]。王凤等[9]认为miR⁃126 表达上调,可抑制白细胞黏附、限制炎症细胞召集,降低血小板的活化和聚集,调节脂质代谢,miR⁃126 具有作为血管内皮损伤标志物的潜能,同时miR⁃126 是缺血相关血管生成和修复信号的重要潜在靶点和调节位点。本研究结果显示,正常息肉组患者血清miR⁃126 表达水平较正常无息肉组高,与Thorlacius⁃Ussing 等[10]研究相似,提示miR⁃126 与结肠息肉的发生有关,猜测其可能参与结肠息肉形成的血管构建。DM 前期结肠息肉与无结肠息肉患者miR⁃126 水平均高于糖耐量正常者,提示miR⁃126 与DM 前期的发生也有关,原因可能为:DM 前期过程中机体为适应胰岛素紊乱等多种失衡机制,可能发生某些炎性反应,从而导致miR⁃126 水平升高。本研究还发现,DM 前期息肉组血清miR⁃126 表达水平较正常无息肉组、正常息肉组、DM 前期无息肉组显著升高,因此研究猜测miR⁃126 可能在DM 前期结肠息肉发病过程中扮演着重要角色。
IGF⁃1 是一种肽生长因子,可促进细胞增殖并抑制细胞凋亡[11⁃12]。有研究显示,DM 患者患结直肠癌风险高于无DM 者,在IGF⁃1 水平高于183.5 ng/mL 时,患结直肠癌的风险显著提高[13]。Parolin 等[14]发现,肢端肥大症患者结肠息肉的发生与IGF⁃1、空腹血糖水平显著相关。陈娟等[15]发现,糖尿病肾病患者血清IGF⁃1 表达水平显著高于健康对照组。本研究中,正常息肉组患者血清IGF⁃1 表达水平较正常无息肉者高,与Parolin 等[14]研究具有类似性,提示IGF⁃1 可能与结肠息肉的发生有关。DM 前期结肠息肉与无结肠息肉患者血清IGF⁃1表达水平均较糖耐量正常者高,提示IGF⁃1 高表达可能参与DM 前期慢性炎症刺激,加剧炎性反应。此外,本研究还发现,DM 前期息肉组血清IGF⁃1 表达水平较糖耐量正常者、DM 前期无息肉组显著升高,猜测IGF⁃1 水平升高可能在DM 前期结肠息肉发病过程中发挥一定作用,具体作用机制需后期继续探讨。
本研究Pearson 分析显示,DM 前期结肠息肉患者血清中miR⁃126 与IGF⁃1 呈正相关,提示两者可能在DM 前期炎性反应过程中存在某种共同调节机制。进一步研究发现,高危结肠息肉组血清miR⁃126、IGF⁃1 表达水平高于低危结肠息肉组,提示miR⁃126、IGF⁃1 表达或与结肠息肉危险程度相关。进一步绘制了ROC 曲线,结果显示血清miR⁃126、IGF⁃1 均可作为诊断DM 前期结肠息肉的血清指标,且两者联合诊断价值与可靠性更高。提示,在血清miR⁃126、IGF⁃1 表达水平升高的DM 前期人群中,需警惕结肠息肉恶变的风险。
综上所述,miR⁃126、IGF⁃1 在DM 前期发生结肠息肉患者血清中均呈高表达,miR⁃126、IGF⁃1 具有一定相关性,对诊断DM 前期患者结肠息肉有一定的诊断价值,两者联合诊断价值更高。

