臭氧胁迫对大豆抗氧化代谢与生殖生长的影响
李程程,张子蕤,宋晓萱,孔娟娟,韩阳,阮亚男
辽宁大学生命科学院,辽宁 沈阳 110036
近地层臭氧(O3)是一种分布较广且对生物有害的气体污染物,它不仅直接威胁着人类和动物的健康,对植物生长发育也有影响(Lefohn et al.,2018;Grulke et al.,2020;Kuerban et al.,2020)。由于 O3污染的不断加剧及对农林植物的损害强度的增加,O3问题已经受到越来越多的关注(Edenhofer et al.,2014;Wang et al.,2016;Emberson,2020)。
近地层 O3大量来自人为排放的氮氧化物(NOx)、植物可挥发性有机化合物(VOCs,volatile organic compounds)、一氧化碳(CO)和甲烷(CH4)等前体物在强光下的光化学反应产物,以及少量来自平流层大气的O3传输(冯兆忠,2020)。中国国家环境监测网络 2013—2017年的数据表明,中国近地层O3年均摩尔分数以3 nmol·mol-1的速度升高(Wang et al.,2019)。全国近地层O3摩尔分数每日8 h滑动平均最大值(MDA8)的年平均值达到(41.2±6.3) nmol·mol-1,长江三角洲等地 MDA8 最大值年平均值高达60—70 nmol·mol-1(Lu et al.,2018;冯兆忠等,2020)。由于O3形成的前体物质排放浓度不稳定,而且无规律性,以及光辐射的昼夜变化、季节性变化及阴雨天气的影响,导致近地层 O3浓度波动较大。O3污染具有日周期变化的特点,夜间O3浓度仅为白天的60%,在天气晴朗的夏季表现尤为突出(Bullbovas et al.,2014;易睿等,2015;阮亚男等,2017)。
O3是具有极强氧化毒性的二次污染物,对植物叶片的可见伤害是最直观的表现。研究发现,200 nmol·mol-1O3熏蒸 10 d即可造成银杏(Ginkgo biloba)叶片边缘卷曲和坏死现象(易睿等,2015)。高浓度 O3通过植物气孔进入到叶肉细胞,溶于细胞壁的结合水中,直接参与或形成活性氧(ROS)间接与细胞壁、细胞质膜的生物大分子发生反应,破坏细胞结构、影响植物正常代谢,对植物形态、生理生化、基因表达、蛋白表达等均有不同程度的影响(Zhao et al.,2005;Bullbovas et al.,2014;阮亚男等,2017)。O3诱导产生的大量ROS可诱导植物体内抗氧化系统启动防御机制,抗坏血酸等抗氧化物在细胞质外体清除ROS,过氧化氢酶、抗坏血酸-谷胱甘肽循环等重要抗氧化物质在共质体内清除余下的 ROS(冯兆忠等,2020)。但植物依靠自身的抗氧化代谢抵御近地层 O3浓度升高是有一定限度的。短期升高的O3浓度(100 nmol·mol-1)下大豆(Glycinemax)叶片影响三羧酸(TCA)循环、细胞壁组成和氨基酸的代谢物,促进气孔关闭的茉莉酸相关代谢物被诱导,比自然浓度处理升高了125倍(Zhang et al.,2021)。而低浓度O3处理却可以增加植物叶面积和生物量,60 nmol·mol-1熏蒸豇豆(Vignaunguiculata)幼苗使豇豆叶面积增加71.2%、生物量也显著增加(Malaiyandi et al.,2014)。O3胁迫使敏感型大豆的叶面积降低,而耐受型大豆表现出相反的结果(Britz et al.,2001)。因此,不同的O3浓度通过诱导特定的生化和分子反应,可以对植物产生不同程度的影响(Li et al.,2021)。
O3浓度迅速变化的这种特性迫使植物经常经历高浓度O3胁迫之后的浓度急剧下降,因此植物在受到O3胁迫后必须快速响应。因此,在O3污染加剧且浓度迅速变化的条件下,研究在不同浓度O3处理后,O3浓度恢复时作物氧化代谢变化,不仅有助于探究作物在恢复期对于O3浓度变化的响应机制,而且有助于确定明晰大豆生产中短期O3胁迫后的可修复浓度(Short et al.,2012;Changey et al.,2018)。大豆是世界范围内广泛种植的油料作物,其整个生长过程包括6个生育时期,分别为种子萌发期、幼苗期、分枝期、开花期、结荚鼓粒期和成熟期。大多数大豆品种具有臭氧的高敏感性(Osborne et al.,2016)。本实验采用不同浓度臭氧熏蒸处理,9 d后停止臭氧通入,使大豆幼苗在自然环境下自我修复,通过测定熏蒸处理后恢复时期植株的生长、抗氧化酶活性、非酶抗氧化物质水平及抗逆基因的差异表现,拟解决以下问题:(1)短时间的高浓度及低浓度O3熏蒸是否会引起大豆体内ROS爆发,而诱导特定的生化及分子响应,最终导致生殖生长发生变化?(2)大豆应对短期高浓度与低浓度O3熏蒸后,恢复期的抗氧化机制是否存在差异,是否存在诱导抗性?
1 材料与方法
1.1 试验区概况与实验材料
试验区位于中国科学院沈阳树木园(41°46′N,123°26′E),属北温带受季风影响的半湿润大陆性气候,四季分明,雨热同期,年平均温度6.2—9.7 ℃,降雨量755.4 mm。树木园占地5 hm2,栽培大量东北地区木本植物,森林覆盖率达57.3%,属城市近自然林(阮亚男等,2008)。
供试大豆品种为辽豆 23号,由辽宁省农业科学院作物研究所提供,2017年5月28日播种。采用内径40 cm,高30 cm的聚乙烯塑料桶进行盆栽。每盆装风干土 15.0 kg,施营养素 N:1 g·kg-1;P2O5:0.6 g·kg-1;K2O:0.8 g·kg-1。形式分别为:尿素(H2NCONH2)、磷酸二氢钾(KH2PO4)、氯化钾(KCl)。出苗3 d后间苗至每盆4株大豆幼苗,6月30日将植株移入开顶式气室进行缓苗。大豆种植期间的水分、肥料均匀一致,无病虫害及杂草等限制因素。
1.2 试验设计
采用开顶式气室(Open-Top Chambers,OTCs)模拟熏蒸方法,设备为9个结构完全相同的OTCs(横截面为正八边形,直径4 m,高3 m)及配套的通气和监测设备,主要包括臭氧发生设备(XH-2000,广州鑫弘智能环保设备有限公司,中国)、固定式气体检测仪(S-900,Aeroqual Inc.,新西兰)、臭氧浓度自动控制器(Campbell Scientific Inc.,美国)实时监测开顶箱内臭氧浓度,及时调整臭氧浓度,保证实验的准确性。
O3熏蒸试验共设3个处理,O3摩尔分数分别为(40.16±8.22) nmol·mol-1(CK,自然环境臭氧摩尔分数)、80 nmol·mol-1、200 nmol·mol-1,每个处理随机选择3个OTCs,气室内均放置9盆大豆植株。处理时间为7月3—12日,每天熏蒸O38 h(09:00—17:00),共熏蒸72 h。熏蒸结束后将植株置于自然臭氧浓度中,进入恢复实验。
1.3 数量性状与生理指标的测定方法
1.3.1 形态指标的测定方法
于大豆完熟期每个处理随机选取3株,对大豆植株进行株高和叶面积测定。叶面积采用剪纸法,测定其第一完全展开叶叶面积。于完熟期在每个处理内随机选取3株进行套透明纱网袋处理,大豆收获后取地上及地下构件并进行分解,地上构件包括茎、叶、荚3部分,地下构件为根,于75 ℃烘干至恒重并获得生物量。对所有大豆植株,测定单株结荚数和籽粒数,待籽粒自然风干后,测定单株籽粒生物量。
1.3.2 生理指标的测定方法
大豆分枝期进行生理指标的测定,取样时间为停止急性熏蒸后的第0、1、2、4、8、24、48、72小时,即不同的恢复时间。所取叶片均为完全展开叶,用锡纸包裹放入液氮内,随后保存至-80 ℃备用。带回实验室后对样品进行生理指标的测定:参照盐酸羟胺法(Ke et al.,2002)测定O2·-产生速率;硫酸钛法(Mukherjee et al.,1985)测定H2O2含量;金属离子比色法(Pellegrino et al.,2013)测定AsA及脱氢抗坏血酸(DHA)含量;GR-DTNB(谷胱甘肽还原酶-5, 5′-二硫代-2-硝基苯甲酸)循环法(Griffith,1980)测定GSH含量;氮蓝四唑(NBT)还原法(Giannopolitis et al.,1977)测定SOD活性;紫外吸收法(Pryor,1995)测定CAT活性;Nakano& Asads方法(Nakano et al.,1981)测定抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)、单脱氢抗坏血酸还原酶(MDHAR)及谷胱甘肽还原酶(GR)活性;硫代巴比妥酸(TBA)法(Buege et al.,1978)测定丙二醛(MDA)含量。
1.4 抗逆基因mRNA转录水平的测定方法
TRIZOL法提取叶片总RNA,利用反转录试剂盒(HiFiScript cDNA Synthesis Kit,CW2569M)进行反转录,在NCBI检索序列信息,用Primer Premier 5.0设计引物,利用合成的引物对各基因进行实时荧光定量 PCR(Quantitative real-time PCR,qRTPCR)扩增。以Actin3基因作为内参,利用 2-ΔΔCt方法(Livak et al.,2001)进行计算,得出大豆中SOD基因家族(Cu/Zn-SOD、Mn-SOD、Fe-SOD)、CAT基因家族(CAT1、CAT2、CAT3、CAT4、CAT5)、APX、GR、AO、Aatin3基因的相对表达量。
1.5 数据处理
应用Microsoft Excel 2007与SPSS 19.0软件对大豆完熟期的主要数量性状及分枝期 O2·-产生速率、H2O2含量、丙二醛(MDA)含量、抗坏血酸(AsA)含量、谷胱甘肽(GSH)含量、抗氧化酶活性(APX、DHAR、MDAR和GR),及SOD基因家族、CAT基因家族、APX基因、GR基因相对表达量的影响进行方差分析,采用t检验(P<0.05)比较各指标处理间差异的显著性;采用重复测量方差分析恢复时间与熏蒸浓度对大豆以上各项生理指标的影响。应用Sigma Plot 12.0软件作图。
2 结果与分析
2.1 形态指标的比较
经方差分析和多重比较,大豆表型主要形态性状对不同浓度臭氧处理的响应存在一定的差异(表1)。其中,在生长性状上,相同叶序的叶面积和株高在低浓度(80 nmol·mol-1)处理下与对照值相近,高浓度(200 nmol·mol-1)处理下则显著低于对照(P<0.05);在物质生产和分配上,地上生物量在低浓度处理下与对照值没有显著差异,高浓度处理下则显著低于对照,地下生物量则两种处理均显著低于对照,表明两种处理对根系生长均产生了不利影响;在结实性状上,单株豆荚数和单株种子数低浓度处理下均显著高于对照,而高浓度处理与对照无显著差异,表明两种浓度O3处理对结实性状均未产生不利影响;在种子大小性状上,单株种子重在低浓度处理下与对照值相近,高浓度处理下则显著低于对照。但两种浓度O3处理的大豆种子百粒重都显著低于对照,表明两种处理的种子均变小,即不同浓度的O3处理可能对种子质量均产生了不利影响。
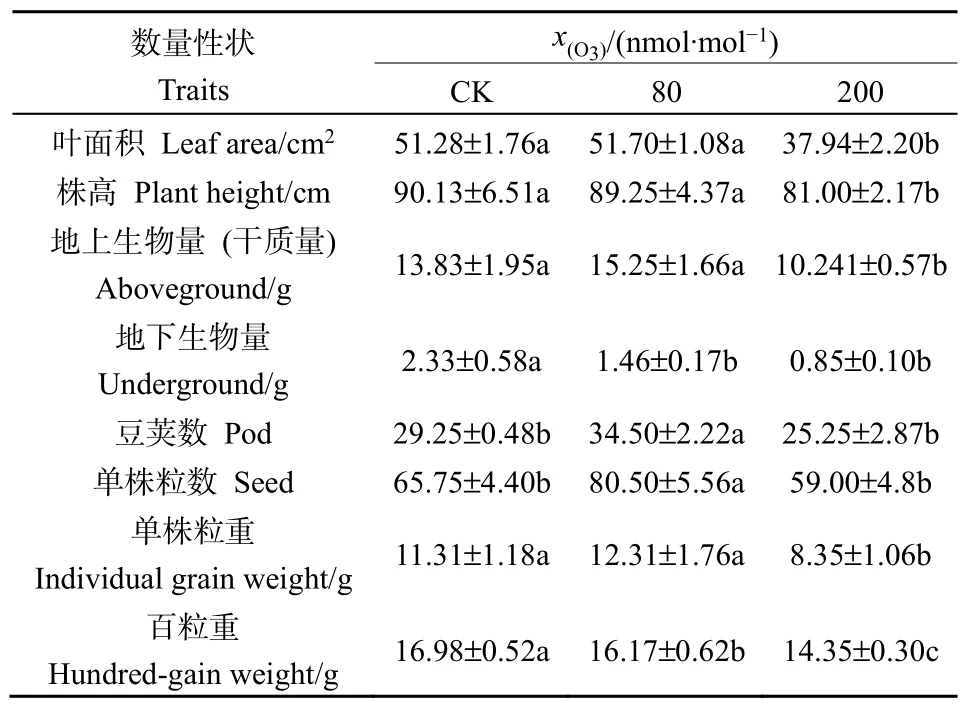
表1 不同浓度臭氧处理下大豆主要数量性状的多重比较Table 1 Multiple comparison of main quantitative traits of soybean with different ozone concentrations
2.2 叶片生理活性物质的变化
2.2.1 活性氧
经方差分析和多重比较,O2·-产生速率在低浓度(80 nmol·mol-1)处理下与对照值无显著差异,之后缓慢波动,72 h后速率降低12.7%(P<0.01);H2O2含量在低浓度处理下与对照值无显著差异。表明低浓度处理并未对大豆产生不利影响。大豆叶片O2·-产生速率值和 H2O2含量在高浓度(200 nmol·mol-1)处理下显著升高(P<0.01),1 h 后达到最高值,之后逐渐下降,72 h时与对照值接近(图1a、b)。臭氧浓度、恢复时间以及两者的交互处理对分枝期大豆的 O2·-产生速率(P<0.01)、H2O2含量(P<0.01)有显著影响。
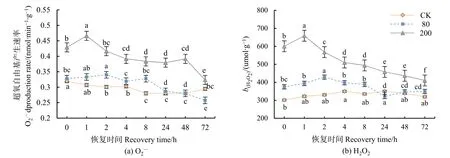
图1 不同浓度臭氧处理结束后对大豆叶片O2·-产生速率、H2O2含量的影响Figure 1 Effects of elevated ozone pretreatment to O2·-production rate, H2O2 content in soybean leaves
2.2.2 抗氧化酶
经O3处理的大豆在恢复期内,SOD活性均显著高于对照值(P<0.005),且前24 h高浓度O3处理SOD活性显著高于低浓度O3处理(图2a)。CAT含量在低浓度处理后恢复4 h时达到最大值,高浓度处理恢复8 h时达到最大值(图2b)。表明低浓度O3处理对SOD、CAT活性可能存在驯化,植株曝露到正常空气中可迅速恢复。臭氧浓度、恢复时间以及两者的交互处理对分枝期大豆的 SOD(P<0.01)、CAT活性(P<0.05)都有显著影响。
经方差分析和多重比较,APX活性均呈先上升后下降的趋势,低浓度处理与对照值在1 h后达到最大值,8 h后低于对照值;高浓度处理1 h后显著低于对照值,2 h之后显著升高(P<0.05)(图3a)。DHAR活性于高浓度处理下2 h后急剧上升,回落后于72 h后无显著差异(图3b)。MDHAR活性在高低浓度处理后1 h均显著上升(P<0.05),之后逐渐下降(图3c)。GR活性在高低浓度处理下恢复期间变化趋势与对照值相同(图 3d)。重复测量方差分析结果表明,恢复时间、臭氧浓度及二者的交互作用对分枝期大豆ASA-GSH循环的关键酶:APX、DHAR、MDAR和GR活性都有显著影响(P<0.05)。
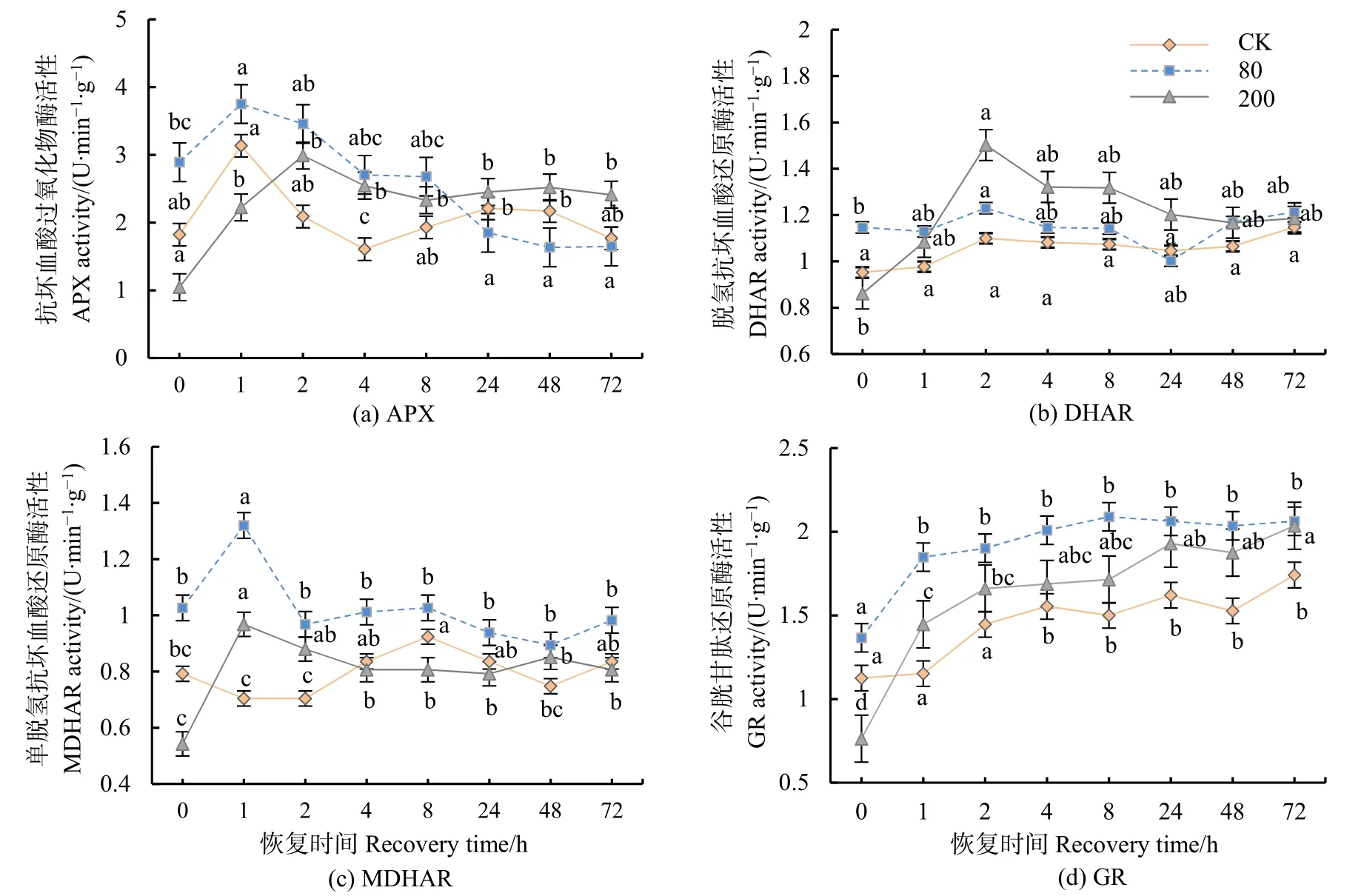
图3 不同浓度臭氧处理结束后对大豆叶片AsA-GSH循环酶活性的影响Figure 3 Effects of elevated ozone pretreatment to the primary enzyme activities in AsA-GSH of soybean leaves
2.2.3 非酶抗氧化物
方差分析和多重比较结果表明,低浓度处理下,AsA呈波动变化,且均高于对照值;在高浓度处理下恢复1 h后显著升高,随后略有下降(图4a)。低浓度处理下,DHA在恢复1 h后显著降低,4 h后时达最大峰值,4—72 h后下降,但与低浓度无显著差异;高浓度处理下恢复1 h后显著增加了80%,之后缓慢降低(图4c)。,低浓度处理下,AsA/DHA恢复期间与对照值无显著差异;高浓度处理下 2 h后呈现最高值状态(图 4e)。低浓度处理下,GSH呈波动下降的趋势;高浓度处理下恢复1 h后迅速下降(图4b)。高低浓度处理下,GSSG在恢复1 h时均达到峰值(图4d)。GSH/GSSG则在高低浓度处理下恢复1 h时显著降低(图4f)。重复测量方差分析结果显示,臭氧浓度、恢复时间及两者交互作用对分枝期大豆AsA、DHA、AsA/DHA、GSSG与GSH/GSSG均有显著的影响(P<0.05),对GSH、GSSG和GSH/GSSG均有极显著的影响(P<0.001)。

图4 不同浓度臭氧处理结束后对大豆叶片抗坏血酸与谷胱甘肽含量的影响Figure 4 Effects of elevated ozone pretreatment to AsA and GSH content in soybean leaves
2.2.4 丙二醛
方差分析和多重比较结果表明,MDA含量在低浓度处理下与对照值不存在显著差异;高浓度处理后1 h显著升高(P<0.001),之后持续下降,48 h后无显著差异(图5)。重复测量方差分析结果显示,臭氧预熏蒸浓度与恢复时间对分枝期大豆叶片MDA含量均有极显著影响(P<0.001)。

图5 不同浓度臭氧处理结束后对大豆叶片MDA含量的影响Figure 5 Effects of elevated ozone pretreatment to MDA content in soybean leaves
2.3 臭氧熏蒸对基因表达水平的影响
量化了分枝期大豆叶片5个CAT基因(CAT1、CAT2、CAT3、CAT4、CAT5)的转录水平。CAT1表达量在低浓度臭氧处理后24 h时达到最大值,高浓度处理后8 h时达到最大值,显著上调,72 h时高低浓度处理均与对照组无显著差异(图6a)。CAT2表达量在高低浓度处理后均显著上调,2 h时其表达量达到最大值(图6b)。CAT3、CAT5相对表达量较低(图6c、e)。CAT4表达量在低浓度处理后24 h时显著上调;高浓度处理下8 h时显著上调(图6d)。
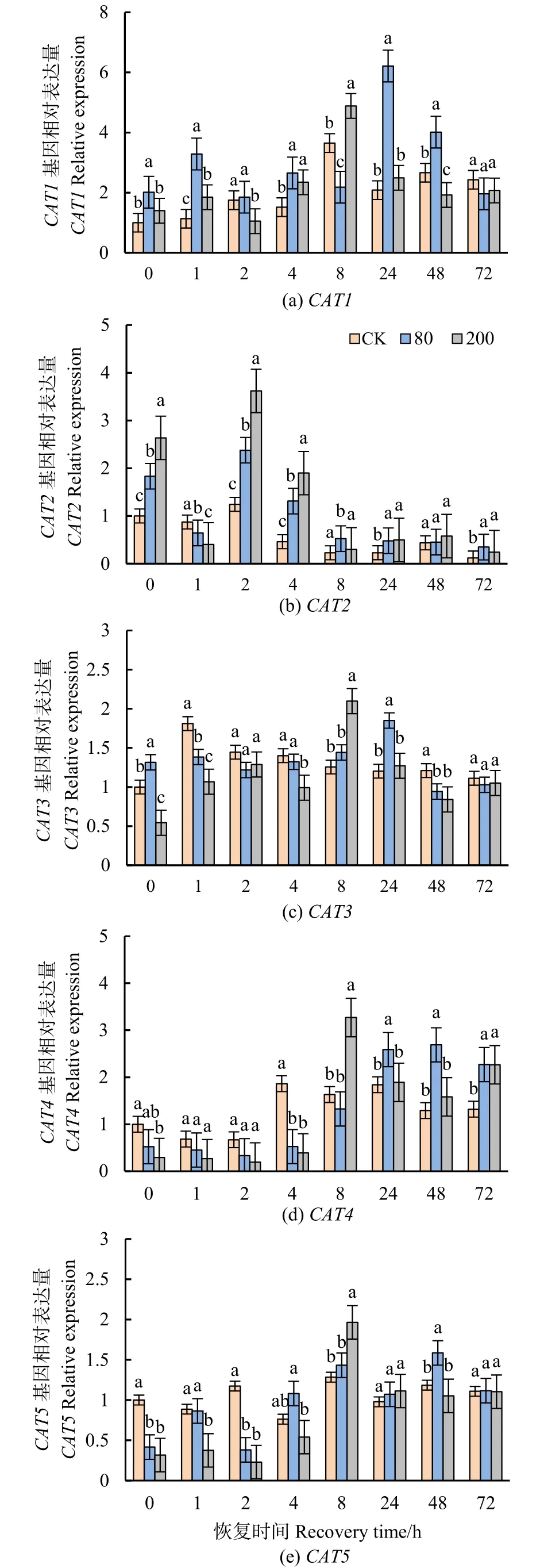
图6 不同浓度臭氧处理结束后对大豆叶片CATs基因表达水平的影响Figure 6 Effects of elevated ozone pretreatment to CATs genes expression in soybean leaves
量化了分枝期大豆叶片3个SOD基因(Cu/Zn-SOD、Fe-SOD、Mn-SOD)的转录水平。Cu/Zn-SOD表达量在高低浓度处理下均显著上调(图7a)。Mn-SOD相对表达量在低浓度处理下0—4 h时显著上调(图7b)。Fe-SOD表达量总体较低,仅低浓度处理下在2—4 h显著上调,高浓度处理下4 h时表达量显著上调(图7c)。
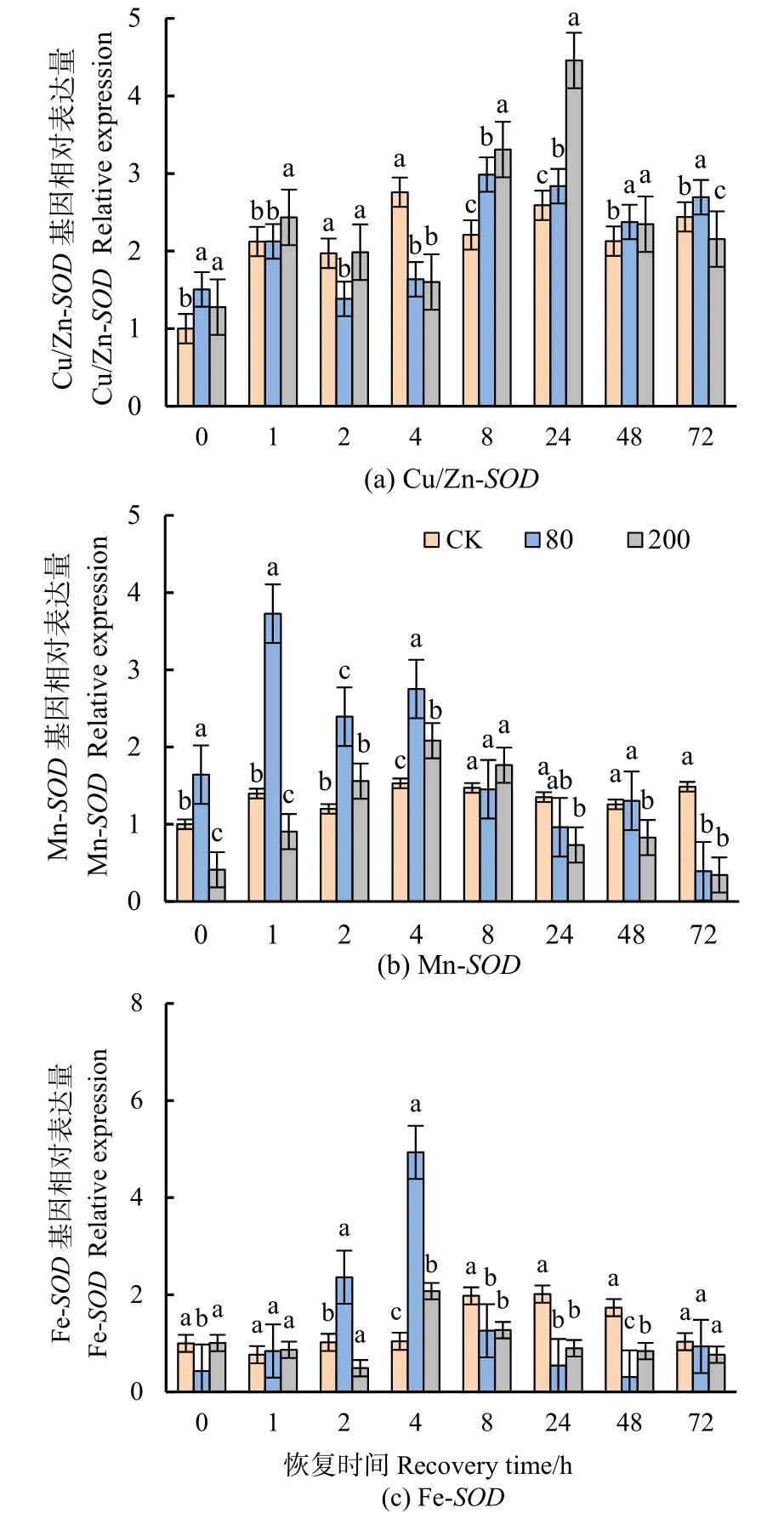
图7 不同浓度臭氧处理结束后对大豆叶片SODs基因表达水平的影响Figure 7 Effects of elevated ozone pretreatment to SODs genes expression in soybean leaves
APX与GR都是AsA-GSH循环主要酶。分枝期大豆叶片APX表达量在低浓度处理下显著上调,高浓度处理后2 h时表达量达到最大值,8 h后无显著差异(图8a)。GR表达量在高低浓度处理后1 h时显著上调,但随着恢复时间的延长,表达量下调(图8b)。

图8 不同浓度臭氧处理结束后对大豆叶片APX、GR基因表达水平的影响Figure 8 Effects of elevated ozone pretreatment to APX and GR gene expression in soybean leaves
3 讨论
近 20年来,伴随着中国城市化和工业化的快速发展,大量的温室气体排放到空气中,近地层的O3浓度不断升高,导致植物长期面临臭氧环境的胁迫作用(Liang et al.,2021)。本研究表明,不同浓度的臭氧胁迫对大豆植株数量性状存在差异性影响,如低浓度(80 nmol·mol-1)臭氧熏蒸后生殖指标(豆荚数和单株粒数)显著增加,但种子百粒重下降,而高浓度(200 nmol·mol-1)熏蒸后相关指标均显著降低。一方面表明低浓度的 O3有利于大豆受到胁迫后的资源权衡,能量倾向于生殖生长,单株种子数增加,但可能导致种子质量降低。另一方面高浓度 O3确实对大豆的生殖产生不利影响,并且叶面积、株高、地上生物量、地下生物量等营养生长指标也在胁迫下显著降低(Malaiyandi et al.,2014;Zhang et al.,2021)。因此,处于恢复阶段的大豆植株将面临缺少光合产物积累、迅速衰老的困境。而实际生产中我们取用的是大豆的种子,对其受到臭氧胁迫后的生理响应过程进行探究成为必然的目标。
大豆经历骤然高浓度臭氧胁迫后,大豆叶片O2·-产生速率、H2O2含量显著升高,导致ROS爆发,造成植物氧化损伤,这印证了第一个假设(Vaultier et al.,2015)。已有研究表明,高浓度臭氧熏蒸导致小麦(Triticumaestivum)、辣椒(Capsicum annum)、食荚菜豆(Phaseolusvulgaris)、水稻(Oryza sativa)等植物叶片内 ROS含量增加(Salvatori et al.,2015;Yamaguchi et al.,2015;Pandey et al.,2018;Macias et al.,2021)。大豆在高浓度臭氧胁迫解除后进入恢复期,体内的平衡再次被打破,代谢机制又一次受到冲击,由于过剩的活性氧水平不能及时消耗掉,所以大豆叶片 ROS水平在恢复初期仍有短暂的升高,但随着恢复期的延长,植物逐渐适应新的平衡,体内过剩的活性氧被逐步降解。本实验中低浓度处理下的 ROS水平活性与对照组无显著差异。在紫外线(UV-B)照射的研究中也观察到相似的情况(Yang et al.,2014)。
非酶促抗氧化物抗坏血酸和谷胱甘肽在植物应对胁迫时具有重要作用(Dumont et al.,2017;Karam et al.,2017)。植物还原型AsA的水平反映了抗坏血酸参与抗氧化反应的能力,代表其应对臭氧胁迫的氧化应激潜力(Calatayud et al.,2001)。本研究中,大豆在低浓度臭氧处理后的恢复期内总AsA含量增加,还原型AsA与氧化型AsA含量始终保持较高水平,表明大豆的抗氧化能力增强。与之相反,高浓度臭氧处理后AsA含量显著降低,在恢复期呈上升趋势,有利于加速大豆植株的修复。另外,O3胁迫可抑制抗氧化酶活性,降低了GSSG的还原比率(Mahalingam et al.,2006),导致高浓度O3处理下大豆GSSG含量急速上升。
植物抗氧化酶活性对臭氧浓度的升高的响应程度受胁迫强度、胁迫时间以及物种差异共同影响(Sim et al.,2009;Yamaguchi et al.,2015;Pellegrini et al.,2017)。本研究中,恢复期内,短期各O3处理9 d的大豆叶片SOD活性显著高于对照。通过对Mn-SOD、Cu/Zn-SOD、Fe-SOD(Bowler,1992;Perry et al.,2009;Alscher et al.,2002)3种SOD相关的基因表达研究,发现臭氧处理下大豆叶片Cu/Zn-SOD表达量处于相对较高水平,表明在修复高浓度O3造成的大豆氧化应激中,Cu/Zn-SOD的高表达对SOD活性起重要作用。CAT是一种高效的ROS清除剂(Gill et al.,2010;Qiao et al.,2015),本研究发现高浓度O3使大豆叶片CAT活性下降,但在恢复期经低浓度O3处理CAT活性升高响应比对高浓度O3处理更迅速。目前在大豆中发现的CAT基因有5种不同亚型,且在高浓度臭氧刺激下均能表达(Slupphaug et al.,2003)。大豆O3胁迫恢复期内,叶片CAT1整体相对表达量较高,CAT活性与CAT1呈显著正相关(r=0.429),可见CAT1亚基在控制大豆O3胁迫恢复期CAT的表达发挥主要作用。不同亚型CAT基因在发挥作用时确实具有差异性表达的特点(Du et al.,2010),在大豆的臭氧胁迫中应当重点关注CAT1基因。大豆APX含量在低浓度臭氧处理后的恢复初期(0—2 h)显著高于对照,但此时的H2O2含量及CAT活性无显著变化,因此在恢复初期很可能是APX催化的清除H2O2反应发挥主要作用(Kaur et al.,2021)。恢复4 h时CAT活性明显上调,催化清除H2O2能力得到增强。MDHAR和DHAR可分别将MDHA和DHA还原为ASA。恢复期间,MDHAR和DHAR活性之和与APX活性值基本相当,说明大豆叶片内AsA合成与消耗可以达到相对平衡,从而维持植物氧化还原平衡,降低ROS诱导的对植物细胞的损伤(Costa et al.,2021)。
进入恢复期后,大豆ROS经抗氧化系统清除调整后下降,缓解氧化胁迫造成的细胞膜脂损伤,MDA含量下降。同时,本研究表明,O3轻度胁迫情况下 ROS的产生和随后的氧化信号传导的改变可能启动其防御机制,以减轻氧化伤害,在恢复期内大豆代谢恢复比较迅速,且SOD、CAT等抗氧化酶要显著高于对照,抗氧化活性增强(Mahmood et al.,2021)。当胁迫强度较高时,细胞修复速率不能跟上ROS的产生速率,便会加剧氧化应激,严重情况下会发生不可逆转的损伤和生理能力丧失(Rozpądek et al.,2015;Kask et al.,2021)。
4 结论
低浓度 O3(80 nmol·mol-1)处理大豆在恢复期内,与对照相比 ROS水平下降,抗氧化酶活性升高,抗氧化物含量升高,抗氧化酶基因表达量增加,引发诱导抗性,但轻度的胁迫导致了植物资源的再权衡,生殖生长优先,单株豆荚数和种子数、单株种子重增加,造成当代大豆种子产量增加,但种子百粒重减小,种子质量可能受影响。高浓度O3(200 nmol·mol-1)处理下恢复期大豆叶片ROS水平显著高于对照与低浓度 O3处理,抗氧化系统清除能力不能迅速缓解氧化伤害诱导产生过量ROS,只能随着恢复期的延长,植物在适宜的环境下逐步缓解高浓度O3处理下诱导的氧化应激。但短期的重度O3处理导致大豆生殖生长受限,植株生物量、种子产量、数量均有下降。
——硫酰氟熏蒸应用技术

