光照和避光条件下石灰性水稻土Fe氧化还原与Cu活性关系研究
董乐恒 ,王旭刚,陈曼佳*,王子豪,孙丽蓉,石兆勇,吴琪琪
1.河南科技大学农学院,河南 洛阳 471023;2.广东省科学院生态环境与土壤研究所/华南土壤污染控制与修复国家地方联合工程研究中心/广东省农业环境综合治理重点实验室,广东 广州 510650
硫酸铜及其与石灰水混合物,是常见的高效杀菌剂,被长期应用于果树疾病的预防及治疗(Favaro et al.,2017),水产养殖业中车轮虫、斜管虫等寄生虫的防治(Tavares-Dias,2021),稻田的除藻(Ohadi et al.,2021)等。硫酸铜的广泛应用,已导致土壤中 Cu积累,严重污染土壤(Santana,1994;Lamichhane et al.,2018;周会程等,2020)。全国土壤污染调查公报显示(2014),中国耕地土壤重金属污染严重,Cu的点位超标率占2.1%,其中轻度、中度、重度污染分别占0.3%、0.15%、0.05%。Cu(Ⅱ)离子在土壤介质中可与有机物、矿质和微生物发生复杂的生物化学作用,使得重金属的赋存形态发生改变(Kumpiene et al.,2008)。例如,调节土壤的pH和有机质含量升高可使Cu(Ⅱ) 离子由水溶态和交换态向有机态和残渣态转化(郝汉舟等,2010;刘勇等,2019);土壤中加入钝化剂如钾长石、硫酸钙、碳酸钙等混合物能显著降低弱酸提取态Cu含量(朱先强等,2017)。
Fe是土壤中丰度最高的可变价过渡金属元素,具有较强的地球化学活性,是土壤中重要的吸附剂和氧化还原剂,可直接影响重金属的钝化、固定等环境行为。在淹水厌氧条件下,土壤中的Fe(Ⅲ) 可在微生物的作用下被还原为Fe(Ⅱ)(Lovley et al.,2004;Weber et al.,2006;马小兰等,2012),异化铁还原菌是主要的铁还原转化媒介;在此Fe(Ⅲ) 还原过程中,铁还原菌以土壤中有机物为电子供体,以铁氧化物中Fe(Ⅲ) 为电子受体,使土壤中含铁矿物溶解,晶相稳定、结晶度高的铁氧化物发生异化还原反应,并重新组合形成结晶度低或无定型的铁氧化物(Kappler,2005),而原本被吸附或共沉淀的重金属随着矿物的溶解而被释放(Frierdich et al.,2011;Bingjie et al.,2014)。同时,厌氧条件下,铁氧化菌均能使 Fe(Ⅱ) 氧化为 Fe(Ⅲ)(Schnell et al.,1993)。在 Fe(Ⅱ) 氧化过程中,铁氧化菌能以还原性Fe(Ⅱ) 为电子供体,以胞外氧化性物质为末端电子受体,通过氧化Fe(Ⅱ) 偶联电子受体还原,从这一过程中贮存生命活动所需的能量(Neubauer et al.,2002),Fe(Ⅱ) 被氧化生成具有良好吸附性的铁(氢)氧化物,如水铁矿、针铁矿、菱铁矿和赤铁矿等,原本被吸附在矿物表面的重金属在二次矿物形成的过程中被固定在结晶度更高的铁矿物中,从而影响重金属的形态和归趋(Latta et al.,2012)。
研究表明,Cu在土壤中的环境行为涉及一系列的氧化还原反应,尤其与土壤中Fe的氧化还原循环过程密切相关(Davranche et al.,2000;Balint et al.,2015)。Matocha et al.(2005)研究发现,厌氧酸性条件下,Cu(Ⅱ) 可被 Fe(Ⅱ) 还原成 Cu。Balint et al.(2015)研究不同氧化还原条件下土壤中Cu活性发现,交替的氧化还原条件会促使Fe、Mn和有机质的氧化还原过程,从而进一步影响Cu在土壤中的迁移转化;在有氧条件下,铁锰氧化物的还原溶解再沉淀有利于Cu的释放和迁移。由此可知,土壤中Fe的氧化还原必然会影响重金属Cu的环境行为。
在稻田生态系统中,光照和避光条件对土壤氧化体系起重要的影响,如与水生生态系统相关的光合微生物在光照条件下的产氧过程会使 Fe(Ⅱ) 氧化(孙丽蓉等,2008),从而对重金属的形态产生影响。石灰性水稻土作为中国北方重点的土壤类型(Shen et al.,2004),目前关于光照和避光条件下,其Fe的氧化还原过程及其与Cu的活性及形态关系仍缺乏系统性的研究。因此,本研究通过模拟不同Cu污染程度(轻、中、重度)土壤,构建恒温厌氧泥浆培养试验体系,分析避光和光照条件下的Fe的氧化还原转化动力学和Cu的活性和形态的变化,以及C转化,探索Fe的氧化还原耦合Cu转化的行为机制,为石灰性土壤中重金属的环境行为提供基础理论支撑。
1 材料与方法
1.1 供试样品
供试样品为石灰性水稻土,采自河南省孟津县(34°48′21″N,112°39′51″E),按多点采样的方式采集深度为 0—15 cm的土壤,土壤样品在实验室自然风干后,去除动植物残体,过0.850 mm筛。供试土壤的理化性质采用常规指标分析方法进行测试(鲁如坤,1999):pH 8.16±0.08,有机质 (14.87±0.10)mg·g-1,全氮 (1.49±0.01) mg·g-1,全磷 (1.03±0.05)mg·g-1,游离铁 (10.24±0.67) mg·g-1,无定形铁(2.20±0.17) mg·g-1,阳离子交换量 (14.95±0.29)cmol·kg-1。
Cu污染土壤制备:依据《土壤环境质量评价分析》,当pH>7.5时,Cu的评价标准值(Sip)为100 mg·kg-1。运用单项污染指数法对土壤中Cu污染的严重程度进行评价,计算公式为:

式中:
Pip——土壤中污染物的单项污染指数;
Ci——调查点位土壤中污染物的实测浓度;
Sip——污染物i的评价标准值。当Pip≤1时,污染评价为无污染;1<Pip≤2 为轻微污染;2<Pip≤3 为轻度污染;3<Pip≤5为中度污染;Pip>5为重度污染。因此,将所采集的土壤样品,通过外加CuSO4·5H2O溶液制备轻、中、重度污染土壤,其污染物质量分数分别为 256、384、512 mg·kg-1,其Pip分别为 2.56、3.84、5.12。
1.2 试验设计
本试验为泥浆恒温厌氧培养。按照1∶1的水土比称取3.00 g风干土样于10 mL西林瓶中,然后加入3 mL不同浓度的CuSO4·5H2O溶液或超纯水,分别配成Cu2+质量分数为256 mg·kg-1(轻度污染)、384 mg·kg-1(中度污染)和 512 mg·kg-1(重度污染)的污染土壤样品以及空白对照样品,共254个,盖上橡胶塞,用高纯氮气充气10 min,加铝盖密封,最后将1/2样品用锡纸包裹后放置于隔水式恒温培养箱[ (30±1) ℃]中避光培养,另外 1/2样品放置于光照培养箱[(30±1) ℃]中光照培养。每隔一段时间进行取样,测定样品中可浸提态Fe(II) 和不同活性Cu。本实验采用破坏性采样,每个样品设置3个重复,文中所示数据均为数据平均值。
1.3 分析方法
可浸提态 Fe(II) 样品按照培养设定的时间分别在第1、2、3、5、7、9、12、15、20、25、30 天进行取样,取出样品充分摇匀后吸取0.4 mL泥浆于10 mL离心管中,加入4.6 mL 0.5 mol·L-1HCl,充分摇匀后放入隔水式恒温培养箱 [(30±1) ℃]中浸提24 h,浸提液使用 0.22 μm 滤膜过滤后采用邻菲罗啉比色法进行测定。采用0.5 mol·L-1HCl和DTPA溶液对第30天样品进行提取,分析体系中活性Cu的含量(Maiz et al.,2000);同时,利用修正BCR提取分析体系中不同形态(包括弱酸提取态、可还原态和可氧化态)Cu的含量(Rauret et al.,1999);Cu的浓度用原子吸收分光光度法进行测定。溶液中可溶性碳以超纯水及按V(water):m(soil)=1∶5的比例浸提,TOC分析仪(孙丽蓉等,2013)(岛津 TOC-VCPH,N2载气 150 mL·min-1,680 ℃催化燃烧,非色散红外检测)测定。
重金属Cu的BCR法提取及分析:培养结束后将反应样品充分摇匀,吸取2 mL泥浆于50 mL离心管中,取1.00 g风干土样于50 mL离心管中作空白对照。(1)弱酸提取态:向装有样品的50 mL离心管加入40 mL 0.1 mol·L-1HOAc溶液,在恒温振荡器中以 (22±0.5) ℃的温度振荡16 h,将振荡完成后的样品以3000 r·min-1离心20 min,收集其上清液测定弱酸提取态 Cu的浓度。(2)可还原态:向上一步离心后剩余的固体中加入40 mL 0.5 mol·L-1NH4OH·HCl溶液,用硝酸调其pH至1.5,然后在恒温振荡器中以 (22±0.5) ℃的温度振荡16 h,将振荡完成后的样品以3000 r·min-1离心20 min,收集其上清液测定可还原态Cu的浓度。(3)可氧化态:向上一步离心后剩余的固体中加入10 mL H2O2(pH为2—3),充分摇匀后静置1 h,随后在 (85±2) ℃水浴锅中水浴1 h,再加入10 mL H2O2于 (85±2) ℃水浴1 h,然后加入50 mL 1 mol·L-1NH4OAc溶液,在恒温振荡器中以 (22±0.5) ℃的温度振荡16 h,将振荡完成后的样品以3000 r·min-1离心20 min。收集其上清液测定可氧化态Cu的浓度。
1.4 数据处理
避光条件下,Fe(Ⅲ) 还原过程采用 Logistic方程进行拟合(王旭刚等,2018):

其中:
a——铁还原容量;
b——一个拟合参数;
k——异化铁还原速率;
Ct——体系中t时刻体系中可浸提态Fe(Ⅱ) 的含量,Fe(Ⅲ) 最大还原速率μmax=0.25ak。
光照条件下,Fe(Ⅱ) 的氧化率为 Fe(II) 的氧化量与 Fe(Ⅱ) 最大积累量之商。其中,Fe(II) 的氧化量为 Fe(Ⅱ) 最大积累量与培养结束后 Fe(Ⅱ) 积累量之差;Fe(Ⅱ) 最大积累量为在所拟定的采样时间内测得的Fe(Ⅱ) 最大值。
数据应用Microsoft Excel 2016和Origin 9.0进行分析处理;应用SPSS 20.0进行方差分析,其中字母 a、b、c表示不同处理间差异达到显著水平(P<0.05)。
2 结果
2.1 Fe的氧化还原动力学
对不同培养条件下,石灰性土壤中Fe的氧化还原过程中可浸提态 Fe(Ⅱ) 的含量进行检测分析(图1)。由图1a可知,避光培养条件下,不同Cu污染程度石灰性土壤中 Fe的氧化还原过程主要表现为Fe(Ⅲ) 的还原,所有处理中可浸提态 Fe(Ⅱ) 含量均随反应进行呈先快速增加后趋于平稳。在反应 30 d后,对照土壤中生成了9.48 mg·g-1可浸提态Fe(Ⅱ);当土壤受到Cu污染时,可浸提态Fe(Ⅱ) 的产生量未受到显著影响,其质量分数介于9.78—10.84 mg·g-1。此外,可浸提态 Fe(Ⅱ) 的动力学曲线符合微生物生长曲线Logistic方程,各参数如表1所示。由表可知,原始空白对照土壤中,Fe(Ⅲ) 最大还原速率为0.57 mg·g-1·d-1;随着 Cu污染程度的加深,土壤中Fe(Ⅲ) 的最大还原速率受到不同程度的抑制,轻、中和重度 Cu污染土壤的最大 Fe(Ⅲ) 还原速率分别下降到 0.50、0.47、0.39 mg·g-1·d-1,与空白对照相比,分别下降了12.28%、17.54%和31.58%。

图1 避光(a)和光照(b)条件下0.5 mol·L-1可浸提态Fe(Ⅱ)含量的变化Figure 1 Change of 0.5 mol·L-1 extracted Fe(II) concentration during incubation under dark (a)and light (b) conditions

表1 避光培养铁还原过程Logistic方程拟合参数Table 1 Fitting parameters of logistic equation for iron reduction under dark condition
光照培养条件下,不同污染程度土壤样品的可浸提态 Fe(Ⅱ) 含量则随反应进行呈现先增加后降低趋于平稳的趋势(图1b)。对照处理中,反应前3天表现为Fe(Ⅲ) 的还原,可浸提态Fe(Ⅱ) 的产生量为 7.68 mg·g-1,反应 30 d 后下降为 4.72 mg·g-1,Fe(Ⅱ) 的氧化率为38.5%。当土壤受到Cu污染时,其Fe(Ⅱ) 氧化开始时间推后至反应第5天;轻、中、重度Cu污染处理下,可浸提态Fe(Ⅱ) 的产生量分别为 7.35、6.92、6.47 mg·g-1;反应 30 d 后分别下降为 6.06、5.58、5.33 mg·g-1,Fe(Ⅱ) 的氧化率分别为17.6%,19.4%、17.6%。由此可见,Cu污染可影响土壤的氧化还原过程,与对照处理相比,抑制了Fe(Ⅱ) 氧化的过程,但不同Cu污染程度处理之间,Fe(Ⅱ) 氧化率未有显著性差异。
2.2 反应前后水溶性碳转化
微生物是铁氧化还原循环过程的主要驱动力,小分子有机碳和无机碳分别是铁还原和铁氧化菌生长的关键因子,为此,本研究同时分析了反应前后水溶性碳含量的变化(图2)。原始土壤样品的水溶性无机碳(WSIC)和有机碳(WSOC)分别为88.98、258.3 mg·g-1。避光反应 30 d,无机碳含量提高到301.15—316.5 mg·g-1,有机碳质量分数则降低为111.5—119.25 mg·g-1。而光照条件反应30 d后,无机碳质量分数下降到79.56—100.84 mg·g-1,但与反应前相比,未有显著差异;而有机碳质量分数则显著降低到 77.07—139.55 mg·g-1。

图2 水溶性无机碳和有机碳含量的变化Figure 2 Changes in water-soluble inorganic and organic carbon concentration
2.3 Cu的活性变化
为研究石灰性水稻土铁氧化还原过程中Cu的活性以及形态转化行为,本研究分析了反应前后土壤中0.5 mol·L-1HCl溶液和DTPA提取态Cu,以考察Cu的活性。反应前,空白对照和轻、中、重度Cu污染土壤中0.5 mol·L-1HCl溶液可提取态Cu质量分数分别为 11.70、267.70、395.70、523.70 mg·kg-1,DTPA可提取态Cu质量分数分别为5.43、261.43、389.43、517.43 mg·kg-1。外加的 Cu(Ⅱ) 均以活性Cu形式存在于土壤中。培养30 d后,各处理Cu含量如(图3)所示。无论避光与否,对照处理中,Cu的活性基本未发生变化。避光条件下,轻、中、重度Cu污染处理中,0.5 mol·L-1HCl溶液可提取态 Cu质量分数分别下降到 0.96、1.29、0.99 mg·kg-1,下降比例高达 99.6%以上(图3a)。光照条件下,0.5 mol·L-1HCl溶液可提取态Cu也有一定程度的下降,分别下降到 193.3、292.5、403.5 mg·kg-1,降幅为23%—27.8%(图3a)。类似地,反应30 d后,体系中DTPA提取态Cu呈现下降趋势(图3b)。避光条件下,轻、中、重度Cu污染处理中,DTPA提取态 Cu分别下降到 10.29、13.92、15.67 mg·kg-1,下降比例高达96.1%(图3a)。光照条件下则分别下降到 66.75、95.75、121.8 mg·kg-1,降幅达74.5%以上(图3b)。由此可见,反应30 d后,尤其是避光条件下,土壤中有效态Cu活性均降低,大部分游离态Cu转化为低活性Cu。

图3 培养结束各处理Cu含量Figure 3 Cu concentration of each treatment at the end of incubation
为进一步分析 Cu在体系中的转化,本研究以中度Cu污染为例,继续分析了弱酸提取态、可还原态和可氧化态Cu的含量(图4)。培养前中度污染土壤样品中,弱酸提取态、可还原态和可氧化态Cu质量分数分别为 384.64、6.66、5.29 mg·kg-1。反应 30 d后,避光条件下,基本不存在弱酸提取态Cu,可还原态Cu和可氧化态Cu质量分数分别从6.66、5.29 mg·kg-1升高为 209.9、138.2 mg·kg-1,分别增长了30.5倍和25.1倍。光照条件下,弱酸提取态Cu质量分数为21.2 mg·kg-1,与培养前相比下降了94.5%,可还原态Cu和可氧化态Cu质量分数分别 198.9 mg·kg-1和 127.0 mg·kg-1,分别增长了28.9倍和18.3倍。由此可见,无论是避光培养还是光照培养均能促进弱酸提取态Cu向可还原态和可氧化态Cu转变,降低土壤中Cu活性,且避光条件下效果更加显著。
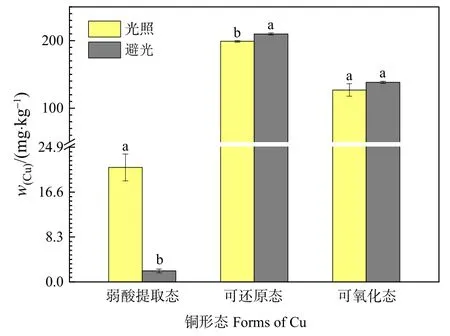
图4 中度Cu污染土壤培养30 d后不同形态Cu含量Figure 4 Cu concentration of different forms in medium polluted soil after incubation 30 days
3 讨论
3.1 铁氧化还原过程对Cu活性的影响
土壤中 Fe的氧化还原过程对重金属的形态转化以及有效性有着重要的影响,已有研究表明,在铁还原过程中,铁还原微生物能够通过自身的代谢活动,将(类)金属如As、Mn、Cr等作为电子受体(供体)从而改变其价态(王春等,2020;钱子妍等,2021)。在本实验中,Fe的氧化还原过程对Cu的活性有着重要的影响。通过对DTPA可提取态Cu的减少量以及HCl可提取态Cu的减少量与Fe(Ⅲ) 的最大还原容量进行相关性分析发现,其二者与铁的还原容量之间存在着显著的正相关关系(图 5),其原因可能在于,随着 Fe(Ⅲ) 被还原为Fe(Ⅱ),Fe(Ⅱ) 与铁氧化物形成配体,具有很强大的吸附性(Tessier et al.,1996),从而吸附Cu(Ⅱ),降低其活性;同时,Fe(Ⅱ) 可与Cu(Ⅱ) 发生交互反应,促使Cu的老化(Tao et al.,2017)。Cu由活性状态向可氧化态和可还原态转变(图3—4)。此外,我们发现在此过程中,体系中水溶性无机碳的增加量与DTPA可提取Cu的减少量以及HCl可提取Cu的减少量之间存在极显著的正相关关系(图5)。众所周知,微生物介导的异化铁还原过程中,微生物能以水溶性有机碳为电子供体,产生水溶性无机碳,可与土壤中Cu(Ⅱ) 结合,生成难溶的CuCO3,从而降低了Cu的活性。在本试验中,光照条件下Cu的活性降低量低于避光条件下,且光照条件可还原态Cu和可氧化态 Cu分别比避光条件少 5.25%和8.10%,这可能是由于,在光照培养后期,光合细菌如蓝藻等以光照为能量来源,水溶性无机碳为电子受体,从而限制了CuCO3的形成,抑制Cu活性的降低。
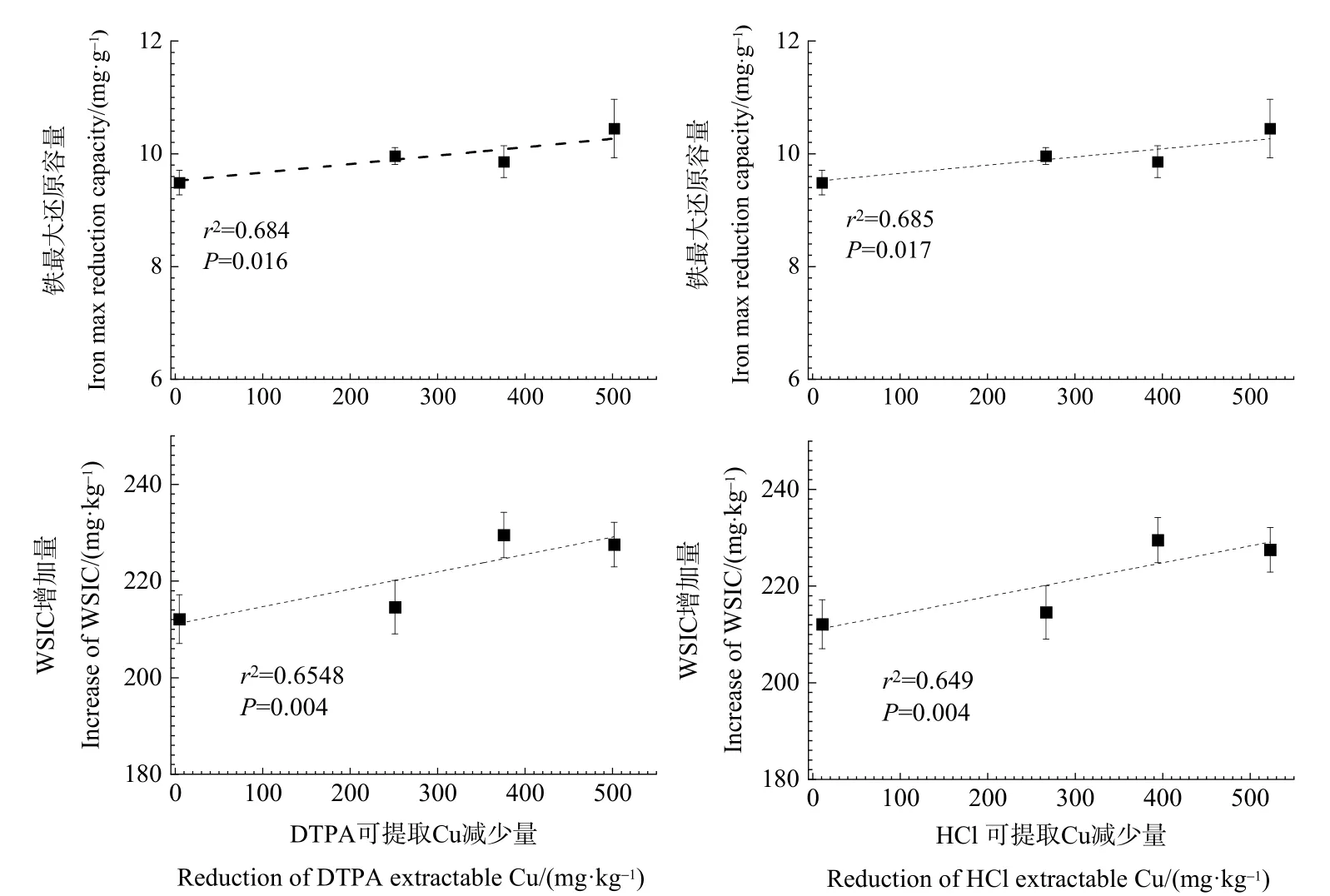
图5 Cu活性与铁最大还原容量和水溶性无机碳(WSIC)增加量相关性Figure 5 Correlation between Cu activity and iron max reduction capacity and increase of water-soluble inorganic carbon (WSIC)
3.2 避光/光照条件 Cu污染程度对铁氧化还原的影响
Fe的氧化还原过程既包含微生物参与的过程,也包含化学过程。已有的研究表明,淹水条件下,土壤的铁还原过程由微生物介导的异化铁还原过程起主导作用(徐丽娜等,2009)。
避光厌氧条件下,异化铁还原微生物能以水溶性有机碳为电子供体,Fe(Ⅲ) 氧化物为电子受体传递电子,使得Fe(Ⅱ) 含量随培养时间的增加而逐渐增加,最终趋于稳定(图1a),同时促进了有机碳的矿化,培养30 d后土壤中水溶性有机碳含量降低了53.8%—56.8%,水溶性无机碳含量增加了2.4—2.6倍(图2)。当土壤中受到Cu污染时,土壤Fe(Ⅲ)的最大还原速率受到一定程度的抑制(表 1),对Fe(Ⅲ) 的最大还原速率与 Cu的污染程度的相关性进行统计分析,结果发现,石灰性土壤的最大铁还原速率与土壤中Cu的含量之间存在着显著的负相关关系(r2=0.904,P=0.044)(图6)。本实验中,Fe的氧化还原过程由微生物起主导作用,与微生物尤其是铁氧化/还原菌活性密切相关。然而 Cu(Ⅱ) 可以通过与细胞内的酶结合使细胞失活,有研究表明,土壤中微生物生物量氮和碳与有效铜含量呈显著负相关关系(王秀丽等,2002)。Cu(Ⅱ) 添加量在50 mg·kg-1时会对土壤微生物活性产生抑制作用(吴春艳等,2006),在400 mg·kg-1时对土壤微生物产生显著毒害作用(王静等,2010)。本实验中,外源添加 Cu(Ⅱ) 含量在 65—130 mg·kg-1之间,随着Cu污染程度的加深,对铁还原微生物的毒害增强,从而在一定程度上抑制了Fe(Ⅲ) 的还原。其次,外加的Cu(Ⅱ) 可吸附在铁氧化物表面,阻碍了铁还原微生物与铁氧化物的直接接触,抑制了Fe(Ⅲ) 还原过程,从而导致Fe(Ⅲ) 的最大还原速率随着Cu污染程度的增加而逐渐减小。

图6 Cu添加量和最大还原速率相关性Figure 6 Maximum reduction rate Cu content is correlated with maximum reduction rate
光照厌氧条件下,不同程度Cu污染均表现为培养前期可浸提态Fe(Ⅱ) 含量逐渐增加,而随着培养的进行,被还原的Fe(Ⅱ) 再次被氧化;然而随着Cu污染程度的加深,Fe(Ⅱ) 的氧化率逐渐降低,研究表明,光照厌氧条件下,Fe(Ⅱ) 的氧化主要是由于土壤中的微生物作用而导致的,如土壤中存在蓝细菌等光合产氧菌,其在光照条件下,能产生氧气,从而导致Fe(Ⅱ) 的直接氧化(孙丽蓉等,2013),因此,随着Cu污染程度的加深,抑制了Fe(Ⅱ) 的氧化过程,此外,光照培养结束后,体系中水溶性有机碳含量显著降低,而水溶性无机碳含量与培养前无显著变化。Wang et al.(2002)研究石灰性水稻土光照条件下培养30 d后发现,体系有机碳含量降低,蓝藻的相对丰度从2.8%增加到11.7%。由此推测,在本研究中,在Fe(Ⅱ) 氧化过程中,光合细菌以水溶性有机碳为电子受体,Fe(Ⅱ) 氧化物为电子供体传递电子,消耗了水溶性无机碳。
4 结论
本研究通过对不同Cu污染程度石灰性土壤中Fe的氧化还原过程及Cu的活性进行系统性研究,结果发现,避光条件下,石灰性土壤主要发生异化铁还原过程;而在光照条件下,先发生铁还原,后发生铁氧化的过程;铁还原/氧化菌是介导土壤铁氧化还原过程的主要驱动力。不同程度Cu污染均会对Fe的氧化还原过程产生抑制作用且随着Cu污染程度的加深,抑制作用逐渐增强;Fe的氧化还原过程亦能够促进土壤中Cu由弱酸提取态向可还原态和可氧化态转变,降低土壤中Cu的活性。

