靶向前列腺特异膜抗原的放射性诊断药物的研究现状和进展
周 旭,崔孟超,沈浪涛,4,*
1.原子高科股份有限公司,北京 102413;2.中国同辐放药研发中心,北京 102413;3.北京师范大学 化学学院,北京 100875;4.中国原子能科学研究院 国家同位素工程技术研究中心,北京 102413
前列腺癌是男性常见的恶性肿瘤之一,也是导致癌症死亡的重要原因。世界卫生组织的癌症数据显示,2020年我国男性前列腺癌发病率位列男性恶性肿瘤发病率第十位,发病率为2.5%,发病数约为11.5万;因前列腺癌导致的死亡率占男性恶性肿瘤导致死亡率的第十三位,死亡率为1.7%,死亡人数约为5.1万[1]。2020年全球前列腺癌的发病数约为141.4万,死亡人数约为37.5万[1]。前列腺癌的准确早期诊断和治疗正受到人们越来越多的关注。
目前前列腺癌的治疗手段主要有手术、放射性治疗和去势治疗等[2]。但是在实际治疗中,有约37%~48%的患者会出现生化复发或者转移性去势抵抗性(非激素依赖型)前列腺癌[3-4]。临床研究表明,对前列腺癌进行准确的早期诊断和定位,有助于医生对前列腺癌患者的预后判断,也有利于提高患者的5年生存率[5]。
前列腺特异膜抗原(prostate-specific membrane antigen, PSMA)在所有前列腺癌细胞表面都过度表达,在前列腺癌的诊断中表现出了很高的灵敏度和极强的特异性,是前列腺癌诊断和治疗的重要靶向位点[2]。本文介绍基于前列腺特异膜抗原的放射性诊断药物的研究现状和最新进展,内容包括放射性核素标记的单克隆抗体、抗体片段和小分子抑制剂等。
1 前列腺癌的常见诊断方法
目前临床上前列腺癌的诊断主要采用直肠指诊、前列腺穿刺活检、血清前列腺特异抗原(prostate-specific antigen, PSA)检查、超声检查、计算机断层成像(computed tomography, CT)、核磁共振成像(magnetic resonance imaging, MRI)、正电子发射断层显像/计算机断层成像(positron emission tomography/computed tomography, PET/CT)、单光子发射计算机断层成像/计算机断层成像(single-photon emission computed tomography/computed tomography, SPECT/CT)等方法[6-7]。这些方法既有各自的优点,但也存在不足之处,对早期前列腺癌的诊断具有一定的局限性[2,6]。
在上述提及的几种方法中,PET/CT和SPECT/CT技术属于核医学分子影像[8]。分子影像(PET/CT[9-11]、SPECT/CT[9-11]、光声成像[12]等)能从分子或细胞水平提供组织新陈代谢状况,从而揭示人体细胞和分子水平上的异常,有助于疾病的早期诊断、以及疾病发生和发展规律的研究。PET/CT及SPECT/CT均依赖于放射性诊断药物。在采用PET/CT或SPECT/CT进行前列腺癌的显像诊断中,比较常见的放射性诊断药物为18F-氟化钠、11C或18F标记的胆碱类药物以及[111In]-ProstaScint等,但它们在诊断的准确性、特异性、灵敏度等方面均有待提高。随着人们对以PSMA为靶点的放射性药物研究的不断深入,近年来已新出现了[68Ga]Ga-PSMA-11等在临床应用和临床研究中的诊断放射性药物。
2 前列腺特异膜抗原的基本结构及功能

图1 前列腺特异膜抗原(PSMA)的结构示意图Fig.1 Structure of PSMA
前列腺特异膜抗原又称Ⅰ型叶酸水解酶,或者Ⅱ型谷氨酸羧肽酶。它由750个氨基酸组成,分子量为100 kDa。如图1所示,PSMA由三个片段组成:(1) 位于细胞内的片段由18个氨基酸组成;(2) 位于细胞外的片段由707个氨基酸组成;(3) 横跨细胞膜的片段由25个氨基酸组成[13]。PSMA的单晶结构显示,位于细胞外的片段又可进一步分为三个部分[14]:蛋白酶部分、顶端部分、螺旋形部分。这三个部分共同围成了一个向内部凹陷的空间(约1 100 Å2,1 Å=0.1 nm):该空间包含了一个双核锌位点和部分极性氨基酸残基;在这个凹陷空间的底部还有可特异性结合谷氨酸(或其类似物)的位点[14]。因此,若一个分子中含有可以与锌离子结合的化学基团,同时也含有谷氨酸(或其类似物)基团,那么它就有可能被用来特异性结合PSMA[2]。
研究表明:在早期前列腺癌中,仅有5%~10%的病例会呈现PSMA阴性;而在转移性和去势抵抗性前列腺癌细胞中,PSMA的表达程度会大大增加,但在正常组织如脑、肠道中的表达量还不到前列腺癌细胞中的1/100~1/1 000[15]。因此,PSMA的表达与前列腺癌的进展程度高度正相关,是前列腺癌诊断和治疗的重要靶点。当特异性的抗体、抗体片段或者小分子抑制剂与PSMA结合后,连有上述基团的PSMA作为一个整体会通过细胞内吞作用被转运到细胞内部[2]。这个转运过程可以加速放射性药物在癌细胞内的积累,从而提高诊断准确性及治疗效果,同时也可以加快放射性药物在血液中的清除速率,降低其对人体带来的副作用。
3 基于前列腺特异性膜抗原的放射性药物
3.1 单克隆抗体放射性药物
1) 7E11-C5.3(CYT-356)抗体
Horoszewicz课题组[16]于1987年研制了单克隆小鼠抗体7E11-C5。该抗体的作用靶点位于PSMA细胞内的部分(图1)。由于7E11抗体是一种亲水性分子,不易通过疏水性的细胞膜,因此,对于大部分的前列腺癌细胞来说,7E11抗体无法有效与PSMA的胞内部分结合。
世界上首个用来标记7E11抗体的核素是111In。该药品称为喷地肽铟[111In]卡罗单抗([111In] capromab pendetide),商品名为ProstaScint。它于1996年获得美国食品药品监督管理局(FDA)批准上市,可用于前列腺癌软组织部位的SPECT显像,但不适用于前列腺癌骨转移显像。这可用7E11的作用机理来解释:前列腺癌软组织的血液供应较少,因此死亡细胞相对较多,而细胞一旦死亡分解,位于细胞内部的PSMA结合位点就容易暴露出来,7E11无需穿过细胞膜就能直接与暴露出来的位点结合;相比之下,骨组织的血液供应比较充足,死亡细胞较少,细胞内部的PSMA位点无法有效暴露,因此7E11抗体便无法与之有效结合[17-18]。除了肿瘤穿透性差,该抗体也存在血液清除速率低、肿瘤组织摄取速率低等问题。除了111In,89Zr[18]、124I[19]等核素也被用来标记7E11-C5.3抗体。与[111In]In-7E11相比,[89Zr]Zr-7E11在PET显像中表现出更高的肿瘤/血液比,而[124I]I-7E11在PET显像中表现出更快的清除速率。
2) J591抗体
由于[111In]In-7E11抗体在特异性和灵敏度上存在问题,因此,人们进行了新抗体的研制。J591抗体是第二代PSMA靶向单克隆抗体,它由Bander课题组[20]研制。该抗体增加了PSMA内化的速率。此外,与7E11抗体不同,J591抗体与PSMA的作用位点为细胞外部的识别位点(图1),从而克服了7E11抗体类药物无法有效穿透细胞膜而只能作用于死亡或濒死细胞的缺点[21],可以更快速地到达靶点。用99Tcm[22]、111In[23]、89Zr[24-25]、64Cu[26]等核素标记J591抗体后,可用于前列腺癌的诊断。其中,从与PSMA的作用机理来考虑,因为J591的作用位点在细胞外部,因此[99Tcm]Tc-J591应比[99Tcm]Tc-7E11-C5.3的显像效果更好,但是实际的实验结果却恰恰相反。这可能是由于标记方法的差异导致的[22]。[111In]In-huJ591的Ⅰ期临床结果表明,其对前列腺肿瘤组织的新生血管系统有较好的靶向作用[23]。Holland[24]和Pandit-Taskar 等[25]完成了[89Zr]Zr-DFO-huJ591(DFO:去铁胺B)的合成并开展了生物学评价,结果表明:该药物在PET显像中能够提供很高的肿瘤/非肿瘤比;其Ⅰ期及Ⅱ期临床数据表明,由于J591抗体本身体积比较大,其药代动力学速率较慢,血液清除时间较长,注射药品后通常需要6~8 d才能达到最佳的肿瘤显像效果,但这也可能给周围的良性组织带来不必要的辐射。[64Cu]Cu-huJ591的实验结果表明该药物在去势抵抗性前列腺癌的显像方面具有优势[26]。
3) 抗体片段
除了单克隆抗体以外,人们还开发了各种抗体片段,用于前列腺癌的诊断与治疗研究。相比于单克隆抗体,抗体片段一般可在保持对肿瘤组织的特异结合的前提下,实现更快的药物递送及非肿瘤组织的清除速率。scFv是源于J591的抗体片段。
Nawaz等[27]研究了基于scFv的诊断用放射性药物68Ga-THP-scFv(THP:三(羟基吡啶酮))。与THP-mal偶联后,所形成的药物前体可在室温、中性pH条件下定量、快速地制备68Ga-THP-scFv,且不需进一步纯化。68Ga-THP-scFv 在血清中较稳定,可以选择性地与DU145-PSMA相结合。PET/CT结果显示,其肿瘤摄取高,且通过肾脏的清除速率较快。Viola-Villegas等[28]研究了一组基于抗体片段scFv的诊断用放射性药物89Zr-Mb和89Zr-Cys-Db。在这些药物中以DFO-Bz-SCN为双功能螯合剂进行抗体片段的偶联和89Zr的标记。两者的标记均可达到较高的放射化学产率及纯度。组织分布测定结果显示了89Zr-Mb 和89Zr-Cys-Db 对 PSMA阳性的异种移植物的特异性,注射后 12 h的放射性摄取分别为(6.2±2.5)%ID/g 和(10.2±3.4)%ID/g。从 PET 图像来看,89Zr-Mb 和89Zr-Cys-Db 表现出比huJ591更快的血液清除率,而两者的肿瘤/肌肉比在所有时间点均显示出与huJ591相当的值。IAB2M 是一种分子量为80 kDa的抗体片段,与scFv相似,也来源于 J591 抗体的改造。临床前研究证明了以去铁敏B为螯合剂的89Zr-IAB2M具有更快的清除速率和快速的生物分布,可以在注射后几小时内获得高对比度图像。在小鼠中,89Zr-IAB2M[29]显示出与89Zr-huJ591 抗体相似的特性,但在注射后 24 h具有更快地血液清除和在PSMA阳性组织中的高吸收[30]。Ⅰ期临床试验表明,使用89Zr-Df-IAB2M 进行 PET 成像是可行的,且具有良好的耐受性,在晚期前列腺癌患者中显示出良好的生物分布,并同时可以针对骨和软组织病变进行显像[31]。
文献[32]报道了一组111In标记的抗体片段111In-JVZ007-c-myc-his 和111In-JVZ007-cys。该组采用了螯合剂二乙烯三胺五乙酸(diethylenetriaminepentaacetic acid, DTPA)的药物显示出了较好的肿瘤靶向性和快速的血液清除能力,可在注射后几小时内进行SPECT/CT成像。其中,111In-JVZ007-cys与大多数放射性标记的小分子 PSMA抑制剂不同,显示出非常低的肾脏摄取。
3.2 PSMA小分子抑制剂放射性药物
与单克隆抗体相比,小分子抑制剂的体积更小,更易通过细胞内吞作用进入细胞内部,从而提高药代动力学速率,适用于实体肿瘤;同时,小分子抑制剂的结构简单,合成方便,更利于临床使用[2]。
常用小分子抑制剂结构的设计一般是从PSMA位于胞外的谷氨酸结合位点出发,以含有谷氨酸的结构为主(图2)。其中最常见的是以Glu-urea-Glu(DUPA)和Glu-urea-Lys为主的基本结构。本文仅讨论含有Glu-urea-Glu和Glu-urea-Lys基团的小分子抑制剂。
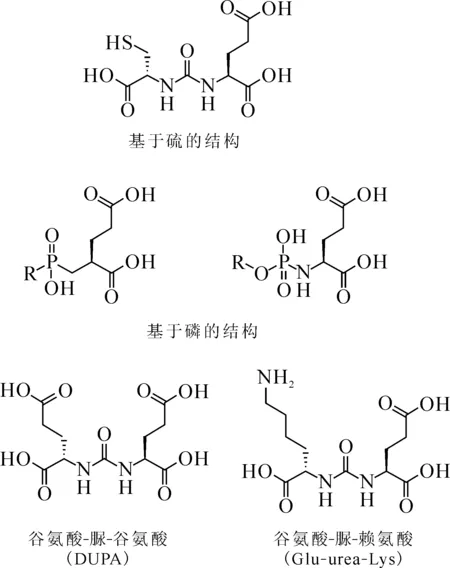
图2 常见的几种可特异结合PSMA的小分子抑制剂(片段)Fig.2 Some common small molecule inhibitors that can bind PSMA specifically
1)99Tcm标记的PSMA小分子抑制剂放射性药物
Hillier等[33]对MIP-1404、MIP-1405、MIP-1427及MIP-1428等化合物进行了详细研究(图3)。其中,MIP-1405及MIP-1427以连有羧基的咪唑基团(2,2′-(2,2′-(氮杂二基双(亚甲基))双(1H-咪唑-2,1-二基))二乙酸,CIM,2,2′-(2,2′-(azanediylbis(methylene))bis(1H-imidazole-2,1-diyl))diacetic acid)作为螯合剂,而MIP-1404及MIP-1428则在此基础上又对结构进行了进一步地修饰(2,2′,2″,2‴-((2,2′-(2,2′-(氮杂二基双(亚甲基))双(1H-咪唑-2,1-二基))双(乙酰基))双(氮杂三基))四乙酸,TIM,2,2′,2″,2‴-((2,2′-(2,2′-(azanediylbis(methylene))bis(1H-imidazole-2,1-diyl))bis(acetyl))bis(azanetriyl))tetraacetic acid),使其含有更多的配位基团,用以增强其螯合能力。MIP-1404及MIP-1427以Glu-urea-Glu为靶向基团,而MIP-1405及MIP-1428则以Glu-urea-Lys为靶向基团,用以比较Glu-urea-Glu和Glu-urea-Lys基团在诊断/治疗中的效果差异。研究结果表明,这四种化合物最终对人前列腺癌细胞(LNCaP)PSMA抗原的亲和力大小顺序如下:[99Tcm]Tc-MIP-1427>[99Tcm]Tc-MIP-1404>[99Tcm]Tc-MIP-1428>[99Tcm]Tc-MIP-1405。若考虑其在肾脏及其他非靶组织中的清除率,则[99Tcm]Tc-MIP-1404显示了最好的结果。目前,该药物已进入了临床Ⅱ期研究阶段。

图3 99Tcm标记的PSMA小分子抑制剂Fig.3 Small molecule inhibitors of PSMA for 99Tcm labeling
Kularatne等[34]在Glu-urea-Glu结构的基础上利用分子动力学软件GLIDE对多种配体与核素的螯合效果进行了预测,预测Dap-Asp-Cys结构可与99Tcm稳定配位,从而制备了含有DUPA-spacer-Dap-Asp-Cys结构的一系列小分子抑制剂。在后续的生物分布研究中,作者发现当DUPA-spacer-Dap-Asp-Cys中spacer部分长度为20 Å时,药物的亲和力及特异性最佳,而过长或过短均会在一定程度上影响显像效果。
Robu等[35]研究了[99Tcm]Tc-PSMA-I&S (imaging & surgery)在放射导向手术中的应用。与[111In]In-PSMA-I&T比较,[99Tcm]Tc-PSMA-I&S的制备更为方便,同时,在PSMA阳性肿瘤部位的吸收量保持不变的情况下,清除速率降低,因此更适合应用于放射导向手术。
目前,国内也开展了一些99Tcm标记PSMA小分子抑制剂的研究工作。99Tcm-PSMA是一种在谷氨酸-脲的基础上,引入6-肼基烟酸(HYNIC)的小分子抑制剂。复旦大学的许晓平等[36]进行了99Tcm-PSMA(99Tcm-HYNIC-Glu-Urea-A)的研究工作。小动物SPECT/CT显示:该药物可以清晰显示PSMA表达阳性(LNCaP)的前列腺癌,1、2、4 h时肿瘤/肌肉比分别为17.3、20.4和18.1;该药主要通过肾脏排泄。而PSMA表达阴性(PC-3)的前列腺癌几乎不摄取99Tcm-PSMA。相比之下,LNCaP肿瘤均能摄取18F-FDG和11C-胆碱,但其肿瘤/肌肉比分别仅为2.1和2.6。
该团队还对99Tcm-PSMA进行了临床研究。初步临床研究表明,99Tcm-PSMA SPECT/CT对前列腺癌原发和转移病灶的探测有较高临床应用价值,且特异性和灵敏度高。在该项研究中,22例复发或转移的前列腺癌患者的99Tcm-PSMA SPECT/CT结果显示:16例患者中至少探测到1处病灶,15例患者在全身平面显像时即可发现淋巴结和骨转移病灶[37]。
进一步的研究表明,99Tcm-MDP(MDP:亚甲基二膦酸盐)发现的骨转移病灶全部被99Tcm-PSMA证实,部分病例99Tcm-PSMA发现了更多的骨转移病灶,且能剔除99Tcm-MDP假阳性病灶[38]。
2)68Ga标记的PSMA小分子抑制剂放射性药物
68Ga是一种短半衰期的放射性核素,其半衰期为68 min。在衰变过程中,68Ga发射出正电子,衰变为68Zn(稳定核素)。由于其母体核素为68Ge,半衰期为270 d,因此68Ga可通过商业化的68Ge/68Ga发生器获得。Ga为第四周期第三主族元素,其电子构型为[Ar]3d104s24p1,常见氧化态为+3价。Ga离子属于硬路易斯酸,根据软硬酸碱理论,Ga离子倾向于与O、N等原子结合,形成稳定的配合物。常见的68Ga标记的PSMA小分子抑制剂示于图4,主要有PSMA-11、THP-PSMA、PSMA-617和PSMA-I&T等。相比于PSMA-11和THP-PSMA,由于分子结构和配位环境的差异,PSMA-617和PSMA-I&T除了可用于68Ga标记以外,也可用于177Lu等金属治疗核素的标记。Eder等[39]于2012年设计合成了PSMA-11。该分子中含有的羟基、羧基及胺基可以与Ga3+配位。生物分布研究表明,[68Ga]Ga-PSMA-11能够以高对比度有效诊断转移性前列腺癌组织。从此以后,[68Ga]Ga-PSMA-11的研究日益受到了关注[40-49]。Schafer等[50]设计合成了PSMA-11的二聚体化合物。该化合物在PSMA-11结构的基础上引入了第二个Glu-urea-Lys基团,表现出更强的PSMA亲和力,与[68Ga]Ga-PSMA-11相比,该二聚体在肿瘤内也具有更长的保留时间和更高的肿瘤/本底比。
相关临床研究结果[51-53]显示,[68Ga]Ga-PSMA-11适用于诊断早期及复发性前列腺癌,其适应性与患者年龄等因素无明显相关性。相应的肿瘤检出率与PSA水平呈明显正相关。特别是与[18F]-氟乙基胆碱([18F]-fluoroethylcholine,[18F]-FECH)[54]相比,当[18F]-FECH无法检出病灶时,[68Ga]Ga-PSMA-11可以检出在膀胱组织附近的复发病灶。2020年12月1日,美国FDA批准了[68Ga]Ga-PSMA-11的上市。该药物用于前列腺癌的诊断,适用于疑似前列腺癌转移、并通过手术或放射治疗可能治愈的患者。
PSMA-617于2015年由文献[55]报道。该化合物是专门为了实现诊断和治疗一体化而设计的。该化合物中不但含有能与PSMA结合的单元,还含有能与Ga3+、Lu3+配位的DOTA(DOTA:N-(4,7,10-三羧甲基-1,4,7,10-四氮杂环十二烷基)乙酰基)螯合单元。[68Ga]Ga-PSMA-617显示出很高的肿瘤/本底比,同时也显示了在肿瘤和肾脏组织中的选择性吸收。作者还研究了PSMA-617与Lu3+配位而用于放射性治疗的效果。研究表明,[177Lu]Lu-PSMA-617在肾脏中的代谢速率及药代动力学速率较高,可以及时从体内非肿瘤组织排出,因此适用于放射性治疗。文献[56]于2014年报道了DOTAGA-ffk(Sub-KuE)(DOTAGA:1,4,7,10-四氮杂环十二烷,1-(戊二酸)-4,7,10-三乙酸)的合成。作者在前期工作的基础上,为了解决代谢稳定性不足等问题,将之前的化合物DOTA-FFK(Sub-KuE)在结构上进行修饰:(1)将DOTA替换为DOTAGA,以提高其药代动力学的速率;(2)将L-氨基酸替换为D-氨基酸,以增强其代谢稳定性。最终得到了新化合物DOTAGA-ffk(Sub-KuE)。68Ga和177Lu标记的DOTAGA-ffk(Sub-KuE)不仅解决了代谢稳定性和药代动力学的问题,同时也显示出了比含有DOTA-ffk(Sub-KuE)结构的药物更强的PSMA亲和力和特异结合。

图4 68Ga标记的PSMA小分子抑制剂Fig.4 Small molecule inhibitors of PSMA for 68Ga labeling
随后,Weineisen等[57]于2015年又在DOTAGA-ffk(Sub-KuE)的基础上进一步修饰,得到DOTAGA-(l-y)fk(Sub-KuE),即PSMA-I&T。[68Ga]Ga-PSMA-I&T和[177Lu]Lu-PSMA-I&T的相关研究结果表明,其靶向性好、体内代谢速率快,同时,在骨、淋巴结及肝脏转移的诊断中,表现出了很高的肿瘤/本底比,可以用于转移性及去势抵抗性前列腺癌的PET显像诊断和放射性治疗。DOTA与68Ga的标记一般需要在加热、酸性pH条件下才能进行。这给药物制备及使用带来了不便,基于此,Young等[58]设计合成了新型的PSMA小分子抑制剂THP-PSMA。THP-PSMA与68Ga3+在室温、中性pH条件下,5 min即可完成标记反应,实现了药物的快速便捷制备。该药物现已进入临床Ⅱ期研究阶段。现有数据表明,[68Ga]Ga-THP-PSMA对肿瘤组织的特异性好,可在血液中快速清除,肿瘤吸收、生物分布以及药代动力学性质均可与[68Ga]Ga-PSMA-11相媲美。
3)18F标记的PSMA小分子抑制剂放射性药物
在用于PET药物的核素中,由加速器生产的18F是使用最广泛的正电子核素。18F的半衰期较长(约为110 min),便于通过具有加速器的核医药中心制备各种18F标记的药物并配送到各医疗机构,因此,18F标记的放射性药物一直受到研究人员的广泛关注。
2008年文献[59]报道了第一种18F标记的靶向于PSMA的放射性小分子抑制剂N-[N-[(S)-1,3-二羧丙基]氨基甲酰基]-4-[18F] 氟苄基-L-半胱氨酸([18F]-DCFBC)(图5)。生物分布及小动物PET研究结果表明,[18F]-DCFBC在给药1 h后,在肿瘤部位有较高的摄取率((8.16±2.55)%ID/g)。临床实验研究(5名患者)结果表明,其对转移性(骨转移及软组织转移)前列腺癌具有一定的诊断能力[60]。目前最常见的两种18F标记的PSMA显像诊断药物是[18F]-DCFPyL和[18F]-PSMA-1007。Chen[61]和Szabo等[62]于2011年合成了[18F]-DCFPyL。[18F]-DCFPyL是在[18F]-DCFBC的基础上,为了改善药代动力学性质而对结构进行修饰的产物。该化合物中引入了Glu-urea-Lys基团,并且以氟代吡啶基团替换了原有的氟代苯基,使化合物结构产生了明显变化,从而对药代动力学性质产生了较大影响,因此,在PSMA阳性肿瘤细胞中具有较高的摄取,同时在非肿瘤组织中的清除速率也较快。因该药物具有高灵敏度及特异性,有望成为针对转移性前列腺癌的PET显像药物[63-69]。2021年5月27日,美国FDA批准了Lantheus公司[18F]-DCFPyL的新药上市许可。

图5 18F标记的PSMA小分子抑制剂Fig.5 Small molecule inhibitors of PSMA for 18F labeling
Cardinale等[70]于2016年设计合成了[18F]-PSMA-1007。相比于[18F]-DCFPyL,[18F]-PSMA-1007也表现出了出色的选择性和特异性,尤其对于生化复发的前列腺癌及PSA值小于0.5 ng/mL的病例同样保持着较高的检出率[71-72],另外,膀胱摄取很低,不影响尿路及盆腔转移灶的诊断。此外,Chen等[73]还利用点击化学合成了[18F]-YC-88。该化合物同样是基于Glu-urea-Lys结构而合成的。[18F]-YC-88在动物实验中表现出了较快的非肿瘤组织清除速率,值得进一步深入研究。
AlF能与一些金属螯合剂形成稳定的配合物,基于此,人们进行了利用18F-AlF配合物标记多肽和PSMA配体的相关研究。该法具有标记条件温和、省时等优点。D’Souza等[74]研究了NODA-MPAA(NODA:1,4,7-三氮杂环壬烷-1,4-二乙酯;MPAA:甲基苯乙酸)的18F-AlF配合物标记。NODA-MPAA可以与 AlF3反应生成有机氟铝酸配合物。标记时间约为15 min,标记率可达49.6%,需高效液相色谱(HPLC)分离纯化。该配合物在 37 ℃、pH=7.4的磷酸盐缓冲溶液(PBS)中孵育 24 h没有显示脱金属的迹象,证明了其稳定性。
文献[75]报道了通过Al18F 配合物成功合成18F-PSMA-11的案例。10 min即可完成标记,经HPLC纯化后,放化纯可达97%以上。在 37 ℃下孵育 2 h后,示踪剂在小鼠和人血浆中稳定。PSMA 阳性相对于 PSMA 阴性异种移植物的摄取明显更高,证实了该示踪剂对PSMA 的特异性。通过对非荷瘤小鼠的 microPET 成像,18F-PSMA-11 的生物分布证明了标记物的快速肾脏清除,而骨摄取至少比肾脏摄取低一个数量级。
Al-Momani等[76]也对18F-PSMA-11进行了细致的研究。[Al18F]PSMA-11 可以在温和条件下在 60 min内于水溶液中制备,并且在人血清中和1%(体积分数)的EtOH/盐水中显示出较高的稳定性。其放射化学产率和放化纯分别为84%±6%和98%以上。此外,与[68Ga]PSMA-11、[68Ga]PSMA-I&T和[68Ga]NOTA-Bn-PSMA相比,[Al18F]PSMA-11 在表达PMSA 的 LNCap 前列腺细胞中表现出更高的摄取和保留。
Lütje等[77]对18F-PSMA-11进行了深入的研究。在体外,18F 和68Ga 标记的标记物在 LS174T-PSMA 细胞中显示出快速内化。在注射后 2 h观察到最高的肿瘤摄取,18F-AlF-PSMA-11 和68Ga-PSMA-11的放射性摄取分别为(10.8±2.3)%ID/g和(7.9±1.3)%ID/g。实验表明,18F-AlF-PSMA-11-PET/CT可以用于观察表达 PSMA 的异种移植物。
Liu等[78]研究了Al18F标记的Al18F-PSMA-BCH。该药物可在 30 min内制备,放化产率约为32%。Al18F-PSMA-BCH与 PSMA 结合的亲合力常数Kd=(2.90±0.83 ) nmol/L。在microPET成像中,生物分布数据显示,注射1 h后,该药物在22Rv1 和 PC-3 肿瘤内的分布数据分别为 (7.87±2.37)、(0.54±0.22)%ID/g。这说明该药物可以区分 22Rv1 肿瘤和 PC-3 肿瘤,亲和力强、选择性好。在临床研究中,11名患者中检测到了37个肿瘤病灶,其中27个病灶的最大标准摄取值(SUVmax)在注射后1~2 h增加。高危前列腺癌患者原发灶的SUVmax高于中危前列腺癌患者。
文献[79]报道了Al18F标记的双 PSMA 配体(18F-Bi-PSMA)的合成和临床前评估。18F-Bi-PSMA 由改进的 ALLINONE 模块制备。该标记过程可在30 min内完成,放化产率约为43%。体外评估表明18F-Bi-PSMA 在表达 PSMA 的细胞中具有强亲和力、高特异性和快速内化的能力:总内化效率为(37.8±2.2)%,NOTA-Bi-PSMA的IC50值(IC5022Rv1=(4.1±0.4) nmol/L,n=3)与PSMA-11的值(IC5022Rv1=(5.2±0.9) nmol/L,n=3)相当。生物分布研究显示,22Rv1 荷瘤小鼠的肿瘤特异性摄取率为 (20.5±3.5)%ID/g。此外,与68Ga-PSMA-11和18F-PSMA-1007相比,18F-Bi-PSMA 表现出更好的药代动力学和更高的肿瘤摄取,以及更好的肿瘤与正常组织的对比度,成像质量较高。
4 展 望
本文评述了PSMA放射性诊断药物的研究现状和进展。PSMA放射性药物在近些年发展迅速,受到了科研机构及制药公司的广泛关注。至今,已有两款PET显像诊断药物被美国FDA批准,即68Ga标记的[68Ga]Ga-PSMA-11和18F标记的[18F]-DCFPyL。由于前列腺癌的显像诊断具有较大的市场空间,因此预计基于PSMA放射性诊断药物的研发仍将持续并可能在以下几个方面展开:
(1) 由于18F标记化学的不断进步及18F药物配送的商业网络已在我国初步形成并继续扩大,因此,18F标记PSMA靶向诊断药物的研发可能是主流之一;
(2)68Ga已成为普及性越来越高的正电子核素,且有[68Ga]Ga-PSMA-11问世,但是能够进行即时标记的PSMA-11药盒还没有获准上市,因此,预期PSMA-11药盒及68Ga标记条件更温和的三羟基吡啶酮(THP)等药盒的研究将深入并最终可能获准上市;
(3) 免疫PET(ImmunoPET)的研究和应用正日益增多,因此,适合于免疫PET、半衰期更长的89Zr(T1/2=78.4 h)和64Cu(T1/2=12.8 h)标记的PSMA诊断药物的研究将仍然是热点;
(4) 基于99Tcm的可得性、经济性和SPECT技术的不断改善和提高,特别是在发展中国家,99Tcm标记的PSMA SPECT诊断药物将有较大的发展余地。
可以预期,在不久的将来,越来越多的PSMA放射性诊断和治疗药物将被研发并进入市场,从而提高前列腺癌早期准确诊断的水平并改善患者的生存率,造福于人类。

