血小板与中性粒细胞相互作用在血管病变中的研究进展*
冶 怡,格日力,乌仁塔娜
(青海大学高原医学研究中心,高原医学教育部重点实验室,青海省高原医学应用基础重点实验室,青海-犹他高原医学联合重点实验室,青海西宁 810001)
血小板是止、凝血与血栓形成过程中的核心成分。而中性粒细胞是人体含量最多的天然免疫细胞,是固有免疫防御的第一道防线。二者胞膜或胞内的蛋白质和细胞因子极为丰富,通过受体介导的激活和释放易于对各种刺激作出快速反应。近年来,在多种血管病变中观察到血小板与中性粒细胞的同时激活,包括动脉粥样硬化,动、静脉免疫性血栓形成,以及肺动脉高压,二者共同作用驱动局部及全身的炎症及免疫反应,继而影响心、脑血管事件的发生。本文就血小板与中性粒细胞通过配/受体的相互激活在上述疾病发生与发展中的作用进行综述。
1 血小板与中性粒细胞相互作用方式
1.1 配/受体介导的直接作用 血小板活化依赖性溶酶体膜蛋白CD62P,即P-选择素(P-selectin),通常储存于血小板α 颗粒中,激活后则迅速表达于细胞表面,活化后血小板的P-选择素可与中性粒细胞表达的P-选择素糖蛋白配体1(P-selectin glycoprotein ligand-1,PSGL-1)结合,介导血小板-中性粒细胞相互作用,触发中性粒细胞内炎症信号级联反应,激活中性粒细胞中的MAPK/ERK1/2 信号通路,产生活性氧(reactive oxygen species,ROS),促进NF-κB 活化及中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)释放,驱动炎症反应及血栓形成[1]。
此外,P-选择素诱导中性粒细胞活化后促进中性粒细胞弹性蛋白酶(neutrophil elastase,NE)和组织蛋白酶G 的分泌,同时二者又通过水解PSGL-1 蛋白末端片段下调中性粒细胞对血小板的黏附,从而形成负反馈调节,有效地平衡血小板与中性粒细胞间的相互作用[2]。
在血栓形成及炎症状态下,中性粒细胞表面的整合素CD11b/CD18[又称巨噬细胞抗原1(macrophage antigen-1,Mac-1)]与血小板膜糖蛋白(glycoprotein,GP)Ibα 结合后以依赖于Akt 磷酸化的途径驱动二者相互作用[3]。此外,Mac-1 不仅能够与整合素αIIbβ3(GPIIb/IIIa)复合体结合,还通过结合血小板表面的第3 种受体——连接黏附分子3(junctional adhesion molecule-3,JAM-3)促进中性粒细胞聚集、弹性蛋白酶释放、内皮损伤、纤维蛋白沉积和血栓形成[4]。
活化的血小板通过与PSGL-1及Mac-1结合介导中性粒细胞向损伤部位的迁移[5]。此外,CD40 与CD40 配体(CD40 ligand,CD40L/CD154)[6],淋巴细胞功能相关抗原1(lymphocyte function-associated antigen-1,LFA-1)与细胞间黏附分子2(intercellular adhesion molecule-2,ICAM-2)[7],以及髓样细胞触发受体1(triggering receptor expressed on myeloid cells-1,TREM-1)与TREM-1L 也都能够以配/受体直接结合的方式诱导下游级联信号的相互激活,促使血小板与中性粒细胞相互作用[8-9]。例如,CD40/CD40L结合促进血小板活化并通过上调Mac-1 增强中性粒细胞的募集;LFA-1/ICAM-2 结合促进中性粒细胞与血小板的黏附;TREM-1/TREM1L 结合促进中性粒细胞ROS的产生、脱颗粒和NETs的释放。
1.2 配/受体介导的间接作用 虽然不直接介导血小板-中性粒细胞相互作用,但许多配/受体与血小板活化有关,通过活化血小板,脱颗粒释放相应物质进而促进其与中性粒细胞的相互激活。这些配/受体包括Toll 样受体(Toll-like receptor,TLR)、补体受体C3aR、高迁移率族盒蛋白1(high mobility group box protein 1,HMGB1)、嘌呤能受体P2Y12 受体和趋化因子受体CX3CR1。
TLR 是一类能够对病原体相关分子模式进行识别、结合,参与固有免疫防御的模式受体。Ren 等[10]首次通过研究血小板对循环肿瘤细胞的影响,明确血小板膜和胞浆表达的TLR4 能够以ERK5-GPIIb/IIIa 整合素依赖性方式促进血小板与中性粒细胞的黏附,并诱导NETs 形成,从而促进肿瘤细胞的远处转移。
Sauter等[11]的研究表明,来源于血小板的补体受体C3aR 加剧了心肌梗死与缺血性脑卒中患者免疫性血栓形成和中性细胞介导的组织损伤。储存在血小板α 颗粒中的趋化因子,如CCL5(C-C motif chemokine 5)/RANTES(regulated on activation,normal T cell expressed and secreted),引起急性肺损伤小鼠模型中的中性粒细胞渗出,从而导致进一步的组织损伤[12]。然而,阻断心肌缺血/再灌注(ischemia/reperfusion,I/R)模型中的CCL5,导致中性粒细胞募集与NETs 形成减少,从而显著降低了I/R 后心肌梗死面积并保留了心功能[13]。
活化的血小板分泌的损伤相关分子模式——HMGB1 通过激活中性粒细胞膜上的晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE),增强中性粒细胞的募集,引起免疫性血栓及NETs 形成[14],而活化的中性粒细胞又能增强HMGB1表达,诱导血小板聚集。同样,LL-37作为中性粒细胞衍生的cathelicidin 家族抗菌肽,具有直接激活血小板并促动脉血栓形成的作用[15]。Rayes 等[16]的研究表明,NE 增强组织蛋白酶G 诱导的血小板活化。
P2Y12 受体拮抗剂[17]的应用能够抑制中性粒细胞介导的血小板聚集和P-选择素表达,减轻血小板与中性粒细胞的黏附和血小板依赖性ROS 的产生。因此,通过阻断血小板P2Y12 受体可减少血小板与中性粒细胞的相互作用并减轻脓毒症中的血栓炎症。
趋化因子fractalkine 通过血小板表面表达的特异性受体CX3CR1 诱导血小板活化与黏附,而fractalkine/CX3CR1 轴的激活触发中性粒细胞黏附到活化的内皮,参与血管周围炎症乃至肺动脉重塑的病理过程[18]。
此外,在细胞外囊泡(extracellular vesicles,EVs)水平上也观察到血小板与中性粒细胞的相互影响。血小板衍生的EVs 在脓毒症[19]和登革热病毒感染[20]中促进NETs 形成和促炎因子释放,并且能够将调节性RNA转运到中性粒细胞,从而介导免疫识别[21]。
总之,血小板和中性粒细胞通过多种配/受体结合,趋化因子参与的信息传递,甚至EVs 介导的效应相互作用,促进局部和全身水平的相互激活(图1)。
2 血小板与中性粒细胞在血管病变中的相互作用
2.1 血小板与中性粒细胞在动脉粥样硬化(atherosclerosis,AS)中的相互作用 AS是指中等动脉或大动脉的动脉壁形成脂质斑片状沉积物,导致血流量减少甚至阻塞血液流出的一种疾病,是心肌梗死、缺血性心脏病和缺血性卒中发生的主要危险因素。
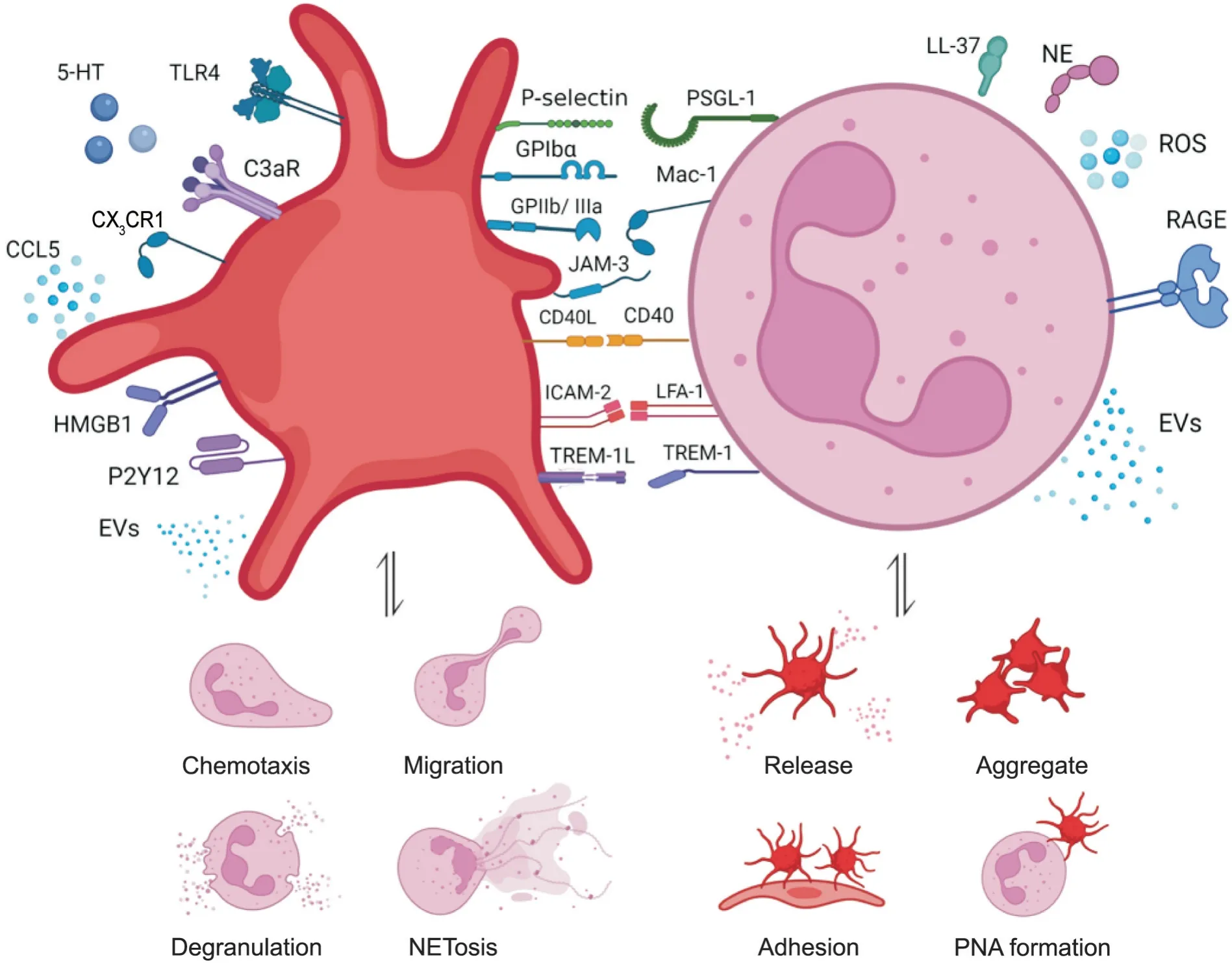
Figure 1.Mode of platelet-neutrophil interaction.PSGL-1:P-selectin glycoprotein ligand-1;GPIbα:glycoprotein Ibα;Mac-1:macrophage antigen-1;GPIIb/IIIa:glycoprotein IIb/IIIa;JAM-3:junctional adhesion molecules-3;CD40L:CD40 ligand;ICAM-2:intercellular adhesion molecule-2;LFA-1:lymphocyte function-associated antigen-1;TREM-1:triggering receptor expressed on myeloid cells-1;TREM-1L:TREM-1 ligand;5-HT:5-hydroxytryptamine;TLR4:Toll-like receptor 4;CCL5:chemokine C-C motif ligand 5;MPO:myeloperoxidase;NE:neutrophil elastase;ROS:reactive oxygen species;HMGB1:high mobility group box protein 1;RAGE:receptor for advanced glycation end products;EVs:extracellular vesicles;PNA:platelet-neutrophil aggregates;PNA:platelet-neutrophil aggregates;NETosis:the process of neutrophil extracellular trap formation.图1 血小板与中性粒细胞的相互作用
Bakogiannis 首次提出血小板、白细胞与内皮细胞三者相互作用导致AS 病变[22]和血栓形成[23]。趋化因子fractalkine 通过血小板表面表达的功能性fractalkine 受体(CX3CR1)诱导血小板活化和黏附,而fractalkine/CX3CR1 轴的激活触发白细胞黏附到活化的内皮,启动AS 病变形成[24]。随后,观察到嗜酸性粒细胞可通过与血小板的相互作用促进AS 斑块的形成和血栓形成,导致两者相互激活[25]。在急、慢性冠状动脉综合征及颈动脉狭窄的患者中观察到中性粒细胞和血小板增多以及血小板-中性粒细胞聚集体(platelet-neutrophil aggregates,PNA)增加[26]。目前已明确活动性AS 中P-选择素与PSGL-1 相互作用促进PNA 的形成,并且在心血管疾病患者中升高的P-选择素与主要不良心血管事件的风险呈正相关[27]。Gerdes 等[28]研究强调血小板通过CD40 刺激内皮细胞与中性粒细胞的募集与活化,从而加剧AS,而CD40缺乏与AS病变减少有关。
此外,中性粒细胞对高斑块负荷的AS 部位的黏附及募集与斑块不稳定、侵蚀和破裂有关;募集到斑块中的活化中性粒细胞可通过NETs 形成加剧AS 形成与进展,并促进促炎性巨噬细胞表型,增加动脉内膜损伤程度[29]。
因 此,P-选择素/PSGL-1 和CD40/CD40L 促 进PNA 的形成,将其募集到AS 斑块中,在AS 炎症反应早期,诱导内皮功能障碍、促进泡沫细胞形成和炎症反应,加速AS 斑块形成、发展;在AS 炎症反应后期,PNA 参与斑块内血管损伤、坏死核形成和纤维帽变薄,促进不稳定斑块破裂,并激活血小板,继发血栓形成(图2A)。
2.2 血小板与中性粒细胞在免疫性血栓形成中的相互作用 血栓性疾病是一类威胁人类健康的重大疾病,炎症反应是促进病理性血栓形成的重要因素。免疫性血栓形成的主要驱动因素是血小板和固有免疫细胞(主要是中性粒细胞、单核细胞与巨噬细胞)的相互作用,协同凝血系统与补体系统,共同构建了一个连接炎症和血栓形成的复杂过程。动脉免疫性血栓形成是AS 进展、斑块糜烂及最终破裂的结果,主要由聚集呈珊瑚状的血小板小梁构成,其表面有许多中性粒细胞黏附,形成白细胞边层,这些高度活化的血小板以Mac-1/GPIbα[30]和P-选择素/PSGL-1[31]结合的方式募集白细胞,促进纤维蛋白(原)沉积并增强血栓稳定性。Darbousset 等[32]利用血栓形成模型证实了中性粒细胞通过活化后表达的组织因子参与血小板诱导的动脉免疫性血栓形成。同样地,Chrysanthopoulou等[33]在原发性高血压患者及小鼠模型中证实中性粒细胞通过NETs 形成,激活血小板启动凝血级联反应,导致血栓形成。血小板与中性粒细胞诱导形成的血栓加重心肌肥厚并恶化心力衰竭[34]。
此外,活化的血小板能大量释放内源性HMGB1,而HMGB1 蛋白通过TLR4-MyD88 轴直接引发血小板的聚集和活化,并通过中性粒细胞上的RAGE 促进NETs 形成,从而导致血小活化和血栓形成的级联反应[35]。
Dhanesha 等[36]通过建立骨髓细胞特异性的整合素α9 缺陷型小鼠α9fl/flLysMCre+,证实了中性粒细胞高表达的整合素α9β1 刺激血小板活化,而活化的血小板进而促进NETs 的释放及动脉血栓形成。然而,通过药物或基因敲除肽酰精氨酸脱亚氨酶4(peptidylarginine deiminase 4,PAD4)来阻断血小板诱导的NETs形成,会减少动脉血栓形成[33]。
炎症是导致免疫性静脉血栓形成的主要因素,静脉血栓形成过程中,内皮炎症反应促进血小板以及单核细胞和中性粒细胞的迅速募集,形成PNA 和血小板-单核细胞聚集体(platelet-monocyte aggregates,PMA)[37]。同样地,血小板与中性粒细胞诱导的静脉血栓形成的潜在分子机制也涉及P-选择素/PSGL-1相互作用,HMGB1诱导的血小板和中性粒细胞分别通过TLR4 和RAGE 激活,以及通过NETs 释放[38]形成的免疫性血栓[39];并且P-选择素基因敲除、HMGB1 受体阻断和抑制NETs 生成显著减少了深静脉血栓形成[40]。
因此,血小板与中性粒细胞中Mac-1/GPIbα、P-选择素/PSGL-1、HMGB1/RAGE 和TLR4 的结合及PNA 与NETs 的形成等是血栓性疾病发病过程中的重要机制(图2B),抑制上述作用机制,如阻断NETs生成,能够显著减少血栓形成,防止疾病进展,为免疫性血栓形成,乃至心、脑血管事件的预防与治疗提供新靶点。
2.3 血小板与中性粒细胞在肺动脉高压(pulmonary hypertension,PH)中的相互作用 PH 是一种预后较差的恶性肺血管疾病,以肺血管阻力进行性升高和右心功能进行性衰竭为主要特征,其基本病理特征是肺动脉内皮受损、血管重构和原位血栓形成。越来越多的证据提示炎症反应在肺动脉高压的发生发展过程中发挥重要作用。
中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)是反映体内免疫平衡失调和全身炎症性反应的潜在生物标志物。近年来研究表明其与心血管系统疾病,自身免疫性疾病、恶性肿瘤及新型冠状病毒肺炎[41]等有关。在慢性血栓栓塞性肺动脉高压[42]和特发性动脉型肺动脉高压(idiopathic pulmonary arterial hypertension,IPAH)中,NLR 与肺血管阻力增加及临床预后显著相关[43]。此外,血小板/淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)作为新近的预测指标,与炎症及血栓前状态显著性相关。NLR 和PLR 在伴有PH 的紫绀型先天性心脏病[44]及结节病[45]中显著升高并与肺动脉收缩压升高的严重程度及术后不良结局相关。PH 患者体内血小板释放的LIGHT 和sCD40L 可以激活中性粒细胞,并且生成大量炎症介质(如NE),可诱导内皮损伤、平滑肌细胞增殖和肺动脉血栓形成[46]。
HMGB1/HMGB1 受 体(TLR4[47]和RAGE[48])在IPAH 和低氧诱导的PH 中显著升高,诱导肺动脉平滑肌细胞和肺动脉内皮细胞的增殖,促进肺血管重塑,提示PH 发病机制中潜在的血小板与中性粒细胞的相互作用。
趋化因子fractalkine 与血小板特异性受体CX3CR1 结合后,刺激中性粒细胞活化,引起血管周围炎症,导致肺小动脉异常收缩、血管重塑及肺动脉压力增高[18]。并且,中性粒细胞趋化因子CXCL4 和CCL5 在血小板特异性降低的PH 小鼠和中显著降低。
此外,前列环素类似物(如依前列醇、曲前列素和伊洛前列素)在PH 中诱导血管舒张,并抑制血小板功能。Gąsecka 等[49]通过前瞻性研究观察到PH 患者在规律服用前列环素类似物后血小板及白细胞来源的EVs 显著减少,PNA 明显降低,血栓延迟形成且血栓面积显著降低[50]。
尽管对PH 疾病进展中血小板与中性粒细胞相互作用的研究开展较少,目前证据强调二者介导的炎症反应和血栓前状态是PH 疾病进展的重要一环(图2C)。
3 总结与展望
综上所述,活化后的血小板内可溶性蛋白及颗粒内容物重新分布至膜上,使配/受体活性或表达增加,为细胞间结合奠定物质结构基础;而活化的中性粒细胞也可表达大量细胞表面受体及配体,以驱动两者间的相互作用,参与多种疾病的发生发展。
然而,除了通过细胞膜表面多种配/受体的直接作用相结合而相互激活外,血小板与中性粒细胞还能够通过趋化因子、黏附分子及NETs 形成等参与的信息传递,甚至细胞外囊泡介导的效应互相作用,促进局部和全身水平的相互激活,从而介导复杂的生理与病理反应,影响AS、免疫性血栓形成与PH 的发生发展。
由于血小板与中性粒细胞相互作用在多种血管病变中发挥重要作用,未来冠心病、脑卒中、血栓性疾病及肺动脉高压的药物治疗或可以在抗栓、抗凝药物基础上加用P-选择素单克隆抗体crizanlizumab、重组DNase酶Pulmozyme 等二者相互作用的拮抗剂,以缓解急、慢性血栓事件,改善患者生活质量。
明确血小板与中性粒细胞相互作用是否存在其他信号通路,完善其分子标记和活化产物改变的意义,为临床预防及治疗心、脑血管疾病及血栓性疾病提供新的靶点与方向,为尽早判断疾病转归以及预后提供参考资料。

