组织驻留记忆T细胞在抗结核分枝杆菌感染中的研究进展*
耿 雪,宫照乾,于嘉霖,邓光存,吴晓玲
(宁夏大学西部特色生物资源保护与利用教育部重点实验室,宁夏大学生命科学学院,宁夏银川 750021)
结核病(tuberculosis,TB)是由结核分枝杆菌(Mycobacterium tuberculosis,MTB)感染引起的一种严重威胁人畜健康的传染性疾病,目前仍然是全球十大致死率疾病之一[1]。据WHO 报告指出:由于这两年受到COVID-19大流行的影响,TB患者的数量大幅度下降,但由于多重耐药、共患病等因素的上升以及对TB 诊断、预防和服务支出的下降,导致TB 的预防和治疗现状变得更加棘手[2-3]。据不完全统计,全球目前有近四分之一的MTB 潜伏感染者,这部分感染者免疫力下降后,就可能发展为活动性TB 患者。由此可见,结核病发生发展与机体免疫应答功能密切相关。
动物机体产生免疫应答的物质基础主要包括免疫器官和免疫细胞,其中免疫活性细胞包括T 细胞和B细胞,而T细胞在机体抗病原菌感染过程中发挥了重要作用。关于T 细胞亚群划分的原则和命名尚没有统一,根据T 细胞受体双肽链构成的不同,T 细胞可分为αβT 细胞和γδT 细胞;根据表面标志和分化抗原的不同,αβT 细胞可分为CD4+T 细胞和CD8+T细胞;根据所处的活化状态不同,T细胞分为初始T细胞、效应T 细胞和记忆T 细胞[4]。目前在TB 的预防和治疗过程中,T 细胞介导的免疫应答是研究重点,其中以记忆T 细胞为热点研究对象[5]。研究发现,组织驻留记忆T 细胞(tissue-resident memory T cells,TRM)可以高度定位病原体感染部位,在宿主抵御入侵病原体并产生免疫保护中发挥重要作用,除了可以增强机体的免疫监视功能外,更重要的是具备再次感染病原体时产生记忆应答的能力[6]。由于TRM作为TB 适应性免疫应答的一个重要组成部分,讨论如何更好地理解这种应答,为研究TB 在肺部感染的局部免疫反应可以成为解决TB 防治困难的一种新方法和抑制TB发病提供新的思路。
1 TRM简介
记忆性T 细胞可分为效应记忆T 细胞(effector memory T cells,TEM)和中枢记忆T细胞(center memory T cell,TCM)亚群,它们在血液、次级淋巴器官和非淋巴组织之间循环,近年来发现的TRM是记忆性T 细胞的第三个亚群,它不再经过循环而存在于组织中,这些组织被定位为抵御宿主感染的第一道防线[7]。据2001 年Hogan 等[8]的研究报道,李斯特菌和水疱性口炎病毒感染小鼠后,抗原特异性CD8+T 细胞可迁移至非淋巴结组织并长期存活,当再次受到相同抗原刺激时,该细胞会第一时间被激活并对抗感染,这类细胞被命名为TRM。越来越多的研究表明TRM对抵抗局部病原菌感染发挥了保护性免疫的作用[9]。除此之外,TRM在调控/抵御肿瘤、过敏和自身免疫性疾病作用显著。更加值得我们关注的是,在MTB 侵入组织时,TRM能够直接快速地发挥防御反应并永久驻留在其感染部位,同时能够促进组织修复,维持组织免疫稳态。因此,开发有利于TRM的形成以及功能的免疫治疗方法不仅对控制MTB 的生长至关重要,而且对防止TB的发展也至关重要。
TRM功能的行使与其细胞表面标志物密切相关,表面标志物决定了TRM在免疫反应部位驻留的持久性[10]。其相关的标志物包括整合素(CD11a、VLA-4、CD49a 和CD103)、细胞表面标志物(PD-1、CD44、CD101 和CD69)和趋化因子受体(CXCR3 和CD73),见图1[11]。但值得一提的是,不是所有的TRM群都显示所有表面标志物,例如:CD49a、CD103、CD44 和CD69的某些组合能够共同定位到细胞上并将其维持在最初感染的部位。研究表明,CD103可以与上皮表面的E-cadherin 相互作用且已被证明介导T 淋巴细胞和上皮细胞之间的黏附,这表明CD103 对上皮组织内的驻留中起重要作用[12];CD49a能够与上皮细胞下致密层的IV 型胶原蛋白结合以建立组织驻留;CD44参与维持细胞形状和完整性,并能与透明质酸、纤维连接蛋白和其他细胞外基质蛋白等许多不同的组织成分相互作用[13];而CD69 能够拮抗S1P1,从而在本质上阻断了对S1P 梯度的任何反应[14]。其中CD103和CD69的表达可以作为TRM的一个识别标志。在早期研究报道中,在MTB 感染过后,TRM特有的基因表达的鞘氨醇-1-磷酸受体1很可能参与介导了TRM局部组织驻留和存活;此外,在肺实质细胞中观察到CD69 的高表达可能与肺组织的驻留有关[15]。然而,最近有报道称TRM可以驻留于MTB感染部位,当MTB再次入侵机体时可以抑制MTB 的扩散,从而使机体产生适应性免疫应答[16]。因此,TRM对控制人类肺TB至关重要,但迄今仍未确定TRM的独特表型标志物。

Figure 1.TRM surface-related markers and localization in lung tissues(as modified according to references[9-10]).图1 TRM表面相关的标志物及在肺组织内的定位(根据参考文献[9-10]修改)
2 TRM功能概述
TRM的种类和功能取决于其所在的组织。在泌尿生殖系统中,TRM在诱导病原菌感染所引起的保护性免疫中起着核心作用;在人的脑组织中,TRM受到关键免疫检查点分子的严格控制,进而对嗜神经病毒的再次激活提供了保护作用[17]。中枢神经系统在结构和功能上是独特的,神经病变病毒进入中枢神经系统进而引起危及生命的感染的能力说明了其需要免疫反应保护来对抗病原菌的感染[18]。但对呼吸系统中TRM的表型、功能和调节特征研究较少[15]。TRM主要包括CD8+TRM、CD4+TRM、Treg TRM及NKT TRM(图2),它们不仅在抗肿瘤、自身免疫性疾病的发生发展中起调控作用,而且CD8+TRM和CD4+TRM在宿主抗TB 的保护性免疫过程中发挥重要作用(表1)[19]。但是目前关于Treg TRM和NKT TRM在抗MTB 感染的作用和功能研究相对较少。

表1 不同TRM的功能(根据参考文献[19]改编)Table 1.Functions of different TRM(adapted from reference[19])

Figure 2.Types of TRM(modified according to reference[19]).图2 TRM的种类(根据参考文献[19]修改)
2.1 CD4+TRM在肺、生殖道、皮肤、小肠、脑等许多非淋巴组织中存在着大量的CD4+TRM[20]。在这些组织中,CD4+TRM主要表达CD11a 和CD69,同时CD103的表达收到T-bet的抑制。值得一提的是,关于CD4+TRM的分布情况,其中一部分CD4+TRM细胞随时间推移能永久驻留在组织中并保持数量稳定;当CD4+TRM细胞再次暴露于相同抗原时可促进快速免疫防御,并在识别和应对反复感染时可取代固有免疫;另一部分CD4+TRM仅能短暂驻留并与循环T 淋巴细胞发生交换。由于CD4+TRM主要通过输出淋巴管离开皮肤,因此多数CD4+TRM是循环细胞[10]。此外,研究报道,在TB 患者体内CD4+TRM的存在与MTB 负荷有关,且抗TB 治疗完成后机体中CD4+TRM数量明显减少[21],因此说明CD4+TRM可以作为活动性TB 的标志物。然而,关于CD4+TRM在MTB 感染过程中的表型、功能仍有许多问题有待探索。
2.2 CD8+TRMCD8+TRM是一种独特的记忆群体,最初在皮肤和肠道被识别,且在在肺、皮肤、肠道、中枢神经系统等非淋巴组织中长期驻留,当再次遭遇相同抗原时可快速增殖,发挥抗感染作用。CD8+TRM主要表达CD103 和CD69,绝大多数CD103 与ITGB7 结合并形成异二聚体,使组织驻留整合素αEβ7成为E-钙黏蛋白的配体。研究表明,缺乏CD4+TRM辅助的CD8+TRM不能上调CD69 和CD103 的表达,无法驻留在气道上皮内,不能形成CD8+TRM[22]。近期有实验研究表明:在小鼠中枢神经系统中发现了CD8+T细胞,它们通过介导局部细胞毒作用,抑制病毒感染[23]。
2.3 Treg TRM在皮肤、肺、肠道、肌肉和脂肪等非淋巴组织中也发现了Treg TRM,这些细胞不参与外周循环。但Treg TRM表达CD103 和CD69,因此在促进组织修复、维持组织免疫稳态和抗病毒免疫中发挥关键作用。此外另有研究表明,病原体感染后,Treg TRM在小鼠脑内大量募集,具有不同的免疫调节作用。一方面,Treg TRM在中枢系统中控制神经免疫应答方面起着关键作用;另一方面,Treg TRM在多种慢性感染中也能够抑制组织损伤[24]。
2.4 NKT TRMNKT TRM已被证实在肝、肺、骨髓和脂肪等组织中驻留。某些组织中NKT TRM具有独特的整合素[25],如淋巴细胞功能相关抗原1 和细胞间黏附分子1 是维持NKT TRM长期驻留的重要分子[26]。NKT TRM同样表达CD103,此外肝脏血管内NKT TRM细胞表达CXCR6。关于NKT TRM的研究中表明在CD1d 存在的情况下,NKT TRM识别糖脂抗原并在细菌感染中起作用[27]。
3 TRM在抗MTB感染中的作用
T细胞免疫应答对于控制TB的发展至关重要[28]。然而,越来越多的证据表明,TRM在控制MTB在内的许多病原体生长方面具有优势[29]。已有研究表明,在TB患者的肺组织中能够鉴定出CD4+TRM和CD8+TRM,它们具有产生并富集IL-17的功能,而IL-17的表达与TB 的严重程度存在潜在联系。利用TB 患者肺部肉芽肿模型发现外源添加IL-17 可以促进MTB 的增值[30]。Fan等[31]的研究结果表明,在患者感染后52周内CD4+TRM群数目保持不变,可能是由于卡介苗(Bacillus Calmette-Guérin,BCG)接种后在组织中持续存在,提供了持续的抗原刺激,从而维持了稳定的CD4+TRM群数目。此外,Turner等[32]发现,在气道疾病的小鼠模型中,停止接触过敏原后,只有CD4+TRM在肺中长期驻留,而CD8+TRM不能驻留在肺组织中。TRM不仅发挥直接作用,还能激活针对病原菌再次感染的固有免疫反应。已有研究表明,MTB能诱导小鼠肺泡灌洗液、鼻黏膜、气管和肺组织中INF-γ、TNF-α 和IL-2 的表达,以及MTB感染产生的TRM能够在组织中驻留很长时间,从而具有防止肺部再次感染MTB的能力[33]。
3.1 CD4+TRM通过II型主要组织相容性复合体(major histocompatibility complex class II,MHC-II)类 途径识别并清除MTB CD4+TRM是宿主抵抗MTB 的细胞免疫应答中的主要细胞。在MHC-II 基因缺失或CD4+TRM缺失的小鼠中,MTB 感染早期导致IFN-γ 水平严重减少,使MTB 呈持续进行性生长[34]。CD4+TRM应答程度还与TB 患者病变程度有关,病变严重或处于进展期的患者CD4+TRM在体外对MTB 蛋白抗原仅有低增殖应答反应,病变范围小或已控制病情的患者对纯蛋白衍生物(purified protein derivative,PPD)反应较强[35]。CD4+TRM的变化提示机体免疫反应能力差异,预示患者治疗转归的不同[36]。
Teijaro 等[37]证实,CD4+TRM在MHC-II 类分子的存在下识别来源于吞噬体的抗原肽,并促进具有抗MTB活性的IFN-γ和TNF-α分泌(图3A)。
与潜伏性感染的受试者相比,在活动性TB 患者中检测到能够同时产生IFN-γ、TNF-α、IL-17和IL-2的CD4+TRM,其中IFN-γ 和IL-2 双重分泌主导了抗MTB的免疫反应[38]。在抗MTB 治疗完成后CD4+TRM明显减少,说明CD4+TRM是活动性TB的标志物[39]。这些发现强调了CD4+TRM影响局部免疫反应结果的重要性。
3.2 CD8+TRM通过MHC-I类途径识别并清除MTB CD8+TRM能够识别来自细胞内环境的抗原并作为细菌负荷的传感器,优先识别严重感染MTB 的细胞。最新的研究表明,强毒MTB 可以从吞噬体逃逸到细胞质中,并有可能直接进入MHC-I类路径[40]。
CD8+TRM在感染防御病原菌入侵宿主中扮演着重要角色。它识别的细胞溶质抗原表达在MHC-I分子上,其分泌的细胞毒性分子如穿孔素、颗粒酶和颗粒溶素可以溶解宿主细胞或者直接杀死MTB(图3B)[32]。此外,当CD8+TRM介导巨噬细胞活化并抑制MTB 生长时,CD8+TRM可以通过FAS或TNF-γ家族相关的细胞死亡受体等分子诱导感染的靶细胞发生细胞凋亡,从而破坏MTB的生长环境,使抗原呈递细胞呈递MTB 起到免疫监视的作用(图3C)。在机体受强毒MTB 感染时,CD8+TRM在调节免疫过程发挥重要的细胞毒作用,同时在促使MTB 暴露及病灶清除等方面也发挥了重要作用。因此,同CD4+TRM相比CD8+TRM能更有效的识别并消灭MTB。
CD8+TRM受MTB 刺激后会释放IFN-γ、TNF-α、IL-2 等细胞因子来提供保护性免疫。从功能的角度来看,以小鼠模型进行利用CD8+TRM控制MTB 感染的研究中发现,IFN-γ 和穿孔素是诱导MTB 感染小鼠过程中免疫保护反应发生的必要因素[41]。此外,由于肺结核患者中CD8+TRM的表达高于肺外结核患者,因此,CD8+TRM的功能差异很可能取决于发生在不同部位的抗原刺激,且可能与细菌负荷相关[42]。综上所述,CD8+TRM的表达对于理解免疫系统如何控制TB的进展可能具有重要意义。
4 TRM与TB疫苗的研制
TB 每年造成的死亡人数超过任何单一病原菌[43]。BCG 是目前唯一获得许可的抗TB 疫苗,这种疫苗在儿童时期有一定的保护作用[44],其通过皮内注射的方式可以预防儿童播散性粟粒性TB 和脑膜型TB,但在成人时期预防效果不佳。因此亟需了解MTB 对宿主的免疫反应,以帮助开发新的疫苗[45]。由于TRM具有永久组织驻留特性和抗菌活性,因此TRM对TB疫苗的开发存在着巨大的潜力。
目前正在使用的疫苗,它的基本原理是模仿病原体诱导的适应性免疫,TRM与针对MTB 感染的保护性免疫反应有关,但在MTB感染后的作用尚不清楚,黏膜疫苗接种被认为是模拟自然感染,能提高感染部位的局部免疫力,全面分析肺气道和肺实质的局部免疫对于合理设计使用BCG的黏膜TB疫苗接种策略至关重要,通过黏膜接种来模拟自然感染途径可以产生TRM,来更好的保护TB。现已经证明了黏膜疫苗诱导的TRM能够在宿主抵抗肺TB中发挥关键作用[46]。
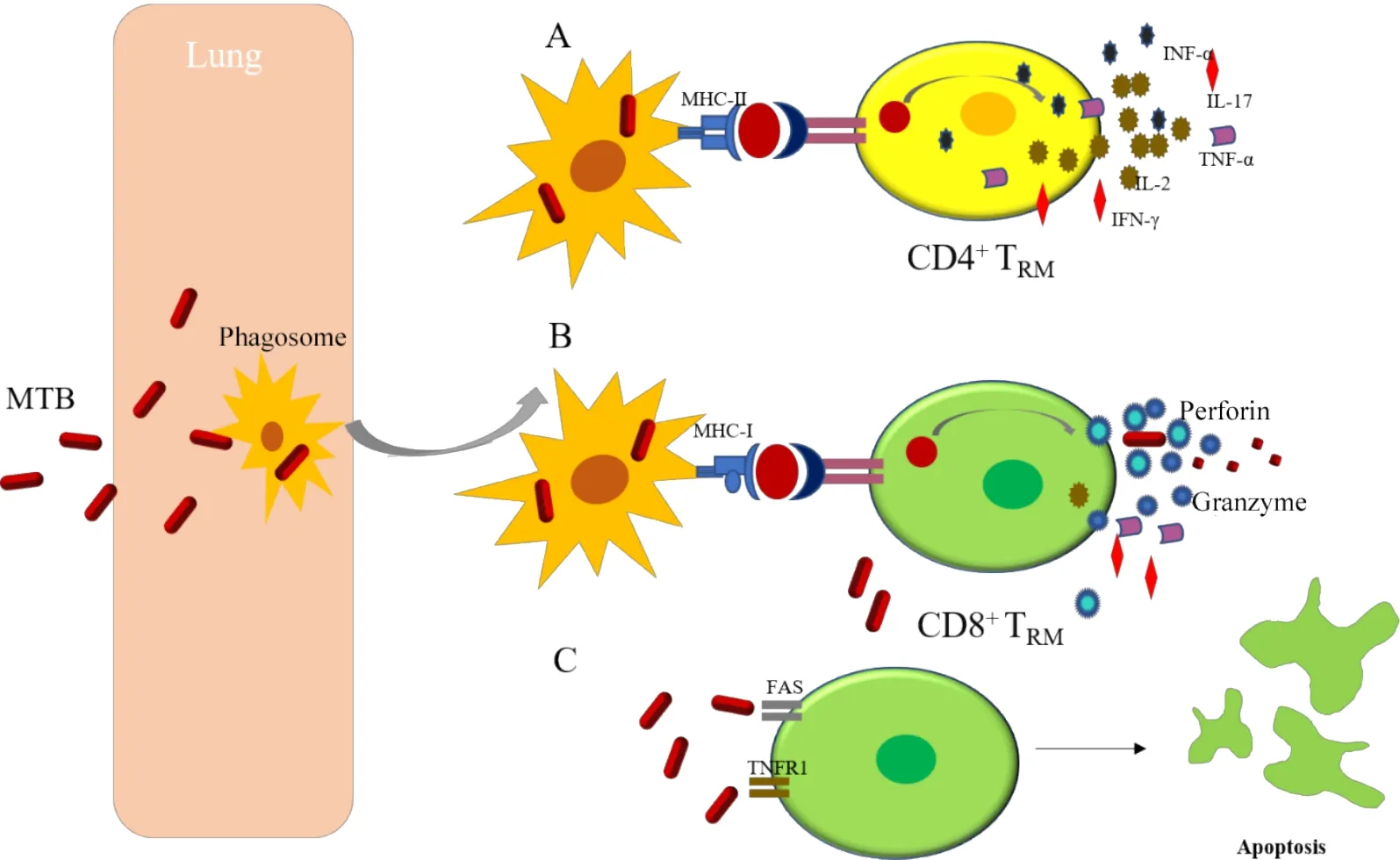
Figure 3.The role of TRM in the anti-MTB immune response.图3 TRM在抗MTB免疫反应中的作用
在动物模型中的研究发现,肺TRM细胞在MTB免疫反应中的重要性。比较皮下接种、鼻内接种和口服给药3 种方法所产生的TRM的数量和种类,鼻内接种和口服BCG 接种显著诱导了TRM向肺实质和气道的浸润,这与皮下注射BCG 接种诱导的浸润非常相似[47]。皮下BCG 接种主要依赖于CD4+TRM的免疫反应。然而,皮下BCG 接种的缺点之一是整体TRM的生成较弱,而且缺乏向肺迁移的黏膜趋化因子受体;口服BCG 给药是一种低侵入性干预,但它不太可能作为人类疫苗接种策略的广泛应用。在目前的研究中,小鼠鼻内BCG 接种被用于研究TRM在预防呼吸道感染中的作用。研究发现鼻黏膜中富含更高比例的TRM,表明小鼠鼻内接种BCG 通过促进TRM的比例和IFN-γ、INF-γ、TNF-α 和IL-2 等抗原特异性细胞因子的释放来保护小鼠呼吸系统免受BCG 感染。同时,小鼠鼻内接种BCG 后,呼吸系统中的TRM增加[48]。TRM在灌洗液、鼻黏膜、气管和肺组织中持续存在很长时间,并具有防止肺部再次感染MTB的能力,表明鼻内接种可能是通过激活呼吸系统黏膜组织中的TRM并预防TB 来诱导免疫反应的最佳方式。此外,BCG产生的TRM可以保护MTB的感染,表明疫苗接种途径不同可能会产生不同数量的CD4+TRM和CD8+TRM。同时,TRM的生物标志物可能是开发疫苗的关键物质,从而需要改变评估疫苗有效性的方法[49]。由于约90%的MTB 感染者在感染后处于潜伏状态,因此研发用于潜伏性感染者的疫苗也具有重要的作用。TRM能够增强BCG 的免疫反应,有可能成为研究疫苗的新靶点。了解MTB感染诱导TRM产生的机制,能为更好地开发新的TB疫苗提供理论依据。
5 展望
TRM定位于MTB 入侵的初始部位,参与外周组织的免疫监测和免疫反应,为MTB 入侵外周组织提供第一道防线。越来越多的研究认识到TRM在组织免疫中发挥重要的作用。在对MTB 感染的免疫应答中,CD4+TRM和CD8+TRM能更有效地抑制MTB 的生长。MTB 特异性CD4+TRM反应对于理解免疫系统如何控制TB 的进展具有重要意义。除此之外,TRM也可能驱动其他重要的疾病过程,如免疫病理和自身免疫,并在癌症的免疫监测中发挥重要影响。虽然目前对TRM的认识可能为疫苗或已知疾病的预防或治疗干预提供新的转化机会,但在人类组织中定义和检测TRM有待进一步研究。目前利用一些标志物CD69 和CD103 定义TRM,但存在于非淋巴组织中或的TRM不容易被检测,我们还需要寻找TRM更加准确的表面标志物,能够真正识别其特征表型,这对于TRM维持的信号通路和转录因子以及应用TRM来研究新的TB疫苗具有重要意义。

