温度、盐度对海月水母碟状体生长及存活的影响
段 妍,孙 明,2,3,*,李 楠,徐 湘,王爱勇,董 婧
1 辽宁省海洋水产科学研究院,辽宁省海洋生物资源与生态学重点实验室,大连市渔业资源养护重点实验室,大连 116023 2 中国科学院海洋研究所,实验海洋生物学重点实验室,青岛 266071 3 中国科学院大学,北京 100049 4 上海海洋大学海洋科学学院,上海 201306 5 大连海洋大学水产与生命学院,大连 116023
海月水母(Aureliacoerulea) 属腔肠动物门 (Coelenterata),钵水母纲 (Scyphomedusae),旗口水母目 (Semaeostomeae),海月水母属 (Aurelia),是一种世界性种类,广泛分布于北纬70度到南纬40度之间的沿岸水域[1]。近十多年间,海月水母在世界各地出现了大规模的暴发现象,严重的影响了渔业,工业和沿岸旅游业[2—4]。同时,海月水母也在我国频繁暴发,2007年在烟台、威海海域暴发,影响了沿岸旅游业和渔业[5];2009年海月水母在青岛海域大量暴发,聚集在水循环系统过滤网上,几乎导致发电机组停机[6];近岸水域暴发也对滨海核电冷源取水安全造成了重大的威胁[7]。
研究发现,海月水母在夏季沿岸水域数量丰富,但年际间的数量变化较大,主要是由于其固着和浮游阶段的水文状况及食物条件会显著影响其时空分布,日本海域报道的较大的水母聚集可达到596只/m3水母体[8],海月水母数量的剧增经常发生在养殖区域和较封闭的海湾区域,特别是流通循环不畅和半咸水区域[9]。近年来研究者们更加关注于对于胶质水母类的研究,海月水母的生活史由有性繁殖的螅状体和无性繁殖的水母体阶段组成,目前大多数研究集中于螅状体阶段,螅状体通过横裂释放碟状体,因此螅状体种群数量决定了释放的碟状体的数量;然而另一方面,底栖固着的螅状体释放碟状体,从而完成从无性世代到有性世代的转变[10],横裂阶段释放的碟状体的存活与生长对水母体种群的大小也起着至关重要的作用[11]。碟状体作为水母浮游阶段的早期幼体,对成体水母种群的数量及分布具有显著的影响,因其处于幼体阶段,对海洋环境的理化因子的变化更加敏感,以前对于碟状体的研究大都集中于摄食[12—13],捕食者[11],运动能力[14],溶解氧[15],pH[16]等。最新的研究还发现,海洋微塑料的富集与摄入会显著的影响海月水母碟状体的生存及行为,降低其运动的平衡性及伞部波动频率[17]。然而对中国近岸分布的海月水母碟状体研究较少[1,6,10]。
研究发现,海流的物理作用是造成碟状体离岸扩散的主要因素,而其他因素(如水体理化因子,捕食等)则共同作用影响碟状体的分布模式[18]。碟状体的存活及生长直接决定水母体的种群密度[19],因此研究水文变化对碟状体生长及存活的影响,对于水母种群变动具有重要的意义[9]。付志璐等[6]研究了温度、盐度对海月水母生长的影响,但未对碟状体可存活的极限温度和盐度进行详细的研究。本文以海月水母碟状体为实验对象,研究了温度、盐度对其存活与生长的影响,旨在为进一步研究海月水母暴发机理、预测潜在分布范围提供重要的基础数据。
1 材料和方法
1.1 实验材料
实验用碟状体为2017年4月在辽宁省海洋水产科学研究院水母生态实验室所培育的螅状体横裂释放所得,培养于120cm×60cm×50cm的水母专用箱中。培养用海水取自大连市黑石礁沿岸,经黑暗沉淀并沙滤后使用。暂养期间,盐度31—34, pH 8.1—8.3, 溶解氧大于5mg/L, 水温15—18℃。饵料为人工孵化的卤虫(Artemiasnauplius)无节幼体, 体长约300μm.
1.2 实验方法
基于团队前期研究,已知海月水母碟状体可在水温10—25℃,盐度22—31范围内良好生长[6],本实验在此基础上,结合辽宁近岸水域的温盐条件,分别在高温区和低温区设置不同温度组,以2.5℃间隔进行详细研究,以期确定海月水母碟状体可存活的温盐范围,并扩展研究了海月水母碟状体适宜生长的盐度范围,将盐度增加到6个梯度,更全面准确地确定适宜海月水母碟状体生长的温盐范围。
海月水母碟状体存活实验共设9个温度梯度:2.5℃、5℃、7.5℃、10℃、15℃、20℃、25℃、27.5℃和30℃;每个温度梯度下设6个盐度梯度:15、20、25、30、35和40。根据预实验碟状体状态观察及统计结果,生长实验共设5个温度梯度:5℃、10℃、15℃、20℃和25℃;每个温度下设6个盐度梯度:15、20、25、30、35和40。每隔1 d升高或降低温度2—3℃和盐度2—3,直至达到实验设定的温盐条件,实验期间温度波动范围:(2.5±0.1)℃,(5±0.1)℃、(7.5±0.2)℃、(10±0.2)℃、(15±0.3)℃、(20±0.3)℃、(25±0.4)℃、(27.5±0.5)℃、(30±0.5)℃;盐度波动范围:(15±0.5)、(20±0.5)、(25±0.5)、(30±1)、(35±1)和(40±1),每2 d换水1次,不进行投喂(此期间碟状体可正常存活)。碟状体适应3d后正式开始实验。每个梯度设3个平行,每个平行10个碟状体,实验用碟状体培养于500mL玻璃烧杯中,放置于智能光照培养箱(GXZ—280B;GXZ—280C)中进行。实验开始后,碟状体每天足量投喂2次。投喂时,用吸满卤虫无节幼体的胶头滴管瞄准海月水母碟状体进行充分投喂,确保达到饱食状态。每组投喂完2h后换水。每天用显微镜(Olympus SZX9)观察碟状体生存率与生长状态,连续观察30d。测量实验初始和结束后海月水母碟状体完全伸展时的伞径。
1.3 指标测定与数据统计分析
海月水母碟状体特定生长率作为生长指标。碟状体伞径长是指当碟状体完全伸展时两个对称位置的缘瓣的直线距离。成活率(survival rate,SR)、特定生长率(specific growth rate, SGR)计算公式如下:
SR(%)=100 × (Nt/N0)
SGR(%)=100 ×(lnDt-lnD0)/T
式中,N0和Nt分别为实验开始和实验t天时碟状体的数量,T为实验持续时间(d),D0和Dt分别为实验开始和实验t天时碟状体的伞径长度(mm)。
采用单因子及双因子方差分析比较不同处理之间可能存在的差异水平。所有统计分析使用SPSS 20.0统计软件,以P<0.05为差异显著性。
2 结果
2.1 碟状体摄食行为观察
实验过程中观察了不同温度、盐度条件下碟状体的生长状态及摄食状况。低温条件下,2.5℃,碟状体基本不摄食,整体状态较差,基本静伏在烧杯底部,触手发白,卷曲,畸形现象明显,成活率低。温度15—25℃,盐度20—35条件下,碟状体生长状态良好,摄食量较大,摄食后的碟状体胃腔饱满,状态舒展,运动自如。实验过程中发现,温度显著影响碟状体对体内饵料生物的消化吸收,摄食1—2h后,温度15—25℃组碟状体逐渐由粉红色转变为透明状态,说明大部分食物已被消化;而较低温度组碟状体依然呈现粉红色,说明卤虫并未被消化完全。而高温组,30℃条件下,碟状体静伏烧杯底部,触手内缩,边缘破碎,模糊,直至溶化消失,10 d后全部死亡。盐度对碟状体的影响仅在高盐条件下较明显,盐度40条件下,碟状体状态较差,触手内缩,发白,虽不静伏底部,但运动和摄食状态不明显。
2.2 温度对海月水母碟状体存活的影响
温度对海月水母碟状体存活的影响如图1和图2所示。在盐度15—35的条件下,各温度组培养10d, 20d, 30d后,碟状体的存活率趋势基本一致,随着温度的升高呈现先升高后降低的趋势,在温度15—25℃时较高,随后降低。在低盐和高盐组 (15和40),温度对碟状体存活的影响会随着培养时间的增加而逐渐显著,随着培养时间的延长,存活率逐渐降低。直至实验结束,培养30d后各实验组碟状体存活率在温度20℃时达到最高,15和25℃组次之,高温组 (27.5和30℃)碟状体存活率显著降低;在盐度40的条件下,碟状体存活率受温度影响趋势与其他盐度组不同,表现为低温组存活率显著高于高温组。
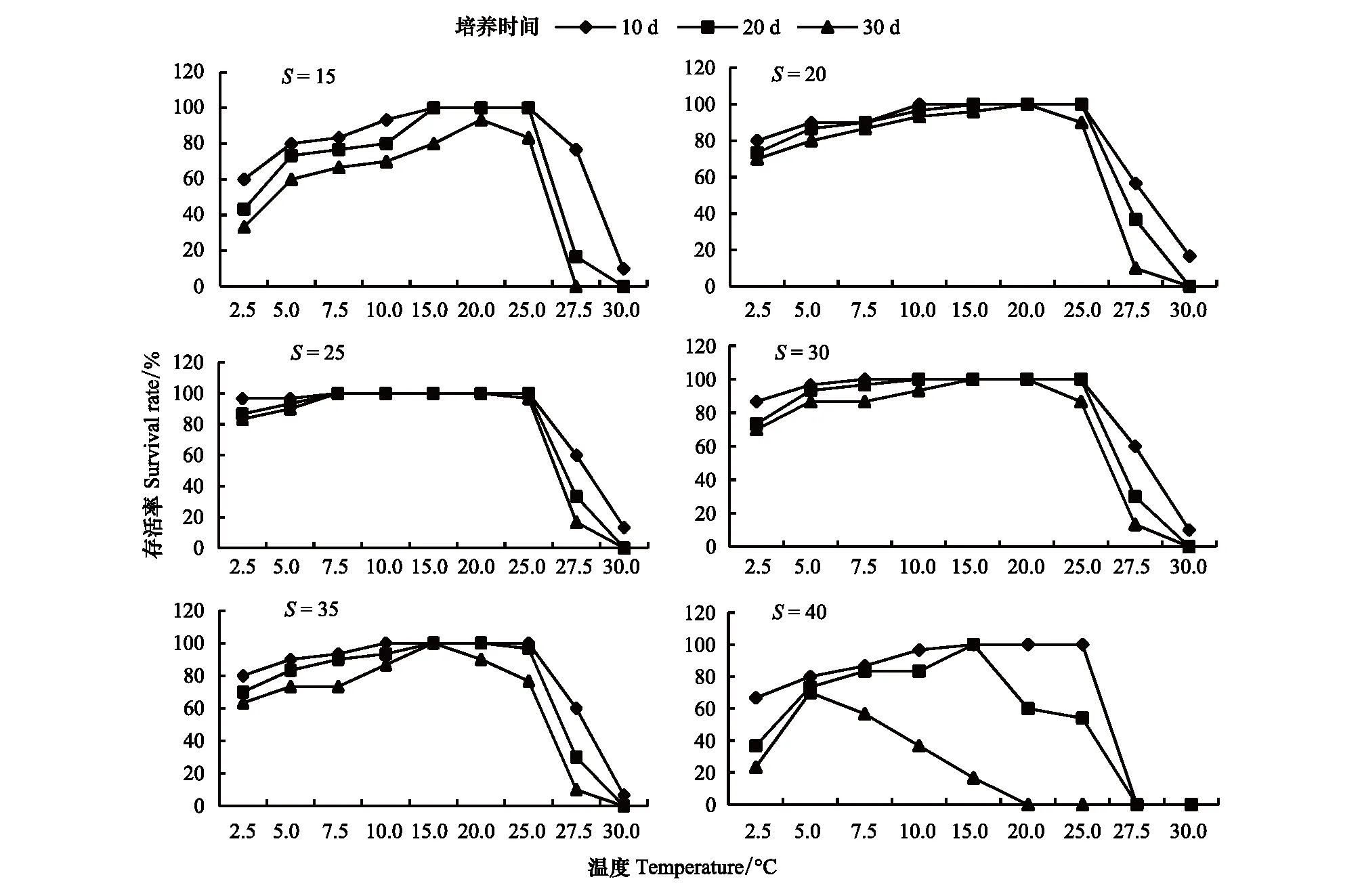
图1 不同培养时间温度对海月水母碟状体存活的影响Fig.1 The effect of temperature on the survival of ephyrae in different timesS: 盐度Salinity
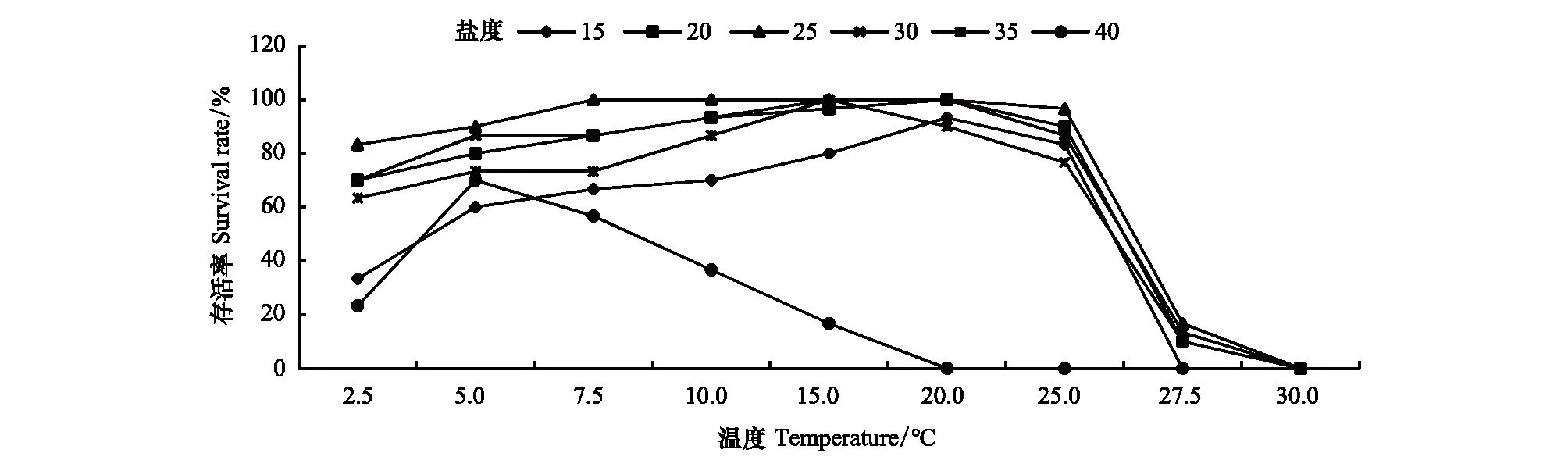
图2 不同盐度条件下培养30d温度对海月水母碟状体存活的影响Fig.2 The effect of temperature on the survival of ephyrae in different salinities at 30d
2.3 盐度对海月水母碟状体存活的影响
盐度对海月水母碟状体存活的影响如图3和图4所示。实验结果显示,5—25℃条件下,盐度对存活率的影响随着盐度升高呈现先升高后降低的趋势,盐度25处理组最高。在温度15—25℃,盐度15—35条件下,盐度对碟状体存活的影响并不显著,培养10d,各盐度组的存活率均达到100%;培养20d,存活率达95%以上。盐度对碟状体存活率的影响在低温(2.5—10℃)较明显,盐度25条件下具有较高的存活率。随着培养时间的延长,盐度40条件下,碟状体的存活率显著降低。
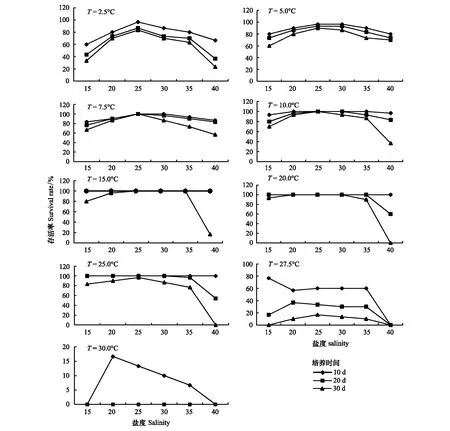
图3 不同培养时间盐度对海月水母碟状体存活的影响Fig.3 The effect of salinity on the survival of ephyrae in different timesT:温度Temperature
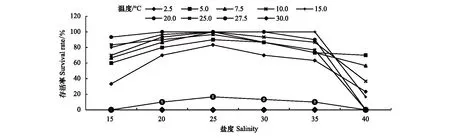
图4 不同温度下培养30d盐度对海月水母碟状体存活的影响Fig.4 The effect of salinity on the survival of ephyrae in different temperatures at 30d
2.4 温盐交互对海月水母碟状体存活的影响
温度盐度交互作用对海月水母碟状体存活的影响如图5所示,存活率随着颜色的变化而变化,其中红色区域分布的海月水母碟状体存活率最高,在15—20℃范围中,盐度25—30海月水母碟状体存活率均为100%。在高盐条件下,处于低温组(2.5—10℃)的碟状体存活率高于高温组(15—30℃)。方差分析结果显示(表1),不同温度贡献的离差平方和为150393.177,均方为18799.147;而不同盐度贡献的离差平方和为51841.733,均方为10368.347;可见温度对碟状体存活的影响要远比盐度的影响大。但温度,盐度和温盐交互对应的相伴概率均为0.000,说明,温度,盐度和温盐交互均对碟状体存活具有显著的影响。盐度的影响主要表现为高盐(40)条件下碟状体存活率的显著降低。
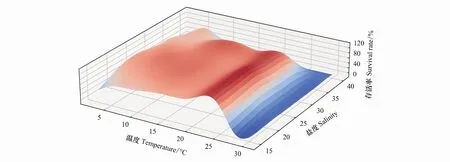
图5 培养30d温度盐度对海月水母碟状体存活的影响Fig.5 The effects of temperature and salinity on the survival of ephyrae at 30d
2.5 温度对海月水母碟状体生长的影响
温度对海月水母碟状体生长的影响如图6所示,在盐度15—35范围内,培养30d,碟状体伞径随着温度的升高逐渐升高,温度5和10℃处理组碟状体伞径显著低于其他处理组,而盐度40处理组,仅在温度5,10,15℃组碟状体存活,且存活的碟状体伞径均未有增长。特定生长率结果显示(图7),各盐度组特定生长率均随温度的升高逐渐升高,在盐度25,温度20℃处理组,特定生长率最大。温度5—10℃处理组,特定生长率大部分处于负值,而温度30℃处理组,培养10d后,碟状体全部死亡。
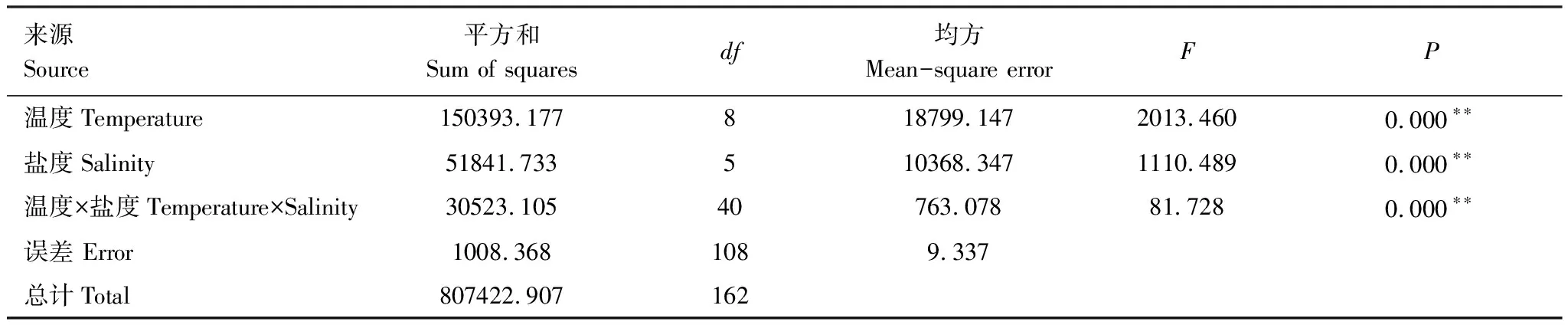
表1 温度盐度交互作用对海月水母碟状体存活率的影响方差分析
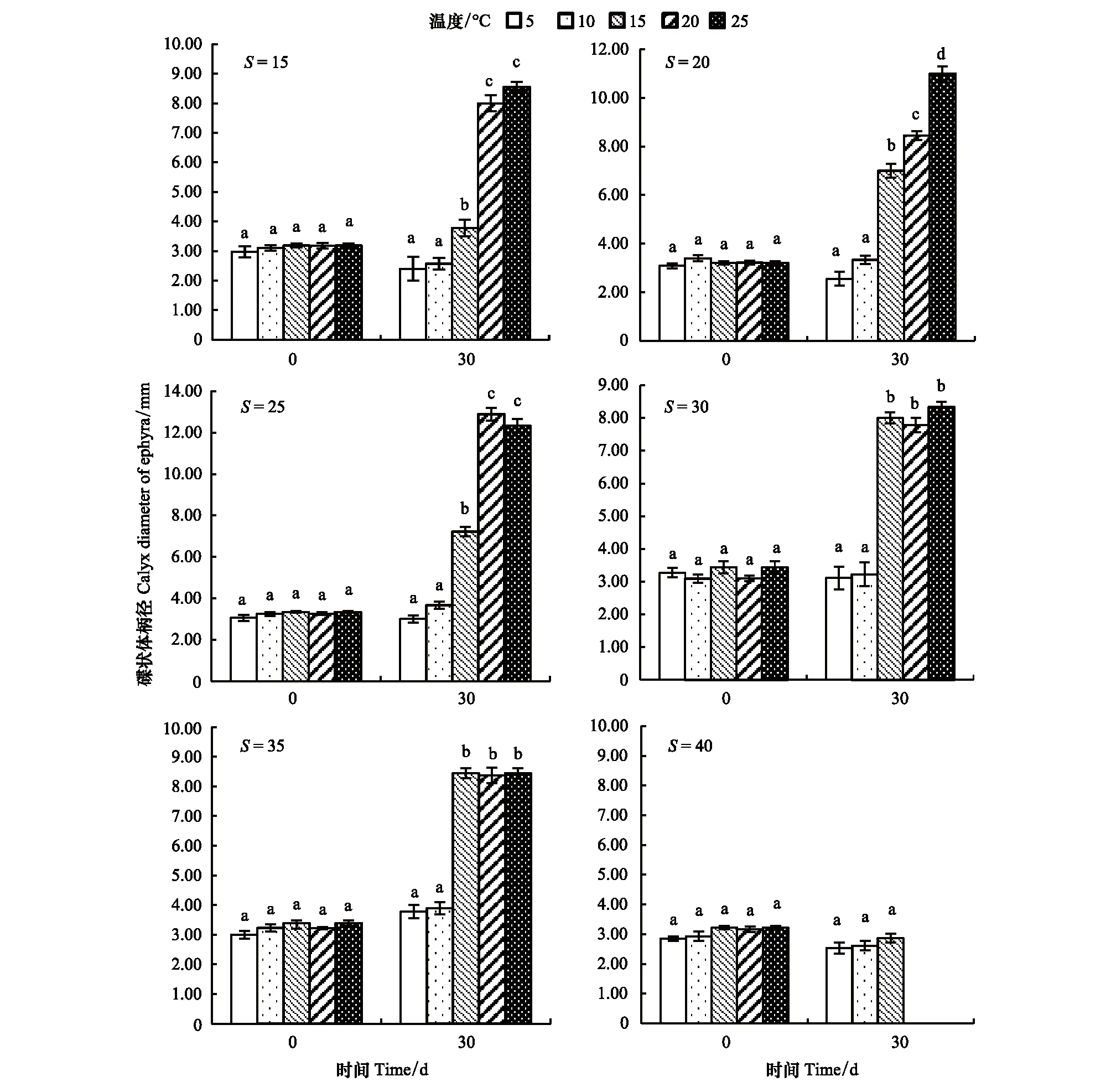
图6 不同培养时间温度对海月水母碟状体生长的影响Fig.6 The effect of temperature on the specific growth rate of ephyra in different times同一簇中不同字母表示差异显著(P<0.05)
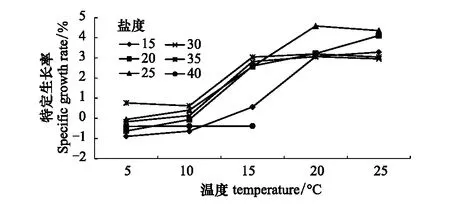
图7 不同盐度下培养30d温度对海月水母碟状体特定生长率的影响Fig.7 The effect of temperature on the specific growth rate of ephyra in different salinities at 30d
2.6 盐度对海月水母碟状体生长的影响
盐度对海月水母碟状体生长的影响如图8所示,在盐度15—40范围内,碟状体伞径随着盐度的升高呈现先升高后降低的趋势,主要表现为在低盐(15)和高盐(40)条件下碟状体伞径低于其他盐度处理组。低温条件下(5—15℃),碟状体伞径在35盐度处理组最大;而随着温度的逐渐升高,碟状体对30以上盐度的适应性降低,表现为在盐度25处理组伞径值最大。盐度对特定生长率的影响结果显示(图9),随着盐度上升,特定生长率出现了先上升后下降的趋势;在低温组(5—15℃)盐度35处理组特定生长率最高,温度20和25℃处理组,盐度25条件下,特定生长率最高;盐度40处理组,特定生长率均呈现负值。
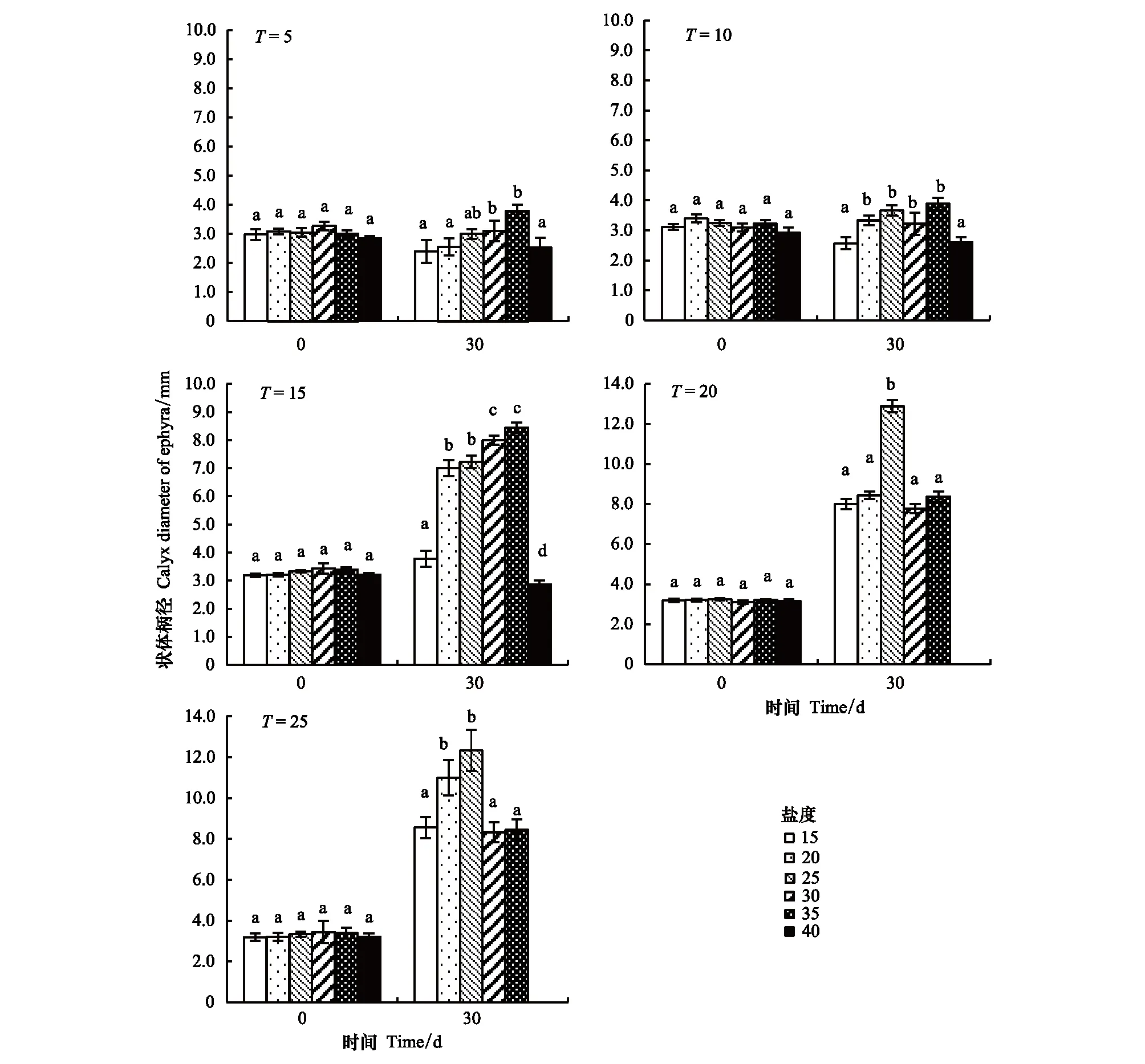
图8 不同培养时间盐度对海月水母碟状体生长的影响Fig.8 The effect of salinity on the specific growth rate of ephyra in different salinities同一簇中不同字母表示差异显著(P <0.05)

图9 不同温度下培养30d盐度对海月碟状体特定生长率的影响Fig.9 The effect of salinity on the specific growth rate of ephyra in different temperatures at 30d
2.7 温盐交互对海月水母碟状体生长的影响
温盐交互作用对海月水母碟状体特定生长率的影响如图10所示,不适的温盐条件会显著影响碟状体的生长,温度5—10℃,各盐度组海月水母碟状体的特定生长率均较低,甚至为负增长。随着温度的升高,10—15℃范围,特定生长率有明显的提高。温度15—25℃和盐度20—35条件下碟状体的特定生长率值较高。其中温度20℃和盐度25条件下的碟状体特定生长率达到最大值。随着盐度和温度的递增或递减,碟状体的特定生长率呈现下降的趋势。
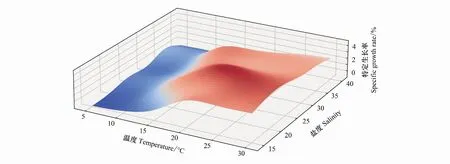
图10 培养30d温度盐度交互对海月水母碟状体特定生长率的影响Fig.10 The effects of temperature and salinity on the specific growth rate of ephyrae at 30d
方差分析结果显示(表2),不同温度贡献的离差平方和为1334.438,均方为333.610;而不同盐度贡献的离差平方和为120.669,均方为24.134;可见温度对碟状体生长的影响要比盐度的影响大。但温度,盐度和温盐交互对应的相伴概率均为0.000,说明,温度,盐度和温盐交互均对碟状体生长均具有显著的影响。
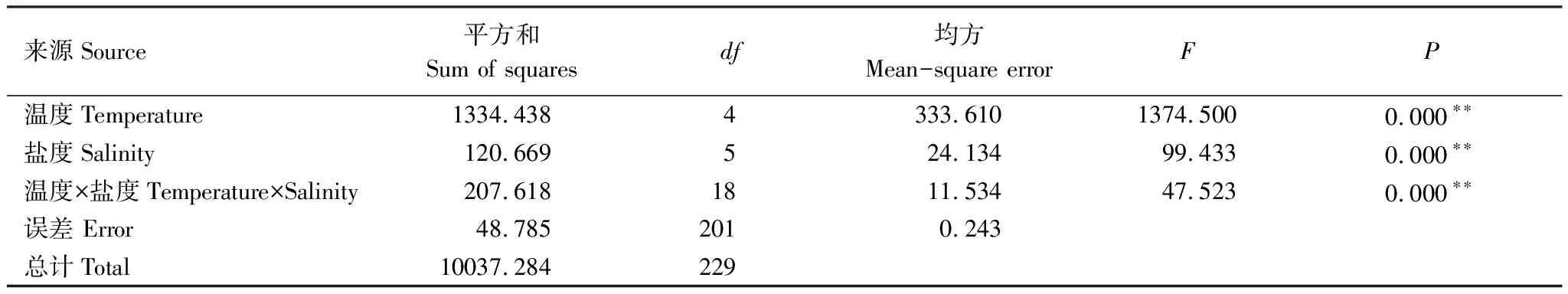
表2 温度盐度交互作用对海月水母碟状体特定生长率的影响方差分析
3 讨论3.1 温度、盐度对碟状体存活的影响
气候变化和人类活动严重破坏了沿岸海洋生态系统,在过去的十多年间,世界范围内的沿岸海域出现了大量的胶质浮游种类,水母的暴发严重影响工业的发展[20],同时水母摄食鱼卵并和鱼类在食物方面存在竞争关系,因此水母的聚集也会严重影响海洋生态系统的健康[21]。在某些区域,海月水母季节性的数量增加甚至超过了其他大型浮游动物数量,对浮游动物种群产生巨大的影响[22]。许多生态学专家预测,水母数量的增加最终可能导致巨大的生态灾难,它们或许会取代鱼类成为海洋生态系统的优势种[23]。整个水母的生活史周期,种群数量会因水体理化因子的变化而显著不同。线粒体和DNA结果显示,在日本,韩国和中国附近海域生活的海月水母为Aureliacoerulea[24—26],碟状体阶段通常被认为是死亡率较高的阶段,其存活的数量会显著影响水母体种群,Ishii等[27]研究发现,在东京湾,大约有99%的新生碟状体死亡。引起碟状体死亡的原因有多种,包括食物,捕食者,水体理化因子的变化等,同时Fu等[28]研究发现,碟状体对饥饿具有较强的耐受力。因此,水体理化因子对碟状体的存活应具有较大的影响。
基于团队前期的研究结果[6],在预实验过程中,设计以2.5℃为区间间隔分别在高温区和低温区选择3个温度梯度,加以研究温度对碟状体生存的影响,但在温度32.5 ℃条件下,碟状体放入1d后,死亡率近50%,6d全部死亡,碟状体状态不佳,大部分呈现卷曲,外翻或内翻,边缘破碎,直至溶化消失的现象,因此,本实验中并未将32.5℃的数据与其他实验数据整合用以比较。可见,海月水母碟状体的适温范围与黄渤海自然水域温度波动范围基本相符。已有研究结果表明,在黄渤海区海月水母螅状体在8—17℃范围内均产生横裂生殖,最适水温为13℃[1,10],同时黄海北部海水温度范围在-1—25℃之间[29],海域温度的波动会对碟状体的适温范围产生较大的影响[30]。
Miyake 等[31]研究发现,不同地理种群的海月水母其横裂释放碟状体的温度具有显著的不同,在地中海区域,14℃时,螅状体横裂释放碟状体,21℃时停止[4];在红海海域,海月水母螅状体在28℃下横裂释放碟状体[10];在台湾附近海域,螅状体横裂温度为20—30℃[32],由此可见,初生碟状体生存温度具有较大的差异,这也会导致其对温度具有不同的适应性。同时,不同种类水母碟状体的适应的温盐范围也不尽相同,Dong等[33]研究发现,白色霞水母碟状体生存的盐度范围为15—35, 生长最适盐度范围为20—35。海蜇碟状体生存盐度为7.05—36.58,生长盐度为9.89—33.63,最适盐度为13.84—26.26;海蜇碟状体生存温度为5—30℃,生长温度为10—25℃,最适温度15—20℃[34]。本实验结果显示,在盐度20—30范围内,温度15—25℃条件下,最适合碟状体存活,存活率均在90%以上。海月水母碟状体可以在温度2.5—27℃,盐度15—35范围内存活。方差分析结果显示,温度,盐度,和温盐交互作用都对碟状体的存活产生显著的影响,但温度的影响较盐度的影响大(表1)。
盐度对碟状体存活的影响主要表现为对高盐条件的耐受力较差,当盐度为40时,碟状体在各温度条件下,存活率均显著降低。盐度对碟状体存活的影响仅在高温(27.5℃)和低温组(2.5—10℃)表现出明显的趋势,随盐度增高呈现先升高后降低的趋势,盐度25条件下具有较高的存活率。可见,碟状体在不适宜的温度条件下,应对盐度变化的调节能力也相应减弱。研究表明,当水体温盐条件发生改变时,生物会产生相关的适应性调节,包括直接的生理调节,使得各个部分回到初始的平衡状态,当水体盐度改变时,体内的离子组成会受到干扰,生物可以通过改变表皮离子的传输机制恢复到正常的状态。另一方面,生物也可以通过间接的方式来适应环境的改变,例如温盐条件发生改变时,生物通过改变其肌肉的收缩率来维持相关的功能[35]。Dillon研究发现,盐度的降低会使碟状体伞部搏动频率增加[36],本实验结果显示,在盐度40条件下,碟状体表现出低温组存活率显著高于高温组,与其他盐度组趋势不同。低温条件下,碟状体基本未有运动行为,大部分静伏在烧杯底部,整体生理代谢过程减慢,对食物的消耗吸收降低,高盐和低温都会导致碟状体伞部波动频率降低,而高温条件下,碟状体的代谢率增加,伞部波动频率加快;因此,低温条件下整体生命活动过程的减缓导致碟状体对盐度的敏感性降低,出现低温高盐组存活率增加的现象。
3.2 温度、盐度对碟状体生长的影响
对伞径22mm的海月水母碟状体的研究发现,温度从5℃增加到14℃,碟状体生长速率显著增加,但从14到21℃,增长速率增加并不显著,在温度30℃条件下,碟状体死亡[37]。Båmstedt研究了温度对碟状体伞径生长的影响,结果显示,在低温6和9.5℃下,最初的几天生长较快,随后生长率下降,盐度22条件下,碟状体生长较好[38]。研究发现,温度、盐度对碟状体生长的影响主要是对其摄食量的影响,碟状体在接近20℃条件下,其摄食量是低温条件下的2.7倍,日生长率也显著增加,盐度也显著影响碟状体的摄食与生长,但跟温度相比影响较弱,摄食量的增加可以缩短碟状体发育成水母体的时间[9]。本实验结果表明,温度、盐度和温盐交互作用显著影响碟状体的生长。在温度20℃,盐度25条件下,碟状体特定生长率最高,本实验中虽未对摄食量进行量化的描述,但实验过程中观察发现,温度对碟状体的食物消化率具有显著的影响,低温条件下,摄食2h的碟状体整体呈现红色,而高温条件下,则从红色转变为半透明的颜色,说明食物已经被消化吸收。Båmstedt也证实低温条件下碟状体对食物的利用效率较低,导致生长速率降低[38]。
付志璐等[6]研究表明,温度25℃和盐度25为碟状体生长的最适条件,与本实验得出的温度20℃和盐度25为碟状幼体生长的最适条件略有差异。然而本实验中,方差分析结果显示,培养30d,盐度25条件下,温度20和25℃组比较,虽然20℃条件下螅状体伞径略高于25℃组,但两组之间并不具有显著性差异,但均显著高于其他温度处理组。本实验再次论证了盐度25为碟状体最适生长盐度,温度略有差异,也可能与碟状体初始柄径相关。付志璐等[6]研究表明,温度显著影响碟状体的生长,但盐度对碟状体生长影响不显著,本实验中发现,温盐均显著影响碟状体的生长,分析原因,前期实验设置的盐度范围在22—31之间,为螅状体适宜的盐度范围,相比前期的实验结果,本实验设置的温度、盐度范围较宽,盐度在15—40之间,较高较低的盐度均会对碟状体的生长产生抑制的作用。同时研究发现,在较低温组(5,10,15℃)盐度35条件下,碟状体特定生长率高于其他盐度处理组,在较高温度组(20,25℃),盐度25条件下,碟状体特定生长率最高。结果与生存实验结果一致,碟状体在低温条件下,对较高盐度具有较强的适应性,温度的降低有助于增加碟状体对较高盐度的耐受力。付志璐等[6]研究发现,温度10—25℃范围内,在盐度22—28条件下,碟状体相对生长率随温度升高而升高,而在盐度31条件下,相对生长率呈现先升高后降低的趋势,在20℃最高,且在低温10℃条件下,相对生长率在盐度31条件下高于其他低盐度组。虽然实验结论表明,盐度的整体影响并不显著,但与本实验结果的基本趋势一致,碟状体在低温条件下对较高的盐度适应能力增加。
本实验结果显示,温度5℃时不适合海月水母碟状体生长,该温度下所有盐度组的特定生长率几乎为负值。温度5℃和10℃组中的碟状体摄食率低,基本失去活力,在烧杯底部处于静止状态,碟状体整体发白且蜷缩,没有生长与变态的过程,没有向水母成体转变的趋势。15—25℃范围,碟状体活力逐渐恢复,摄食率逐渐提高,烧杯内可见碟状体整体舒展且处于游动状态。
综上,本实验认为:海月水母碟状体可以在温度2.5—27.5℃,盐度15—35条件下存活,在15—25℃范围内可正常生长,在温度20—25℃和盐度20—30条件下适宜海月水母碟状体生长,其中温度20℃和盐度25条件下海月水母碟状体特定生长率达到最大。黄渤海区海月水母螅状体在4—5月份横裂释放碟状体,随着碟状体的释放,5—6月份数量达到峰值,此时,海水温度大约在12—18℃左右[1],随着春夏季节的到来,温度持续上升,接近20℃时,达到最适合碟状体生长的温度,大量释放的碟状体生长开始加速,适合的环境条件使其快速的成长为幼水母,直至成体水母。

