单叶蔷薇幼苗根系对不同潜水埋深的适应机制
张晓龙,邓 童,刘学森,郑玲娜,于 超,6,罗 乐,6,*
1 北京林业大学园林学院,北京 100083 2 城乡生态环境北京实验室,北京 100083 3 花卉种质创新与分子育种北京市重点实验室,北京 100083 4 教育部园林环境工程研究中心,北京 100083 5 林木花卉遗传育种教育部重点实验室,北京 100083 6 国家花卉工程技术研究中心,北京 100083
根系是植物在适应陆地生活中逐渐进化形成的器官[1],具有固定植株、吸收水分养分以及合成和贮藏营养物质、激素并向地上部分输送的功能[2]。根系的生长状况与分布特征可以反映土壤中物质能量的吸收利用程度[3],体现不同地理环境下植物的生态适应对策[4]。根系形态、拓扑结构、生长速度、生长角度和扭曲程度等特征都属于根系构型研究的范畴[5]。有研究表明,不同植物根系在异质环境下的适应性表现不一,如沙柳(Salixpsammophila)作为深根系植物,但既可利用浅层土壤水又能吸取地下水,而乌柳(Salixcheilophila)、柠条(Caraganakorshinskii)等浅根系植物,根冠比小,主要水源是降水形成的浅层土壤水[6]。疏叶骆驼刺(Alhagigagnebin)可以通过增加垂直根系长度、扩大根冠比来应对深层潜水带来的干旱胁迫[7]。面对高中低水位时,柽柳(Tamarixchinensis)根系拓扑结构由叉状分支向人字形分支模式过渡,表明其具有良好的环境适应性和可塑性[8]。因此,开展不同潜水埋深条件下植物根系构型研究,对于理解植物在不同生境中的资源配置机制和生态适应性策略具有重要意义。
目前,限制我国西北干旱、半干旱地区植物生长发育的主要因子为水分,在降水稀缺的干旱区自然生态系统中,地下水的时空分布又将直接或间接影响生态系统过程、植物群落组成及植物用水策略[9—10]。虽然近60年来西北地区气候暖湿化明显[11],但年极端高温事件发生频次亦为增加趋势[12],且未来气候变化具有暖干化的潜在特点[13],所以,无论当前还是未来,地下水对西北植被的生存都具有重要意义。
单叶蔷薇(Rosapersica),亦称为小檗叶蔷薇(Rosaberberifolia,异名),是蔷薇科(Rosaceae)蔷薇属(RosaL.)多年生落叶丛生灌木,在我国主要分布在新疆西北部地区,以建群种的形式生长于海拔120—950 m的山坡、荒地或路旁等干旱地带的灌丛群落中,具有抗寒、抗旱、耐盐碱、根系发达等优点[14],是用于防风固沙、防止水土流失和控制荒漠化的优良植物。近年由于北疆地区开垦农田、扩建道路、兴修水渠等人为活动,单叶蔷薇生境急剧恶化,种群面积和数量迅速减少,若不进行及时保育,则该物种濒危风险将进一步加大[15]。作为国家二级保护植物,目前单叶蔷薇的研究主要集中在地上器官形态学[16—18]、生境调查与群落特征[19—21]、分类学[22]、孢粉学[23]以及生物学特性[24]等方面,根系研究探讨较少,特别是异质性环境下根系构型的适应性机制尚不明晰;在野外,成年植株地下直根可达170 cm以上,且直根上有大量的地下茎,并靠地下茎进行无性繁殖,这种形态发育特征有利于其在干旱条件下充分利用土壤水分进行生长[15,18]。因此,本研究以单叶蔷薇幼苗为试验材料,目的是对比不同潜水埋深条件下单叶蔷薇幼苗生长发育、根系形态、拓扑结构与分形维数以及表型可塑性的变化,初步阐明其根系的生长适应性策略。研究结果可补充单叶蔷薇根系生态学研究,对该物种的繁育也具有一定指导作用,亦可为今后单叶蔷薇植被生态修复、抗逆性研究提供理论基础。
1 材料和方法
1.1 试验设计
试验以一年生单叶蔷薇播种苗为材料,种子采自新疆野外,选取健康饱满的种子进行层积催芽。2021年1月15日播种,4月1日开始设置不同的潜水埋深进行试验。
试验容器为直径16 cm的PVC管,对照组为70 cm高的种植土柱;结合前期预试验情况和参照胡杨幼苗等试验设置[8,25],本试验组设置5个不同的种植土柱高度:30、40、50、60、70 cm,底部均设高度为10 cm潜水层,即为5个不同潜水埋深梯度,供试土壤(河沙∶田园土∶草炭土∶珍珠岩∶石子为2∶6∶2∶1∶1)与潜水层之间采用石子、带孔塑料板隔离(图1)。处理编号依次为CK、D30、D40、D50、D60、D70。5个取样时间:第15、30、45、60、75天,每个处理6株幼苗,共180株单叶蔷薇幼苗。
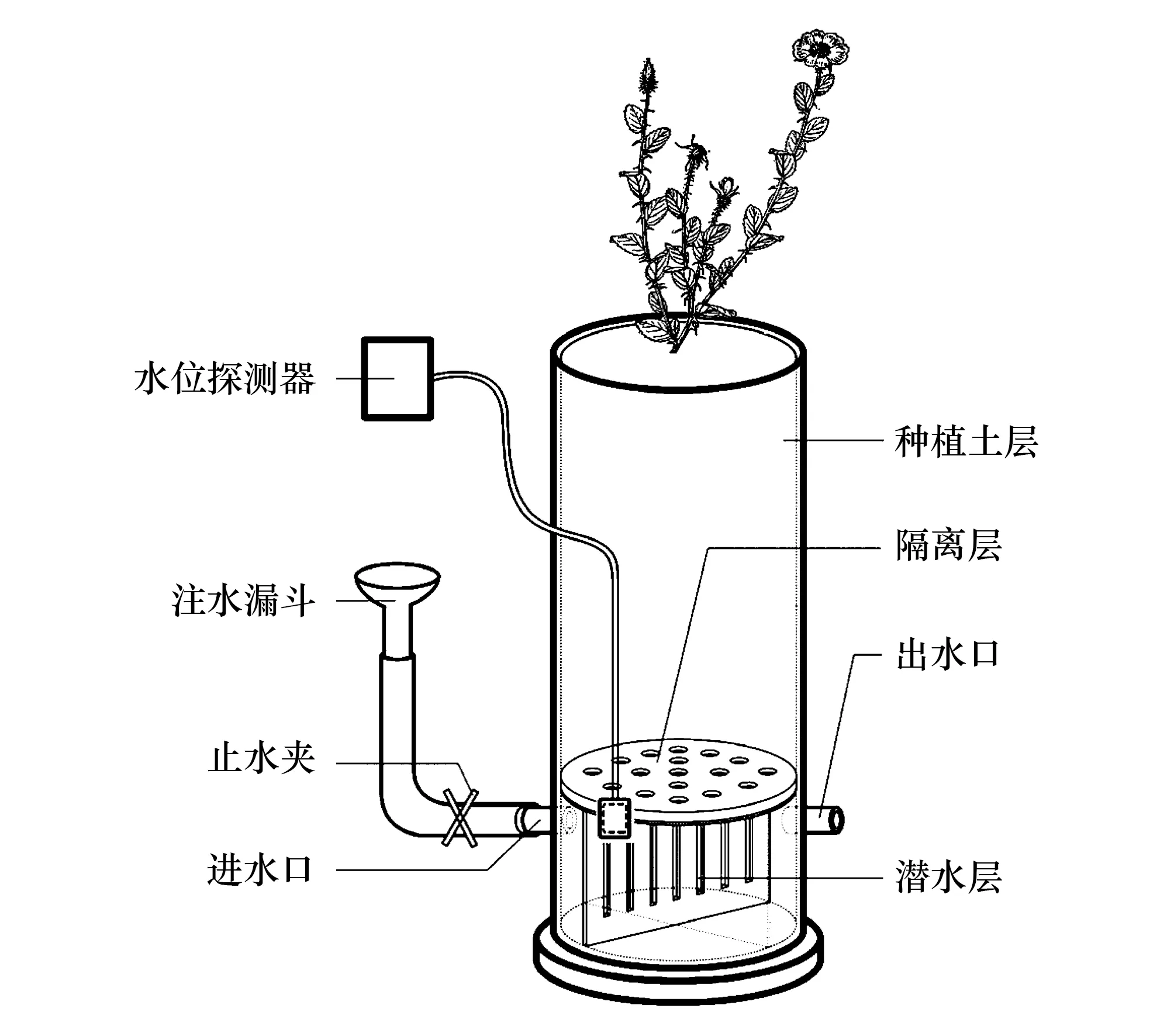
图1 试验装置示意图Fig.1 Schematic diagram of experiment device
试验于北京林业大学小汤山基地的塑料大棚中进行,整个试验期间不对单叶蔷薇幼苗进行施肥、灌溉,每7天定时补充潜水层。
1.2 测定方法
分别于试验开始后的第15、30、45、60天和第75天进行破坏性取样,每个处理选取6株生长程度相近的健康个体作为样株,用于试验分析。取样前用卷尺进行株高测定。取样后,用水洗净根系,将植株从基部剪开,向塑料盘中倒入少许蒸馏水并将根系平铺在塑料盘中,用镊子调整根系位置避免交叉重叠,使用台式扫描仪(ScanMaker I800 Plus)进行扫描(分辨率600 dpi),后用根系分析系统(RhizoVision Explorer 2.0.2)处理扫描的图片,获得根系总长度、根表面积、根体积、根系内部连接数量等相关指标。分析完毕后用蒸馏水洗净根系,用滤纸吸干水分,将地上部分与根系分别放入烘箱105 ℃下杀青15 min,再于65—75 ℃下烘干至恒重,用天平称量其干重。从以下四个层次分析相关指标:
(1)生长发育:株高、扎根深度、垂直根系生长速率、地上干物质、根系干物质、根冠比、根尖数量;(2)根系形态:总根长、根表面积、根体积、分支数量、比根长、比根表面积、根组织密度、分支密度,本研究以直径级别进一步划分细根(d<2.0 mm):0—0.50 mm(G1)、0.50—1.00 mm(G2)、1.00—2.00 mm(G3)[26],探究不同径级根系之间的关系;(3)拓扑结构与分形维数:拓扑指数、分形维数;(4)可塑性分析:表型可塑性指数。
其中,比根长=总根长/根系干重;比根表面积=根表面积/根系干重;根组织密度=根系干重/根体积;分支密度=分支数量/总根长;拓扑指数Ti=lgA/lgM,Ti值越接近于1,根系越接近人字形分支模式,Ti值越接近于0.5,根系越接近叉状分支模式;表型可塑性指数=(性状的最大值-性状的最小值)/性状的最大值,范围为0—1,值越大表示表型可塑性越大。
1.3 数据处理
利用Microsoft Office Excel 2021整理数据,IBM SPSS Statistics 25.0进行单因素(ANOVA)分析, 邓肯法(Duncan)分析显著性(P<0.05),使用Origin 2021绘图,各图中的数值均为平均值±标准误差。
2 结果与分析
2.1 不同潜水埋深对单叶蔷薇幼苗生长发育的影响
随着时间变化,不同潜水埋深对单叶蔷薇幼苗株高、扎根深度、根尖数量、地上干物质、根系干物质、根冠比的影响日益显著(图2),对垂直根系生长速率影响不显著(表1)。所有处理下的幼苗株高整体上均呈上升趋势,其中D30、D40处理下的单叶蔷薇幼苗株高增长尤为明显,至第75天时,两组较CK分别增长86.78%、75.05%,D50、D60、D70组株高较CK变化不显著。对于扎根深度,相比第60天时,D30处理在第75天时下降13.00%,而其他处理下的单叶蔷薇幼苗根系在整个生长季内均表现出不同程度的增长,D30、D40、D50处理下的扎根深度分别在第45、60、75天时穿过隔离层到达潜水层;相比CK,扎根深度增幅最大出现在第75天时的D50处理组(111.00%)。第75天时D30处理下扎根深度相对下降,该处理在S5阶段内垂直根系生长速率表现出负增长(4.59 mm/d);相比CK,试验组所有的垂直根系生长速率在S1、S2阶段内差异显著,在S3、S4、S5阶段内不显著;CK、D30、D40、D50、D60、D70垂直根系生长速率分别在S2、S4、S2、S5、S2、S5阶段内达到最大值,依次为5.55、14.30、10.17、10.42、11.47、8.12 mm/d(表1)。

表1 不同阶段单叶蔷薇幼苗垂直根系生长速率/(mm/d)
就地上干物质、根系干物质而言,整个生长季内不同处理下两项指标均呈增长趋势,显著差异性出现在试验中后期(图2)。第45天时,仅D40组地上干物质量(0.0703 g)较CK(0.0392 g)差异显著;D40、D50、D60、D70组的根系干物质量依次为0.0217 g、0.0244 g、0.0268 g、0.0230 g,较CK(0.0086 g)差异显著,D30(0.0170 g)与CK之间差异不显著。第60天时,仅D30、D60两组的地上干物质量(0.1766 g、0.1422 g)、根系干物质量(0.0605 g、0.0641 g)较CK(0.0326 g、0.0165 g)差异显著。第75天时,D30、D40、D60组的地上干物质量依次为0.4397、0.1966、0.2128 g,较CK(0.0639 g)差异显著,其他处理与CK之间差异不显著,根系干物质量仅有D30、D60两个处理较CK(0.0269 g)差异性显著,为0.1547、0.1162 g。此外,相较CK,单叶蔷薇幼苗地上干物质、根系干物质同是在第75天时的D30处理下增幅最大,为588.11%、475.46%;整个生长季内,CK处理下单叶蔷薇幼苗地上干物质、根系干物质分别增长315.58%、375.81%,D30处理下分别增长1940.52%、1641.53%,D40处理下分别增长747.82%、564.67%,D50处理下分别增长640.08%、757.26%,D60处理下分别增长937.80%、1288.79%,D70处理下分别增长244.35%、409.20%,表明D30处理有利于单叶蔷薇幼苗的生长,同时也证明单叶蔷薇幼苗具有极强的抗旱能力,在完全干旱的条件下仍能继续生长。
不同潜水埋深对单叶蔷薇幼苗根冠比的显著性影响仅出现在第45天和第60天(图2)。第45天时,D30、D50、D60和D70处理下的根冠比较CK差异性显著,分别增加115.38%、81.40%、81.83%、66.80%;第60天时,仅有D40处理下的根冠比与CK存在显著性差异,下降47.81%。整体而言,D40处理下的单叶蔷薇幼苗根冠比为W型变化趋势,D30、D50、D60和D70均为“先升后降再升”的N型趋势,而CK呈“先降后增再降”趋势。
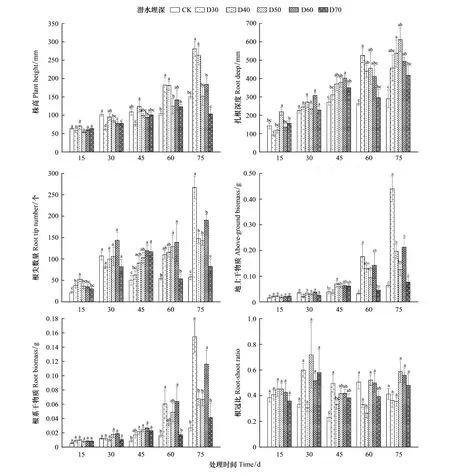
图2 单叶蔷薇幼苗生长指标对不同潜水埋深的响应Fig.2 Response of growth indexes of Rosa persica seedlings to different groundwater levels图中不同小写字母表示不同组之间差异显著(P<0.05)
第15天时,D30、D40处理下的单叶蔷薇幼苗根尖数量较CK存在显著性差异;第45天时,D50、D60、D70组与CK存在显著性差异;第60天时,D50和D60组较CK、D70存在显著性差异;第75天时,D30、D40、D50、D60处理下的根尖数量与CK处理存在显著性差异,D70与CK之间无显著性差异。整个生长季内,试验组和对照组处理下的单叶蔷薇幼苗根尖数量均表现出“先升后降再上升”的趋势,CK处理下的根尖数量从22.33增至58.00个,D30从37.83增至267.00个,D40从52.83增至147.69个,D50从36.50增至143.36个,D60从35.33增至190.55个,D70从30.17增至82.36个。
2.2 不同潜水埋深对单叶蔷薇幼苗根系形态的影响
不同潜水埋深对单叶蔷薇幼苗总根长、根表面积、根体积和分支数量均有显著性影响,且时间越久,不同处理之间的差异愈加明显。第75天时,D30组在总根长、根表面积、根体积和分支数量与其他处理均为显著差异,四项指标较CK分别增长3.94、5.93、10.36、4.57倍,是所有处理中增幅最大的一组试验处理;D40、D50和D60处理下的四项指标均显著高于CK;而D70与CK之间差异不显著。整个生长季内,CK处理下的幼苗在总根长、根表面积、根体积上始终保持“先升后降再上升”的N型变化趋势,而D70处理下的幼苗在这三个指标上始终保持“先降后升再降再升”的W型趋势;在分支数量这一指标上,CK和D70处理均为N型趋势(图3)。不同潜水埋深对单叶蔷薇幼苗比根表面积无显著影响(图3)。第60天时D30组的比根长与D50、D60存在显著差异,第75天时D70组比根长与D30、D60存在显著差异。第45天的D30、D60组,第60天的D30、D40组均在根组织密度上与CK有显著差异;第75天时,D30、D40、D50和D60组与CK之间均存在显著差异。对于分支密度,仅第60天时的D50、D60与D30、D70之间存在显著差异。不同处理下单叶蔷薇幼苗的比根长、比根表面积总体上呈下降趋势,而比根体积、分支密度为增长态势。
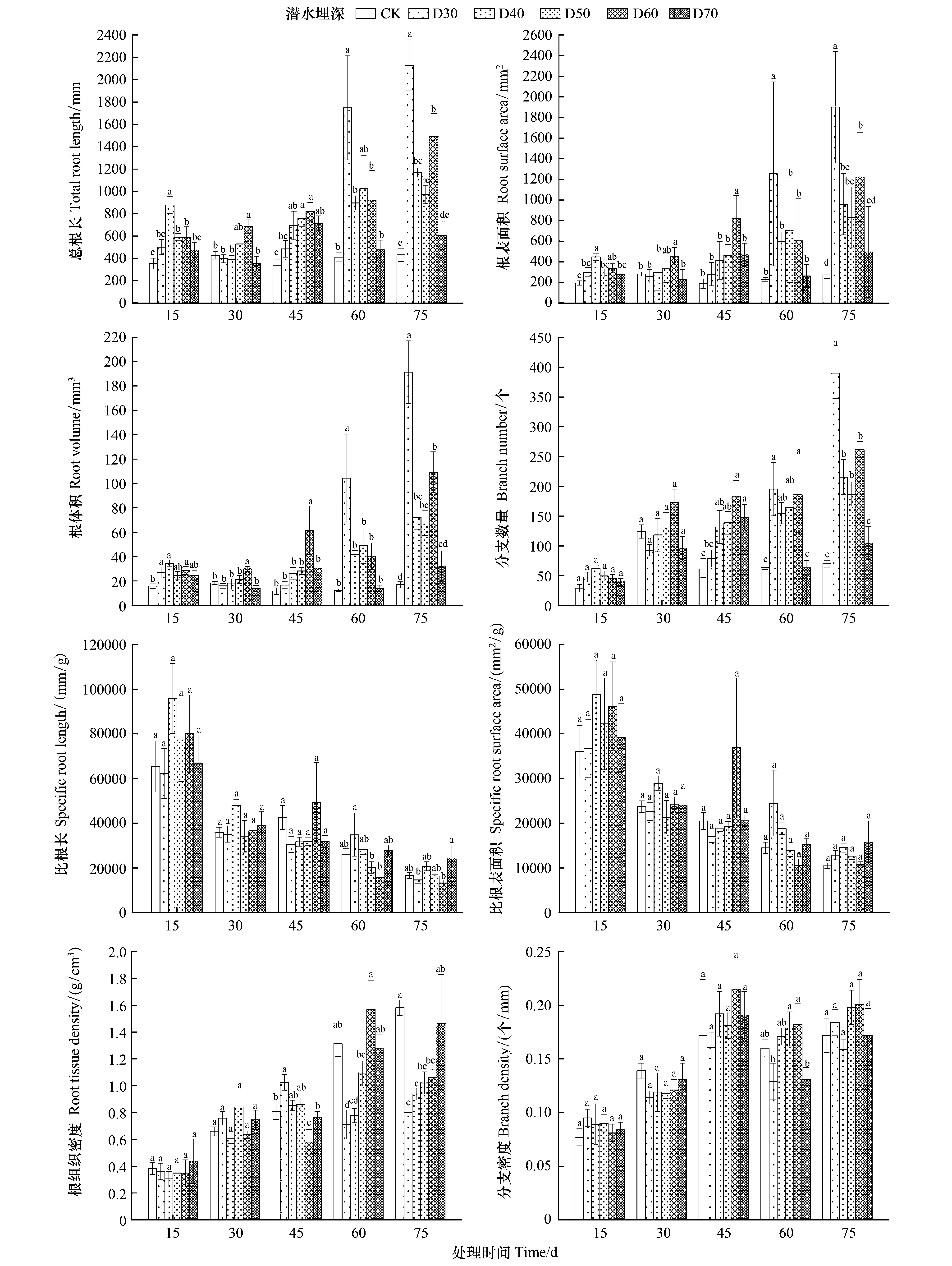
图3 单叶蔷薇幼苗根系形态指标对不同潜水埋深的响应Fig.3 Response of root morphological indexes of Rosa persica seedlings to different groundwater levels图中不同小写字母表示不同组之间差异显著(P<0.05)
与整个植株的总根长、根表面积、根体积相比,单叶蔷薇幼苗各径级细根三项指标所占比例均随潜水埋深的变化而发生改变(图4)。试验期内,幼苗G1级细根总根长占植株总根长的比例均呈整体上升趋势,D70增幅最大(29.51%),CK紧随其后(26.45%),而G2+G3级细根总根长所占比例均呈下降趋势。针对根表面积占比、根体积占比,G1级细根在不同潜水埋深影响下表现出不同趋势,基本可以分为两类:D70、CK处理下的G1级细根表面积占比分别增长了12.49%、7.96%,根体积占比分别增长了20.94%、13.04%,而其他处理在两项指标上均为负增长,其中D30组的G1级细根表面积占比、根体积占比均是最大降幅(8.29%、16.25%)。由于本试验中的幼苗粗根(d≥2 mm)数量较少,试验苗根系主要由细根(d<2 mm)构成,所以在进一步分级的情况下G1与G2+G3级根系在上述指标上表现出相反的变化趋势。

图4 不同潜水埋深下单叶蔷薇幼苗不同径级根系性状所占比例变化Fig.4 Changes in the proportion of root traits of different diameter classes in Rosa persica seedlings under different groundwater levelsCK,对照组 Control check;D30、D40、D50、D60、D70,均为试验组,潜水埋深依次是30、40、50、60、70 cm;图中不同小写字母表示不同组之间差异显著(P<0.05)
2.3 不同潜水埋深对单叶蔷薇幼苗根系拓扑结构和分形维数的影响
如图5所示,试验中后期的单叶蔷薇幼苗根系在拓扑结构和分形维数上存在显著差异。D30处理下的拓扑指数从0.85(第15天时)下降至0.81(第75天时),CK组降幅0.03,其他处理下的拓扑指数基本保持稳定。整体上不同处理下的拓扑指数保持在0.8—0.9之间,接近1,说明单叶蔷薇幼苗根系属于典型的人字形分支模式,受环境影响小。单叶蔷薇幼苗分形维数经历了“先增后降再增”的趋势,相比第15天,第75天时的CK和D70处理下分形维数分别下降了0.03、0.04,而其他四个处理均是微增,整体上分形维数保持在1.25—1.45之间,D30与CK、D70之间差异显著。

图5 不同潜水埋深下单叶蔷薇幼苗拓扑指数和分形维数的变化Fig.5 Changes in topological index and fractal dimension in Rosa persica seedlings under different groundwater levels图中不同小写字母表示不同组之间差异显著(P<0.05)
2.4 不同潜水埋深对单叶蔷薇幼苗表型可塑性的影响
由图6可知,CK组单叶蔷薇幼苗在总根长(0.212)、根表面积(0.333)、根体积(0.364)上可塑性指数未超过0.5,说明该组幼苗在三项指标上可塑性相对较低;D30至D70五组幼苗在根冠比上均保持较低可塑性;D70组的株高(0.483)、D50组的总根长(0.483)可塑性指数也均低于0.5;D30组表型可塑性最为突出,在除根冠比外的9项指标上均处于0.79—0.96之间。
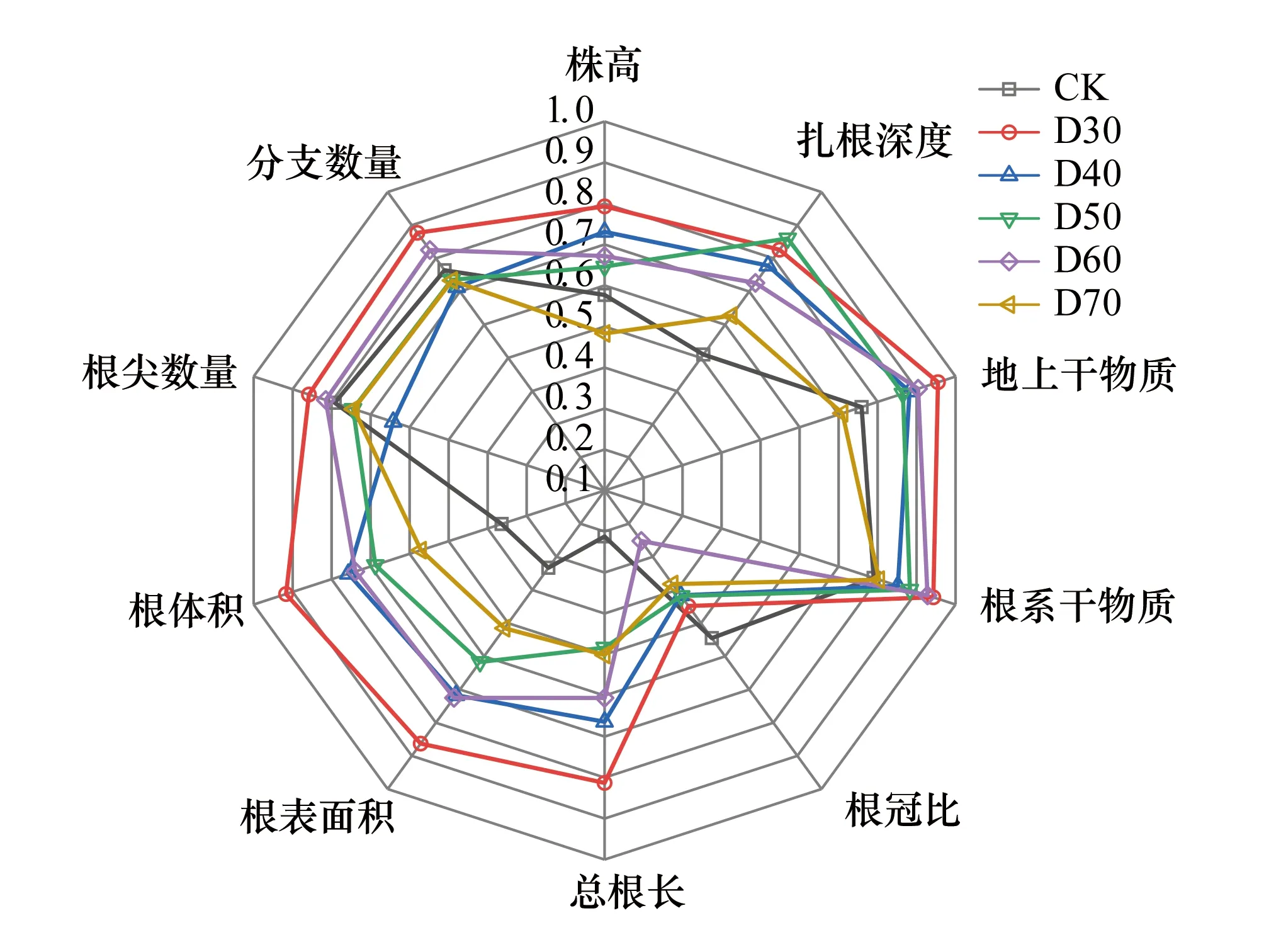
图6 不同潜水埋深下单叶蔷薇幼苗的表型可塑性 Fig.6 Phenotypic plasticity of Rosa persica seedlings under different groundwater levels
3 讨论
3.1 单叶蔷薇幼苗生长发育对潜水埋深的响应
植物表型特征与水分变化有着密切关系,潜水埋深可以通过影响土壤水分进而影响根系发育与形态特征[27]。本试验中发现,在不同潜水埋深条件下,株高、扎根深度、根尖数量和分支数量对潜水埋深响应具有一定规律,相比CK组根系指标差异显著,进一步证实水分对单叶蔷薇幼苗根系影响很大。D30、D40处理下的单叶蔷薇幼苗根系分别能够在45、60 d内到达潜水层解除干旱胁迫,进而转向全面的生长阶段,植株长势旺盛,叶面积更大,主茎上甚至萌发出侧枝(图7),而新生侧根能在水中生长,表现出与干旱胁迫下不同的新特点:顶部新生侧根变长变直,基部根系的木质化得以推进(图8)。对于D30组幼苗在S5阶段垂直根系生长速率为负增长的现象,很可能是充足的水分使得其面临着新的胁迫,即水涝胁迫,该组容器深度10 cm处的土壤含水率已高达15.80%,所以幼苗很有可能通过降低垂直根系长度、增加分支和根尖数量来获取更多氧气以适应新的环境。这点与王丽娟[25]、李强等[28]的研究发现一致:持续淹没造成土壤含氧量降低,最终抑制了胡杨(Populuseuphratica)幼苗根系的生长;盛晋华等[29]采用全根挖掘法发现,中龄与成龄的梭梭(Haloxylonammodendron)根系距地下水位50 cm处时通过毛细管和地下水相连接,土壤含水率分别为4.03%和4.59%,由于根不再下扎而是转向水平方向延伸生长,故推测4%—5%左右土壤含水量会对梭梭根系生长产生明显的抑制作用。
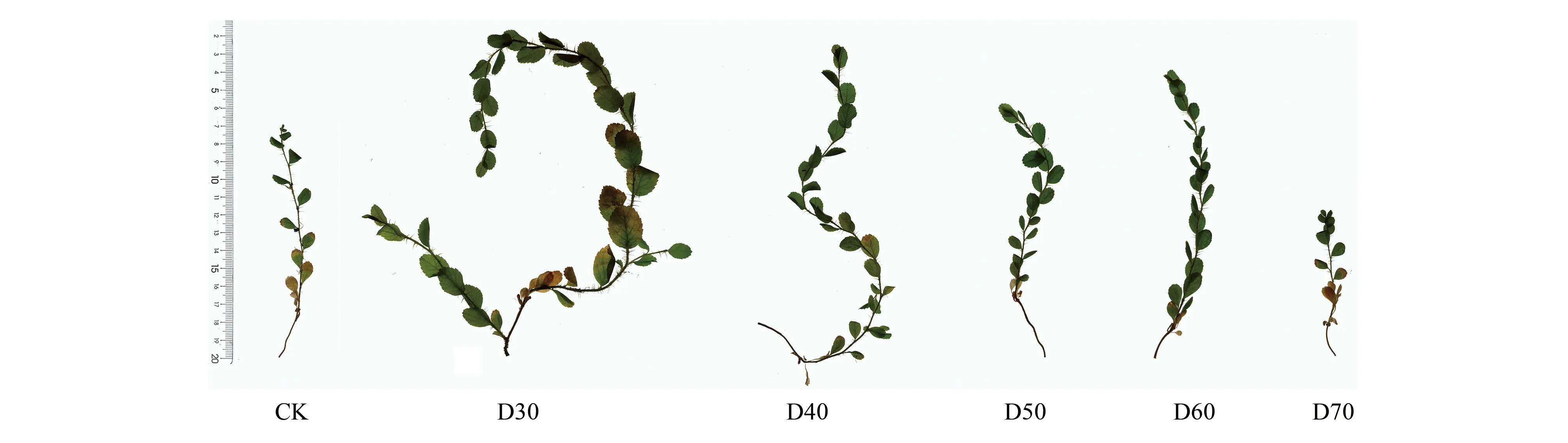
图7 第75天时单叶蔷薇幼苗地上部分对比Fig.7 Comparison of above-ground parts of Rosa persica seedlings on the 75th day
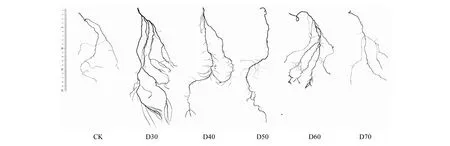
图8 第75天时单叶蔷薇幼苗根系对比Fig.8 Comparison of root of Rosa persica seedlings on the 75th day
第75天时CK、D70组幼苗在株高等18个指标中差异均不显著,但是二者之间又有所区别:CK组不设潜水层,所以幼苗面临着严重且持久的干旱胁迫,而D70组设有潜水层,一方面土壤本身通过毛细现象可以向表层土运输水分[30],另一方面幼苗增加扎根深度、根尖和分支数量,利用根尖的根毛区来吸收水分[31],所以D70组在总根长、根表面积、根体积等指标上始终高于CK。这进一步说明适度的干旱可以促进单叶蔷薇幼苗根系的生长,从而使植株表现出较强的抵抗能力[32—33]。
抗旱性的形成是植物形态结构和生理生态功能对干旱环境适应的结果[34]。当受到干旱胁迫时,植物通常会降低生长速率来减少对水分的消耗,同时将更多的光合产物分配到根系以增强自身竞争能力,提高获取土壤水分的能力,从而达到投资收益率最大化[35]。试验组和对照组的单叶蔷薇幼苗一方面调整根系形态,即增加总根长、根表面积、根体积和分支数量,另一方面通过提升根系干物质量来应对干旱,使得根系支撑、分布范围和单位根系所占的土壤空间不断扩大,可以更有效地利用土壤中的水分,符合生物量分配理论。从整体来看,D50、D60、D70和CK可以通过增加根冠比应对干旱,而D30、D40的根冠比经历了先升高后下降的过程,说明干旱胁迫最终得以解除,已不再需要过多地投入在根系干物质上,进而转向地上器官的生长,这都表明了单叶蔷薇幼苗对水分胁迫响应的敏感性和整体性,可以灵活调节生物量分配模式来更好的适应异质性环境。
3.2 单叶蔷薇幼苗根系形态对潜水埋深的响应
比根长和比根面积是指示根系功能的重要指标,可综合反映植物吸收资源的能力与生态适应性[36],值越大表明投入相同的成本会产生更高的养分利用效率[37—38],裸果木(Gymnocarposprzewalskii)[39]、枫香(Liquidambarformosana)[40]、杉木(Cunninghamialanceolata)[52]等即是通过增加比根长和比根面积来应对干旱胁迫。但也有些研究指出:当土壤水分缺乏时,植物根系组织密度增大,导致比根长、比根表面积会减小[41]。本研究中,单叶蔷薇幼苗在比根长、比根面积两个指标上随胁迫时间呈整体下降,根组织密度、分支密度增大,这与李金航等[26]研究结果一致,杨洁等[42]认为这可能是试验处理和水分梯度不同导致的结果,Zhou等[43]认为这是植物在干旱胁迫下保存水分的策略之一,还有待深入探究。
粗根(d≥2 mm)被称为结构性根,细根(d<2 mm)又称为功能性根,后者主要是从土壤中吸取营养物质和水分,同时也是菌根形成的场所[44]。细根生理代谢极其活跃,它总是处于不断地产生-生长-衰老-死亡-再生的周转过程中,而该过程可使得植物地上与地下部分生物量得到重新分配[45],同时逆境下的细根通过主动死亡减少呼吸作用造成的能量消耗、释放大量营养物质以改良土壤,最大限度地确保植株存活生长,这是植物对环境胁迫的适应机制[46]。本研究中的单叶蔷薇幼苗根系主要由细根构成,G1+G2+G3径级总根长、根表面积、根体积始终占整个根系比例的80%以上,有时甚至占到100%;单叶蔷薇幼苗细根的生长并非都表现为单一的被促进或抑制,而是与胁迫程度有关,如在前60天内,G1径级(0—0.50 mm)的细根又在整个根系中占有支配地位(69%以上),原因可能是单叶蔷薇幼苗处于严重的干旱胁迫时,可通过增加代谢活跃的G1径级(0—0.50 mm)细根来提高吸水能力,同时以自身的死亡完成物质的再分配,增加根系资源利用效率,进而应对不利的生长环境。干旱胁迫下的春玉米(Zeamays)[47]、黄栌(Cotinuscoggygria)幼苗[48]也有类似现象。至第75天时,除了CK和D70外,其他组的G1径级占比均下降,G2+G3径级(0.50—2.00 mm)的细根总根长、根表面积、根体积占比伴随着干旱的基本解除和根系木质化而得以增加。
3.3 单叶蔷薇幼苗拓扑结构和分形维数对潜水埋深的响应
根系的空间分布决定植物对土壤的探索范围和对土壤资源可用性进行动态响应的能力[49—50]。基于根的连接和分支点的排列,Fitter等[51]总结出两种根系拓扑结构类型,即人字形分支和二叉状分支,并且通过拓扑指数来反映不同植物根系的分支模式。不同处理下的单叶蔷薇幼苗根系拓扑指数保持在0.8—0.9之间,潜水埋深影响较小。虽然人字形分支模式根系建成成本高,但是根系内部竞争小,是植物对营养匮乏生境的适应,有利于获得更深土壤中的水养资源[52]。分形理论是对根系构型定量化研究的新方法,根系分形维数越大,分支越多;相反,分形维数越小,反映出根系的分支能力相对越弱[7]。本试验中,D30处理下的根系分形维数表现出先升后降再升的趋势,在分支数量、根尖数量两个指标的变化中得以验证,尤其是第60—75天时,D30组分形维数再次上升,分支能力加强,这最终也导致了D30的拓扑指数下降,有向叉状分支模式(Ti=0.5)过渡的发展趋势,未来可以延长D30等处理的观测时间,进一步探究单叶蔷薇幼苗根系在水分充足的条件下有无发生叉状分支的可能性。虽然CK、D70组幼苗在分支数量、根尖数量上整体保持缓慢增长,但与第一次采样相比两组的分形维数均出现下降,说明后期的单叶蔷薇幼苗根系分支能力相对减弱,这可能是受长期干旱导致的结果,其植株枝叶受胁迫表现更为明显(图7)。
3.4 单叶蔷薇幼苗表型可塑性对潜水埋深的响应
可塑性在自然界中广泛存在,按性状类型可分为形态可塑性、生理可塑性、行为可塑性、生活史可塑性等,是植物适应环境变化的最直观的策略之一[53]。表型可塑性是指同一基因型的物种应对异质生境而改变表型性状的能力[54]。表型可塑性强的植物往往具有更强的适应性和更宽的生态幅,占据更大范围的生境,从而成为广幅种[55]。杨宁等[56]研究发现,林下、中林窗、大林窗等4种不同林冠环境中,林缘旷地的箭竹(Sinarundinariabasihursuta)地下茎、粗根、细根生物量百分比均最高,分株形态差异显著;叶子奇[57]对干旱区河漫滩胡杨根系生长与形态适应对策进行了研究,发现当年生胡杨幼苗根系构件(主根、侧根、末端根)即可对干旱胁迫表现出不同程度的响应,尤其是在重度干旱胁迫下,幼苗根冠比和根构型变化相当显著。面对70 cm潜水埋深和对照组带来的长久干旱时,单叶蔷薇幼苗仅在地上干物质、根系干物质、根尖数量和分支数量4个指标上有较大的可塑性(0.70—0.80);相反,最强的表型可塑性发生在D30组株高、扎根深度、地上干物质、根系干物质、总根长、根表面积、根体积、根尖数量、分支数量9个指标上(0.793—0.955),这说明单叶蔷薇幼苗根系在第一年内就可发生功能分化,形态可塑性、分配可塑性极为显著。占据多样的生境或最大限度地达到表型与生存环境的一致性,可以有效缓冲环境对植物生长和生殖产生的消极影响,从而可以避免成为生态角度上的脆弱小种群,避免造成遗传瓶颈[58]。
4 结论
潜水埋深可以显著影响单叶蔷薇幼苗的生长发育,幼苗可通过改变根系形态、增加扎根深度、提高根系生物量等根系构型特征来应对中短期的干旱胁迫,深层潜水和CK处理下的幼苗还通过扩大根冠比来适应更长久的干旱环境。从资源分配的角度来看,单叶蔷薇幼苗为减少碳消耗而采用相对简单化、内部竞争较小的人字形分支结构,短而细的密集横向分支(0—2 mm细根为主)成为根系扩大土壤资源获取效率的活性位点,从而保障植株生长发育的物质供需平衡,这是单叶蔷薇对环境胁迫的适应性策略。适度的干旱,如50—70 cm的潜水埋深,可以促进单叶蔷薇幼苗扎根深度,而单叶蔷薇幼苗在较浅的潜水埋深(30—40 cm)环境中能快速解除干旱,更好的进行地上器官的生长发育,具体表现为在在株高、总根长、根表面积、根体积、根尖数量、分支数量、根组织密度、分形维数和地上、地下干物质10个指标上与CK组差异显著,这表明单叶蔷薇幼苗对异质性环境具有极高的适应能力,表型可塑性强。

