银基纳米合金的抗菌应用进展
马 敏,常江南,杨润良,杜继远,孙 琳,李明雪
(河南大学 化学化工学院,河南 开封475004)
“ESKAPE”超级细菌对人类的健康造成很大的威胁,主要包括多重耐药(MDR)肠球菌、金黄色葡萄球菌、鲍曼不动杆菌、铜绿假单胞菌、肺炎杆菌和肠杆菌物种等[1]。从1967年开始,MDR肺炎链球菌就快速增长,在2000年增长率达到85%[2]。由于不规范地使用大量抗生素,超过70%的细菌可以抵抗一种以上的抗生素[3]。因此,研究较为新颖的抗菌方法是迫在眉睫的。
贵金属纳米材料因其可调控的理化特性,所以在临床上实现了广泛的抗菌应用。其中,具有不同形状和尺寸的银纳米结构对感染细菌显示出潜在的应用前景[4]。由于银对核酸、蛋白质等细胞内外含氮和硫的生物分子具有高亲和力,从而影响细胞活动,导致细胞死亡。银纳米结构表现出尺寸依赖性的抗菌效率。银纳米粒子(Ag-NPs)越小,抗菌效率越高。当银纳米结构的尺寸超过40 nm时,内吞作用变得困难,生物可利用的Ag+量保持裸露[5]。当尺寸相同时,带正电荷表面的银纳米颗粒比带负电荷的纳米颗粒具有更强的抗菌活性[6]。虽然可以通过控制银纳米结构的尺寸和表面电荷来提高抗菌效率,但由于Ag-NPs的不稳定性而容易发生聚集现象[7]。这种聚集使银纳米材料更少地进入细菌,也减少了细胞间Ag+的含量。而紫外线也会驱动Ag-NPs的聚集,这是因为银纳米材料的紫外波段和吸收波段之间的光谱重叠,引起了振荡偶极-偶极相互作用[8]。

1 银纳米合金的抗菌机理
银纳米合金由于其纳米粒子可以通过多种配位键(包括Ag-N、Ag-S与膜蛋白结合)附着在细菌表面而广泛应用于抗菌领域。表面带正电荷的纳米颗粒具有强吸收性,有助于纳米粒子进入细菌细胞质。在细胞质中,银纳米合金被氧化并以Ag+的形式释放。此外,Ag、Au纳米合金的内源催化也可以产生ROS[12],直接作用于细菌,实现抗菌的目的。并且,细胞内过量ROS会引起一系列的反应导致细菌死亡,例如:氧化损伤,氧化应激和膜脂过氧化。此外,它还可以破坏细菌的细胞膜使细胞内的DNA、蛋白质等成分渗透出来,与银原子或Ag+进行协调作用,导致细胞代谢紊乱。
2 银纳米合金的抗菌效果
银纳米结构的易氧化的特性导致了它们的不稳定性和潜在毒性,这一缺点可以通过加入另一种贵金属来进行改善。例如,在高盐介质中,单层金原子涂层不仅可以提高银纳米片的稳定性,而且可以持续释放Ag+,增加其抗菌活性。Wang等[13]比较了具有不同Au/Ag比例的金银纳米笼(GSNCs)的抗菌性能,结果表明金银纳米合金中金含量的增加可以实现较强的抗菌效果。这由于GSNCs表面带正电荷,导致了细菌细胞壁破坏、细胞膜破裂和损害细胞间活动。然而,它没有考虑Ag+释放的差异性。此外,还评估了具有不同Pt比例的Pt/Ag合金纳米颗粒的生物效应[14]。发现Pt/Ag合金(10% Pt)对细胞代谢有明显的不利影响,而Pt/Ag合金(≥50% Pt)与纯Ag-NPs相比具有较低的细胞毒性,并且提高了抗菌活性。这些结果表明提高Pt的含量可以防止银的氧化和释放。
Koller等[15]在Au或Ti薄膜上制备Ag点阵列并比较它们的抗菌效果,钛膜作为对照组。由于牺牲阳极效应,Ag-Au薄膜表现出比Ag-Ti薄膜更高的杀菌效果。表明金膜上释放较多的银离子和具有更强的杀菌活性(图1a)。这是因为耦合Au和Ag纳米材料,形成Ag为阳极,Au为阴极的原电池结构,促进Ag+的释放。在原电池结构中,Ag形成合金后失去电子。然而,Ag也可以接受来自其他贵金属的电子,在它们的界面处形成抗氧化状态,这称为“电子补偿效应”。这种效应与氧化Ag的牺牲阳极效应不一样,它与其他贵金属转移到Ag的平均电子密度密切相关[16]。例如,尽管纳米片和纳米笼都具有核@壳(Ag@Au)结构,但纳米片界面处的银可以接受更多由金层提供的电子。因此,Ag-Au纳米片中的电子补偿作用比纳米笼强。
此外,两种金属元素的分布决定抗菌效果。例如,与Ag-NPs相比,共溅射的Ag50Pt50合金不仅具有低细胞毒性而且具有高抗菌活性。也没有观察到Ag+释放的增加,表明牺牲阳极效应没有增强[17]。然而,连续溅射的Ag-Pt纳米片的牺牲阳极效应可以提高银纳米片的抗菌活性,这些结果可以通过不同的分布方式来解释(图1b)[18]。连续溅射的Ag-Pt合金具有清晰的界面,增强了牺牲阳极效应。同时,在共溅射Ag-Pt结构中,Pt元素中的电子可以均匀地分裂Ag原子,从而增加电子补偿效应和降低牺牲阳极效应。总之,良好的Ag-Pt结构具有加速Ag+的释放和抗菌作用。
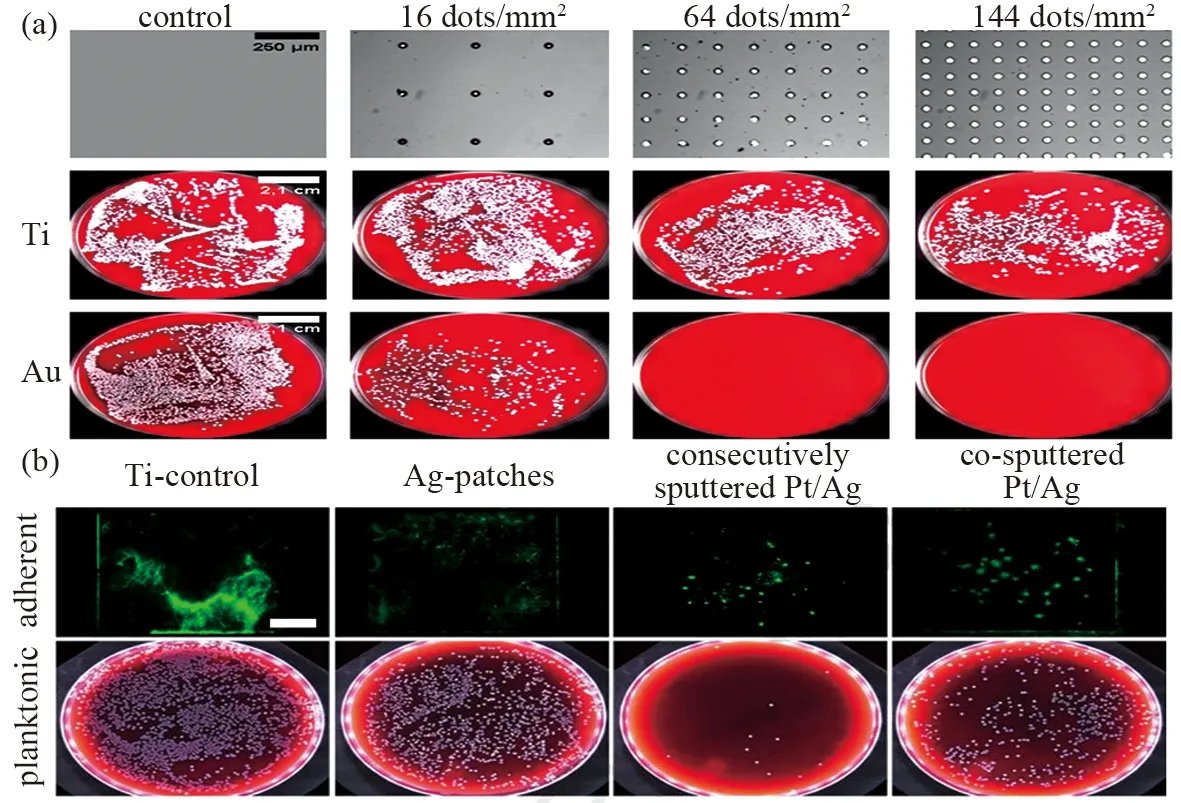
图1 用贵元素涂覆后增强Ag+释放的机制:在Au或Ti薄膜上制备Ag点并比较它们的抗菌效果[15](a)、连续溅射和共溅射Ag-Pt合金的抗菌效率比较[18](b)
3 银纳米合金的光热抗菌应用
虽然Ag+具有不可逆的杀菌效果,但还有一些新兴的银纳米材料耐药菌株。最初的抗银菌株存活下来主要是将有毒的Ag+还原为Ag单质或通过P型腺苷三磷酸酶或通过化学渗透的Ag+/H+逆向转运蛋白流出银物种。当Ag-NPs长期暴露时,芽孢杆菌和沙门氏菌适应了细胞氧化应激刺激,表现出银抗性决定因子(SilB)[19]。银基纳米材料与相应的化学或物理策略相结合可以增强其抗菌效率。当核尺寸小于2 nm时,金属纳米簇(即Ag、Au和Au@Ag纳米簇)可表现出对抗多重耐药菌性。亚纳米尺寸赋予了金属纳米团簇快速扩散,细菌容易内吞以及模拟氧化酶/过氧化酶特性以产生ROS[20]。此外,大多数纳米团簇在体内也具有强而稳定的发光特性,可以追踪它们与细菌的相互作用以研究抗菌机制。
光热照射也可以破坏细菌的结构,因为它具有处理时间短、细菌耐药性可忽略不计等优点[21]。这就需要金属纳米材料能有效吸附近红外光。虽然大小约为40 nm的Au-NPs的SPR峰值位于550 nm处[22],但它可以通过将金沉积到不同的银纳米结构上来调整吸附范围。合金中的银核部分被氧化,SPR峰值可以转移到NIR区域[23]。这可以精确地调控Ag-Au、Ag-Pt和Ag-Pd合金的物理化学和光学特性。
对于具有较大尺寸或深度蚀刻的银核GSNCs,SPR吸光度可以调控到NIR区域。在Au框架的形成过程中,Au3+蚀刻了一半的Ag核,从而实现光学特性。此外,用药物和热响应相变材料代替原有的Ag核也可以实现可控的药物释放[24]。以这种方式将抗生素和光学特性协同有利于实现抗菌活性。例如,高度空心的GSNCs可以作为有效的光学特性来破坏808 nm照射下的细菌膜。而细菌预处理的巨噬细胞膜涂覆在GSNCs上,显示出对感染细菌的个性化靶向能力(图2a)[25]。为了增强抗菌性能,在808 nm照射下具有光学特性效应的GSNCs与达托霉素和抗体相结合,靶向MRSA表面的葡萄球菌蛋白A。菌种靶向特异性和抗菌肽结合NIR疗法证明了对耐药性生物膜是有效的(图2b)[26]。而锚定在GSNCs表面的Dap会在体内循环过程中存在药物传递效率低的问题。虽然这些策略结合了物理(近红外辐射)和生化(抗菌肽)手段,但忽略了纳米笼内银的残留。Qin等[27]近期报道了存在半胱胺时银组分用于感染伤口的治疗。除了银组分的快速释放外,随着SPR从可见光(530 nm)到NIR-II(1 064 nm)区域的转移,半胱胺也可以引起GSNCs的聚集,从而表现出光学特性。因此,基于光学特性和Ag+释放的协同关系,提出了一种广谱抗菌策略来有效治疗MDR物种。

图2 GSNCs包裹的金黄色葡萄球菌膜的示意图[25](a)和靶向光活化纳米结构协同光热和抗生素治疗金黄色葡萄球菌的机制示意图[26](b)
4 具有高抗菌活性的多孔Ag-Pt和Ag-Pd合金
Pt或Pd纳米材料是最有前景的抗菌剂,因为它们可以在氧化Ag模板上原位催化产生ROS以干扰细菌的代谢[28]。使用Pt或Pd基纳米材料来加速H2O2转化为对致病菌有毒的羟基自由基(·OH)来实现抗菌目的。
用硝酸对不同Pt/Ag比率的Pt/Ag-NPs进行了Ag合金的蚀刻。在酸性环境中存在H2O2时所获得的多孔Pt50Ag50结构具有与ORR抗菌效率有关的酶模拟活性(图3a)[17]。虽然Pt50Ag50具有易蚀刻性质,但其他Pt/Ag比值的合金效率较低,这是由于Pt75Ag25中的Pt屏障以及Pt25Ag75中Pt不足。对于Ag-Pd合金,Gao等[29]合成了具有不同Pd含量的核@壳合金纳米笼。选择AgPd0.38合金作为导管的涂层添加剂,能够抑制生物膜形成(图3b)。AgPd0.38纳米笼利用细胞内的H2O2和O2产生表面结合的ROS,毒性作用限制在20~200 nm。而纳米笼表面产生的ROS对宿主哺乳动物细胞表现出裸露的毒性,会对病原菌造成有效损伤。

图3 氧化酶样AgX(X=Pt(a)或Pd(b))合金产生活性氧以对抗病原体
在Pt-Ag合金中,Pt和Ag原子是交错分布的,没有明确的边界。因此,在蚀刻Ag核后形成多孔结构,提高了表面积与体积的比率。然而,Pd-Ag纳米笼是通过GR反应产生的,形成清晰的核壳结构。而且Pd-Ag纳米笼中的Ag核容易氧化和释放,留下薄而多孔的Pd壁。因此,银被认为是产生多孔结构的理想模板,但它也可以被其他元素取代。例如,Pt-Pd核框架纳米晶体分两步制备,即Pt原子的选择性生长和FeBr3对Pd原子的化学蚀刻。这种纳米晶体结构提供了特别活跃的小平面和大表面积,通过过氧化物的酶活性将H2O2分解为·OH,表现出优异的杀菌效率。
5 结论与展望
多重耐药性的出现导致细菌对经典抗生素的有效性下降,需要寻找新的抗菌策略[30]。虽然银纳米材料在临床上得到应用,但它仍然面临着许多问题,尤其是抗银病原体的出现。这主要是由于银纳米材料的不稳定性削弱了Ag+在感染部位的释放和积累,使Ag+的含量低于最低杀菌浓度。通过涂覆更惰性的金属形成合金,可以更好的提高稳定性,同时这种涂层可以控制Ag+释放来达到增强抗菌的目的。尽管银合金纳米材料表现出显著的优势,可以作为治疗MDR的潜在抗生素,但仍然有许多工作需要进一步改进,特别是在临床应用方面。因此有必要对其抗菌机制、细胞毒性和可调控的理化性质等进行更深入系统的研究,为制备高效、低毒、低生产成本的新型抗菌材料提供理论指导。

