淫羊藿种子变温层积过程中胚形态及生理生化变化
徐宠然, 葛 慧, 贾袭伟, 李 飞, 久西加, 赵 鑫, 张 妍, 陈红刚,2, 杜 弢,2*
(1.甘肃中医药大学药学院, 甘肃 兰州 730000; 2.甘肃中医药大学西北中藏药协同创新中心, 甘肃 兰州 730000)
淫羊藿(EpimediumbrevicornuMaxim.)为小檗科(Berberidaceae)淫羊藿属(EpimediumLinn.)多年生草本植物,全草入药,是常用中药之一,其性温,味辛、甘,入肝、肾二经。《本草纲目》谓其有益气、坚筋骨、补腰膝、强心力等功效[1],主治阳萎早泄、腰酸腿痛、四肢麻木、半身不遂、神经衰弱、健忘、耳鸣、目眩等症[2]。淫羊藿苷是淫羊藿的主要活性物质之一,对骨质疏松、阿尔兹海默病、帕金森、脑缺血、动脉粥样硬化、风湿病等多种疾病均有显著改善作用[3]。淫羊藿药材的市场需求不断扩大,但因其种子存在休眠现象,发芽率低且生长缓慢[4],导致其野生资源日渐匮乏,目前已被列为近危植物(IUCN标准)。
种子休眠是指具有生活力但在适宜的环境条件下经过一段时间后仍不能发芽的现象[5]。层积过程中种胚的发育和生理生化的变化是种子休眠解除的重要途径。变温层积通过促进胚形态发育、萌发物质的转化及能量积累从而解除种子休眠,这在北五味子[6]、圆齿野鸦椿[7]等植物种子上已有验证。在层积过程中,通过营养物质的水解与转化,促进种胚生长发育,为打破休眠奠定了形态基础。同时,呼吸途径相互转化也是种子休眠解除的关键条件,呼吸途径论指出,种子休眠解除是呼吸代谢糖酵解途径(EMP)和三羧酸循环(TCA)途径向磷酸戊糖途径(PPP)转化的结果[8]。另外,激素是植物自身合成的具有调节种子休眠和萌发的有机物质。在植物体内已发现生长素类、赤霉素类、细胞分裂素类、脱落酸和乙烯等激素,对植物的生长发育发挥调控作用[9]。
近年来研究发现,巫山淫羊藿(EpimediumwushanenseYing)[10]种子存在胚形态及生理后熟。朝鲜淫羊藿(EpimediumkoreanumNakai)种子在自然层积的条件下种胚发育快,率先完成形态后熟[11]。王晶等[12]研究表明变温层积处理可加速胚的发育,同时减少胚乳中萌发抑制物质含量,随着层积时间延长,朝鲜淫羊藿种子胚率和活力显著增加,变温层积5个月胚的活力达到95%。同时研究表明淫羊藿种子同样具有休眠现象[13],韩伟等[14]研究认为低温层积淫羊藿种子有利于种子内大分子营养物质降解,促进胚的进一步发育,然而目前对于淫羊藿种子有关变温层积的研究未见报道,变温层积对其种胚发育及生理生化特性的影响仍不明确。因此,本研究通过对淫羊藿种子进行变温层积处理,测定不同层积时间种子胚形态及生理生化物质的动态变化规律,旨在探究淫羊藿种子胚形态变化及生理生化物质之间的内在联系,为今后研究淫羊藿种子变温层积提供理论依据。
1 材料与方法
1.1 试验材料
淫羊藿种子于2020年7月采于甘肃中医药大学和政药用植物园(35°15′48″ N,103°24′21″ E),由甘肃中医药大学杜弢教授鉴定为淫羊藿种子。采收后揉搓去除外种皮,再过筛剔除瘪粒,自然阴干。
1.2 试验方法
1.2.1种子变温层积处理 将河沙洗净过筛(40目),高压灭菌锅灭菌(121℃,30 min),铺至距容器底部3~4 cm处,将淫羊藿种子装入纱布网袋,平铺于河沙之上,再覆盖3~4 cm河沙,保证种子处于容器中部,沙子湿度为9%~11%,用保鲜膜封住容器,打孔透气。第1~90 d将容器放置于室内(20~25℃),第91~150 d置于4℃冰箱中。每隔30 d取样一次,样品置于—80℃冰箱保存,用于生理生化指标测定。
1.2.2种子胚形态及胚率观测 从各层积时期样品中分别随机选取15粒种子,蒸馏水浸泡24 h,OCT胶水常温包埋10 min,冷冻包埋5 min(-20℃),Leica-CM1950型恒冷切片机切片(厚0.12 mm),0.1%固绿醇溶液染色30 s,LeicaDM 500显微镜观察种子形态结构,测量胚长和种子长,并用如下公式计算胚率。
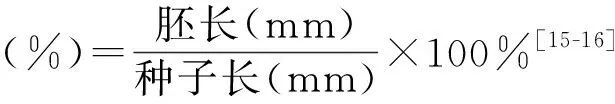
1.2.3种子营养及生理生化指标测定 淀粉含量、可溶性蛋白质含量、可溶性糖含量均采用试剂盒(南京建成)测定,具体操作按试剂盒说明进行。葡萄糖-6-磷酸脱氢酶(G-6-PD)活性、赤霉素(GA)含量、吲哚乙酸(IAA)含量、脱落酸(ABA)含量均采用ELISA酶联免疫法试剂盒(上海钦诚)测定,具体操作按试剂盒说明进行。
1.2.4数据分析 使用SPSS 25.0软件进行方差及相关性分析。
2 结果与分析
2.1 淫羊藿种子胚形态、胚率变化
淫羊藿种子存在形态后熟现象,即种子在采收后种胚尚未发育完全,且种子成熟度不一致。在常温层积过程中由球形胚阶段逐渐发育为心形胚阶段,低温层积中种胚继续发育,最终达到子叶期胚阶段(图1A~1F)。

图1 淫羊藿种胚形态Fig.1 Embryo morphology of Epimedium brevicornu Maxim.注:A.未层积;B.层积30 d;C.层积60 d;D.层积90 d;E.层积120 d;F.层积150 dNote:A. non stratification;B. stratification 30 d;C. stratification 60 d;D. stratification 90 d;E. stratification 120 d;F. stratification 150 d
胚率在整个层积过程中总体呈上升趋势(图2)。常温层积期间(1~90 d)胚率呈现阶梯式增长趋势,30~60 d期间显著升高(P<0.05),胚率在低温层积(90~150 d)期间显著升高(P<0.05),并在层积150 d时达到最大值(73.30%)。
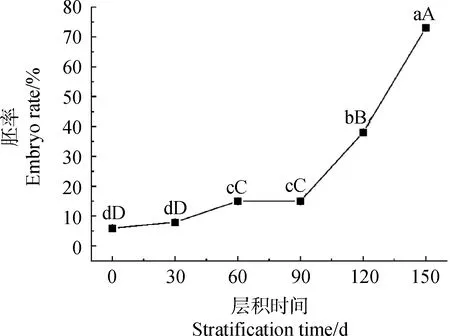
图2 不同层积时期淫羊藿种子胚率变化Fig.2 Changes of embryo rate of Epimedium brevicornu Maxim. seeds in different stratification periods注:不同小写字母表示处理时间之间在0.05水平差异显著(P<0.05);不同大写字母表示处理时间之间在0.01水平差异显著(P<0.01)。下同Note:Different lowercase letters indicate that there are significant differences between treatment times at the 0.05 level;Different capital letters indicate that there are significant differences between treatment times at the 0.01 level. The same as below
2.2 营养物质含量的变化
变温层积过程中,种子内营养物质含量变化显著(图3)。可溶性蛋白质含量整体呈上升趋势,层积150 d时的含量(58.47 mg·g-1)约是处理前(7.22 mg·g-1)的8倍。可溶性蛋白质含量在常温层积(1~90 d)期间含量显著升高(P<0.05),在层积30 d时含量增加量最大,并在90 d时达到最大值(62.53 mg·g-1),进入低温层积(90~150 d)后,含量逐渐下降(图3A)。
随着层积时间的延长,可溶性糖含量先下降再上升,最后再下降,最终含量(59.34 mg·g-1)较处理前(78.68 mg·g-1)减少约24.58%。可溶性糖含量在层积的前60 d含量下降显著,60~120 d期间小幅上升后保持平稳,层积的后30 d显著下降(P<0.05)。
淀粉含量在层积的前30 d显著下降(P<0.05),并在30 d时达到最小值(25.77 mg·g-1),此后逐渐上升,至层积150 d时与初始含量基本持平(图3B)。
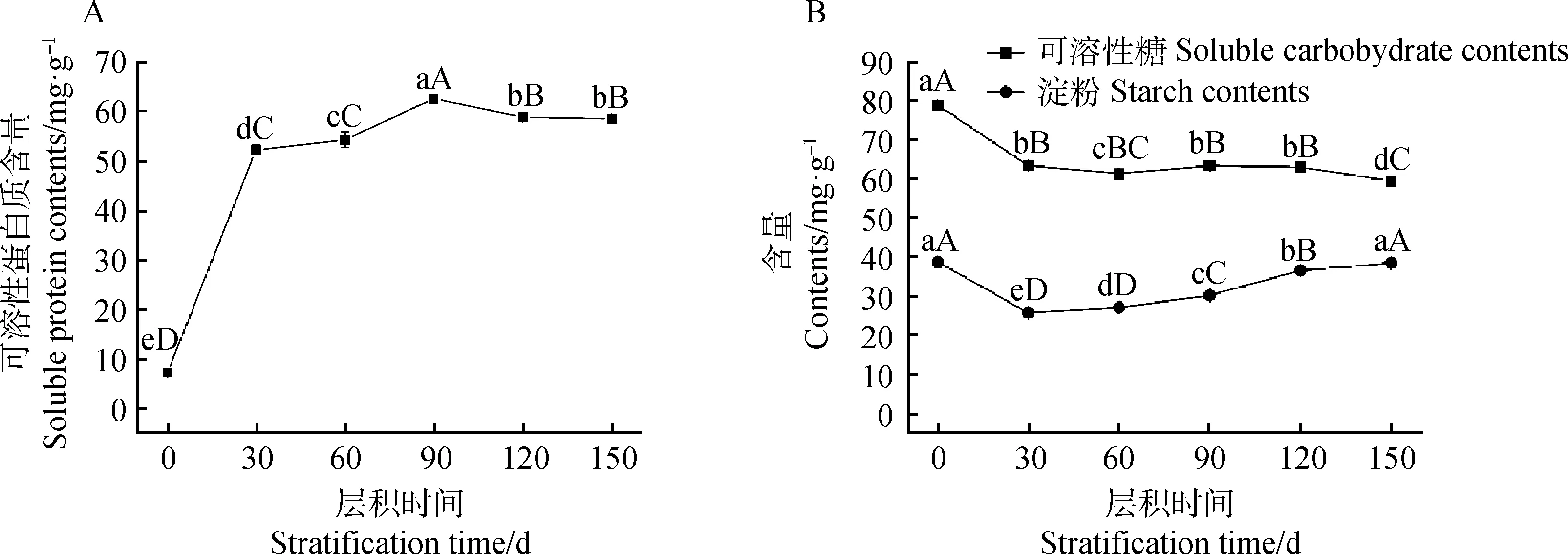
图3 淫羊藿种子层积过程中营养物质含量变化Fig.3 Changes of nutrient content in seeds of Epimedium brevicornu Maxim. during seed stratification
2.3 呼吸途径关键酶活性变化
在变温层积过程中,种子内葡萄糖-6-磷酸脱氢酶(G-6-PD)活性整体呈升高趋势。层积的前30 d内上升显著(P<0.05),后期在26.36~30.80 U·gprot-1范围内波动。层积150 d时G-6-PD活性(28.80 U·gprot-1)较处理前(22.90 U·gprot-1)增加约25.77%(图4)。
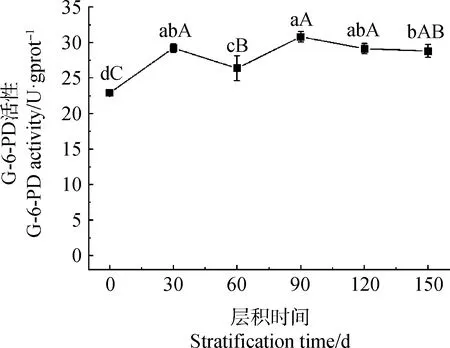
图4 淫羊藿种子层积过程中葡萄糖-6-磷酸脱氢酶活性变化Fig.4 G-6-PD activities in respiratory pathway of Epimedium brevicornu Maxim. seeds during seed stratification
2.4 内源激素含量变化
变温层积过程中,种子内吲哚乙酸(IAA)含量整体呈上升趋势。IAA含量在层积的前30 d升高显著(P<0.05),后期在20.52~22.36 ng·g-1范围内小幅波动,并在150 d时达到最大值(22.36 ng·g-1),较处理前(18.39 ng·g-1)显著增加约21.63%(图5 A)。
赤霉素(GA)含量整体呈上升趋势。GA含量在层积的前90 d内平稳上升,90~120 d期间显著上升(P<0.05),并在120 d时达到最大值(109.47 ng·g-1),而后下降,但最终含量(94.89 ng·g-1)依然较处理前(70.29 ng·g-1)显著增加约35.01%(图5 B)。
脱落酸(ABA)含量在层积的前30 d迅速升高,30~120 d期间在157.66~172.52 ng·g-1范围内小幅波动,后显著下降(P<0.05)(图5C)。
各内源激素含量间比值在常温层积(1~90 d)过程中呈下降趋势,在低温层积(90~150 d)过程中呈上升趋势,并始终表现为(GA+IAA)/ABA最大,GA/ABA次之,IAA/ABA明显小于前两者,且变幅较小(图5D)。
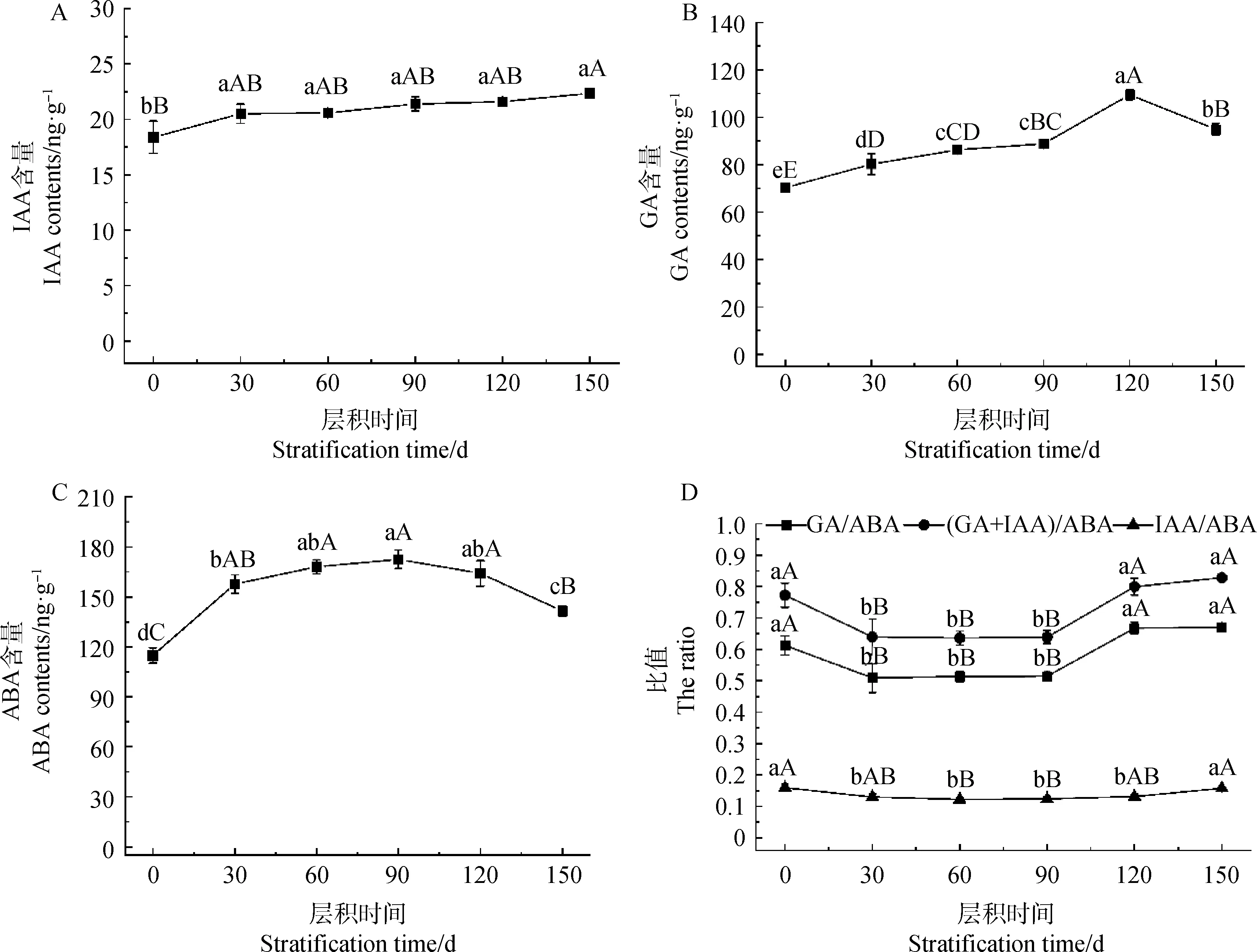
图5 淫羊藿种子层积过程中内源激素含量及其比值的变化Fig.5 Changes of endogenous hormone content and their ratios in seeds of Epimedium brevicornu Maxim. during stratification
2.5 影响胚率的关键生理特性分析
层积过程中生理生化指标与胚率的相关分析表明(表1),除可溶性糖外,其他生理生化指标均与胚率呈正相关关系,其中淀粉(r=0.539)、GA(r=0.615)、IAA(r=0.652)含量与胚率呈显著正相关关系。

表1 各指标与胚率的相关性分析Table 1 Correlation analysis between each index and embryo rate
3 讨论
3.1 后熟与种胚形态的关系
研究表明,休眠分为生理休眠、形态休眠、形态生理休眠、物理休眠和综合休眠5种休眠类型,其中种胚形态尚未发育完全被称为形态休眠[17]。老山芹种子存在形态后熟现象,在层积过程中,种胚由心形胚及鱼雷胚阶段,逐渐发育为子叶胚阶段,完成形态后熟过程[18]。本研究结果表明,淫羊藿种子由于种胚尚未发育完全,种子在层积处理前多数为球形胚,具有形态休眠,淫羊藿种胚在变温层积过程中伸长发育,层积后胚率显著上升(P<0.05);胚形态在层积过程中由最初的球形胚发育为心形胚最后形成子叶胚。此结果与铁筷子[19]和东北刺人参种子[20]在后熟过程种胚的发育过程相似。
3.2 后熟与营养物质转化的关系
种子在打破休眠的过程中,伴随着内部营养物质含量的变化。淀粉是植物体内重要的储藏物质,在维持碳水化合物供需平衡中起到重要作用。可溶性糖是代谢的中间产物,它是由淀粉降解产生,同时又作为呼吸底物被消耗,因此,可溶性糖含量的高低既与淀粉降解的速度有关,又与呼吸消耗的速度有关[21]。可溶性蛋白质是部分细胞结构的基础物质,在种子生长发育中起到提供氮素的重要作用,为种胚的生长提供物质能量[22]。
在本试验的变温层积过程中,淫羊藿种子内淀粉含量先降低后升高,其含量在层积前后无显著差异,可溶性糖含量下降,可溶性蛋白质含量显著上升(P<0.05)。在层积的前30 d种子内淀粉含量显著下降(P<0.05),说明在变温层积前期淀粉酶加速对淀粉的分解,种子内代谢活动加强,种子对营养物质的需求量增加,淀粉被转化成可溶性糖等物质,为种子萌发提供养分。随着层积天数的增加,种子内的淀粉含量逐渐上升,原因是淫羊藿种子内部储存能量,为种子萌发提供物质基础,此结果与薛晨阳对黄精种子的研究结果相似[23]。结果显示种子内淀粉含量在层积30~150 d期间显著上升(P<0.05),种子胚率在此阶段同样呈上升趋势,且相关性结果表明淀粉含量与胚率呈显著正相关关系(r=0.539),说明淀粉积累可能利于胚形态发育,淀粉含量的升高,对种子打破休眠、促进萌发有一定的促进作用。可溶性糖在层积前期含量显著减少(P<0.05),是因为种子中呼吸消耗的速度(即种子中被消耗的可溶性糖)大于种子中淀粉降解的速度(即种子中产生的可溶性糖),可溶性糖分解产生能量,供应给种子维持正常的生理活动,在60~120 d期间,可溶性糖含量小幅上升,表明层积过程中种子内大分子营养物质分解为可溶性糖,为种子萌发做准备,120~150 d含量显著降低(P<0.05),可溶性糖逐渐分解,为种子萌发提供能量,假色槭种子在层积过程中可溶性糖含量同样为先下降再上升最后下降,总体呈降低的变化规律[24]。可溶性蛋白质含量在淫羊藿种子层积前后显著增加(P<0.05),种子胚率同样显著增加,可能与可溶性蛋白质是部分细胞结构的基础物质,在种子生长发育过程通过提供氮素,为种胚的生长提供物质能量有关。这与王妮妮等对天女木兰种子进行室内控制变温的研究结果一致[25]。
3.3 后熟与呼吸代谢的关系
氧化调节学说认为植物体内有三条最基本的呼吸代谢途径,具体为糖酵解途径(EMP)、磷酸戊糖途径(PPP)、三羧酸循环途径(TCA)[26]。研究表明种子从休眠到萌发的转变,同时也是EMP和TCA向PPP的转变[27]。G-6-PD作为PPP途径的关键限速酶,一定程度上反映了相应呼吸途径的活化水平。如华重楼种子休眠解除过程中G-6-PD活性提高,促进PPP途径顺利运行,从而促进华重楼种子休眠的解除[28]。杨晓玲等[29]在山楂种子的研究中发现,在种子层积后PPP途径显著加强,并促进了非糖物质的氧化分解。本研究结果表明,在层积处理过程中,作为PPP途径的限速酶,G-6-PD活性显著升高(P<0.05),PPP途径逐渐活化。
3.4 后熟与内源激素的关系
植物激素对种子的休眠萌发具有重要的调节作用,ABA可以诱导种子休眠,它对种子的生理代谢和酶活性有抑制作用,通过影响核酸与有关蛋白质的合成,抑制种子萌发[30]。GA可拮抗ABA的抑制效应,是促进种胚生长,激发种子萌发的物质,通过刺激诱导水解酶,削弱屏障组织(如胚乳或种皮),诱导种子中贮藏物质的储备,刺激胚的生长,以促进萌发,从而打破种子休眠[31]。IAA通过调控ABA,GA的合成和传导影响种子的休眠及萌发[32]。但有关IAA对于种子的休眠与萌发目前尚有不同说法,树莓种子在打破休眠的过程中IAA含量呈上升趋势[33],还有研究表明,IAA具有诱导种子休眠的作用[34]。金银花种子在层积过程中GA,IAA含量呈升高趋势,促进休眠的解除[35]。种子休眠的释放和萌发是多种激素之间相互作用的结果,某一种激素含量和敏感性的变化并不能完成这一复杂的生理过程[36],种子的休眠与萌发不仅与植物内源激素的绝对含量有关,还与各类促生长的激素与抑制生长的激素之间的比例及平衡有关[37]。同时GA与ABA的比值被认为是影响种子休眠的一个重要原因,是植物种子休眠状态的主要调节因素[38]。GA与ABA比值升高会促进种子萌发、解除种子休眠,反之则抑制萌发[26]。司倩倩等[39]研究发现玉铃花种子在打破种子休眠过程中GA/ABA,IAA/ABA均呈升高趋势。张成才等[40]对百蕊草休眠解除的研究也得出类似结论。本研究结果表明,淫羊藿种子在层积过程中GA及IAA含量整体呈现增加趋势,通过拮抗ABA的抑制作用促进种胚生长发育,ABA含量在后期显著降低(P<0.05)。GA/ABA,IAA/ABA,(IAA+GA)/ABA的比值均在低温层积(90~150 d)中显著升高,同时在此阶段种子胚率同样显著上升(P<0.05),说明低温层积中萌发促进类激素比例的增高,是种子打破休眠、促进萌发的关键因素。
4 结论
本研究表明淫羊藿种子存在形态休眠现象;在变温层积过程中种胚发育与淀粉含量、IAA含量、GA含量呈显著正相关关系;营养物质的相互转化为种子打破休眠过程中的呼吸代谢提供能量,并为种子萌发提供物质基础;促生长类激素与抑制生长类激素比值增大,则促进种胚生长发育。综上所述,在淫羊藿种子种胚发育过程中,营养物质及呼吸途径的相互转化、内源激素的合成与传导,有效促进了种子形态后熟,为淫羊藿种子变温层积打破休眠提供理论依据。

