TFEB在海藻糖改善哮喘小鼠肺脏炎症中的作用研究
谢贵会 李 冰 蔡美娟 赵小兵 (枣庄市妇幼保健院儿一科,枣庄 277100)
海藻糖为两分子D-吡喃葡萄糖的异头碳原子上的半缩醛羟基间去水缩合而成的非还原性双糖,存在于霉菌、藻类、干酵母、麦角等,由较低级的生物如酵母、细菌、昆虫和植物合成,也可由人工合成,但在哺乳动物中无法合成。大量实验结果表明,不同应力条件下,海藻糖可稳定生物膜和蛋白结构,有效保护细胞膜和蛋白结构功能,使生物体在异常情况下,如高温脱水、冷冻时,仍保持细胞活性,防止细胞因失水导致的损伤[1-2]。低等生物(如酵母)中,海藻糖可迅速积累,使其在干旱、热休克、氧化应激和蛋白聚集中仍能存活[3]。海藻糖也能保护哺乳动物细胞免受应激损伤,海藻糖赋予细胞较高保水能力,从而保护细胞内细胞器不受水合/脱水作用破坏[4-5]。因此,海藻糖是一种潜在的有益化合物。研究发现海藻糖具有抗氧化功能,并显著降低细胞内大量未折叠或错误折叠蛋白积累,促进β-淀粉样蛋白清除而在神经退行性疾病小鼠模型中发挥有益作用,改善阿尔茨海默病[6-8]。最新研究表明,海藻糖可通过促进细胞内脂滴清除减少肝脂肪变性,促进自噬改善肝损伤[9]。但炎症应激状态下海藻糖的作用尚未阐明。
哮喘又名支气管哮喘,是由多种细胞及细胞组分(如肥大细胞、中性粒细胞等)参与的慢性气道炎症,常伴随气道反应性增高,导致反复发作的喘息、气促、胸闷和(或)咳嗽等症状,多在夜间和(或)凌晨发生,此类症状常伴有广泛而多变的气流阻塞,且免疫支气管哮喘作为最常见的慢性气道疾病,患病率较高[10]。最新流行病学调查显示,50 991例调查人群中支气管哮喘发病率为4.2%,其中并发气道限制的支气管哮喘达1.1%,年龄、吸烟、过敏等均可引发哮喘,因此探索哮喘的发病机制和寻找新的抗哮喘药物刻不容缓[11-13]。本研究通过哮喘小鼠模型检测小鼠肺脏炎症变化,通过给予海藻糖研究海藻糖在哮喘相关气道炎症中的作用,并揭示海藻糖改善哮喘相关气道炎症的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄C57BL/6小鼠购自南京模式动物中心,生产许可证号:SCXK(苏)2019-0005,体质量23~25 g,使用许可证号:SYXK(皖)2018-0032,饲养于SPF级动物房,23 ℃、50%湿度,昼夜周期为12 h。所有动物实验均经枣庄市妇幼保健院伦理委员会审批(IACUC 号:002-0023),严格按照实验动物伦理和3R原则设计、实施动物实验。
1.1.2 试剂与仪器 海藻糖(6138-23-4)、卵白蛋白(OVA,1405-69-2)购自美国Sigma;氢氧化铝(HT-205)购自泰星新材料有限公司(中国);IL-1(H002)、IL-4(H005)、IL-5(H006)、IL-13(H011)以及 IFN-γ(H025)和小鼠OVA 特异性 IgE(OVA-sIgE)试剂盒(H017)购自南京建成生物工程研究所(中国);细胞核/质蛋白分离试剂盒(78833)购自美国赛默飞;TFEB 抗体(13372-1-AP)、CD3 和CD4 荧光标记抗体(10021-1-AP、10031-1-AP)购自美国Proteintech;瑞氏染液(G1040)购自索莱宝(中国);肺脏特异性腺相关病毒TFEB-ShRNA AAV9 及其对照病毒由上海汉恒生物有限公司(中国)构建;超声雾化器(JZ-8B)购自北京九州晟欣科技有限公司(中国)。
1.2 方法
1.2.1 分组与处理 40 只C57BL/6 小鼠随机分为对照组(C组)、哮喘组(AS组)、海藻糖低(TL组)、中(TM 组)、高剂量组(TH 组),每组 8 只,TL 组、TM 组和TH 组从致敏阶段第1 天开始每天灌胃给予0.4、0.8、1.2 ml 质量分数为5%的海藻糖溶液,C组给予等量生理盐水,处理30 d。另取20 只C57BL/6 小鼠随机分为Schamble组(S组)和shRNA组。
1.2.2 哮喘小鼠模型建立 在AS 组、TL 组、TM 组和 TH 组中构建哮喘模型,第 0、10、20 天腹腔注射OVA 和氢氧化铝混合液致敏小鼠,剂量为50 μg OVA 和2 mg 氢氧化铝生理盐水溶液,第30 天雾化吸入2%OVA 2 h,诱导小鼠哮喘状态。C 组致敏阶段腹腔注射等剂量氢氧化铝混合液,激发阶段采用生理盐水雾化吸入作为对照。密切观察小鼠行为状态,判断小鼠哮喘状态,哮喘模型建立期间及模型建立结束后20 d 海藻糖组继续给予海藻糖处理10 d。
1.2.3 标本采集
1.2.3.1 血清收集 2%OVA 雾化激发哮喘48 h后,2%戊巴比妥钠麻醉小鼠,心尖取血,4 ℃、2 000 r/min 离心15 min,收集血清,-80 ℃保存用于后续检测。
1.2.3.2 支气管肺泡灌洗液和肺组织收集 分离暴露肺部,结扎左支气管,静脉留置针气管插管,进入右支气管,向其中反复抽注500 μl 预冷的PBS 缓冲液,回抽获得约200 μl 支气管肺泡灌洗,4 ℃、2 000 r/min 离心15 min,收集上清用于炎症相关因子检测,沉淀立即用于炎症细胞包括嗜酸性细胞、中性粒细胞以及淋巴细胞计数。实验结束后剪切左侧肺组织,取约100 mg 置于4%多聚甲醛固定,其余部分-80 ℃保存用于后续检测。
1.2.4 支气管肺泡灌洗液中炎症细胞计数 取100 μl 预冷的PBS 重悬支气管肺泡灌洗液沉淀,涂片,干燥后进行玻片瑞氏染色,加入瑞氏染液30 min后PBS 缓冲液洗掉多余染液,光学显微镜下进行炎症细胞分类计数,根据细胞形态(尤其是细胞核形态)统计各组嗜酸性粒细胞、中性粒细胞和淋巴细胞差异。
1.2.5 双抗夹心酶联免疫吸附法检测支气管肺泡灌洗液中炎症因子浓度 根据试剂盒说明书检测支气管肺泡灌洗液上清中炎症因子(IL-1、IL-4、IL-5、IL-12、IFN-γ)浓度:预先包被相应捕获抗体的包被微孔中依次加入标本、标准品、HRP 标记的检测抗体,温育并彻底洗涤,底物TMB 显色(TMB 在过氧化物酶催化下转化为蓝色,并在酸的作用下转化为黄色)。颜色深浅与炎症因子浓度呈正相关,酶标仪测定450 nm处吸光度(OD)值,计算样品浓度。
1.2.6 OVA-sIgE 试剂盒检测小鼠肺泡灌洗液及血清中IgE 含量 酶标包被板上加入不同稀释浓度的标准品及待测样品,另设置空白对照孔(不加样品及酶标试剂,其余操作相同),封板膜封板,37 ℃温育30 min,揭掉封板膜,弃液体,甩干,每孔加满洗涤液,静置 30 s 后弃去,重复 5 次,拍干。50 μl/孔加入酶标试剂,空白孔除外,重复温育洗涤步骤。50 μl/孔加入显色剂A,再50 μl/孔加入显色剂B5,振荡混匀,37 ℃避光显色15 min,50 μl/孔加入终止液终止反应(此时蓝色立转黄色),显色,依次测量450 nm处各孔OD值。
1.2.7 肺脏CD4+T 淋巴细胞分离 采用胶原酶分离肺脏中单个核细胞,取各组肺脏组织1 000 mg,剪成小块,Ⅳ型胶原酶消化3 h,反复捶打成单细胞悬液,Percoll 密度梯度离心获得小鼠肺脏单个核细胞悬液,用CD3 和CD4 荧光标记抗体进行流式细胞分选,分选出CD3+CD4+T细胞用于后续检测。
1.2.8 肺脏TFEB 干扰 构建肺脏特异性腺相关病毒TFEB-shRNA AAV9,采用24G导管经小鼠肺呼吸道递送病毒液至气管,1×1011pfu/只,最大程度特异性递送,实现TFEB-shRNA AAV9 在肺脏的高效表达。C 组给予等剂量Scramble-shRNA AAV9,3 d后C组和TFEB干扰组均采用1.2.1和1.2.2方法给予海藻糖和模拟哮喘模型,海藻糖处理剂量为中剂量组,观察TFEB干扰后海藻糖对哮喘改善的影响。
1.2.9 Western blot 肺脏在RIPA 裂解液中振荡研磨匀浆,冰浴,4 ℃、12 000 r/min 离心20 min,取上清作为肺脏总蛋白,-80 ℃保存。根据试剂盒说明提取细胞核和细胞质蛋白,离心后的细胞核蛋白和细胞总蛋白进行SDS-PAGE 电泳分离,转至PVDF膜,加入相应抗体进行免疫反应,化学发光,显影,分析结果。
1.3 统计学分析 采用Prism 6.2软件进行数据分析。计量资料采用表示,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 哮喘小鼠海藻糖处理后行为变化 C 组小鼠表现正常,正常饮食,体质量缓慢增加。哮喘模型组小鼠呼吸加深加快,站立时摇晃,口唇发绀,烦躁,胸部呼吸起伏,腹部肌肉痉挛,频繁点头、抓耳和咳嗽。海藻糖处理组小鼠哮喘症状随海藻糖剂量增加逐渐改善。
2.2 海藻糖显著降低肺脏炎症细胞浸润 AS组小鼠巨噬细胞、嗜酸性粒细胞、中性粒细胞和淋巴细胞数显著高于C组小鼠。与AS组相比,海藻糖处理组小鼠巨噬细胞、嗜酸性粒细胞、中性粒细胞和淋巴细胞数量均呈剂量依赖性降低(P<0.05,图1)。

图1 肺脏炎症细胞分类计数Fig.1 Lung inflammatory cells classification counts
2.3 海藻糖可改善肺脏炎症因子分泌 AS组小鼠支气管肺泡灌洗液中炎症因子IL-1、IL-4、IL-5、IL-13 及 IFN-γ 浓度显著高于 C 组,与 AS 组相比,海藻糖处理组炎症因子IL-1、IL-4、IL-5、IL-12 及IFN-γ浓度均呈剂量依赖性降低(P<0.05,图2)。

图2 支气管肺泡灌洗液中炎症因子浓度Fig.2 Concentrations of inflammatory factors in bronchoalveolar lavage fluid
2.4 海藻糖可改善哮喘小鼠IgE分泌 ELISA检测结果显示,AS 组小鼠支气管肺泡灌洗液中IgE 含量显著高于C组,与AS组相比,海藻糖处理组IgE含量呈剂量依赖性降低(P<0.05),血清IgE 含量变化与肺泡灌洗液相同(图3)。

图3 支气管肺泡灌洗液和血清中IgE含量Fig.3 IgE contents in bronchoalveolar lavage fluid and serum
2.5 海藻糖可促进小鼠肺脏CD4+淋巴细胞中转录因子EB 入核 提取小鼠肺脏CD4+淋巴细胞检测TFEB 在细胞中的定位,结果显示,CD4+淋巴细胞中,随着海藻糖处理剂量增加,细胞中TFEB 表达升高,TFEB 下游分子PGC1α 水平也逐渐升高,表明海藻糖可能通过上调TFEB-PGC1α 轴改善哮喘炎症。对于细胞核中的TFEB,研究发现AS 组小鼠TFEB基本存在于胞质中,细胞核中几乎无TFEB 存在,海藻糖处理后细胞核中TFEB 含量增加,细胞质蛋白中TFEB 含量降低,入核增加(图4),提示海藻糖可能通过促进TFEB入核改善哮喘小鼠肺脏炎症。

图4 细胞核中TFEB含量Fig.4 TFEB content in nucleus
2.6 TFEB 干扰后海藻糖介导的哮喘炎症细胞浸润改善作用消失 TFEB-shRNA AAV9 下敲效果如图5 所示,TFEB-shRNA 显著下调小鼠肺脏中TFEB表达,表明TFEB-shRNA AAV9 下调TFEB 表达有效。与Scramble 组相比,TFEB 干扰组炎症细胞,包括巨噬细胞、嗜酸性粒细胞、中性粒细胞和淋巴细胞数显著增加,即TFEB 干扰后,海藻糖抑制哮喘巨噬细胞、嗜酸性粒细胞、中性粒细胞和淋巴细胞浸润作用减弱(图6),表明TFEB 是海藻糖改善哮喘炎症细胞浸润的重要调控因子。

图5 TFEB-shRNA下敲效果Fig.5 TFEB-shRNA knockdown effect
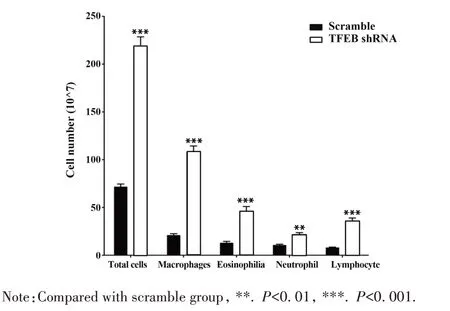
图6 TFEB干扰后肺脏炎症细胞分类计数Fig.6 Lung inflammatory cells classification counts after TFEB interference
2.7 TFEB 干扰后海藻糖对哮喘炎症因子和IgE 的改善作用消失 TFEB 干扰后,炎症因子IL-1、IL-4、IL-5、IL-13及IFN-γ浓度及IgE 水平较Scramble 组明显升高,即海藻糖抑制哮喘炎症因子和IgE 水平的作用消失(图7),表明TFEB 是海藻糖哮喘炎症改善作用的重要介导因子。

图7 TFEB 干扰后支气管肺泡灌洗液中炎症因子和IgE浓度Fig.7 Inflammatory factors and IgE concentrations in bronchoalveolar lavage fluid after TFEB interference
3 讨论
流行病学调查显示,全球范围内哮喘患者人数高达3.4亿,且呈上升趋势,主要与生活环境改变有关,尤其是空气污染以及相关过敏原增加、室外PM2.5 颗粒增加普遍提高了气道对外界刺激物的敏感度[14]。近年我国哮喘患病率逐年提高,最新全国流行病学调查显示我国哮喘患病率为7.7%,尤其是儿童哮喘患病率高达9.5%[15]。目前治疗哮喘的疗效较好药物是糖皮质激素、支气管扩张剂、茶碱和白三烯调节剂,其中吸入糖皮质激素是哮喘长期治疗的首选药物,如布地奈德和丙酸氟替卡松等,但长期激素吸入会带来诸多副作用,如咽部疼痛,咽部真菌感染,体质量增加、血糖增高、骨质疏松等,因此积极寻找治疗哮喘的治疗药物具有重要临床意义[16]。
研究发现海藻糖可通过促进巨噬细胞中TFEB入核上调自噬-溶酶体系统,改善动脉粥样硬化[14,17]。巨噬细胞浸润及炎症因子分泌是诱发支气管哮喘的重要因素,但海藻糖可否改善支气管哮喘炎症状态?本研究通过给予支气管哮喘小鼠海藻糖处理,检测小鼠支气管炎症程度,判断海藻糖对支气管哮喘的作用,结果发现给予海藻糖后,支气管哮喘小鼠支气管炎症细胞浸润减少,炎症因子分泌减少,气道炎症状态明显改善,表明海藻糖对支气管哮喘的缓解作用明显。
海藻糖对蛋白聚集物的清除常伴随细胞自噬[18]。自噬是一种进化上保守的细胞内清除机制,可促进细胞内错误折叠蛋白、脂质聚集物和受损细胞器降解,促进细胞内能量有效循环。激活自噬可限制巨噬细胞炎症反应,通过保存能量、清除错误折叠蛋白和/或受损细胞器以及改善线粒体功能改善气道高反应[19]。但海藻糖对支气管哮喘小鼠气道的自噬作用尚不清楚,因此课题组将进一步检测海藻糖处理后哮喘小鼠支气管中的自噬作用,明确海藻糖的作用机制。
全球儿童哮喘和肥胖发病率均呈上升趋势[20]。流行病学研究将肥胖作为哮喘的危险因素,并提出了一种可能的因果关系[21]。肥胖型哮喘被认为是独特的用于鉴定预后较差和较难控制型哮喘的重要表型,导致肥胖哮喘表型的各种机制已被提出,其中全身炎症的机械效应是普遍认可的机制,结合海藻糖改善脂质代谢的作用可更好地理解为肥胖导致的气道炎症是哮喘风险增加的原因之一[22]。海藻糖除一方面直接改善哮喘气道炎症外,还可能通过改善肥胖脂质代谢和炎症状态进一步延缓哮喘进展,也为海藻糖对肥胖患者哮喘的改善作用提供了更为明确的理论依据[23]。此外,海藻糖对炎症的改善作用可能与逆转哮喘小鼠体内Th1 和Th2 细胞免疫失衡有关,抑制Th2细胞免疫过激状态,下调炎症因子 IL-1、IL-4、IL-5、IL-13 及 IFN-γ 分泌,缓解气道炎症[16]。因此,海藻糖可能通过多种机制改善气道炎症,治疗哮喘。
炎症在多种疾病中(包括神经退行性疾病、癌症、衰老、代谢紊乱和其他感染性疾病)均发挥重要作用,因此,调节炎症反应过程是一种颇具前景的治疗包括神经退行性变和癌症的方法[24]。本研究表明海藻糖是一种重要的炎症调节剂,可有效控制炎症进而改善哮喘,在此基础上课题组将进一步探究海藻糖可否作为创新药物治疗炎症性疾病,尤其用于难治性慢行炎症性疾病(如哮喘)治疗。

