金荞麦HPLC 条件优化及表儿茶素鉴定研究
吴海涛,陈玥,杨微,吴灵玉
(1.黑龙江八一农垦大学理学院,大庆 163319;2.黑龙江八一农垦大学生命科学技术学院;3.中国疾病预防控制中心病毒病预防控制所传染病预防控制国家重点实验室;4.中国农业科学院兰州畜牧与兽药研究所/农村农业部兽用药物创制重点实验室/甘肃省新兽药工程重点实验室)
金荞麦(Fagopyrum dibotrys(D.Don)Hara)为蓼科植物金荞麦的干燥根茎,味微辛、涩,性凉。中药学将其归为清热药一类,用于清热解毒,排脓祛瘀,治疗肺热咳嗽[1-2]。现代药理学研究发现,金荞麦的药理活性有抗癌,抗菌,解热、阵痛、抗炎,镇咳祛痰作用,抗血小板聚集作用,调脂和降糖作用,抗氧化作用,增强巨噬细胞的吞噬功能,抗突变作用,抗衰老作用等[3-5]。目前科学家对金荞麦的研究较为广泛,通过国内外研究发现,金荞麦中的化学成分主要有黄酮类、萜类化合物、有机酸类、甾体化合物等[6],其中发挥主要活性的成分为黄酮类,包括芦丁、芹菜素、表儿茶素、原花青素等[7]。
我国科学家研究金荞麦时间较早,从古至今,已发现金荞麦的多种临床应用并均具有较好的疗效,其主要的药用部位为块茎。目前,金荞麦在临床上能够用于治疗闭经、盆腔炎等妇科疾病,缓解支气管炎、肺炎、咽喉肿痛、鼻咽肿瘤等呼吸道系统疾病,金荞麦还能治疗消化系统疾病如胃痛、胆管感染等,并对皮肤化脓性感染、外伤感染、急性乳腺炎、及家禽的一些急、漫性感染性疾病具有一定的疗效[8-9]。由于金荞麦对各种呼吸道疾病具有较好的治疗及缓解作用,目前有文献表明金荞麦在预防和治疗新冠肺炎上也具有较大的潜力[10]。
金荞麦是疗效确切的上市药,有些学者研究了它的治疗原理。梁明达等[11]和孟凡虹等[12]采用活性追踪法从金荞麦根茎中分离得到了活性部位,通过体内外实验证明该活性部位能够明显的抑制肿瘤细胞的生长,并通过一系列实验证明该活性部位为原花青素的缩合性单宁混合物,且其具有较高的抗癌活性,混合物中含有多羟基黄酮结构,基本单元为(-)-表儿茶素[13],有(+)儿茶素、(-)表儿茶素、原花青素B1、原花青素B2以及原花青素C1,化学分类中属于儿茶素类中的黄烷醇类。结合中外文献,儿茶素类化合物可抗HIV,抑制肿瘤细胞生长,细胞毒(COX-1 抑制剂),抗溃疡,阻止病原体入侵,抗菌,抗腹泻(阻滞在大肠中产生吲哚),类似维生素P 样作用等;其中表儿茶素有抗氧化(DPPH 清除剂,IC50=1.7(g·mL-1;对照抗坏血酸,IC50=3.9(g·mL-1),抗过敏,抗炎,抗诱变,降血脂(减少血清中的胆固醇),抑制胆碱酯酶,骨髓细胞增殖促进[14]等作用;而原花青素类物质有抗肿瘤(抑制TPA 诱导的小鼠皮肤肿瘤),抗氧化(抑制LDL 的氧化,抗氧化活性强于维生素C),DPPH 清除(活性强于维生素C 和维生素E)等活性[15]。因此,研究将检测黄烷醇类成分中的表儿茶素作为金荞麦质量检测的指标。
1 材料与方法
1.1 材料
1.1.1 试验材料
表儿茶素标准品(中国药品生物制品鉴定所提供);Symmetry C18 色谱柱(Waters 公司生产);乙腈、甲醇均为色谱级(北京百灵威科技有限公司);纯净水(华润怡宝饮料有限公司);甲酸、乙酸、甲苯、乙酸乙酯均为分析纯。
药材金荞麦由黑龙江康麦斯药业有限公司提供,由黑龙江八一农垦大学生命科学技术学院制药工程系贾桂燕老师鉴定为金荞麦。
1.1.2 仪器与设备
LC-2010A 型高效液相色谱仪(日本岛津);SHZ-D(III)型循环水式真空泵(巩义市予华仪器有限公司);RE52-99 型旋转蒸发器(上海亚荣生化仪器厂);FA2104 型电子天平(上海越平科学仪器有限公司);pH 计(力辰科技)等。
1.2 试验方法
1.2.1 样品的制备
选取质地均匀的金荞麦根茎,根据实验设计方案,确定所需药材的量(尽量使整个实验用同一批药材,并额外预留1/2 的药材以备实验失败样品不足),洗净待晾干后进行粉碎(若过于干燥,在粉碎前撒适量蒸馏水,以防止粉尘飞扬),10 目筛过滤网过滤,置于暗处保存,备用。取金荞麦药材粗粉约20 g,50%的乙醇,60 ℃加热搅拌提取三次,每次提取时间为1 h,液料比为15∶10,得总滤液减压浓缩至近干,取部分粗提物用乙腈-水混合溶液溶解后进行TLC 和HPLC检测,得到的色谱图均不理想,发现粗提物所含杂质太多,对后续实验的检测有较大影响,为了进一步完善该方法,对所得粗提物进行了聚酰胺柱层析实验,即将粗提物用纯水溶解后湿法加入聚酰胺柱中,首先进行水洗脱,采用3 倍柱体积的纯水,弃去水液,更换洗脱液,采用4 倍柱体积乙醇洗脱,收集洗脱液,减压浓缩至近干,最终得到实验所需含杂质较少的金荞麦提取物。
1.2.2 TLC(薄层色谱)鉴别
取提取物适量于试管中,用乙腈-水(10∶90)溶解,制得样品溶液。取表儿茶素标准品适量,溶解剂为甲醇,即为对照品溶液。
使用微量毛细管分别吸取样品溶液和对照品溶液各1 μL,点于Gf254 硅胶薄层板上,展开剂为甲苯-乙酸乙酯-乙酸(20∶5∶1),放入层析杠中,展开,晾干。均匀的喷上三氯化铝乙醇溶液显色剂,烤板至干燥后,分别于365 nm 和254 nm 下的紫外光灯观察,当在254 nm 下观察时,并没有发现供试品在标准品相同位置处有相同斑点。这与预期的实验结果不同,故进行更为精密的HPLC 实验来验证。
1.2.3 HPLC 色谱条件的优化
(1)检测波长的选择
表儿茶素为黄烷醇类化合物,其在270~290 nm 范围内均有紫外吸收,为了找到实验所用表儿茶素标准品的最大紫外吸收,在查阅有关文献和书籍后,得出其最大紫外吸收在280 nm 处,但由于文献中有报道检测波长为220 nm,所以将供试品溶液分别在220 nm 和280 nm 下进行了检测。
(2)缓冲盐种类的选择
儿茶素类高效液相色谱法中所用缓冲盐的pH值普遍为3 左右,但其种类却较多,实验选择pH 为3 的甲酸水溶液pH 为3 的乙酸水溶液进行比较。
(3)流动相比例的选择
对乙腈-甲酸水体系的梯度进行了考察,共选择了5 种流动相梯度进行考察,如表1 所示。

表1 流动相比例Table 1 Mobile phase ratio
1.2.4 金荞麦中表儿茶素的HPLC 鉴定
(1)供试品溶液的制备
取提取物适量,用乙腈-水(10∶90)溶解,过0.45 μm 微孔滤膜,置于2.0 mL 样品瓶中,得供试品溶液,放入样品架上并记录编号为1-1。
(2)标准品溶液的制备
取表儿茶素标准品适量,以甲醇为溶解剂,制成0.2 mg·mL-1的比奏准品溶液,使用0.45 μm 微孔滤膜过滤,转移至2.0 mL 样品瓶中,得对照品溶液,放入样品架上并记录编号为1-2。
(3)流动相的制备
量取500 mL 纯净水两份,一份直接过0.45 μm过滤用水膜,另一份加入适量甲酸并用pH 计测得pH 为3 后过0.45 μm 过滤用水膜,再量取色谱甲醇、色谱乙腈各500 mL,过0.45 μm 过滤用有机膜,四种流动相放入超声波清洗仪中超声排气20 min,即得。
(4)HPLC 鉴定
检测条件为:Symmetry C18(150 mm×4.6 mm,5 μm) 色谱柱;35 ℃的柱温;280 nm 的检测波长;1.0 mL·min-1的流速;流动相为乙腈和甲酸缓冲盐溶液(PH=3.0),按比例为7.5∶92.5 等度洗脱;进样量为20 μL。理论塔板数按(-)-表儿茶素峰计算应不低于5 000。
以相同色谱条件,分别精密吸取对照品溶液和供试品溶液各20 μL 进样,进行测定。
(5)精密度实验
精密吸取表儿茶素标准品溶液,浓度为100 μg·mL-1,每次10 μL,重复进样6 次,记录主峰保留时间。
(6)重现性实验
将金荞麦按1.2.1 步骤重复处理5 份,按(4)方式进样,每次进样20 μL。记录表儿茶素峰保留时间。
(7)稳定性实验
精密吸取同一金荞麦样品溶液,于0、2、4、6、8、10、12、16、20、24 h 分别进样,每次进样20 μL。记录表儿茶素峰保留时间。
2 结果与分析
2.1 HPLC 色谱条件优化的结果与分析
2.1.1 检测波长
在其他检测条件相同情况下,比较220 nm 和280 nm 所得谱图,如图1,2 所示。比较后得出280 nm下的谱图出峰较多,基线较平,峰形较好,主要成分峰的分离度较好,可以达到基线分离,8~56 min 可以清楚的看到14 个主峰,而在220 nm 波长下,主峰辨识度较差,为进一步的检测的优化考虑,故选择280 nm作为检测波长。
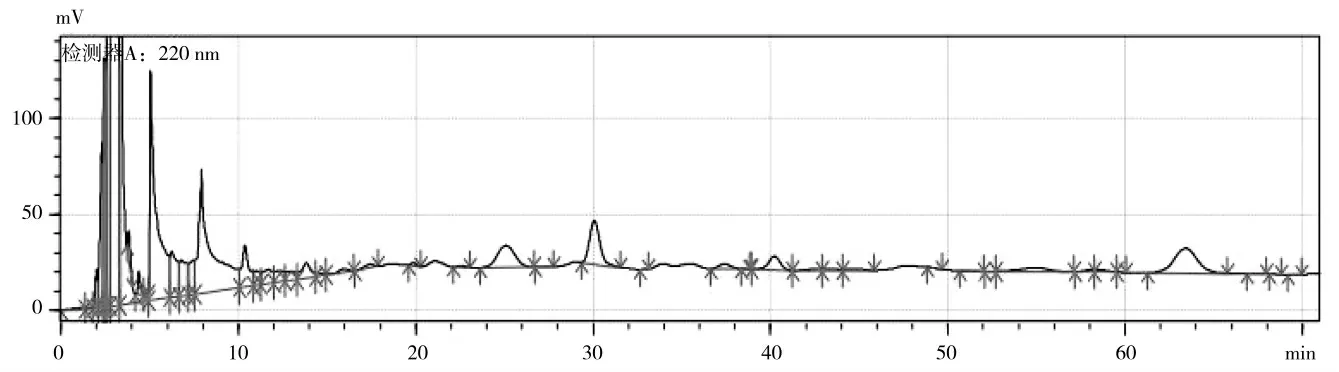
图1 检测波长为220 nm 下的HPLC 谱图Fig.1 HPLC spectra were detected at 220 nm
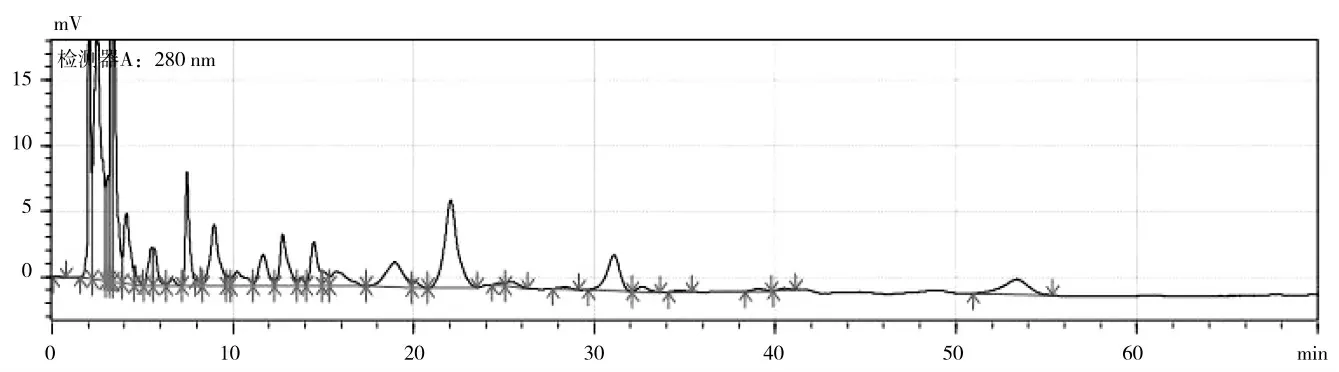
图2 检测波长为280 nm 下的HPLC 谱图Fig.2 HPLC spectra were detected at 280 nm
2.1.2 缓冲盐
在其他检测条件相同情况下,按缓冲盐为pH 为3 的甲酸和乙酸分别检测后,如图3,4 所示。结果表明,甲酸体系与乙酸体系相比较而言,基线较平,出峰时间合理,峰分离度较好,因此选择pH 为3 的甲酸水溶液作为缓冲溶液。

图3 pH 为3 的甲酸水体系下的HPLC 谱图Fig.3 HPLC spectrogram of formic acid water system at pH 3
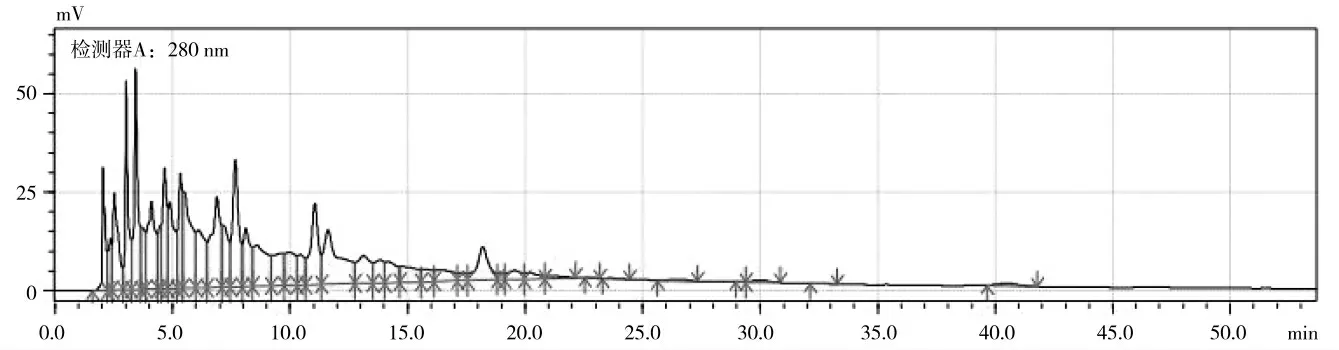
图4 pH 为3 的乙酸水体系下的HPLC 谱图Fig.4 HPLC spectrogram of acetic acid water system at pH 3
2.1.3 流动相比例
在其他检测条件相同情况下,按表1 所示流动相比例分别检测,如图5-9 所示。结果表明,1 条件下前15 min 由于理论塔板数不够,峰分离度较差,基线不平;2 条件下出峰较少、16.5 min 的峰型拖尾,对称性较差;3、4 条件下基线飘移较严重,分离度太差,证明流动相梯度不合适;而5 条件下(如图9)所出峰基线、峰型、分离度、对称性等各方面均较好。因此选择流动相比例为乙腈-甲酸水为7.5∶92.5。

图5 流动相比例为1 下的HPLC 谱图Fig.5 HPLC spectra with mobile phase ratio of 1

图9 流动相比例为5 下的HPLC 谱图Fig.9 HPLC spectra with mobile phase ratio of 5
2.2 金荞麦中表儿茶素HPLC 鉴定的结果
2.2.1 HPLC 定性鉴定结果
结果表明,表儿茶素标准品保留时间为31.074 min,供试品相对保留时间为31.832 min,供试品表儿茶素峰与标准品峰保留时间一致。如图10,11 所示。

图10 金荞麦药材HPLC 谱图Fig.10 HPLC spectrum of Fagopyrum buckwheat
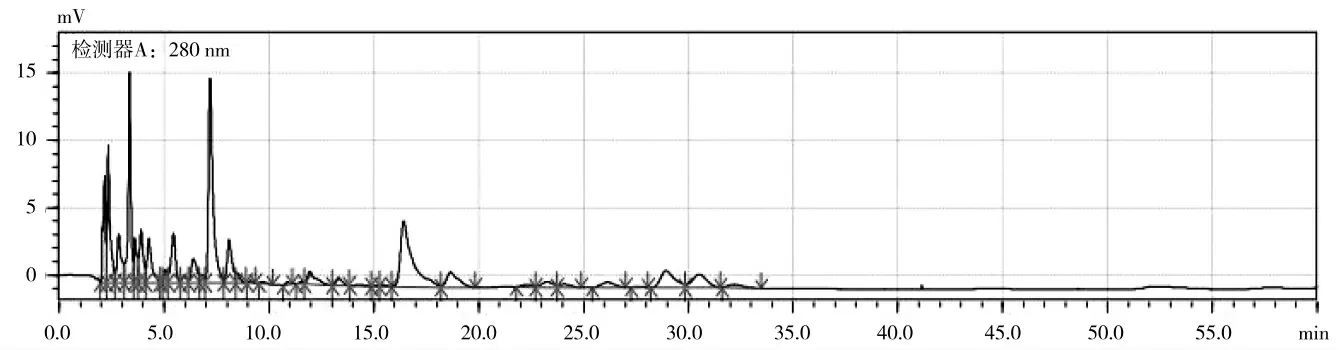
图6 流动相比例为2 下的HPLC 谱图Fig.6 HPLC spectra with mobile phase ratio of 2

图7 流动相比例为3 下的HPLC 谱图Fig.7 HPLC spectra with mobile phase ratio of 3

图8 流动相比例为4 下的HPLC 谱图Fig.8 HPLC spectra with mobile phase ratio of 4

图11 表儿茶素标准品HPLC 谱图Fig.11 HPLC spectra of epicatechin standard
2.2.2 HPLC 精密度实验结果
表儿茶素标准品保留时间的RSD 为0.79%,表明测定结果较准确。

表2 表儿茶素标准品Table 2 Epicatechin standard
2.2.3 HPLC 现性实验结果
金荞麦样品中表儿茶素峰的保留时间为RSD 为1.71%(n=5),重现性良好。
2.2.4 HPLC 稳定性实验结果
金荞麦样品中表儿茶素峰保留时间的RSD为0.84%(n=10),可见金荞麦样品在24 h 内都比较稳定。

表3 表儿茶素标准品Table 3 Epicatechin standard
3 讨论
中国药理文化博大精深,中药更是一个相对复杂的体系,究其原因来讲,主要是中药中含有较多部位具有有效成分,这也导致了其有效成分分离提取的难度,传统方法如蒸馏法,萃取法已经很难满足研究的目的,色谱方法的应用和研究极大地提高了分离测定的速度和准确性。其中应用最广泛的是高效液相色谱法,HPLC 具有样品用量少、分离效率高、灵敏度高、应用范围广、分析速度快、几乎可以适用于任何定性定量分析领域等优点。此外还报道过应用紫外分光光度法[16]、大孔树脂法[17]、薄层色谱法[18-19]等鉴别方法,但都不具备HPLC 所具备的一切优点,也不及HPLC 应用的广泛。
目前对于儿茶素类化合物的检测及鉴定方法众多,其中主要有薄层色谱法(TLC)、毛细管电泳法(CE)、气相色谱法(GC)、高效液相色谱法(HPLC)以及胶束毛细管电动色谱等[20-21]。由于天然中药的化学成分相对复杂,用分光光度法进行检测会有许多干扰因素,检测过程中检测试剂的加入时间、显色剂的显色时间等因素均对检测结果具有较大的影响。故实验则通过HPLC 等化学分析手段,对金荞麦的HPLC 条件进行优化并对醇提物中的表儿茶素成分进行了鉴定研究,为今后进一步完善其质量标准提供依据。
实验只鉴定了黄烷醇类中的表儿茶素,且表儿茶素峰峰面积相对较小,可以看出表儿茶素并不适合作为金荞麦中的代表性化合物来对金荞麦进行质量鉴定,因此猜测在之前的薄层色谱实验中没有观察到表儿茶素并非其中不含这种成分,而是含量太低,薄层色谱灵敏度太低所造成。
4 结论
实验采用高效液相色谱法对金荞麦提取物中黄烷醇类代表化合物表儿茶素进行定性检测,使用的条件在药典基础上,对其中的检测波长、缓冲盐、流动相比例进行了优化,得到最优条件为:检测波长280 nm,流动相为乙腈-甲酸水溶液(pH=3.0)等度洗脱,7.5∶92.5 的比例。优化后的条件缩短了表儿茶素的保留时间,且分离度和对称性均相对较好。稳定性和重现性实验,表明优化后方法稳定、重现性好,该条件为其他黄烷醇类物质如儿茶素、原花青素等的鉴定提供方法依据,也为今后金荞麦质量控制的进一步改进提供依据。

