跑步对香烟提取物所致小鼠肺气肿模型的影响及机制研究
李永荣,谢海彬,李 红,孙 杰
1 甘肃中医药大学附属医院,甘肃兰州 730020;2 深圳市罗湖区中医院,广东深圳 518001;3 广州中医药大学第一附属医院,广东广州 510405
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是临床常见的呼吸系统疾病,以持续性呼吸系统症状为主要临床表现,肺气肿是其最主要的影像学表现[1]。吸烟是COPD 发生的主要危险因素,长期吸烟会导致肺部炎症,引发肺结构改变[2]。研究表明,COPD发展不仅与肺部炎症有很大关系,还与全身炎症反应有关[3-4]。研究发现,在COPD 患者肺组织活检中,气道上皮细胞中信号传导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)表达明显增加[5-6]。STAT3是细胞内介导凋亡及炎症信号转导重要通路蛋白,STAT3活化后能够调节下游多种基因表达并参与细胞凋亡和炎症的调控[7]。
临床研究表明,有氧运动可改善COPD 患者症状,提高其生活质量[8]。实验研究表明,有氧运动可降低肺氧化应激和肺部炎症[9],但有氧运动对COPD动物全身炎症和炎症转录因子的影响尚未见报道。本研究通过观察跑步对香烟提取物致肺气肿小鼠肺部炎症、全身炎症及STAT3 表达的影响,探讨跑步运动改善COPD的相关机制。
1 材料和方法
1.1 主要实验仪器和试剂
电动跑步机(安徽正华生物仪器设备有限公司);芙蓉牌香烟(湖南中烟工业有限责任公司);Rabbit Anti-STAT3、p-STAT3 Polyclonal Antibody(美 国Sigma公司);白细胞介素(interleukin,IL)-1β、IL-6、IL-10、IL-17和肿瘤坏死因子-α(tumor necrosis factor,TNF-α)ELISA试剂盒(天根生物科技有限公司)。
1.2 实验动物
选择6~8周龄清洁级雄性C57BL/6小鼠40只,体质量20~25 g,购买并饲养于甘肃中医药大学动物中心[实验动物生产许可证号:SYXK(甘)2015-0005]。甘肃中医药大学动物中心饲养条件:自由饮食,环境温度在23~25 ℃,12 h/12 h明暗交替。
1.3 动物分组与模型制备
实验动物采用随机数字表法分为对照组、运动组、肺气肿组和肺气肿+运动组,每组10 只。小鼠适应性饲养3 d 后,参照ZHANG 等[10]文献进行香烟提取物提取及模型制备。对照组和运动组小鼠在实验第0、11、22天分别通过腹腔注射0.3 mL磷酸盐缓冲液(phosphate buffered saline,PBS);肺气肿组和肺气肿+运动组小鼠在实验第0、11、22天分别通过腹腔注射0.3 mL 香烟提取物(相当于香烟7 支/d)。本研究方案中对动物处理均按照《关于善待实验动物的指导性意见》执行,本实验方案经甘肃中医药大学医学研究伦理委员会审批通过(伦理审批号:IACUC 2016-039)。
1.4 干预方法
在实验开始前,运动组和肺气肿+运动组小鼠在跑步机上进行3 d 适应,10 min/d。实验开始后第23~29 天,运动组和肺气肿+运动组小鼠进行跑步机有氧训练,15 m/min,30 min/d 持续运动7 d;对照组和肺气肿组小鼠第23~29天在笼内自由活动。
1.5 观察指标
1.5.1 小鼠肺气肿程度评价 采集血液和支气管肺泡灌洗液(bronchoalveolar lavage,BAL)后,每组随机选5只小鼠取出左侧肺组织,用4%福尔马林灌注并固定24 h。进行组织包埋、切片后,采用苏木精-伊红(HE)染色法观察小鼠肺组织病理改变情况,光学显微镜下观察拍照,计算肺泡弦长[11]。
1.5.2 小鼠肺部炎症评估 通过分析BAL 中炎症细胞以及炎症因子水平来评估肺部炎症。采血后,对小鼠进行气管切开和插管,并用1 mL PBS 溶液冲洗肺部,收集冲洗液即BAL。采用血细胞计算器对BAL 中白细胞、中性粒细胞和淋巴细胞进行计数。采用ELISA 法检测BAL 中IL-1β、IL-6、IL-10 和IL-17表达水平。
1.5.3 小鼠全身炎症评估 采用腹腔注射戊巴比妥钠(30 mg/kg)麻醉小鼠后,进行剖腹手术,在腔静脉中采集1 mL血液,采用血液分析仪进行全血细胞(白细胞、中性粒细胞、淋巴细胞)含量分析;采用ELISA 法检测血液中IL-1β、IL-10、IL-17 和TNF-α水平。
1.5.4 免疫印迹分析 收集各组另外5只小鼠左肺组织,加入全细胞裂解液,BCA 法进行蛋白定量,加入Loading Buffer 制备成电泳样品,取30 μg 进行SDS-PAGE 电泳,然后转至PVDF 膜上。经5%牛奶封闭1 h 后用PBS 溶液洗膜。分别加入兔源STAT3一抗(1∶1 000)和p-STAT3 一抗(1∶1 000),4 ℃孵育3 h。回收一抗、洗膜后加入山羊抗鼠二抗(1∶25 000),室温孵育1 h。洗膜后加入显影剂,利用化学发光扫描系统显影并摄片,采用Quantity One 图像分析软件对吸光度值进行分析。
1.6 统计学方法
采用SPSS 20.0 统计软件进行分析。计量资料符合正态分布,数据以(±s)表示,方差齐时,组间比较采用ANOVA 单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 4组小鼠肺气肿程度比较
小鼠肺组织病理染色结果显示,对照组和运动组小鼠肺泡形态结构完整,气管及血管周围未见炎细胞浸润;肺气肿组小鼠气管及血管周围可见大量炎性细胞浸润,肺泡壁破碎,形成肺大疱;肺气肿+运动组小鼠气管周围可见少量炎性细胞浸润,肺泡变小。见图1。肺泡弦长计算结果显示:与对照组比较,运动组小鼠肺泡弦长无明显改变(P>0.05),肺气肿组及肺气肿+运动组小鼠肺泡弦长均明显增大(P<0.05)。与肺气肿组比较,肺气肿+运动组小鼠肺泡弦长明显减小(P<0.05)。见表1。
表1 4组小鼠肺泡弦长比较(±s) μmTable 1 Comparison of chord length of alveolus pulmonis in four groups(±s) μm

表1 4组小鼠肺泡弦长比较(±s) μmTable 1 Comparison of chord length of alveolus pulmonis in four groups(±s) μm
注:与对照组比较,1)P<0.05;与肺气肿组比较,2)P<0.05。Note:Compared with the control group, 1) P<0.05; compared with the emphysema group,2)P<0.05.
组别对照组运动组肺气肿组肺气肿+运动组n 10 10 10 10肺泡弦长38.24±4.10 39.33±4.32 57.84±6.011)45.90±4.231)2)
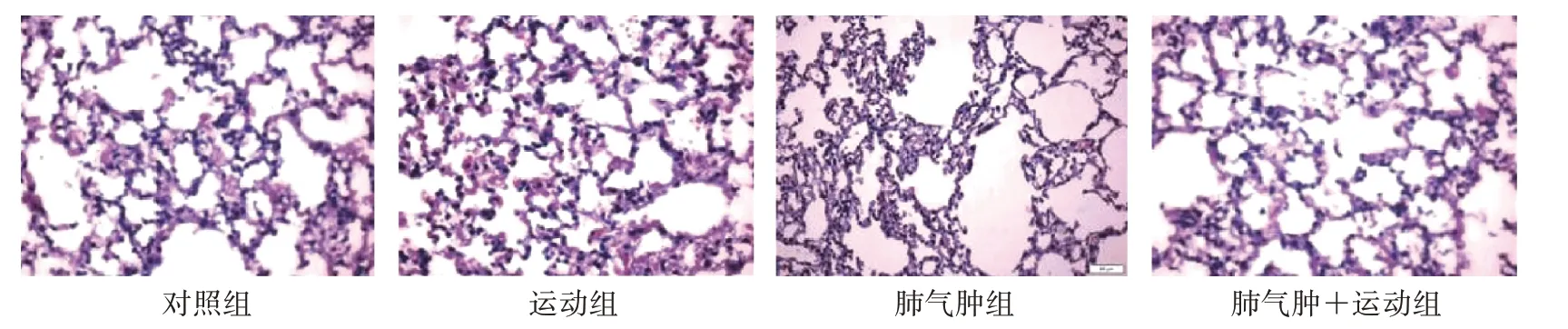
图1 4组肺组织HE染色图(×100)Figure 1 HE staining of lung tissue in four groups(×100)
2.2 4组小鼠肺部炎症情况比较
与对照组比较,肺气肿组小鼠BAL 中白细胞、中性粒细胞、淋巴细胞含量及IL-1β、IL-6、IL-17 表达水平均升高,而IL-10 水平降低,差异具有统计学意义(P<0.05);肺气肿+运动组小鼠BAL 中白细胞、中性粒细胞、淋巴细胞含量及IL-1β、IL-6、IL-17 表达水平升高,IL-10 水平降低,差异均有统计学意义(P<0.05)。与肺气肿组比较,肺气肿+运动组BAL 中白细胞、中性粒细胞、淋巴细胞含量及IL-1β、IL-6、IL-17 表达水平更低,IL-10 水平更高,差异均有统计学意义(P<0.05)。见表2。
表2 4组BAL中炎性细胞含量及细胞因子表达水平比较(±s)Table 2 Comparison of inflammatory cells and cytokines of BAL in four groups(±s)
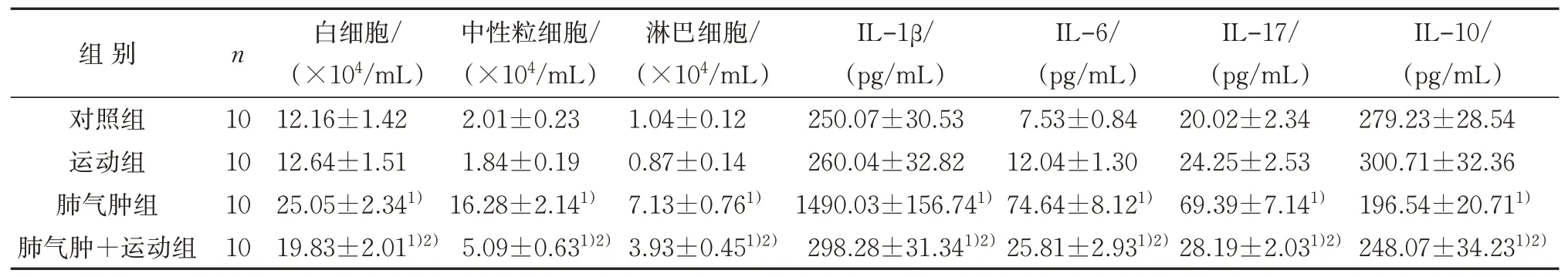
表2 4组BAL中炎性细胞含量及细胞因子表达水平比较(±s)Table 2 Comparison of inflammatory cells and cytokines of BAL in four groups(±s)
注:与对照组比较,1)P<0.05;与肺气肿组比较,2)P<0.05。Note:Compared with the control group,1)P<0.05;compared with the emphysema group,2)P<0.05.
组别对照组运动组肺气肿组肺气肿+运动组n 10 10 10 10白细胞/(×104/mL)12.16±1.42 12.64±1.51 25.05±2.341)19.83±2.011)2)中性粒细胞/(×104/mL)2.01±0.23 1.84±0.19 16.28±2.141)5.09±0.631)2)淋巴细胞/(×104/mL)1.04±0.12 0.87±0.14 7.13±0.761)3.93±0.451)2)IL-1β/(pg/mL)250.07±30.53 260.04±32.82 1490.03±156.741)298.28±31.341)2)IL-6/(pg/mL)7.53±0.84 12.04±1.30 74.64±8.121)25.81±2.931)2)IL-17/(pg/mL)20.02±2.34 24.25±2.53 69.39±7.141)28.19±2.031)2)IL-10/(pg/mL)279.23±28.54 300.71±32.36 196.54±20.711)248.07±34.231)2)
2.3 4组小鼠血液炎症情况比较
与对照组比较,肺气肿组小鼠血液中白细胞、中性粒细胞、淋巴细胞含量及IL-1β、IL-17、TNF-α表达水平升高,IL-10 水平降低,差异均有统计学意义(P<0.05);肺气肿+运动组小鼠血液中IL-1β、IL-17和TNF-α表达水平均升高,IL-10表达水平降低,差异均有统计学意义(P<0.05)。与肺气肿组比较,肺气肿+运动组小鼠血液中白细胞、中性粒细胞、淋巴细胞含量及IL-1β、IL-17 和TNF-α 表达水平较低,IL-10 水平较高,差异均有统计学意义(P<0.05)。见表3。
表3 4组小鼠血液中炎性细胞及细胞因子比较(±s)Table 3 Comparison of inflammatory cells and cytokines of blood in four groups(±s)
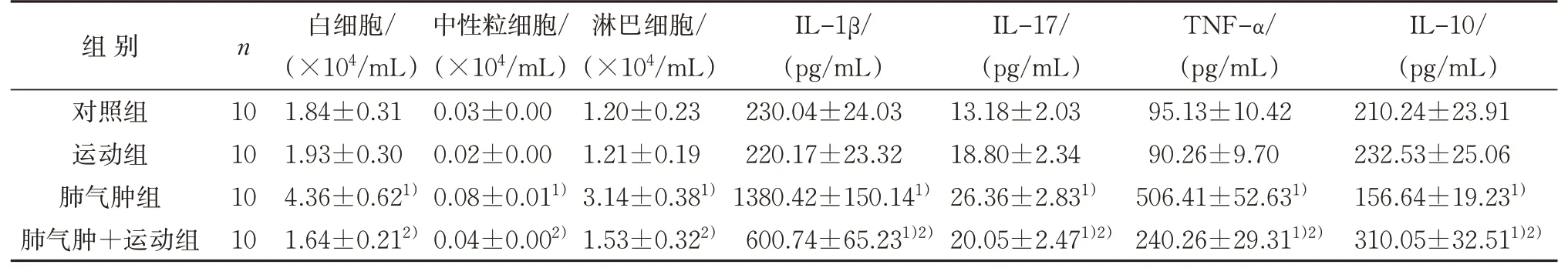
表3 4组小鼠血液中炎性细胞及细胞因子比较(±s)Table 3 Comparison of inflammatory cells and cytokines of blood in four groups(±s)
注:与对照组比较,1)P<0.05;与肺气肿组比较,2)P<0.05。Note:Compared with the control group,1)P<0.05;compared with the emphysema group,2)P<0.05.
组别对照组运动组肺气肿组肺气肿+运动组n 10 10 10 10白细胞/(×104/mL)1.84±0.31 1.93±0.30 4.36±0.621)1.64±0.212)中性粒细胞/(×104/mL)0.03±0.00 0.02±0.00 0.08±0.011)0.04±0.002)淋巴细胞/(×104/mL)1.20±0.23 1.21±0.19 3.14±0.381)1.53±0.322)IL-1β/(pg/mL)230.04±24.03 220.17±23.32 1380.42±150.141)600.74±65.231)2)IL-17/(pg/mL)13.18±2.03 18.80±2.34 26.36±2.831)20.05±2.471)2)TNF-α/(pg/mL)95.13±10.42 90.26±9.70 506.41±52.631)240.26±29.311)2)IL-10/(pg/mL)210.24±23.91 232.53±25.06 156.64±19.231)310.05±32.511)2)
2.4 4组小鼠肺组织STAT3表达比较
与对照组比较,肺气肿组小鼠肺组织中p-STAT3表达水平升高(P<0.05);肺气肿+运动组小鼠肺组织中p-STAT3 表达水平升高(P<0.05)。与肺气肿组比较,肺气肿+运动组小鼠肺组织中p-STAT3表达水平降低(P<0.05)。见表4、图2。
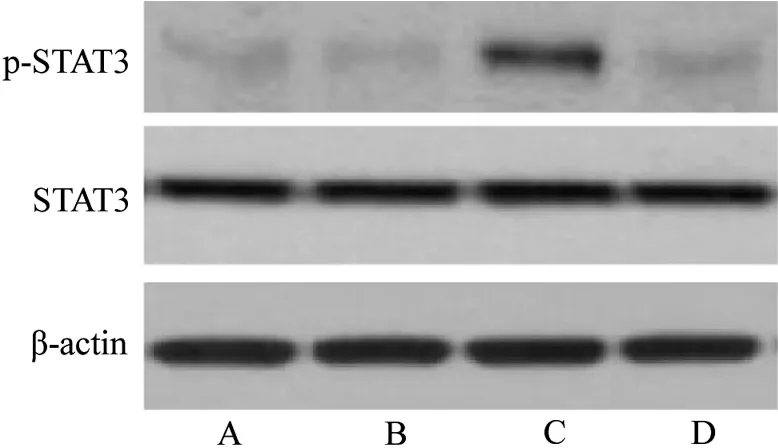
图2 4组肺组织STAT3和p-STAT3蛋白典型免疫印迹图Figure 2 Typical immunoblot images of STAT3 and p-STAT3 proteins of lung tissues in four groups
表4 4组小鼠肺组织STAT3和p-STAT3蛋白表达比较(±s)Table 4 Comparison of STAT3 and p-STAT3 protein expression of lung tissue in four groups(±s)
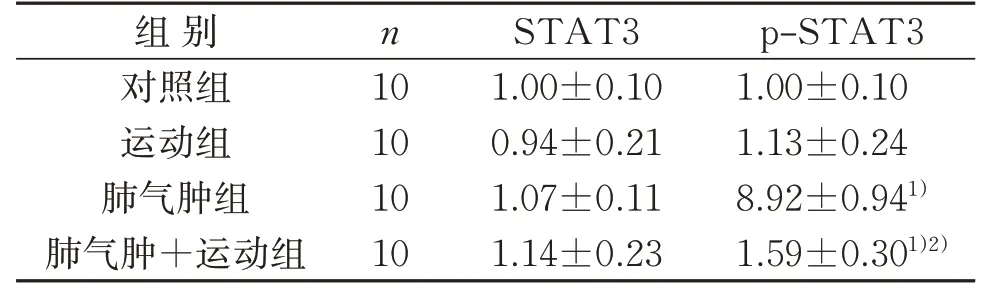
表4 4组小鼠肺组织STAT3和p-STAT3蛋白表达比较(±s)Table 4 Comparison of STAT3 and p-STAT3 protein expression of lung tissue in four groups(±s)
注:与对照组比较,1)P<0.05;与肺气肿组比较,2)P<0.05。Note:Compared with the control group, 1) P<0.05; compared with the emphysema group,2)P<0.05.
组别对照组运动组肺气肿组肺气肿+运动组n 10 10 10 10 STAT3 1.00±0.10 0.94±0.21 1.07±0.11 1.14±0.23 p-STAT3 1.00±0.10 1.13±0.24 8.92±0.941)1.59±0.301)2)
3 讨 论
研究表明,香烟可引起慢性肺部炎症,这种炎症不仅会影响气道,而且会影响肺远端,促进肺实质发展[12]。作为一种有效的促炎剂,香烟可激活多种促炎细胞因子(如IL-1β、IL-6、IL-17 和TNF-α),这些细胞因子在肺部炎症和结构改变中起着关键的作用[13-15]。在COPD 和哮喘等慢性呼吸道疾病中,促炎细胞因子会吸引和激活白细胞进入炎症部位,导致非溶解性炎症反应,使炎症过程永久化[16]。有研究表明,在COPD 患者的肺组织中,中性粒细胞作为主要炎性细胞,参与了气道重塑和气道阻塞进展[17]。虽有研究表明,有氧运动能有效改善COPD预后,但其具体作用机制仍不明确[18]。为此,本研究旨在观察跑步对肺气肿小鼠肺部及全身炎症细胞和细胞因子影响,并对其机制进行初步探讨。
3.1 跑步可有效减轻肺气肿小鼠肺部及全身炎症
本研究采用香烟提取物制备小鼠肺气肿模型,与对照组比较,模型组小鼠肺组织出现明显肺气肿表现,BAL 和血液中炎性细胞含量及促炎因子水平升高,抗炎因子水平升高。与模型组比较,肺气肿+运动组小鼠肺气肿程度较轻,BAL 和血液中炎性细胞含量及促炎因子水平较低,抗炎因子水平降低升高,这提示跑步可以有效减轻肺部及全身炎症反应,延缓模型小鼠肺气肿进程。这可能与以下因素有关:①炎性细胞(如中性粒细胞等)可以释放出多种介质,这些介质不仅与炎症过程有关,还与气道重塑有关[19]。跑步运动通过抑制肺部及全身炎性细胞及炎性因子表达,使炎性细胞在肺中迁移减少,抑制气道重塑,从而有利于维持肺的完整性和功能性[20-21]。②IL-10 作为一种抗炎细胞因子,可拮抗其他细胞因子促炎作用,从而控制炎症。研究报道,IL-10 主要是通过抑制κB 抑制因子激酶激活或NF-κB 的DNA 结合能力,从而抑制NF-κB 启动相关前炎症因子基因的转录[22]。这与研究显示,有氧运动可改善COPD 大鼠肺功能表现,减轻COPD大鼠肺组织病理损害,还可促使COPD 大鼠肺组织中炎症因子表达下降的结果相似[23]。
3.2 跑步减轻肺气肿小鼠肺部及全身炎症机制与调控STAT3表达有关
研究表明,长期暴露于香烟烟雾可激活气道上皮细胞,触发与COPD 相关炎症和纤维化反应信号通路(如STAT)[24]。STAT3 是STAT 家族的主要成员,在不同细胞及组织广泛表达,是IL-6 信号传递中的急性反应因子[25]。IL-6 通过STAT3 与IL-21、IL-23 一起调节Th17 细胞分化,从而增加IL-17 分泌[26]。而IL-17 通过调控气道中炎症细胞,促进中性粒细胞趋化及调控因子表达,从而促进中性粒细胞黏附和浸润[27-28]。本研究结果显示,与对照组比较,肺气肿组小鼠BAL 和血液中IL-17水平升高,肺组织中p-STAT3 表达水平也升高;与肺气肿组比较,肺气肿+运动组小鼠BAL 和血液中IL-17 水平降低,肺组织中p-STAT3 表达水平也降低,表明跑步可能通过抑制小鼠肺组织STAT3 激活,减少IL-17 分泌,发挥对肺气肿小鼠肺部和全身炎症的抑制作用。
4 小 结
跑步可以减轻肺气肿模型小鼠肺部气道炎症,还能抑制肺气肿小鼠全身炎症,减轻肺气肿病理表现,其机制可能与抑制STAT3 的激活有关。下一步可以利用基因敲除小鼠或STAT3 小分子抑制剂FLLL31进行研究,以进一步检验STAT3与小鼠肺气肿炎症反应之间的关系。

