中国夏季奥运会项目优秀运动员运动诱发性支气管痉挛的流行病学调查
刘 猛,曹 志,莫仕围,吕冰强,寻红星,黄 森,王 丹,高炳宏*
(1.上海体育学院 竞技运动学院,上海 200438;2.重庆市体育科学研究所,重庆 400016;3.深圳大学体育学院,广东 深圳 518060;4.湖南省体育科学研究所,湖南 长沙 410005)
运动诱发性支气管痉挛(exercise-induced bronchoconstriction,EIB)是指高强度运动中或运动后出现的暂时性气道狭窄,可单独发生,也可能伴有胸闷、咳嗽、呼吸困难等症状(曹志 等,2021;刘猛等,2021)。EIB不仅会诱发呼吸不适等症状,还会直接导致最大摄氧量下降、呼吸肌耗氧量增加、通气/血流比值异常等,进而严重影响机体运动能力(Price et al.,2014)。另外,EIB还是非心源性运动猝死的主要诱因之一。例如,美国1982—2018年共有37名职业运动员死于EIB诱发的运动性猝死,其中,74.1%发生于训练或比赛中(Price et al.,2014);意大利2003年23.1%的非创伤性运动猝死事件(61例,含职业运动员、普通人群等)与EIB直接或间接相关(Becker et al.,2004)。新英格兰杂志曾报道,运动员群体的EIB发病率为11%~50%,远高于普通人群的4%~7%(Boulet et al.,2015)。EIB及其相关疾病已成为影响运动员健康的第一大慢性疾病(Couto et al.,2018),严重威胁运动员的生命健康,必须高度重视。
夏季奥林匹克(以下简称“夏奥”)运动会项目运动员一直是EIB高发人群。例如,1996年亚特兰大奥运会,美国代表团中游泳、赛艇及田径项目运动员被确诊患有EIB的比例分别为30.6%、25.4%和18.6%(Weiler et al.,1998);2004年雅典奥运会,英国和澳大利亚两国代表团的EIB治疗用药豁免(EIB-therapeutic use exemption,EIB-TUE)申请率分别高达20.7%和21.9%(Anderson et al.,2006);2004—2012年连续3届夏奥会中,德国和西班牙两国代表团的EIB发病率均超过15%(Burns et al.,2015)。另外,近年来受职业体育发展和环境污染等内外因素影响,优秀运动员的EIB发病率正在迅速增加。例如,2012年,意大利和芬兰奥运选手的EIB发病率分别从2004年的11.3%和9.4%增加到17.2%和12.6%(Bonini et al.,2015a;WADA,2012);相比2008年,世界反兴奋剂机构(World Anti-Doping Agency,WADA)在2016年受理的EIB-TUE申请增加了83.4%。与此同时,受EIB高发因素影响,近年来EIB药物滥用、过度治疗等兴奋剂违规问题频发(Allen et al.,2019)。例如,2018年平昌冬奥会,仅挪威代表团(109人)就使用了6 000多份EIB药物,引发国际舆论的高度关注和巨大争议(中国反兴奋剂中心,2019)。由此看来,EIB已俨然成为阻碍奥林匹克运动健康发展的重大问题,应给予高度关注。
中国既是体育人口大国,也是奥运奖牌强国,我国优秀运动员可能面临同样严重的EIB问题。但是,相比西方国家,我国甚少关注运动员的EIB问题,鲜见相关研究报道。通过前期文献检索与梳理,仅查阅到2份相关公开资料:Kenneth等(2008)指出,1996—2004年,共有1 532名奥运参赛运动员申请EIB-TUE,但无中国运动员;中国反兴奋剂中心(2019)指出,2010—2018年,我国运动员的EIB-TUE申请率始终小于1.0%,远低于国际平均水平(5.8%~7.7%)。但是,同期我国成人哮喘患者总量已达4 570万,位居世界第一(Huang et al.,2019)。由此,本研究认为,我国运动员的EIB问题可能被严重低估,而这会对我国运动员的身心健康、参赛备战及体育事业的长期健康发展产生不利影响。基于此,本研究以我国夏奥项目优秀运动员为研究对象,对我国运动员的EIB问题进行流行病学调查,旨在初步掌握我国夏奥项目优秀运动员的EIB发病情况,比较不同运动项目、类型、性别、竞技水平之间EIB发病的差异;同时,对比健康运动员,分析EIB运动员的肺通气功能、呼吸道炎症等关键指标的特点,以期为积极开展我国运动员EIB的预防、诊断和治疗,以及制定相应政策和开展相关科学研究提供实证依据与理论支撑。
1 研究对象与方法
1.1 研究对象
本研究从国家队(田径、曲棍球、篮球、橄榄球等)和省市专业队(上海市、重庆市、天津市、湖南省、四川省等)招募被试。被试的运动等级须不低于国家一级,每周训练时间不少于15 h,且竞技水平满足下述条件之一:1)曾入选或为现役国家队运动员;2)全国综合性运动会比赛前24名;3)全国锦标(冠军)赛前16名;4)在其他同等或更高级别竞技水平赛事取得相应名次者。同时,参考相关研究(Reis et al.,2012),并为确保被试的安全,排除标准为:1)患有慢性阻塞性肺疾病、肺心病、抑郁症或其他重大疾病;2)曾接受过胸外科手术;3)实验前3周内曾发生肺部感染;4)实验前已停训2周及以上;5)实验前1周内曾出现中度或重度的感冒、呼吸道感染等症状。
经过严格筛选,来自15个夏奥项目的413名优秀运动员(女235人,男178人)纳入样本并参加了支气管运动激发实验,其中2人未能完成测试(举重1人,摔跤1人),剩余411名运动员中含国际级运动健将19人,运动健将148人,国家一级运动员244人(表1)。参考Alaranta等(2004)的研究,上述413名运动员根据运动环境特点可分为室内项目(泳池项目53人,陆上项目201人)和室外项目(公路项目50人,场地项目109人),根据运动专项特征又可分为耐力项目(83人)、技巧项目(92人)、速度力量项目(152人)和团体项目(86人)。另外,参考Rundell等(2013)的研究,收集了全部413名运动员的常驻训练基地资料(图1),被试长期驻训于10个不同的训练基地(闹市区8个,郊区2个),全部训练基地均毗邻交通主干道,距离交通主干道的平均直线距离为(35.3±32.4)m。实验开始前,所有运动员都知悉本研究的目的、内容、实验流程及潜在风险等,并签署知情同意书。本研究严格遵守《赫尔辛基宣言》,并经上海体育学院学术与伦理委员会审核批准(文件编号:102772020RT082)。
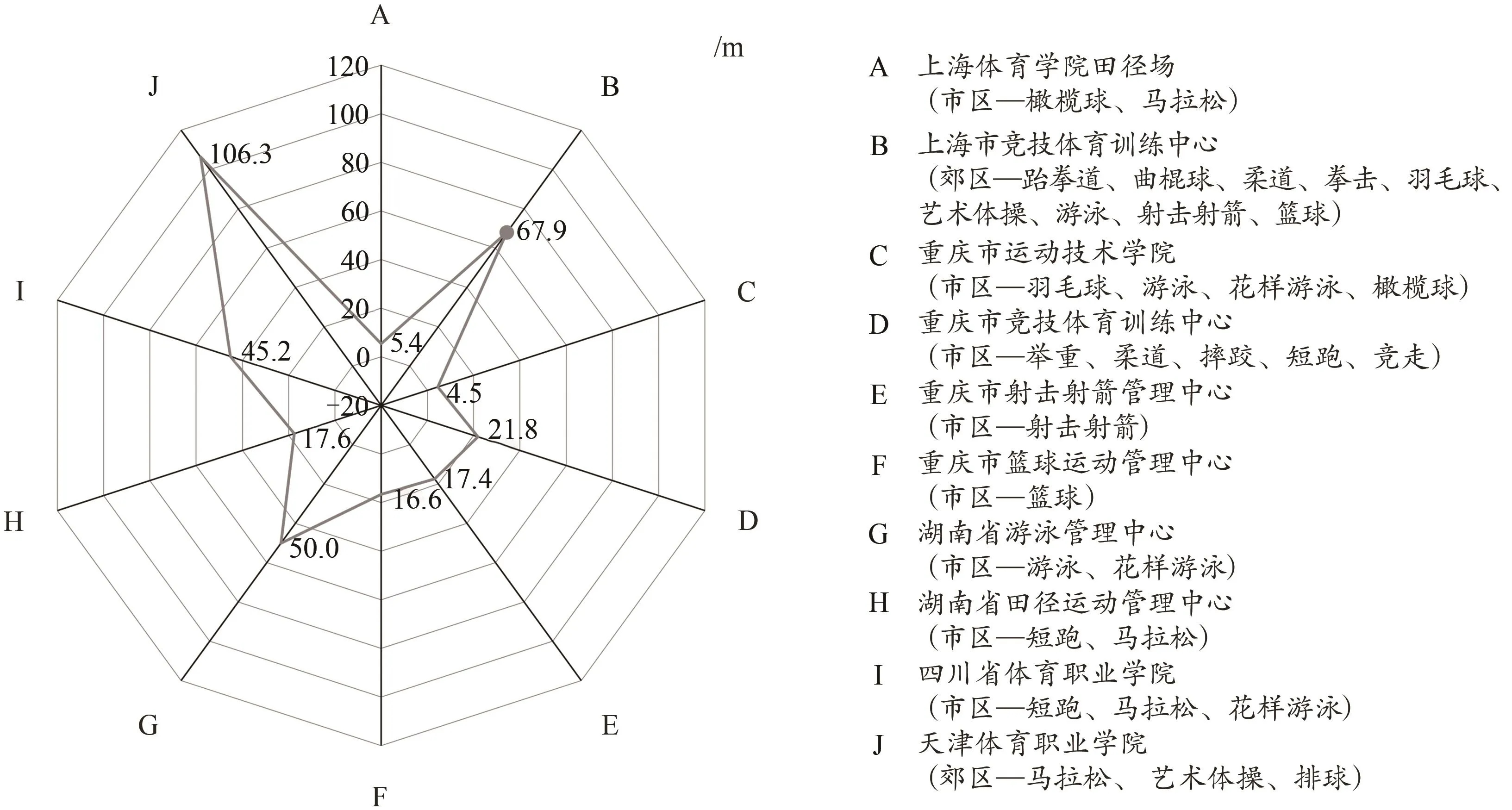
图1 运动员常驻训练场馆距离交通主干道的距离情况Figure 1.Distance between the Athletes’Training Hall and the Arterial Road

表1 纳入的运动项目及对应人数Table 1 The Included Sports and Number of Athletes
1.2 测试流程
实验包含3个部分:血液样本采集、问卷调查及支气管运动激发实验。每位运动员均在1天之内完成所有数据采集:清晨,空腹状态下进行血液样本采集;下午,在研究人员辅助下,先完成调查问卷,再进行支气管运动激发实验(图2A)。
1.2.1 血液样本采集
测试日清晨(7:30—8:30),研究人员采集运动员空腹(禁食≥8 h)肱静脉血4 mL,并分装于A采血管(1 mL)和B采血管(3 mL)。A管样本于采样结束后的10 min内,用血液细胞分析仪(BC-5150,迈瑞,中国)测试白细胞、嗜碱性粒细胞、嗜酸性粒细胞及中性粒细胞计数等指标;B管样本于采样结束后30 min内,用高速离心机(TG16,蜀科,中国)分离出血清样本(3 000 R/min,15 min),并低温(-80℃)保存于医用冰箱(BDF-86V158,海尔,中国)。全部实验结束后,指定1名研究人员对所有运动员的血清样本进行分析(SAL-6000,迈瑞,中国;Spectra-Max iD5,美谷,美国),获取白介素-6(IL-6)、白介素-8(IL-8)及克拉式细胞蛋白16(Clara Cell Protein 16,CC16)等生化指标。
1.2.2 问卷调查
问卷调查于支气管运动激发实验前进行。采用美国奥委会医学委员会制定的EIB基本信息调查问卷(Weiler et al.,1998),其主要包括以下8方面内容:形态学参数(身高、体质量等)、运动经历(训练时间、年限等)、呼吸系统疾病史(哮喘病、慢性阻塞性肺疾病等)、运动呼吸不适症状(喘息、胸闷、呼吸困难等)、家族哮喘史(限直系亲属)、吸烟史、过敏史(食物、药物等)和EIB诊治信息(临床诊断、用药及EIB-TUE等)。
1.2.3 支气管运动激发实验
采用实验室运动测试法进行支气管运动激发实验,此方法已被国际奥委会医学委员会(International Olympic Committee Medical Commission,IOC-MC)和 WADA 共同推荐用于EIB诊断,且已被大量用于相关研究(Levai et al.,2016;Simon et al.,2014)。具体操作如下:运动员佩戴好鼻夹和心率带(M430,Polar,芬兰)后,自行选择合适的初始跑速,先在跑步机(T150,Cosmed,意大利)上预跑2~3 min,随后每20 s跑速增加2 km/h,坡度增加0.5°,以逐步达到其极量强度(90%最大心率),最后,保持此极量强度继续跑6 min(图2B)。测试前30 h内,所有运动员均禁止剧烈运动、饮酒、吸烟,并避免食用具有EIB缓解作用的食物或补剂,如鱼油、维C等(Oliver et al.,2015);试验前2 h,将实验室的温度、湿度调控并维持在标准状态(18℃~25 ℃,30%~60% 相对湿度;Tikkakoski et al.,2019);试验前1 h,运动员进入实验室以适应室内环境。实验安排在下午进行(14:00—18:00),实验日上午运动员均为休息状态。
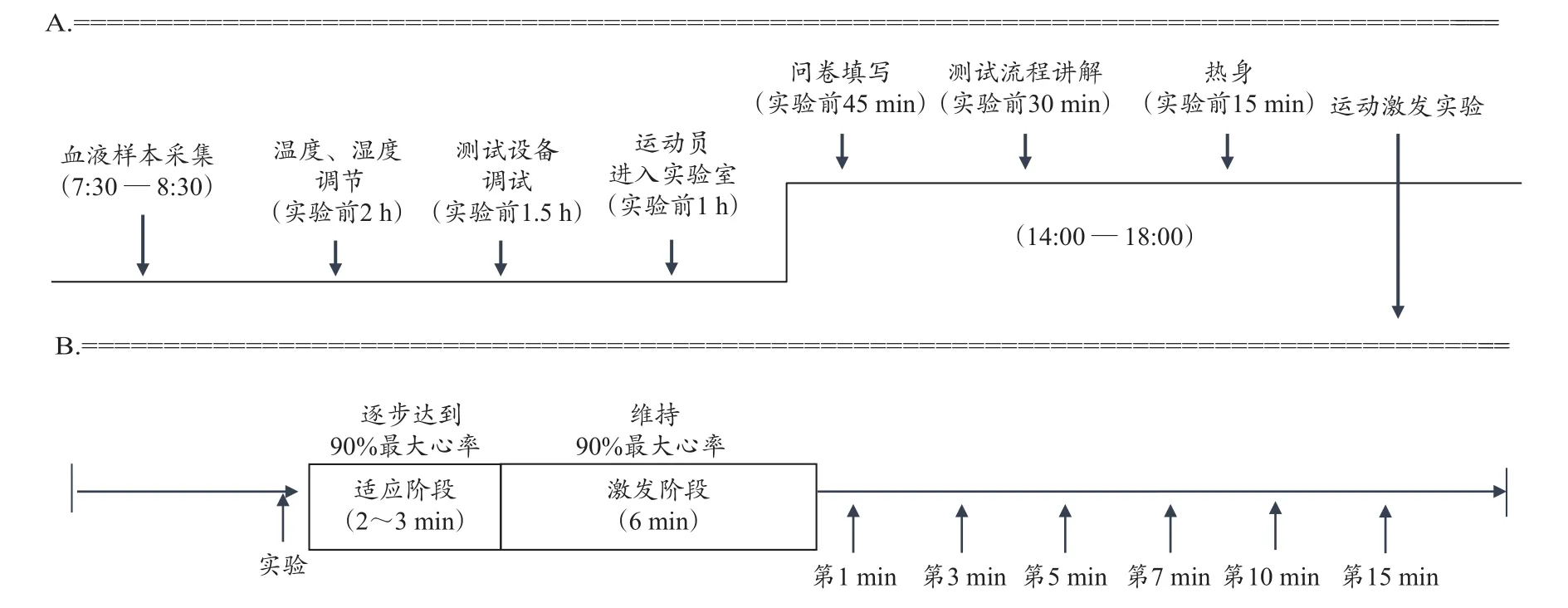
图2 测试流程Figure 2.Testing Protocol
根据美国胸科协会推荐的EIB诊断方法(Parsons et al.,2013),在支气管运动激发实验前即刻及结束后第 1、3、5、7、10、15 min时,使用肺功能仪(Chest HI-101,捷斯特,日本)对运动员进行肺功能测试,并分别记录第1 s用力呼气容积(forced expiratory volume in one second,FEV)、最大通气量(maximal voluntary ventilation,MVV)、用力肺活量(forced vital capacity,FVC)及呼气峰值流速(peak expiratory flow,PEF)等通气指标,并计算FEV下降率,即,FEV下降率=实验前 FEV/实验后 FEV×100%。当FEV下降率≥10%时,诊断为EIB阳性(Bonini et al.,2015a)。
1.3 数据处理与统计分析
研究结果录入Excel 2019进行编码和整理,并导入SPSS 25.0进行统计分析,结果用平均值±标准差表示。采用卡方检验,比较EIB与健康运动员在呼吸不适症状、呼吸系统病史等方面的差异,以及EIB发病率在性别、不同运动类型(室内vs室外;耐力vs技巧vs速度力量vs团体)、不同竞技水平运动员[(国际级)运动健将vs国家一级运动员]之间的差异。采用2(组别:EIB组、健康组)×7(实验后7个时间点)重复测量方差分析比较EIB与健康运动员的肺通气能力(FEV、FEV下降率、FVC、PEF以及MVV)差异。采用独立样本t检验,比较EIB与健康运动员的血液炎症指标(全血,白细胞、中性粒细胞、嗜碱性粒细胞及嗜酸性粒细胞计数;血清,IL-6、IL-8、CC16)差异。事后检验均采用最小显著性差异法(LSD),显著性水平定为P<0.05。
2 研究结果
2.1 支气管运动激发实验结果
参与支气管运动激发实验的411名被试中,109人(男38,女71)被确诊为EIB阳性,EIB整体发病率为26.5%。比较不同运动项目运动员的EIB发病率(图3A),排在前5位的运动项目依次为游泳(51.5%)、曲棍球(40.7%)、花样游泳(40.0%)、橄榄球(38.5%)和田径(33.3%),排在后5位的运动项目依次为柔道(11.1%)、艺术体操(10.5%)、羽毛球(9.5%)、举重(9.5%)和摔跤(6.5%),首位与末位相差高达8倍;其他5个运动项目运动员的EIB发病率介于15.0%~25.0%之间,差异较小。另外,4个距离不等的径赛项目中,400 m(栏)运动员的EIB发病率最高(11人,50.0%),之后依次为马拉松(9人,33.3%)、100 m/200 m(5人,27.8%)和竞走(5人,22.7%),但两两之间无显著差异(图3B)。
如图3C所示,女性运动员EIB发病率(71人,30.2%)显著高于男性运动员(38人,21.3%;P=0.049);(国际级)运动健将(48人,28.7%)和国家一级运动员(61人,25.0%)的EIB发病率无显著差异(P=0.45)。如图3D所示,根据项目特点,耐力、团体、技巧和速度力量项目运动员被诊断为EIB阳性的比例分别为37.3%(31人)、33.7%(29人)、20.7%(19人)和20.0%(30人),其中,耐力项目的EIB发病率显著高于力量速度项目(P=0.038),其他各类之间无显著差异。
如图3E所示,室外项目EIB发病率(58人,33.1%)显著高于室内项目(51人,21.6%;P=0.05)。在室外项目中,场地项目EIB发病率(44人,35.2%)与公路项目(14人,28.0%)无显著差异;在室内项目中,泳池项目(53人,47.2%)与陆上项目(183人,14.2%)EIB发病率差异显著(P<0.001)。另外,室外场地项目的EIB发病率显著高于室内陆上项目(P=0.01)。
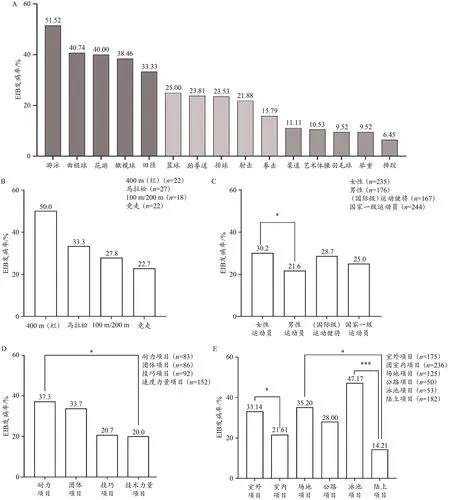
图3 不同运动项目(A)、不同距离径赛项目(B)、不同性别与竞技水平(C)及不同项目类型(D、E)运动员的EIB发病率比较Figure 3.Comparison of the EIB Incidence in Different Sports(A),Track Sports of Different Distance(B),Different Gender and Competitive Levels(C)and Different Sports Types(D,E)
另外,根据支气管运动激发实验结果,将被试分为EIB组(n=109)和健康组(n=302)。运动激发试验后,EIB组运动员的FEV下降率均显著高于健康组(P<0.001;图4A)。支气管运动激发实验前,EIB组与健康组运动员的FEV、FVC、MVV和PEF值均无显著差异(图4B~E)。激发实验后,EIB组运动员的FEV值均显著低于激发试验前(P<0.001),且同比显著低于健康组(P<0.05);健康组激发实验前后FEV无显著变化(图4B)。激发实验后,EIB组和健康组运动员的FVC值均下降,但EIB组下降趋势更明显,显著低于同期健康组(P<0.05;图4C)。EIB组与健康组的MVV值在激发实验后先上升再下降,但波动幅度不大;EIB运动员的MVV值在激发实验后的各时间点均显著低于健康组(P≤0.05;图4D)。EIB组的PEF值在激发实验后显著下降(第1 min,P<0.001;第5 min,P=0.05;第7 min,P=0.03),并在第3 min显著低于健康组(P=0.029);健康组的PEF值在激发实验后并无显著变化(图4E)。
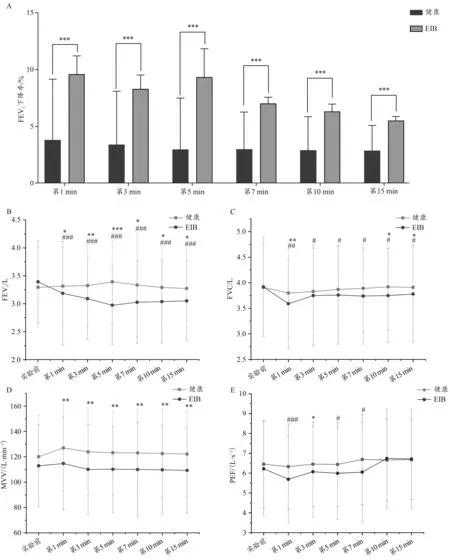
图4 EIB组与健康组在支气管运动激发试验前、后肺通气指标的比较Figure 4.Comparison of Different Pulmonary Function Parameters between EIB and Healthy Groups at Pre-and Post-Exercise Provocation Test
2.2 调查问卷结果
EIB组与健康组运动员各项基本资料的比较结果如表2所示。两组被试的身高、体质量、年龄、周训练时间与训练年限、吸烟人数比例、申请EIB-TUE人数比例均无显著差异。EIB组出现运动呼吸不适症状(P<0.001)、有过敏史(P=0.003)、有家族哮喘史(P=0.019)、曾被确诊患有哮喘(P<0.001)、接受过抗哮喘药物治疗(P<0.001)和曾被确诊患有EIB(P=0.019)的运动员比例显著高于健康组。
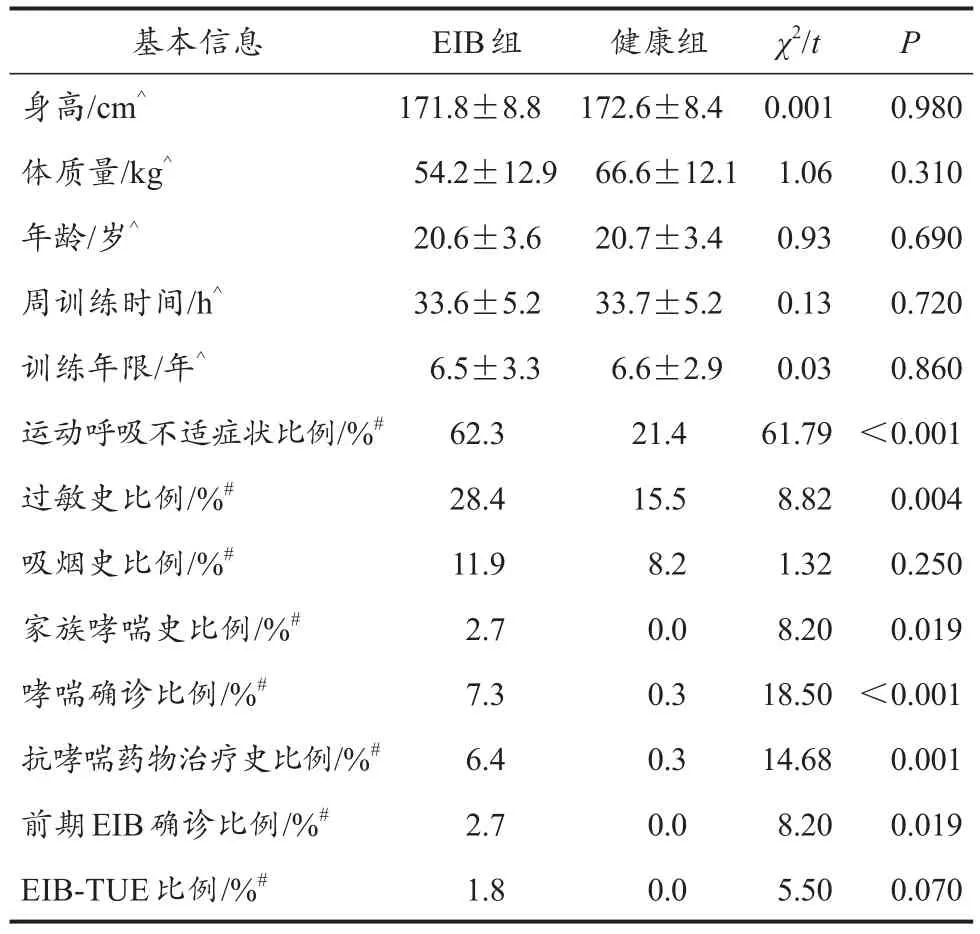
表2 健康组和EIB组运动员的问卷调查信息比较Table 2 The Questionnaire Results in EIB Group and Health Group
2.3 血液指标测试结果
EIB组与健康组运动员呼吸道炎症指标的比较结果如表3、4所示。EIB组运动员的嗜酸性粒细胞计数(P=0.007)和中性粒细胞计数(P=0.022)均显著高于健康组;两组运动员的白细胞计数和嗜碱性粒细胞计数无显著差异(表 3)。EIB 组运动员的 IL-6(P<0.001)、IL-8(P<0.001)及CC16(P=0.015)均显著高于健康组(表4)。
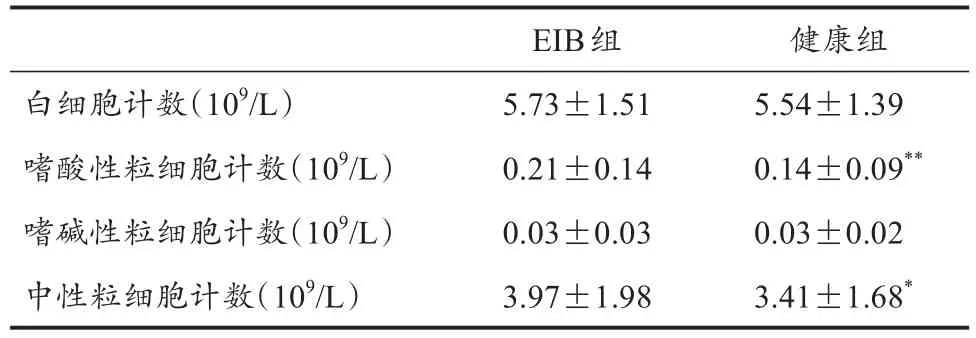
表3 静脉血血常规指标测试结果Table 3 Blood Cell Counts in EIB and Healthy Athletes
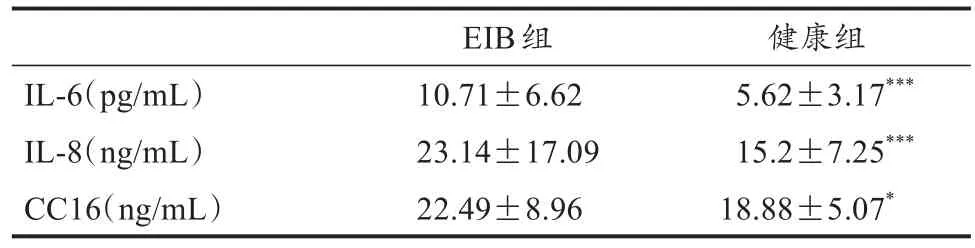
表4 血清指标测试结果Table 4 Serum Indicator Results in EIB and Healthy Athletes
3 讨论
3.1 夏奥项目优秀运动员的EIB发病情况
自1984年美国首次大规模对夏奥项目运动员进行EIB调查,英国、德国、意大利、澳大利亚等国也相继对本国夏奥项目运动员开展EIB调查。EIB引发的运动猝死、药物滥用及违规治疗等,已使其成为危害运动员身心健康、破坏公平竞赛的重要问题。2008年,IOC-MC与WADA在瑞士洛桑达成共识,建议各国关注运动员的EIB问题,及早开展EIB的诊治预防工作(Kenneth et al.,2008)。自此,欧美等国家愈发重视运动员的EIB问题,并制定了多项“预防诊治”措施,如无氯泳池、EIB补剂及防护面罩等(Oliver et al.,2015;Seifert et al.,2017)。本研究对来自15个不同夏奥项目的411名运动员进行EIB调查发现,被试EIB发病率为26.5%,部分项目(如游泳、花游、曲棍球)的EIB发病率超过40%,游泳项目更是高达51.5%。对标西方主要体育国家公布的EIB数据(图5),我国夏奥项目运动员的EIB问题似乎更为严重,但国内对运动员EIB问题的重视程度严重不足,此次被确诊EIB阳性的109名运动员中,仅 3人已知患有 EIB,且只有 2人曾申请 EIB-TUE,剩余的106人(97.2%)均为首次确诊。这可能与以下4方面因素有关:1)训练量的巨大差异。在我国现有竞技体育人才培养模式下,运动员的训练时间(≥33 h/周)远高于西方国家运动员(≥15 h/周;Dauty et al.,2015)。2)空气环境质量相对较差。受工业化发展和城镇化建设等因素影响,近20年来我国的平均空气环境质量低于欧美等国家(Yin et al.,2020),且我国绝大部分训练场地处于闹市区,毗邻交通主干道。3)饮食结构不同。对比西餐,中餐大多存在食盐烹饪摄入量较高且维生素不足等问题,可能导致EIB风险的增加(Oliver et al.,2015)。因此,体育主管部门应尽快将EIB问题的预防、诊断、治疗工作纳入奥运备战保障体系。
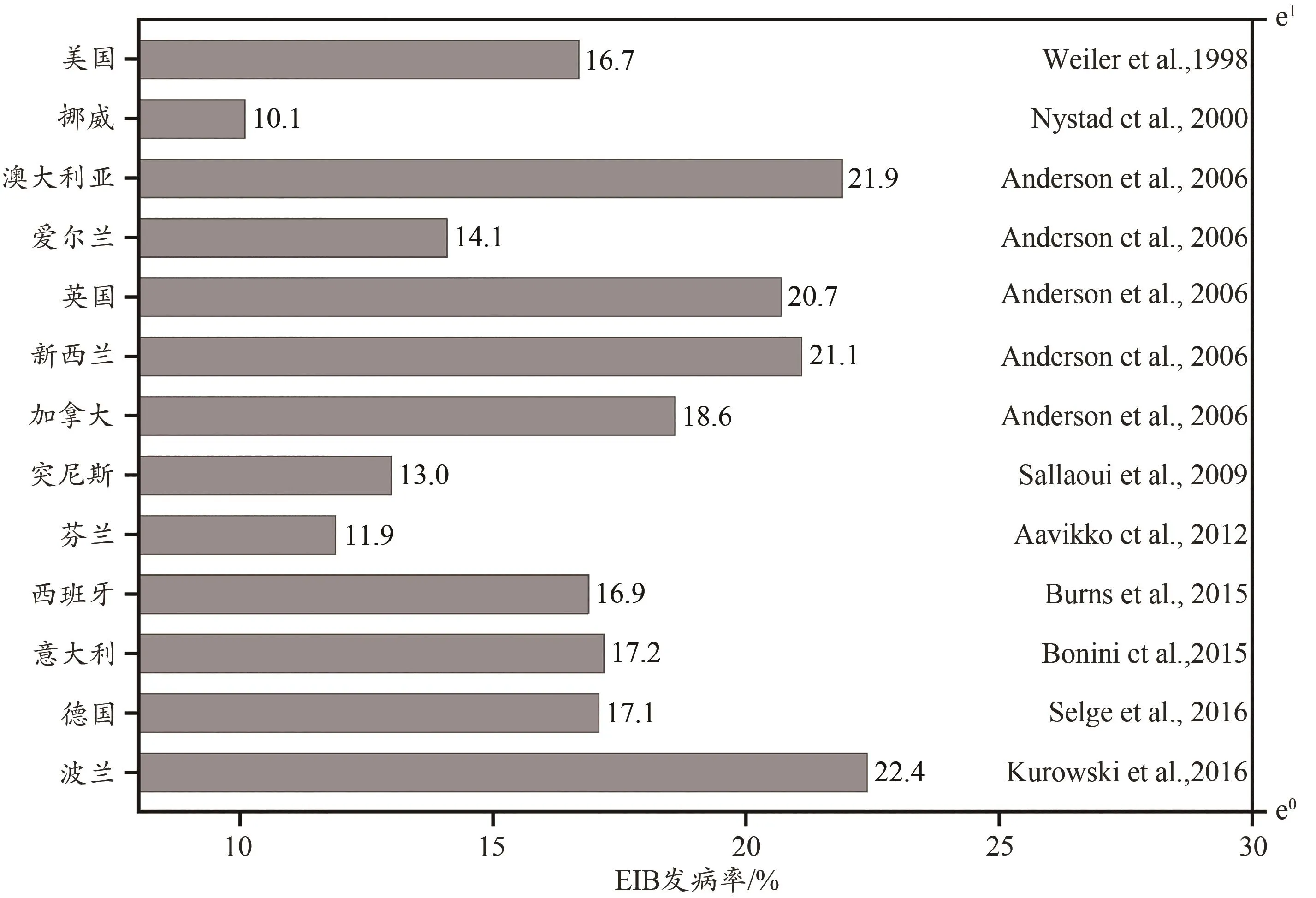
图5 主要体育国家EIB发病率Figure 5.The Incidence of EIB in Different Countries
EIB的产生是一个复杂的病理生理学过程,受激素分泌、专项特征、运动环境及竞技水平等内外因素影响,不同性别、运动项目、运动类型的运动员EIB发病率差异较大(5%~78%;Del et al.,2015)。相比男性,女运动员的EIB发病风险更高,例如,Simon等(2014)对130名同等竞技水平的优秀运动员(男65,女65)进行支气管运动激发实验发现,66.2%的女运动员被诊断为EIB阳性,显著高于男性(35.4%);Nystad等(2000)指出,来自7支美国国家队的男、女运动员的EIB发病率分别为18.0%和26.0%,与本研究结果基本一致。虽然也有研究指出,男性业余锻炼人群的EIB发病风险高于女性(Rodriguez et al.,2020),但其被试群体年龄跨度较大(19~73岁),且被试运动年限、项目、负荷强度及运动持续时间等差异较大,故研究结果难以推广至优秀运动员群体。
呼吸道的解剖结构不同可能是导致不同性别运动员EIB发病率差异的原因之一。女性呼吸道的横截面积约为男性的60%,在同等运动负荷条件下,女性更易出现呼吸道表层黏膜渗透压失衡(Archiza et al.,2021)。此外,性激素分泌水平的不同可能是另一个重要诱因。Raquel等(2017)发现,女性在青春期与绝经前哮喘发病率远高于同龄男性,而在青春期前和绝经后与同龄男性无明显差异。这提示,女性性激素分泌水平与EIB之间可能存在关联。Zhao等(2001)发现,呼吸道肥大细胞内有黄体酮受体,表明性激素参与了呼吸道炎症产生。Kristin等(2006)比较了女性EIB运动员在月经周期的通气功能变化,发现FEV下降率在黄体酮中期(黄体酮浓度最高)和卵泡中期(黄体酮浓度最低)分别为17.4%±2.3%和12.8%±3.4%,认为EIB发病风险与黄体酮的浓度呈正相关,女运动员在黄体酮分泌高峰期进行剧烈运动时可能更易发生EIB。Hellings等(2003)通过动物实验发现,雌性小鼠注射黄体酮后,呼吸道中的嗜酸性粒细胞数量及血清IL-5水平均显著上升,且支气管气道高反应性加重,认为黄体酮分泌会催生呼吸道炎症,间接诱发EIB。因此,女运动员在进行赛程安排时可通过避开黄体酮分泌高峰期来降低EIB发病风险。
专项特征(强度、时间及持续性)是导致不同项目运动员之间EIB发病率差异的另一主要因素(Chenuel,2020)。相比技巧和速度力量项目,耐力项目运动员的EIB发病率更高,2000—2008年连续3届夏奥会,耐力项目选手的平均EIB-TUE申请率始终保持在前3位(铁人三项,24.9%;自行车,17.2%;游泳,17.1%),技巧和速度力量项目一直占据后3位(拳击,1.7%;乒乓球,1.5%;举重,1.2%),二者之间相差超过10倍(Kenneth et al.,2008);英国271名夏奥会选手(来自13个运动项目)的EIB调查结果显示,游泳(44.4%)、自行车(39.1%)和曲棍球(31.3%)3个项目的EIB发病率最高,柔道(12.5%)、跆拳道(11.1%)和羽毛球(9.1%)最低(Anderson et al.,2006)。本研究同样发现,在纳入的15个夏奥项目中,我国耐力项目运动员的EIB发病率最高(37.3%),技巧(20.7%)和速度力量项目(20.0%)的发病率相对更低。现有研究表明,长期反复高通气量呼吸造成的呼吸道黏膜炎症,以及各种污染物、刺激物的伴随吸入造成的上皮组织损伤,是耐力项目运动员EIB高发的主要原因,通过环境改善和佩戴EIB防护面具可有效降低此类项目运动员的EIB风险(Couto et al.,2018;Seifert et al.,2017)。
田径作为一个大类项目,具有运动分项多、不同分项间的专项特征差异大等特点。在研究田径项目时,现有研究常将其作为一个整体来分析田径运动员的EIB发病率(Anderson et al.,2006;Kenneth et al.,2008)。但是,由于EIB与运动专项特征密切相关(Bonini et al.,2015b),不同田径分项,尤其是不等距离径赛项目(如短跑、竞走、马拉松等)运动员的EIB发病率可能存在很大差异。Del等(2015)综述指出,竞走、马拉松等长距离项目运动员出现EIB的风险较高,而100 m/200 m、400 m(栏)等短距离径赛项目运动员的EIB风险较低。本研究探究不等距离径赛项目运动员的EIB发病率发现,400 m(栏)项目运动员EIB发病率最高,其后依次为马拉松、100 m/200 m和竞走。研究结果与Del等(2015)的观点并不一致,这可能是因为运动强度对EIB发病风险的影响比运动持续时间更大。剧烈运动引发的呼吸道通气量陡增,会导致气道黏膜炎症和上皮细胞损伤,进而显著增加EIB风险(Ali et al.,2012);动物实验研究同样发现,为期21天的运动干预后,高强度组小鼠的气道炎症水平比低强度组高出78.0%,EIB风险显著增加(Decaesteker et al.,2021);也有部分研究认为,运动强度大于90%~95%最大心率时,运动员的EIB风险最高(Couto et al.,2018),400 m(栏)基本符合上述特征。由于相关资料有限,此问题有待进一步研究论证。
运动员所处的运动环境是诱发EIB的另一关键因素,且决定了不同项目运动员的EIB发病率(Rundell et al.,2013,2015)。对于室外项目,低温、干燥的空气是诱发EIB的主要原因。呼吸时,近端各级支气管需对吸入的空气(-10℃~25℃,20%~60%相对湿度)进行加温、加湿处理,以达到37℃、100%相对湿度的肺部气体交换标准(Kennedy et al.,2019)。此过程会加速呼吸道黏膜的水分和热量流失,进而增加EIB风险。Stensrud等(2006)发现,从潮湿环境(95%HR)转训至干燥环境(40%HR),运动员高强度运动后的FEV值显著下降,EIB发病率明显增加;Sant’Anna等(2019)指出,高强度运动时,FEV下降率会随吸入气体的湿度下降而上升,二者呈显著负相关。另外,户外环境中的工业污染物、雾霾粉尘及车辆尾气(如NO、SO)等会诱发呼吸道炎症,加剧气道上皮组织损伤,进一步增加EIB风险。Giles等(2019)发现,公路自行车运动员在车流量较大的交通主干道剧烈运动1 h后,诱导痰中的嗜酸性粒细胞、肥大细胞数量以及尿液样本中的CC16水平均显著性升高,且提升幅度大于在乡间公路环境骑行;McCreanor等(2007)对比EIB健身爱好者在交通要道(PM2.5=28.3 μg/m)和森林公园(PM2.5=11.9 μg/m)健步走2 h后各项通气指标发现,2组被试的FEV和FVC值均显著下降,但交通要道组的下降幅度更大。本研究发现,室外项目运动员的EIB发病率显著高于室内项目,这可能主要与上述环境因素有关,但仍需进一步研究以确定众多环境因素(低温、干燥、空气污染物等)中诱发EIB的主导因素,从而为室外项目运动员EIB预防策略的制定和治疗方案的选择提供支持。
泳池项目(游泳、花样游泳等)被认为是EIB风险最高的夏奥运动项目(Weiler et al.,2016)。例如,1996年亚特兰大奥运会,美国游泳运动员的EIB发病率高达30.0%,位居26个参赛项目之首(Weiler et al.,1998);2000年悉尼奥运会和2004年雅典奥运会,英国代表团中EIB发病率最高的项目均为游泳,分别为41.0%和44.0%(Anderson et al.,2006);2004—2009年,泳池项目运动员的EIB-TUE申请率始终保持在12.0%~25.0%,远超其他夏奥项目(Kenneth et al.,2008)。与上述报道类似,本研究被试中游泳和花样游泳项目运动员的EIB发病率在纳入的15个夏奥项目中分别位居第1位(51.5%)和第3位(40.0%)。泳池消毒剂(次氯酸钠、卤代乙酸盐等)是导致泳池项目运动员EIB高发的主要原因(Carter et al.,2019)。氯化物会与泳池内的微生物发生取代反应生成氯仿,与含氮化合物(尿、汗、痰等)反应生成氯胺,同时挥发出三卤甲烷类等,上述刺激物可通过呼吸道、皮肤进入体内,对各级呼吸道上皮组织造成直接或间接损伤,进而引发炎症,诱发EIB。Bernard等(2003)通过流行病学调查发现,青少年游泳运动员的每周训练时长不仅与EIB、哮喘发病率呈显著正相关,而且与肺部疾病血清标记物(肺表面活性物质相关蛋白A)含量呈显著的正向剂量-效应关系;同时,仅在室内泳池环境中静坐1 h也会导致上述蛋白物质含量的显著升高。另外,虽同为高强度对抗性项目,游泳运动员的EIB发病率(68.6%)显著高于拳击选手(8.3%),且前者诱导痰中的嗜酸性粒细胞、中性粒细胞计数及相关过氧化物酶含量也明显更高(Levai et al.,2016)。
3.2 肺通气功能及炎症反应特征分析
呼气流速指标(如FEV、FVC、MVV及PEF等)是反映肺通气功能变化以及进行EIB诊断、评估的主要临床指标(Couto et al.,2018)。其中,FEV值作为“第一”呼气流速指标,对EIB的临床诊断和预后治疗均具有重要意义(Ali et al.,2012)。前人研究指出,在正常情况下,由于运动后具有支气管扩张作用的前列腺素E的激活和释放(Stang et al.,2018),FEV值会缓慢上升或保持不变(Ali et al.,2012),本研究同样观察到健康组运动员的FEV值在运动激发实验后缓慢上升。然而,与健康组不同,本研究中EIB组运动员在支气管运动激发实验后,FEV值先逐步下降,在第5 min达到最低值后,再小幅缓慢回升,且始终显著低于同期健康组。多项研究已指出,支气管平滑肌收缩或痉挛是造成FEV值下降的主要原因(Ali et al.,2012;Kippelen et al.,2018)。高强度运动时,高通气量呼吸(最高可达200 L/min)和大量刺激物(如氯气、雾霾等)的伴随吸入,会导致近端各级呼吸道黏膜的水分“散发与补充”机制失衡,引发黏膜表面体液渗透压升高、黏膜纤毛清除率下降等问题,并导致白三烯、嗜酸性粒细胞、前列腺素E等炎症介质的大量释放,进而激活支气管平滑肌内的特异性受体,引发平滑肌收缩或痉挛。另外,本研究还发现,虽然EIB组的FEV值在5 min后逐步上升,但直至15 min时仍显著低于初始值。Sallaoui等(2009)也发现,运动激发实验后,EIB 运动员的 FEV值在第 2、6、10、15、20 min均显著低于健康运动员,且直至第30 min时才基本恢复至初始值。Weiler等(2016)推断,FEV值的恢复速度可能与运动强度及炎症介质数量有关,具体作用机制目前尚不明确,有待进一步研究探讨。
呼吸道气流受限是EIB的主要临床症状(钟南山等,2018)。呼吸道气流受限发生时,FVC、MVV及PEF等呼气流速指标会明显下降,继而引发呼吸肌做功负荷增加、最大摄氧量下降、通气/血流比例失调等问题,最终对运动表现产生不利影响(Price et al.,2014)。本研究发现,支气管运动激发实验后,EIB组运动员的FVC值和PEF值明显下降,MVV值虽无明显变化,但显著低于同期健康组。研究认为,除支气管平滑肌收缩或痉挛外,呼吸道的黏液过度分泌、长期慢性炎症、上皮组织的反复“损伤-修复”等造成呼吸道气流摩擦力增加及结构非均匀式狭窄、变形和重塑,进一步加剧了呼吸气流受限(Couto et al.,2018;Satia et al.,2021)。Kippelen等(2018)发现,相较健康人群,EIB患者较弱的气道上皮管腔输水能力易造成气道黏膜液体层的浓度上升,继而引发黏膜上皮基膜变厚、纤毛摆动弹性下降、颗粒细胞增多、气道表面“非规则性凹凸”等问题,显著增加吸入或呼出空气流经各级支气管时的摩擦力;与此同时,气道黏膜液体层的浓度升高还会刺激杯状细胞释放大量的黏液合成剂——黏蛋白5AC,该蛋白因子过量合成的黏液会在气道管腔内滞留形成阻塞、痰栓等,大幅降低呼吸道的气流顺畅性(Bougault et al.,2012)。另外,黏液的过度分泌造成呼吸道黏膜炎症呈慢性进行性发展,进而导致近端多级呼吸道(尤其是10~12级)的变形或小气道关闭,严重影响人体的呼吸效率(Satia et al.,2021)。呼吸道黏膜上皮的反复“损伤-修复”造成表层组织的胶原沉积、上皮纤维化及炎症介质的无规律分布,进而导致多级气道的重塑或非均匀式狭窄,进一步削弱呼吸道的气流流畅性(Kippelen et al.,2018)。
血液或痰液样本中,嗜酸性粒细胞、白三烯、白介素、前列腺素D等炎症细胞(或因子)的增多或升高,是EIB患者特有的免疫病理学特征(Kuchar et al.,2013),其对EIB发病风险的评估及确诊之后的干预治疗均具有重要指导意义。本研究发现,在无任何外部因素干扰下(安静状态),EIB组运动员的IL-6、IL-8水平及嗜酸性粒细胞、中性粒细胞计数均明显高于健康组运动员,其中,IL-8水平更是超出健康运动员1倍(P<0.001),这与前人研究结果一致。例如,Santos等(2020)发现,相较健康马拉松运动员,EIB马拉松运动员的IL-6、IL-8和IL-10水平更高,且上述炎症因子水平与EIB严重程度高度相关;Stang等(2018)对运动员进行了血液分析和肺功能测试,发现EIB游泳运动员IL-8水平和嗜酸性粒细胞计数明显高于健康运动员,且IL-8水平和FEV下降率显著相关,认为在日常训练中可通过监控血清白介素水平来评估和预测EIB的发病风险及发展趋势,这对EIB的预防与治疗具有较高的临床应用价值。此外,Chimenti等(2010)还发现,高强度运动结束后,EIB运动员诱导痰中的FeNO水平显著升高,而健康运动员无明显变化,认为诱导痰FeNO水平测试是一种预测EIB发病风险的有效方式,且相比采血测试,诱导痰测试具有无痛无创、操作简易等优点,便于在运动队推广使用。
除上述炎症细胞(或因子)外,尿液或血液CC16水平也是反映EIB发病风险的重要指标(Couto et al.,2018)。CC16是气道上皮细胞损伤的关键标记物,Marieann等(2021)发现,剧烈运动后,EIB马拉松运动员中发生呼吸不适症状的人数比例、诱导痰中破损上皮细胞的数量以及尿液CC16水平均显著高于健康运动员,认为高通气量呼吸导致的黏膜上皮损伤是造成上述结果的重要原因。Romberg等(2017)研究指出,支气管运动激发实验后,EIB与健康运动员的尿液CC16水平均明显升高,但EIB组的增加幅度要远大于健康组;FEV值与CC16水平显著相关,随着CC16水平的上升,EIB运动员的病情逐步恶化。在此基础上,本研究对比完全安静状态下(剧烈运动结束后24 h)EIB与健康运动员的血清CC16水平发现,EIB运动员的血清CC16水平仍显著高于健康运动员,这提示我们,高通气量造成的呼吸道上皮组织应激性损伤不是短时性的,需较长时间(>24 h)才能恢复。
4 结论
本研究对15个夏奥项目411名优秀运动员进行支气管运动激发实验发现,我国夏奥项目优秀运动员面临严峻的EIB问题。我国夏奥项目优秀运动员的EIB发病率呈现三大特点:女性运动员高于男性运动员,室外项目高于室内项目,泳池项目高于其他项目。鉴于此,我国运动员、教练员及体育主管部门应高度重视运动员的EIB问题,及早部署,并研究相应的预防策略和治疗方法。另外,相比健康运动员,EIB运动员表现出明显的肺通气功能障碍及呼吸道炎症反应症状。建议一线科研和医疗人员通过监测相关炎症因子(如IL-8、CC16)的变化来预测或评估运动员EIB的发病风险或发展趋势,并通过多种非药物性措施(如无氯泳池、防霾场馆及营养补剂等)来预防或治疗EIB。

