不同方法在中枢神经系统感染病原学诊断中的价值
曾国芬,李晓杰,梁家隐,韩翔飞,雷姿颖,徐乐加,陈兰停,胡 波,高志良,刘 静
(中山大学附属第三医院 1. 感染科; 2. 检验科; 3. 药剂科,广东 广州 510630)
中枢神经系统(central nervous system,CNS)感染是常见的致残、致死性疾病,2017年全球患病人数约有1 730万例,伤残生活年数超过145万[1]。高效、准确的病原体诊断是正确治疗的前提[2],在CNS感染的诊治中发挥着关键作用。然而,常规的病原体检测技术,如直接镜检(革兰染色、墨汁染色等)、细菌/真菌培养、抗原抗体检测、传统核酸检测具有敏感性低、特异性差、通量低等缺点,难以满足临床的需求。文献报道,几乎有一半的脑膜脑炎患者没有确定病因[3],无明确病原体脑炎的病例更是高达69.8%[4]。快速分子诊断是新兴的病原体诊断技术,具有检测周期短、操作简单,可有效提高病原体诊断及指导抗微生物治疗等优点。近年来宏基因组第二代测序(metagenomics next-generation sequencing,mNGS)广泛运用于临床,提高了诊断水平,但存在缺乏检测标准、耗时长、背景菌干扰大等困境[5]。FilmArray meningitis/encephalitis (FA ME) panel是一款基于多重PCR (polymerase chain reaction)原理的自动化快速分子诊断设备,可在1 h检测14种最常见的急性CNS感染病原体。2015年FA ME被美国食品药品监督管理局批准用于临床,目前已在国外多个国家使用,但在我国大陆的使用较少。本研究以某院收治的疑似CNS感染患者为研究对象,回顾性分析FA ME及mNGS在CNS感染病原体诊断的效果,并结合细菌/真菌培养、病毒核酸/血清学结果进行比对分析,帮助临床医生正确认识以上方法的检测性能,提高CNS感染的诊断水平。
1 对象与方法
1.1 研究对象 本研究为单中心、回顾性、观察性研究。以2020年6月—2021年1月中山大学附属第三医院收治的疑似CNS感染患者为研究对象,采取以下纳入与排除标准收集脑脊液(CSF)标本进行FA ME检测。纳入标准为:(1)有CNS感染的临床表现,如发热、头痛、呕吐或意识改变,神经定位体征等;(2)患者均已进行入院常规检测,如血常规、炎性指标、CSF常规及生化、CSF涂片或培养等项目;(3)CSF常规显示白细胞(WBC)升高;(4)主管医生认为不能排除CNS感染的患者。排除标准:外伤导致的CNS感染。病原学诊断细菌、真菌以培养为金标准,病毒以病毒核酸或血清学检测为金标准。研究最终纳入患者29例。所有的检测结果均由主管医疗组医生根据患者临床情况(症状、体征、实验室检查、影像学检查及治疗反应等)进行分析,作出最终诊断。本项目遵循的程序符合伦理学标准,已通过中山大学附属第三医院医学伦理委员会批准,伦理批件号为:中大附三医伦[2020]02-130-01,临床试验注册号为ChiCTR2000038045。
1.2 FA ME panel FA ME panel是利用巢式多重PCR技术进行的一站式多重病毒体分子检测系统。该设备集核酸提取、扩增及产物检测为一体,同时检测14种常见CNS感染的病原体,包括6种细菌(大肠埃希菌、流感嗜血杆菌、产单核细胞李斯特菌、脑膜炎奈瑟菌、无乳链球菌、肺炎链球菌),1种真菌(新生隐球菌)和7种病毒(巨细胞病毒、肠病毒、单纯疱疹病毒1型、单纯疱疹病毒2型、人疱疹病毒6型、人双埃可病毒、水痘带状疱疹病毒)。本研究严格按照厂家说明书使用FA ME进行检测。
1.3 mNGS 本研究的mNGS检测结果来自于金域、予果生物、杰毅生物等测序公司。基本检测流程包括标本采集、核酸提取、文库建立和生物信息学分析。mNGS结果判断标准参考既往文献[6]。
1.4 实验室检查 所有入组患者由主管医生根据临床情况安排入院常规检测项目,包括血常规、炎性指标、血清学检测、巨细胞病毒(cytomegalovirus,CMV)核酸、EB病毒核酸、CSF常规、CSF生化、隐球菌抗原、CSF涂片或培养等项目。各检测项目均根据规范的检测流程在医院检验科完成。
1.5 统计分析 应用SPSS 25.0软件进行统计分析。患者临床特征、病原体检出情况采用例数及百分比表示,组间差异比较采用Fisher’s确切概率检验,P≤0.05为差异具有统计学意义
2 结果
2.1 患者临床资料 29例CNS疑似感染患者,男性23例(79.3%),24例(82.8%)患者年龄≥18岁。29例患者均进行FA ME检测,1例为无效检测。22例患者完成了mNGS检测。所有患者根据临床需要接受入院血常规、炎性指标、血清学、核酸、CSF常规及生化、CSF涂片或培养等院内检测。29例患者进行腰穿,其中22例(75.9%)患者在腰穿前使用了抗菌药物。26例(89.7%)患者为社区获得CNS感染,3例(10.3%)为医院术后相关感染。临床特征资料见表1。
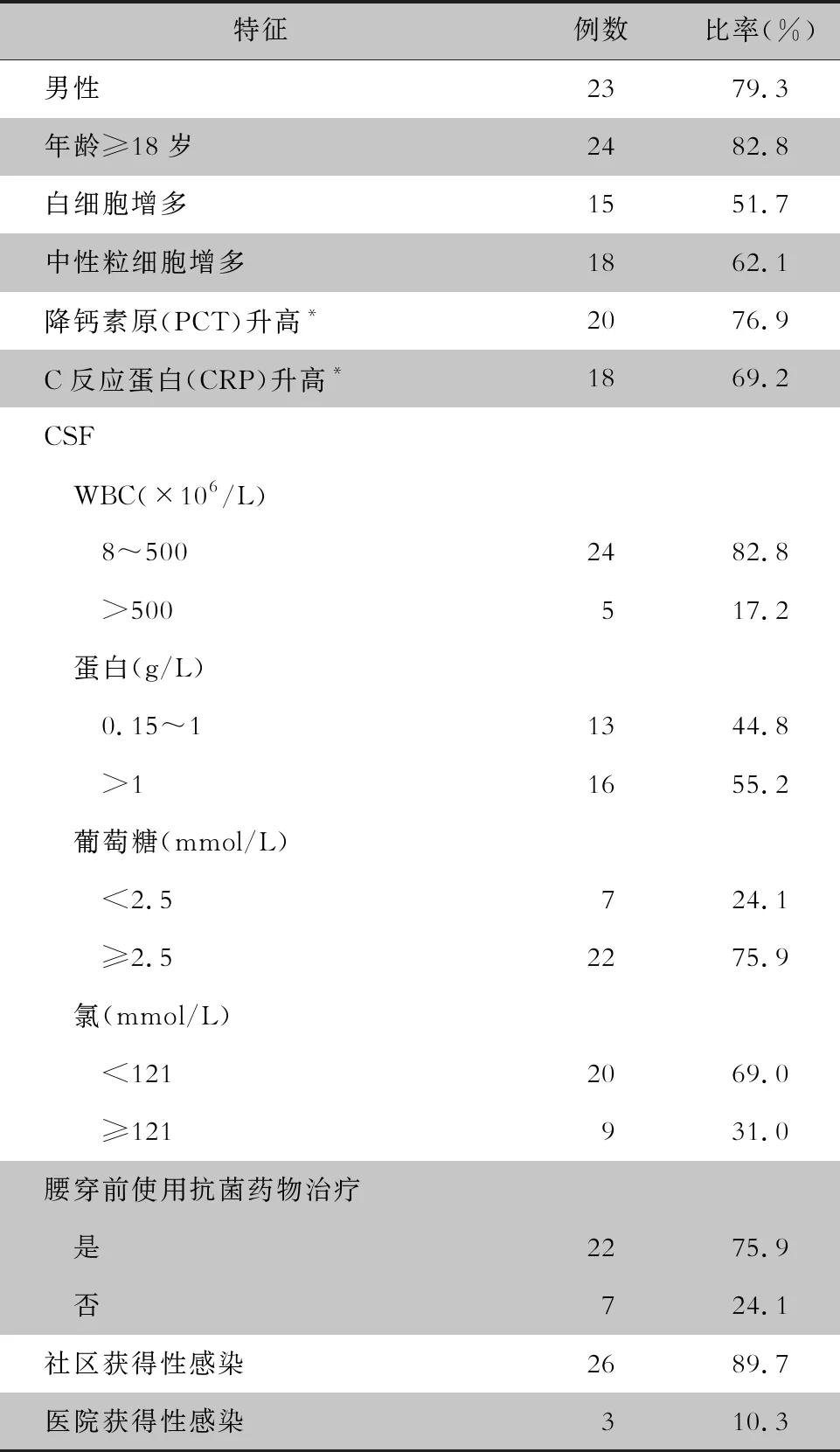
表1 29例CNS患者临床特征
2.2 病原体检出情况 FA ME、mNGS细菌阳性率分别为7.1%、9.1%,数值高于细菌培养(3.4%),但差异无统计学意义(P=1.000)。FA ME检出的病原体分别为产单核细胞李斯特菌(2株)、大肠埃希菌(1株)、肺炎链球菌(1株),其中2株产单核细胞李斯特菌经临床综合判断后为假阳性。mNGS分别检出肺炎链球菌、草分枝杆菌、无乳链球菌各1株,其中草分枝杆菌经临床判断为污染菌。培养获得耐甲氧西林金黄色葡萄球菌、藤黄微球菌及模仿葡萄球菌各1株,结合临床判断藤黄微球菌、模仿葡萄球菌为污染菌。1例患者mNGS及细菌培养阴性,FA ME检出大肠埃希菌,符合患者病情,判断为感染病原体。
真菌方面,FA ME、mNGS阳性率分别为10.7%、13.6%,均低于真菌培养(17.2%),差异具有统计学意义(P=0.003)。FA ME及培养检出的真菌均为隐球菌,mNGS检出隐球菌外,有1株为念珠菌属。其中念珠菌属经临床判断为假阳性。FA ME未检出的病例为隐球菌负荷最低的2例患者。
FA ME、mNGS对于病毒阳性率分别为3.6%、18.2%,高于院内病毒核酸/血清学检测(0)。FA ME检出巨细胞病毒(CMV)及单纯疱疹病毒2型各1株,其中CMV结果经临床综合判断后为假阳性。mNGS分别检出CMV 4株,人类(伽马)疱疹病毒4型、EB病毒及鼻病毒B各1株。其中2株CMV经临床判断为假阳性。1例患者mNGS及院内病毒核酸/血清学检测均为阴性,FA ME检出单纯疱疹病毒2型,经临床判断符合患者病情,判断为感染病原体。3例患者FA ME及院内病毒核酸/血清学检测为阴性,mNGS分别人类(伽马)疱疹病毒4型、鼻病毒B和CMV,经临床判断为感染病原体。见表2、3。
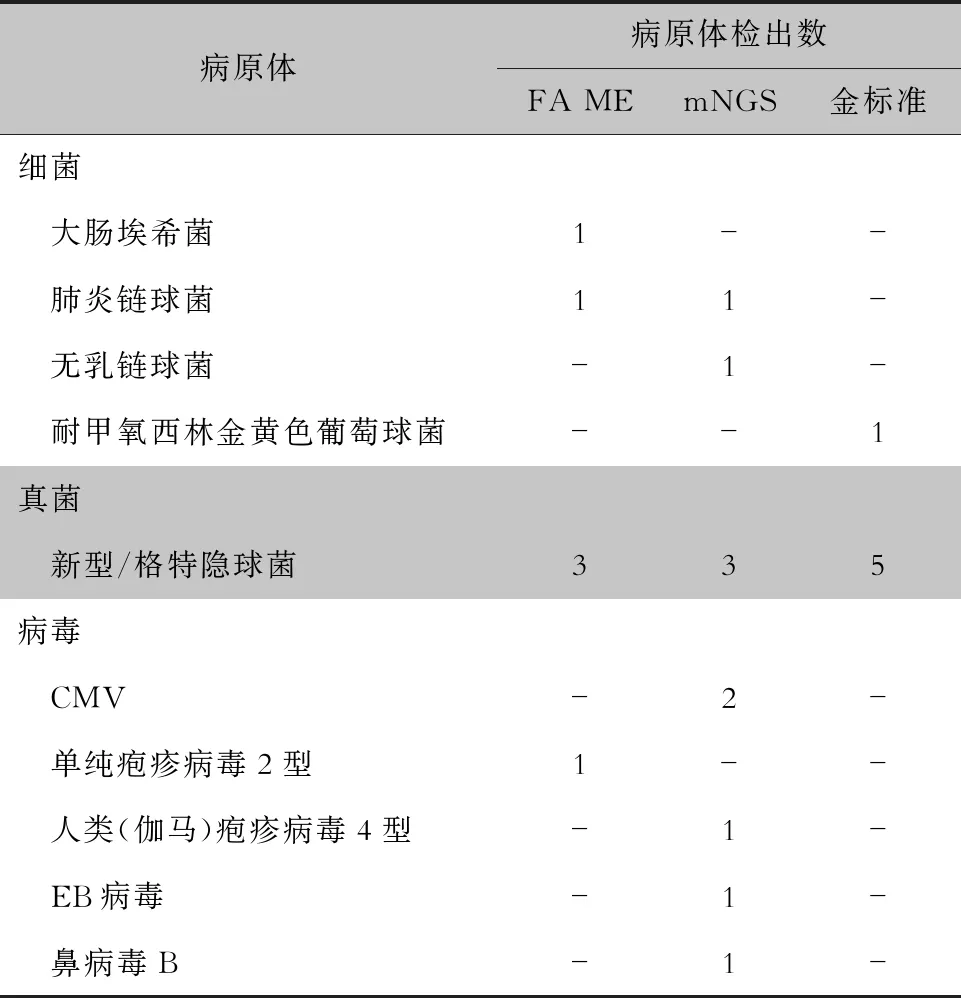
表2 FA ME、mNGS、金标准方法病原体检出情况
同时完成FA ME、mNGS和院内检测三种方法的21例患者,2例检出隐球菌,11例检测结果为阴性,三种检测方法结果一致。

表3 FA ME、mNGS、金标准方法病原体检出率
3 讨论
CNS感染是临床的危急重症,标本采集前普遍使用抗菌药物,加之CSF中病原菌负荷本身较低,传统的院内检测病原体方法确诊率很不理想。快速、准确的病原学诊断是目前研究的重要方向。近年来,一系列快速分子诊断设备的涌现使得许多疑难的、新的病原体诊断成为可能。本研究结果显示,FA ME在CNS感染病原体诊断中具有积极的作用。3例患者院内检测阴性,而FA ME检测明确了病原体,分别为大肠埃希菌、肺炎链球菌、单纯疱疹病毒2型感染。
病原学快速诊断使早期的特异性治疗成为可能,虽然FA ME很有吸引力,但需要注意假阳性及假阴性的情况。文献[7]报道,FA ME检出1型单纯疱疹病毒假阳性,导致结核性脑膜炎病例误诊为病毒性脑炎而延误病情。本研究结果亦显示,FA ME检出的2株产单核细胞李斯特菌及1株CMV经临床认定为假阳性。研究[3,8-9]发现,FA ME在隐球菌诊断方面出现假阴性,甚至在隐球菌抗原、涂片及培养均获得阳性结果的病例中仍未能检出隐球菌。本组5例隐球菌感染病例中,FA ME检出率为60.0%,培养阳性率为60.0%,墨汁染色及隐球菌抗原阳性率均高达100%。因此,当怀疑隐球菌性脑膜炎时,建议使用细菌涂片、培养作为首选的检查方法。另一方面,FA ME包含自动化报告输出系统,检测完成后可自动报告结果,有研究发现自动化报告存在假阴性[10]。本组病例检测过程中有3例(1例大肠埃希菌及2例产单核细胞李斯特菌)原始报告呈假阴性。临床实践中不应盲目相信FA ME报告系统输出的结果,而应检查每个病原体靶标的溶解曲线后作出最后结论,必要时复查。特别是对于免疫抑制患者,FA ME的数据目前尚缺乏,在FA ME出现阳性结果时注意甄别是否为责任病原菌,而结果为阴性时也应慎重下结论,避免假阴性,不应盲目减少经验性治疗,以免延误病情[7,11]。
本研究显示,产单核细胞李斯特菌及CMV是CNS感染中假阳性率最高的病原体。产单核细胞李斯特菌是一种革兰阳性杆菌,是重要的食源性病原体,可导致多种临床综合征,包括母婴感染、败血症和CNS感染等[12]。神经李斯特菌病是致命的CNS感染,研究显示仅39%的神经李斯特菌病患者存活并完全康复,长期的后遗症超过了细菌性脑膜炎和感染性脑炎[12-14]。产单核细胞李斯特菌对头孢类抗生素天然耐药,常规针对脑膜炎的经验性治疗不能充分治疗该菌引起的颅内感染,而传统培养的阳性率低[15],临床表现缺乏特异性[12],故神经李斯特菌病的诊断常常面临困境。有学者认为,FA ME检测产单核细胞李斯特菌病原是特别有利的,因为针对这些病原体的PCR检测在其他商业检测方法中不常用[3]。已有文献报道,培养阴性的CNS感染,FA ME快速诊断出产单核细胞李斯特菌脑干脑炎,进而及时采用特异性的抗菌治疗挽救了患者生命,同时减少了不必要的抗菌药物暴露[15]。然而,产单核细胞李斯特菌广泛存在于自然界中,腰穿操作、标本检测等过程中均可能受到环境污染,本研究中FA ME检出的2株李斯特菌均被证实为污染菌,无特异性抗李斯特菌治疗即好转。因此,临床实践中应特别注意结合临床和检测结果,进行综合判断。
CMV易引起潜伏感染,故CSF中容易被检测到。CSF中CMV的检出可能为原发感染,亦可能是潜伏感染或感染的再激活[16],是否为真正的责任病原体需综合临床情况。事实上,FA ME中的疱疹病毒,包括单纯疱疹病毒1型、单纯疱疹病毒2型、CMV、水痘-带状疱疹病毒、人疱疹病毒6型均可出现类似假阳性的情况,临床实践中应注意甄别[16]。另一方面,Hanson等[17]曾报道FA ME出现CMV假阴性的情况。本研究中有1例病例FA ME检测CMV阴性,mNGS检测阳性,而结合临床最终考虑为CMV脑膜脑炎。研究发现,FA ME的病毒检测敏感性低于单基因PCR检测[18],因此,推测该假阴性的结果可能由样本中病毒载量低导致,亦可能受限于FA ME对病毒的检测性能[19]。
FA ME主要针对社区获得性CNS感染病原体,不适合用于院内感染的CSF标本[20],有学者认为医院或术后脑膜炎的患者不应进行FA ME检测[7]。本组3例医院获得的CNS感染病例FA ME检测均为阴性,亦支持该观点。
mNGS是目前临床上广泛使用的新型病原学诊断手段。通过对临床样本的DNA或RNA进行鸟枪法测序,可以无偏倚地检测多种病原微生物,但因价格较高,操作过程复杂,检测流程及结果判读缺乏统一的标准等原因,导致推广受到一定的限制。尚无官方机构正式批准的适应证及推荐领域,结果原则上需要其他方法验证,不能单独作为病原学确诊或排除的证据[21]。在CNS感染中,mNGS已成功检测到多种新发及少见病原体,提高了病原体的检出率[22],目前被推荐为急性CNS感染的二线首选及慢性CNS感染的首选检测手段[23]。本研究结果显示,mNGS较细菌培养具有更高的阳性率,尤其在病毒检测方面优势突出,但亦存在假阴性的情况(单纯疱疹病毒2型、大肠埃希菌及隐球菌)。因此临床实践中应根据患者的病情个体化选择检测方案。
以往研究FA ME在浙江及上海医疗机构收治的儿童(小于18岁)CNS感染诊断中的效果,显示FA ME在CNS感染诊断中的运用前景[24-25]。本研究对象多来自成人,82.8%患者大于18岁,且来自南方地区,是FA ME在大陆真实世界中为数不多的实践研究。如今mNGS在我国已广泛应用,本研究结合mNGS进行对比分析,进一步提高了研究的实用性,研究结果具有较好的临床借鉴作用。
单中心、回顾性研究及样本量小是本研究的不足。纳入的29例可疑CNS感染患者接受了FA ME检测和院内常规检测,仅22例进行mNGS检测。另外,本研究来自真实世界临床实践,纳入的病例来自全院不同科室,进行mNGS检测的公司不尽相同,测序平台、核酸提取试剂及判断阈值均可能存在差异,因此,本研究结果有赖于后续开展大样本量前瞻性研究进一步验证。
综上所述,FA ME、mNGS可作为传统检测的补充手段提高CNS感染病原体检出水平。鉴于CNS感染的严重性及复杂性,临床医生应综合临床情况个体化选择检测方法,并注意对结果的正确解读。
致谢:感谢患者的理解及生物梅里埃公司的技术支持。
利益冲突:所有作者均声明不存在利益冲突。

