龟肉蛋白肽延缓果蝇衰老的作用及机制研究
吴俊豪,王 晶,KHO SETHYKUN,覃 川,王倩倩,余 鹏,冯凤琴,
(1.浙江大学生物系统工程与食品科学学院,浙江杭州 310058;2.浙江大学宁波研究院,浙江宁波 315100;3.余姚市冷江鳖业有限公司,浙江宁波 315400)
衰老,通俗来说是指生物体的生长发育经过成熟期后,随着年龄的继续增长,生物个体的器官功能性和内环境稳定性等发生不可避免地下降或衰退,从而趋向死亡的过程与状态[1-2]。许多慢性疾病,如风湿免疫病、心脑血管疾病和中枢神经病等,都与衰老有着密切的联系[3-4]。衰老是受基因与环境等多重因素影响的复杂表型,其具体机理目前尚无定论,而自由基学说是目前衰老研究领域较有说服力的理论学说[3]。该学说认为,机体的自由基水平会随着有氧代谢增加,过剩的自由基会引发脂质的过氧化,破坏细胞的氧化还原稳态,造成组织的不可逆损伤,最终导致机体的衰老[5-7]。随着社会发展和科技进步,人们对于延缓衰老的需求也在增加,开发天然的抗氧化功能性食品具有重要的现实意义。过往研究表明,抗氧化肽不仅具有优良的自由基清除能力,而且稳定性好、无免疫反应[8-10]。Chen 等[11]酶解深红鲷鱼鱼鳞得到的抗氧化肽能有效延长果蝇的平均寿命、最高寿命和半数死亡时间。Ding 等[12]通过酶解和纯化从鹿茸中提取的抗氧化四肽Trp-Asp-Val-Lys 能有效抑制斑马鱼体内活性氧的生成。Tonolo 等[13]研究证实,四种牛奶衍生肽在细胞内的抗氧化作用主要通过激活Keap1-Nrf2 信号通路完成。由此可见,生物活性肽的抗衰老功能研究潜力巨大,开发新型抗氧化肽是食品与医药领域值得关注的重点方向。
乌龟肉在我国有着悠久的食用历史,传统中医认为乌龟肉有润肺滋阴、舒通心气的作用,兼具了营养和药用价值[14-15]。石扬等[14]以中华草龟为原料,通过酶解和葡聚糖凝胶柱层析得到了高纯度的抗肿瘤活性肽。杨昭等[15]利用碱性蛋白酶和复合蛋白酶对中华草龟、中华花龟和鳄龟肉进行水解,结果表明龟肉酶解液具有较高的自由基清除率,推测其具有抗氧化作用。现阶段关于龟肉蛋白肽的研究主要集中在抗肿瘤活性和体外抗氧化活性方面,但是并未涉及动物寿命实验、体内抗氧化活性以及基因表达等相关方向。寿命是评价抗衰老作用最为直接的观测指标[16],而果蝇有着生活史短、易于繁殖、含有人类75%已知疾病的同源基因等优良特性,是抗衰老研究中常用的动物模型[17]。本研究以果蝇作为模型,用含不同剂量龟肉蛋白肽的培养基喂养,通过生存实验以及体内SOD、CAT 活性和MDA 含量的测定来评价龟肉蛋白肽的抗衰老功能,并通过测定抗氧化相关基因Sod1、Sod2和Cat以及寿命相关基因mth、Rpn11的表达来探究龟肉蛋白肽的抗衰老机制,期望为开发龟肉蛋白肽抗衰老功能食品提供相关的理论依据。
1 材料与方法
1.1 材料与仪器
新鲜乌龟肉 余姚市冷江鳖业有限公司;Canton-S 黑腹果蝇 浙江中医药大学动物实验中心;动物蛋白酶A1(200000 U/g) 南宁庞博生物工程有限公司;细胞色c、抑肽酶、杆菌肽、甘氨-甘氨-色氨-精氨酸和甘氨酸-甘氨酸-甘氨酸标准品(纯度≥95%)上海阿拉丁生化科技股份有限公司;总超氧化物歧化酶、过氧化氢酶、丙二醛试剂盒 南京建成生物工程研究所;FastKing cDNA 第一链合成试剂盒、RNA simple 总RNA 提取试剂盒 天根生化科技(北京)有限公司。
Legend Micro 高速台式离心机 赛默飞世尔科技(中国)有限公司;RE-3000A 型真空旋转蒸发器郑州南北仪器设备有限公司;Ultimate3000 高效液相色谱仪 美国Dionex 公司。
1.2 实验方法
1.2.1 龟肉蛋白肽的制备 参考张永进等[18]的方法稍作修改,将新鲜乌龟肉洗净切块、去除脂肪,蒸煮3 h 后匀浆,加入动物蛋白酶A1,50 ℃恒温酶解6 h后取出,立即置于沸水浴中灭酶20 min,然后过滤并离心,取上清液蒸发浓缩、冷冻干燥得到龟肉蛋白肽粉末。
1.2.2 龟肉蛋白肽的营养成分分析 参照GB 5009-2016《食品安全国家标准》中相应的方法测定龟肉蛋白肽的水分、灰分、蛋白质、酸溶蛋白质等含量。
1.2.3 龟肉蛋白肽分子质量及分布测定 参照GB 5009-2016《食品安全国家标准》,利用高效液相色谱法进行测定。样品处理方法:精确称取0.02 g 龟肉蛋白肽样品,定容到10 mL 并混匀,使用微孔滤膜(0.22 μm)过滤后进样检测。
色谱条件:TSK gel 2000 SWXL 分析柱(300 nm×7.8 mm),柱温30 ℃,流动相按照乙腈:水:三氟乙酸=450:550:1(v/v/v)的比例配制,进样体积20 μL,流速0.5 mL/min,于220 nm 检测波长下运行30 min。分别以高纯度标准品甘氨酸-甘氨酸-甘氨酸(189 Da)、甘氨-甘氨-色氨-精氨酸(451 Da)、杆菌肽(1450 Da)、抑肽酶(6512 Da)以及细胞色c(12400 Da)的保留时间对分子量的对数作标准曲线,得到y=-0.2187x+6.7329(R2=0.9901),进一步计算得到龟肉蛋白肽的分子质量,单位为Da。
1.2.4 龟肉蛋白肽的氨基酸组成测定
1.2.4.1 样品前处理 参考史晋源等[19]方法,取20 mg龟肉蛋白肽粉末置于15 mL COD 消解瓶,滴加1 mL盐酸溶液(6 mol/L),同时充入适量氮气,立刻密封消解瓶,150 ℃恒温加热1.5 h,随后冷却至室温。取各氨基酸对照品10 mg,超声溶解于0.1 mol/L 盐酸溶液,定容至25 mL 得到氨基酸标准溶液。
1.2.4.2 氨基酸衍生化反应 流动相A 为乙酸钠溶液(0.1 mol/L,pH6.5);流动相B 为经过超声脱气的80%乙腈溶液;按乙醇:水:三乙胺=2:2:1(v/v/v)的比例配制再干燥液;按异硫氰酸苯酯:乙醇:三乙胺:水=1:7:1:1(v/v/v/v)的比例配制衍生溶液;按流动相A:流动相B=9:1(v/v)的比例配制样品稀释液。将不同量的氨基酸标准液(1、5、10、15、20 μL)分别与6 μL 水解液加入1.5 mL 离心管中,依次加入10 μL 再干燥液和20 μL 衍生溶液,涡旋混匀,期间多次使用氮气干燥,依次加入50 μL 流动相B 和450 μL 流动相A,涡旋混匀,经膜过滤后进样上机检测。
1.2.4.3 高效液相色谱的测定条件 C18色谱柱(4.6 mm×250 mm,5 μm),柱温38 ℃,进样体积10 μL,流速1 mL/min,于254 nm 波长下运行。以乙酸钠溶液(0.1 mol/L,pH6.5)作为流动相A,经过超声脱气的80%乙腈溶液作为流动相B,梯度洗脱时间见表1。以各氨基酸的峰面积为横坐标,氨基酸标液的质量浓度为纵坐标,分别进行线性回归分析,得到各氨基酸的标准曲线,用于龟肉蛋白肽样品中各氨基酸的定性和定量分析。

表1 梯度洗脱时间Table 1 Gradient elution time
1.2.5 果蝇培养基的制备 基础培养基的配方为105 g 玉米粉、40 g 酵母粉、75 g 白砂糖、7.5 g 琼脂、10 mL 丙酸及1000 mL 纯净水。样品培养基配制方法和剂量选择参考史晋源等[19]的方法,在基础培养基中加入不同剂量龟肉蛋白肽,将实验组培养基配成对照组(空白)、低剂量组(0.2%)、中剂量组(0.4%)和高剂量组(0.8%),按40 g/瓶分装于玻璃瓶中用于果蝇扩种,按5 g/管分装于玻璃试管中用于果蝇的寿命分析。
1.2.6 果蝇扩种 果蝇的饲养环境为温度25 ℃,湿度60%~70%,昼夜12 h 交替。将果蝇从保种瓶转移到新的扩种瓶中,通入CO2使其全部麻醉,在果蝇挑取板上区分雌雄性别,按照雌:雄=40:20 转入含基础培养基的瓶中进行交配产卵。5 d 后放出初代果蝇,培养约10 d,羽化的果蝇即为亲代果蝇。将亲代果蝇按照雌雄比40:20 接入实验饲料组,第5 d 放飞亲代果蝇,约第10 d 飞出的果蝇即为接种果蝇。
1.2.7 果蝇生存试验 将24 h 内羽化的果蝇转入空瓶,通入CO2麻醉以区分雌雄性别。各试验组试管饲养30 只雌性或雄性果蝇,重复10 次。每隔3 d 给各试管果蝇换新培养基,观测各试管果蝇的存活数,计算果蝇实验常用的寿命指标[20](半数死亡时间、平均寿命、平均最高寿命、平均寿命延长率以及存活率),同时绘制雌雄果蝇的生存曲线。各项寿命指标的计算公式如下:

1.2.8 果蝇抗氧化活性实验 参考Xin 等[21]和张明等[22]的方法,分别于20 d 果蝇青年期和40 d 果蝇老年期时,使用CO2麻醉果蝇并加生理盐水制成10%组织匀浆,置于低温离心机中离心15 min(4 ℃,8000 r/min),取上清液,使用试剂盒分别测定每组雌、雄果蝇的总SOD、CAT 活性和MDA 含量。
1.2.9 果蝇基因表达实验 参考张晓寒等[23]的实验方法稍作修改,选取基础培养基为空白对照组,选取果蝇生存实验和抗氧化活性实验的最佳剂量,即0.8%龟肉蛋白肽为实验剂量,选择生存实验延寿效果较好的雌性果蝇为实验对象,重复上述果蝇培养和扩种实验,在第21 d 时,参照相关试剂盒说明进行果蝇总RNA 提取和cDNA 合成。以cDNA 为模板,利用荧光实时PCR 检测其抗氧化相关基因Sod1、Sod2和Cat,以及寿命调节相关基因mth、Rpn11的mRNA表达水平。引物序列见表2,以rp49为内参基因,基因表达以PCR 的2-ΔΔCt值表示。

表2 引物序列Table 2 Primer sequences
1.3 数据处理
本研究使用SPSS 22.0 软件分析统计学差异,各项数据以平均值±标准差(Mean±SD)表示,组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05 为差异有统计学意义。使用Graphpad Prism 9 软件绘图。
2 结果与分析
2.1 龟肉蛋白肽营养成分分析
龟肉蛋白肽的部分成分含量见表3。龟肉的蛋白酶解产物中含有大量蛋白质,占总营养成分的86.49%,其中85.98%为酸溶蛋白,而且水解度高达32%。酸溶蛋白含游离氨基酸和小肽,具有较低的分子量,可以很好地溶于酸性溶液中[24],说明龟肉蛋白肽在体内容易被消化吸收。

表3 龟肉蛋白肽的营养成分Table 3 Nutrient content of PTPDP
2.2 龟肉蛋白肽分子质量分布
蛋白酶解产物中,分子量相对较小的肽链片段往往会表现出更强的抗氧化活性[25]。申彩虹[26]通过酶解法制备得到了海参寡肽(130~2000 Da)和海参多肽(2000~5000 Da),前者的抗氧化能力显著强于后者。另一研究也显示,鲈鱼肉水解所得肽段中抗氧化活性最强的肽段同时相对分子质量也最小[27]。龟肉蛋白肽分子量分布情况见表4,其中分子量为180~500 Da 的肽段含量最大,占60.39%。龟肉蛋白肽中94.71%的肽段为1000 Da 以下的小肽,因此推测其具有潜在的抗氧化功能。

表4 龟肉蛋白肽分子量分布Table 4 Molecular weight distribution of PTPDP
2.3 龟肉蛋白肽氨基酸组成
过往研究表明,甘氨酸和谷氨酸是内源性抗氧化剂谷胱甘肽的组成氨基酸[28],谷氨酸还参与红细胞的生产,具有抵抗记忆力减退、改善脑细胞等抗衰老作用[29];精氨酸与细胞增殖、信号传导等多种生物学功能相关,可改善多种衰老相关疾病[19,30];支链氨基酸,包括缬氨酸、亮氨酸及异亮氨酸在内,可以有效延长实验小鼠的各项寿命指标,具有抗氧化、延缓衰老的作用[31];此外,丙氨酸、脯氨酸、苯丙氨酸、赖氨酸也被广泛认为具有抗氧化功效[19]。龟肉蛋白肽由16 种氨基酸组成(见表5),上述10 种具有抗氧化、抗衰老功能的氨基酸共占80.30%,其中甘氨酸(15.79%)、谷氨酸(14.70%)和脯氨酸(9.73%)的相对含量最高。因此推测龟肉蛋白肽可能具有抗氧化、延缓衰老的作用。
2.4 龟肉蛋白肽对果蝇寿命的影响
寿命是评价抗衰老作用的生物实验中最直接的观测指标,果蝇实验中,通常用半数死亡时间、平均寿命、平均最高寿命和平均寿命延长率作为观测指标[16]。不同剂量龟肉蛋白肽对雌、雄果蝇寿命的影响如表6 所示,除低剂量组果蝇的半数死亡时间外,各实验组果蝇的各项寿命指标均较对照组有所上升,且对寿命的延长效果随喂食龟肉蛋白肽的含量增加而升高。对于雄性果蝇,高剂量组的平均寿命极显著增加(P<0.01),平均最高寿命显著增加(P<0.05)。对于雌性果蝇,低剂量组的平均最高寿命显著增加(P<0.05),中剂量组的平均最高寿命极显著增加(P<0.01),高剂量组半数死亡时间、平均寿命和平均最高寿命均极显著增加(P<0.01)。综上所述,0.8%龟肉蛋白肽培养基喂养果蝇对其寿命的延长效果最佳。
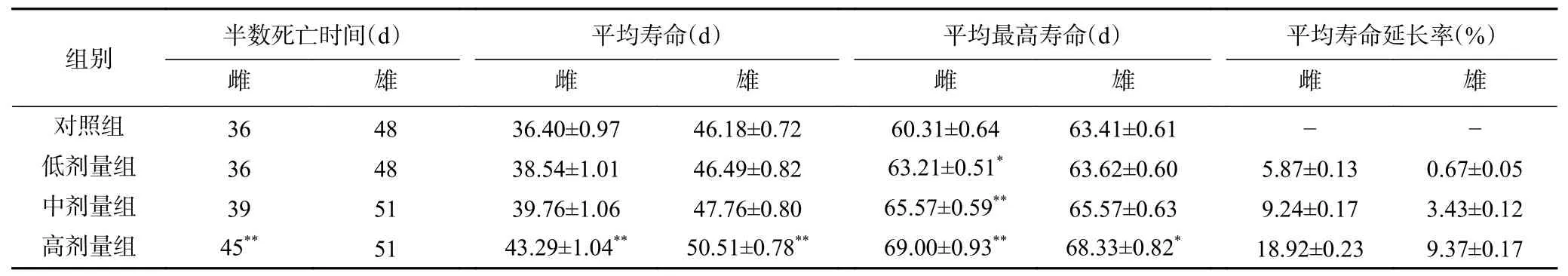
表6 不同剂量龟肉蛋白肽对雌、雄果蝇寿命的影响Table 6 Effects of different doses of PTPDP on the lifespan of female and male D. melanogaster
果蝇的生存曲线见图1,20 d 之前,各实验组相比空白对照无显著性差异(P>0.05),20 d 后高剂量组雌、雄果蝇的存活率均逐渐高于对照组。各剂量龟肉蛋白肽喂养下,雌雄果蝇存活率归零的时间均较对照组变晚,其中0.8%龟肉蛋白肽组最晚。总体来说,龟肉蛋白肽可以增加雌雄果蝇的存活率,其中0.8%龟肉蛋白肽的效果最好。

图1 雌性(A)和雄性(B)果蝇的生存曲线Fig.1 The survival curves of female (A) and male (B) D.melanogaster
本实验中,龟肉蛋白肽对雌性果蝇的延寿效果好于雄性:喂食0.8%龟肉蛋白肽的雌性果蝇半数死亡时间较对照组极显著延长(P<0.01),而雄性果蝇则无显著性差异(P>0.05);0.2%、0.4%龟肉蛋白肽喂养的雌性果蝇平均最高寿命分别显著延长(P<0.05)、极显著延长(P<0.01),而同组雄性果蝇不呈显著性差异(P>0.05);0.8%龟肉蛋白肽组雌性果蝇的平均最高寿命较对照组极显著延长(P<0.01),而同组雄性果蝇并未呈现极显著差异(0.01<P<0.05)。以往同类研究表明[19,32],由于对受试药物的适应性与敏感性不同,雌、雄果蝇的寿命实验结果会存在差异,因此可推测本实验中雌性果蝇对龟肉蛋白肽更为敏感。
2.5 龟肉蛋白肽对果蝇体内抗氧化活性的影响
抗氧化酶如超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)可以清除机体的多余活性氧,从而实现体内自由基的动态平衡[32-34],二者的活性是评价机体自由基清除能力的间接指标。丙二醛(malondialdehyde,MDA)是多不饱和脂肪酸等脂质在氧自由基作用下发生氧化反应的最终产物,具有细胞毒性,通常会随年龄的增大而增多[35],其含量是间接反应脂质氧化程度的重要指标[36]。
如表7 所示,随着果蝇年龄的增长,40 d 时SOD活性较20 d 普遍降低。0.4%龟肉蛋白肽组雌性果蝇20 d 和40 d 的SOD 活性均较对照组显著增强(P<0.05),同组雄性果蝇20 d 的SOD 活性显著增强(P<0.05),但40 d 时无显著差异(P>0.05)。0.8%龟肉蛋白肽组雌、雄果蝇20 d 和40 d 的SOD 活性均较对照组显著增强(P<0.05),其中雌性果蝇20 d 时极显著增强(P<0.01)。综上所述,龟肉蛋白肽能有效提高果蝇SOD 活性,最佳剂量为0.8%,且对雌性果蝇SOD 活性的提升效果好于雄性。

表7 不同剂量龟肉蛋白肽对果蝇体内SOD 活性的影响Table 7 Effects of different doses of PTPDP on SOD activity of D. melanogaster
如表8 所示,0.2%和0.4%龟肉蛋白肽喂养雌性果蝇20 d 和40 d 的CAT 活性较对照组分别显著增加(P<0.05)、极显著增加(P<0.01),而同剂量喂养的雄性果蝇CAT 活性则没有显著增强(P>0.05)。0.8%龟肉蛋白肽组雌性果蝇20 d 和40 d 的CAT活性极显著增加(P<0.01),雄性果蝇20 d 时显著增加(P<0.05),40 d 时极显著增加(P<0.01)。综上所述,龟肉蛋白肽能有效提高果蝇CAT 活性,最佳剂量为0.8%,对雌性果蝇作用效果较好。

表8 不同剂量龟肉蛋白肽对雌、雄果蝇体内CAT活性的影响Table 8 Effects of different doses of PTPDP on CAT activity of female and male D. melanogaster
如表9 所示,与空白对照相比,0.2%龟肉蛋白肽饲养的果蝇体内MDA 含量无显著性变化(P>0.05)。0.4%龟肉蛋白肽组雄果蝇40 d 的MDA 含量与对照组相比显著减少(P<0.05)。喂食0.8%龟肉蛋白肽的雌、雄果蝇在20 d 和40 d 的体内MDA 含量均显著减少(P<0.05)。综上所述,0.8%龟肉蛋白肽能有效降低果蝇体内MDA 含量。

表9 不同剂量龟肉蛋白肽对雌、雄果蝇体内MDA含量的影响Table 9 Effects of different doses of PTPDP on MDA content of female and male D. melanogaster
2.6 龟肉蛋白肽对果蝇基因表达的影响
Sod1、Sod2和Cat基因的表达分别影响超氧化物歧化酶和过氧化氢酶的活性,是评价生物体抗氧化能力的常用指标[4,37]。mth基因的表达量被认为与寿命呈负相关性,研究表明mth发生突变会使成年果蝇的平均寿命会延长35%[38]。Rpn11基因的表达可以减少衰老相关的泛素化蛋白在体内积累,从而延长果蝇寿命[39]。
如图2 所示,与对照组相比,使用0.8%龟肉蛋白肽培养基的实验组雌性果蝇体内的抗氧化相关基因Sod1、Sod2和Cat的表达量均有上升,其中Sod1和Sod2基因的表达量显著上升(P<0.05),Cat基因的表达量极显著上升(P<0.01)。寿命相关基因mth基因的表达量极显著下降(P<0.01),而Rpn11的表达量极显著上升(P<0.01)。综上所述,0.8%龟肉蛋白肽通过上调抗氧化相关基因Sod1、Sod2、Cat和寿命相关基因Rpn11的表达,以及下调寿命相关基因mth的表达来延长果蝇寿命。

图2 0.8% PTPDP 喂养的雌性果蝇基因表达Fig.2 Gene expressions of female D. melanogaster fed by 0.8% PTPDP
3 结论
本研究酶解乌龟肉得到大量1000 Da 以下的小分子肽段,龟肉蛋白肽富含甘氨酸、谷氨酸和脯氨酸等多种具有抗氧化活性的氨基酸。0.2%、0.4%和0.8%的龟肉蛋白肽都可以有效延长果蝇寿命,提高果蝇体内多项抗氧化活性指标,其中喂食0.8%龟肉蛋白肽的作用效果最佳。同等剂量下,相较雄性果蝇,雌性果蝇对龟肉蛋白肽更为敏感。0.8%的龟肉蛋白肽通过上调抗氧化相关基因Sod1、Sod2、Cat和寿命相关基因Rpn11的表达,以及下调寿命相关基因mth的表达来延长果蝇寿命。综上所述,本研究的结果表明龟肉蛋白肽具有潜在的抗衰老功效,为后续相关医药产品或保健食品的开发与应用提供了一定的参考。由于衰老的机制较为复杂,且果蝇与人类在许多层面上差异较大,后续研究可以使用小鼠等哺乳动物作为模型,为深度探究龟肉蛋白肽的抗衰老功能和作用机制,提供更详实的实验依据。

