蕙兰一个PEBP家族基因的克隆及生物信息学分析
楚志刚,田云芳
(1.郑州师范学院 信息科学与技术学院,河南 郑州 450044;2.郑州师范学院 生命科学学院,河南 郑州 450044;3.郑州市观赏药用特色资源植物重点实验室,河南 郑州 450044)
蕙兰(),兰科兰属,又称夏蕙、九节兰等,是传统意义上中国兰花的一大种类,是我国二级保护珍稀物种,观赏和经济价值较高。现阶段兰科植物研究在分子水平上多集中于观赏蝴蝶兰(ssp.)、药用石斛(ssp.)及切花文心兰(ssp.)等洋兰。随着分子生物学研究的深入,兰花花发育及花期研究方面有了较大的进步,但是蕙兰花期调控相关基因的研究还不多见。
磷脂酰乙醇胺结合蛋白(phosphatidyl ethanolamine-binding protein, PEBP)家族基因被认为是调节植物营养阶段转向生殖阶段的关键基因,决定植物的生殖生长和某些组织形态构建。PEBP家族基因含3个亚家族:分别是FT-like(和)、TFL-like(1、和)和MFT-like。FT-like是非常重要的开花调控因子,被称作“成花素”;TFL-like则功能相反,可以抑制花原基的形成,从而使开花延迟;MFT-like主要表达于种子,影响脱落酸(ABA)与赤霉素(GA)信号通路,调控种子发育和萌发。
在许多植物中已分离到PEBP家族基因,例如龙眼()、荔枝()、蝴蝶兰()、菊花()、玫瑰()、矮牵牛()、向日葵()、郁金香()、春兰()、万代兰()等。荔枝、蝴蝶兰、玫瑰、矮牵牛等园艺植物的同源基因过表达都能使其出现早花现象,龙眼的1是晚花基因;向日葵的1基因和郁金香的1和3基因均是抑制成花的基因。
在种子进入休眠状态时,基因可以通过启动()基因的反义 RNA-COOLAIR阻抑其表达,并改变染色质而破除休眠。梨的2基因过表达可以促进苹果的营养生长、延迟其休眠和叶片衰老。Gao等在研究蓝莓时发现过表达基因会导致蓝莓植株提前开花和矮化。在李树中过表达杨树的基因不仅可以使李树提前开花,还能改变李树的形态,使其分枝化情况更为严重。而洋葱1和4对鳞茎形成的作用则相互拮抗。除此之外,研究还发现基因可以调控气孔的开与关,比如过表达的基因转基因植株表现为气孔开放,而-1突变体则表现为气孔关闭。
由于PEBP家族基因在植物发育特别是营养生长到生殖生长发育转变过程中的调控作用及在植物育种中的应用前景,其功能研究及作用机制成为目前研究热点之一。不同植物中常常具有较多的PEBP家族基因,不同的基因很可能功能不同,因此要厘清植物PEBP家族基因的分子作用机制,首先要明确PEBP家族基因植物中的功能。
目前在花期和植物生长形态调控功能上,PEBP家族基因的研究较多,而蕙兰开花及逆境胁迫中PEBP功能和作用机制有待清晰。本文利用同源克隆法得到基因的 cDNA序列,进行时空表达,并对CfPEBP蛋白进行生物信息学分析,为深入探究蕙兰PEBP家族基因的功能提供理论基础。
1 材料与方法
1.1 试验材料
试验所用蕙兰来自大别山,种植于郑州师范学院观赏、药用兰花河南省工程实验室,用蕙兰花蕾期叶片为材料进行基因克隆。另取蕙兰3个发育时期的13种器官和组织为试验材料,包括成苗期的根和叶片,花蕾期的根、叶片和花葶,盛花期的根、叶片、花葶、萼片、花瓣、唇瓣、合蕊柱、子房材料进行实时荧光定量表达分析。材料取后迅速用液氮速冻,于-80 ℃冰箱备用。
1.2 总RNA的提取及cDNA第一链的合成
方法参照田云芳等。蕙兰不同器官和组织的总RNA采用TRIzol Reagent (Ambion)提取,蕙兰花蕾阶段叶总RNA用M-MLV 反转录酶(TaKaRa)进行合成cDNA,用于蕙兰基因克隆。实时荧光定量PCR 所用cDNA 用PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa)进行合成,稀释10倍备用。
1.3 蕙兰PEBP基因克隆
根据GenBank中已登录AB052943(水稻)、AY705794(小麦)、AK376849(大麦)、NM_001112781(玉米)、GU324590(黑麦)等相关早花基因序列高度保守区,采用Primer Premier5.0设计引物(表1),用于克隆基因片段序列。PCR反应程序: 94 ℃ 5 min;94 ℃ 40 s,59.5 ℃ 40 s,72 ℃ 40 s,35个循环;72 ℃ 10 min。凝胶回收,连接到pMD19-T,转化DH5α,鉴定送测。
根据中间片段设计3′端巢式引物3F1和3F2、5′端巢式引物5R1和5R2(表1),分别结合3′-RACE(TaKaRa)试剂盒引物3′-RACE Inner Primer和3′-RACE Outer Primer、5′-RACE(Clontech)试剂盒引物NUP和UPM进行目的基因的RACE扩增。
按3′-RACE(TaKaRa)说明将蕙兰总RNA逆转录合成cDNA第1链,分别于57 ℃(PCR程序:94 ℃ 4 min;94 ℃ 40 s,57 ℃ 40 s,72 ℃ 1 min,30个循环;72 ℃ 10 min)和57.2 ℃(PCR程序:94 ℃ 4 min;94 ℃ 40 s,57.2 ℃ 40 s,72 ℃ 1 min,30个循环;72 ℃ 10 min)进行PEBP 3′-RACE巢式PCR反应,回收PCR产物、转化、测序。
按5′-RACE(Clontech)说明将蕙兰总RNA逆转录合成cDNA第1链,分别于65 ℃(PCR程序: 94 ℃ 4 min;94 ℃ 40 s,65 ℃ 40 s,72 ℃ 1 min,30个循环;72 ℃ 10 min)和54.2 ℃(PCR程序:94 ℃ 4 min;94 ℃ 40 s,54.2 ℃ 40 s,72 ℃ 1 min,30个循环;72 ℃ 10 min)进行PEBP 5′-RACE巢式PCR反应,回收目的片段、转化、测序。
将保守片段、3′端和5′端序列在DNAMAN中进行拼接,得到该基因的cDNA全长,并查找ORF及推导氨基酸序列。
1.4 生物信息学分析
NCBI比对查找ORF (www.ncbi.nlm.nih.gov/gorf/gorf.html),进行BLAST比对(blast.ncbi.nlm.nih.gov/blast.cgi);将序列登录至GenBank;利用ProtParam (web.expasy.org/protparam/)预测分子式、pI、分子量与不稳定指数;利用PROSITE (prosite.expasy.org/)预测其编码蛋白的结构功能域;通过Protscale (web.expasy.org/protscale/)进行疏水性分析;信号肽通过SignalP-5.0 (www.cbs.dtu.dk/services/SignalP/)预测;用NetPhos 3.1 Server (www.cbs.dtu.dk/services/NetPhos/)预测蛋白磷酸化位点;TMHMM Server v.2.0 (www.cbs.dtu.dk/services/TMHMM-2.0/)跨膜预测;输入PSORT (psort1.hgc.jp/form.html)、Plant-PLoc (www.csbio.sjtu.edu.cn/bioinf/plant-multi/) 和WoLF PSORT网站 (wolfpsort.hgc.jp/) 进行亚细胞定位;应用PRABI (npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_ gor4.html)和PredictProtein (predictprotein.org/)预测卷曲螺旋;通过SWISS-MODEL (swissmodel.expasy.org/SWISS-MODEL.html)三维建模。利用DNAMAN软件构建系统进化树。

表1 CfPEBP基因扩增和表达引物
1.5 密码子偏好性分析
本研究利用EMBOSS软件包中CodonW计算有效密码子数(effective number of codon,ENC)、GC含量、GC3s (第3位碱基GC含量)等;CHIPS计算同义密码子相对使用度(Relative synonymous codon usage, RSCU);CUSP计算密码子使用频率(Frequency)。分别采用Excel、SPSS和R语言进行数据分析。
1.6 CfPEBP基因时空表达
根据所获得蕙兰PEBP家族基因序列设计1对特异引物PEBP-QF和PEBP-QR,以蕙兰(JN177718)和3(KC794503)为内参基因,引物为ACT-QF、ACT-QR和UBQ3-QF、UBQ3-QR,采用SYBR Premix Ex TaqTMⅡ kit(TaKaRa)进行实时荧光定量PCR反应,反应体系为25 μL,反应条件为:95 ℃ 3 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 15 s,40个循环。反应在荧光定量PCR仪(Eppendorf)上进行。实验设置3个生物学重复,3个技术重复。相对表达量按照2-ΔΔC法计算。
2 结果与分析
2.1 CfPEBP基因克隆
以蕙兰花蕾期的叶片为材料,提取总RNA,反转录为cDNA,以PEBP-F和PEBP-R为引物(表1),获得300 bp的基因中间产物片段(图1-A)。结合5′-RACE和3′-RACE,分别获得850 bp 的5′端序列(图1-B)和3′端620 bp序列(图1-C),两端产物与基因中间序列均有重合。三段核苷酸序列经DNAMAN软件拼接,获基因cDNA序列全长,长度为768 bp,其中,3′-UTR为160 bp,5′-UTR为77 bp,ORF为 531 bp,推测的氨基酸176个(图2)。在NCBI网站进行BLASTN分析,发现此序列与春兰()的基因(HM106985) 有100%的相似性,与春兰()、墨兰()、建兰()和蕙兰()的基因(HM120863、HM120862、HM803115、HQ164434)有99%以上的相似性。因该基因具有PEBP功能结构域(图3),故将此基因命名为,登录号为MT795710,蛋白登录号为AHB86975。

A.CfPEBP基因片段 B.5′-RACE C.3′-RACEM, DL 2000分子量标记物; 1-3, PCR 扩增产物。M, DL 2000 marker; 1-3, PCR product.图1 CfPEBP基因克隆Fig.1 Cloning of CfPEBP gene

图2 CfPEBP基因序列和推测的氨基酸序列Fig.2 The nucleotide acid sequence and deduced amino of CfPEBP
2.2 CfPEBP氨基酸序列比对
用BLASTX将CfPEBP翻译成氨基酸,功能结构域分析发现,该氨基酸序列包含一个PEBP功能域(图3)。序列比对分析表明,的氨基酸序列与春兰FT(ADI58462) 具有100%的相似性,与蕙兰FT(ADW76861)具有99%的相似性,与石斛FT(AVW83070)的同源性有96%、文心兰FT(QLM02196)同源性为92%、杜鹃茶FT(QII80827)同源性为86%,保守性较强。
2.3 生物信息学分析
2.3.1 蛋白质序列理化参数及亲疏水性
利用 ProtParam分析发现该蛋白包括176个氨基酸,分子式为CHNOS,分子量为19 848.39 u;等电点pI为6.42;精氨酸(10. 2%)和缬氨酸(10.8%)含量较高,不稳定参数为43.37,脂溶指数为80.74,GRAVY值为-0.311。利用 Protscale进行疏水性分析,10、120、125氨基酸位点附近有3 处高分值(Score>1.5) 峰,属于疏水性区域;而75、80、140、170 氨基酸位点附近有5处低分值(Score<-1.5) 峰,属于高亲水性区域,是蛋白质进化中氨基酸的主要插入位点。
2.3.2 二级结构预测及亚细胞定位
利用PRABI网站预测,该蛋白由6.82%的α-螺旋、30.68%的延伸链和62.50%的无规则卷曲所组成。利用PredictProtein预测,该蛋白包含无规则卷曲67.61%、螺旋结构7.95%和片层结构24.43%。
利用NetPhos 3.1 Server预测磷酸化位点有丝氨酸(Ser) 9个,苏氨酸(Thr)5个,酪氨酸(Tyr)1个。TMHMM Server v. 2.0跨膜预测表明,CfPEBP 跨膜肽链位于膜外侧,无跨膜结构域。SignalP-5.0分析显示该蛋白不具有信号肽结构域。
利用PSORT分析亚细胞定位的可能性是:细胞质45%、微体39.2%、溶酶体30.3%、线粒体基质空间10%,该蛋白极可能是一种细胞质或者微体蛋白。利用WoLF PSORT分析显示该蛋白位于细胞质的可能性为55.14%。同时利用Plant-PLoc定位分析表明该蛋白定位于细胞核。
2.3.3 三级结构及功能位点预测
通过同源建模(模板:6igj.1.A;同源性:76.07%) ,发现CfPEBP所编码蛋白左侧主要是α-螺旋结构,右侧主要是β-折叠,两区域通过长链卷曲连接(图4)。利用PROSITE预测发现该蛋白具有PEBP功能域。
2.3.4 系统进化树
系统进化树(图5)构建表明,与春兰、建兰、墨兰的亲缘关系较近,与文心兰、石斛的亲缘关系相对较远,与绿竹、毛竹的亲缘关系最远。说明PEBP亚家族成员存在种属特异性,同时也可以看出同一物种的同一类PEBP亚家族成员序列存在较大差异。

图3 CfPEBP蛋白保守结构域Fig.3 CfPEBP conservative protein domain structure

图4 CfPEBP蛋白Swiss-model 建模(左)及功能位点预测(右) Fig.4 Swiss-model modeling (left) and functional site prediction results (right) of CfPEBP

图5 CfPEBP基因系统进化树分析Fig.5 Phylogenetic tree of CfPEBP sequences
2.3.5 密码子偏好性分析
物种进化中,会出现对密码子选择不平衡,即密码子使用偏好性 (codon usage bias,简称密偏性)。利用CodonW 计算蕙兰基因 ENC值为57.37,GC含量为0.513,GC3s 值为0.497。当ENC≤35时该基因密偏性较强,CfPEBP的ENC值偏大,密偏性较弱,各密码子使用频率较为一致;且密码子适应指数 (CAI) 为 0.161,小于1,说明的密偏性较弱。密码子末位为 T(U)、C、A、G 的频率分别为0.296 8、0.354 8、0.305 3、0.238 1。
CHIPS 在线计算蕙兰基因密码子的RSCU值,结果表明,除AUG起始密码子和UGA、UAG、UAA终止密码子外,的密码子中RSCU>1的有22种,偏性较强的有GGC、AGA、AGU、AAG、CCA、CUC (RSCU≥2)。
在线NCBI数据库中获取18个PEBP基因的 CDS样本。统计表明(表2),GC为54.07%、密码子第1、2和3位上的GC含量即GC1s、GC2s、GC3s分别为57.80%、45.90%、58.51%,呈现GC3s>GC1s>GC2s。18个CDS编码的蛋白使用频率最高的密码子为GGC(甘氨酸),最低的为 AAA(赖氨酸)。

表2 PEBP基因密码子特性参数
表3表明,18个物种PEBP家族基因的CAI值范围为0.138~0.241,远远小于1,说明密偏性较弱。ENC均值50.38,均在35以上,说明密偏性有差异且基因表达水平不同,与基于CAI的分析结果相似。基于RSCU,蕙兰HQ164434、文心兰KJ909968、文心兰EU583502、石斛MF063061、香蕉KF853468、牵牛AB154823的密偏性较强,均有25个以上RSCU值>1的密码子。
采用 R语言进行关联分析结果显示,GC与C3s、G3s、CAI、FOP、GC3s在<0.01水平上正相关,与U3s、A3s、ENC在<0.01水平上负相关;ENC与C3s、G3s、CAI、FOP、GC3s、GC负相关,与 U3s、A3s均在<0.01水平上正相关,说明不同物种基因所编码的氨基酸组成较为相似(图6)。
中性分析发现(图7-A),密码子第3位平均GC含量(GC3)的范围为0.390~0.866,密码子第1、2位平均GC含量(GC12)在0.49~0.53,大部分基因分布于回归线两侧,线性回归系数为0.1249,其碱基组成差异不大,尤其是刚好分在对角线的少数基因,主要受突变压力影响。

表3 不同物种间PEBP家族基因的偏好性参数分析

**表示达极显著水平(P<0.01)。** represented the significant difference (P<0.01).图6 PEBP家族基因密码子特性参数之间的相关性Fig.6 The correlation coefficient between the codon usage parameters of PEBP gene family
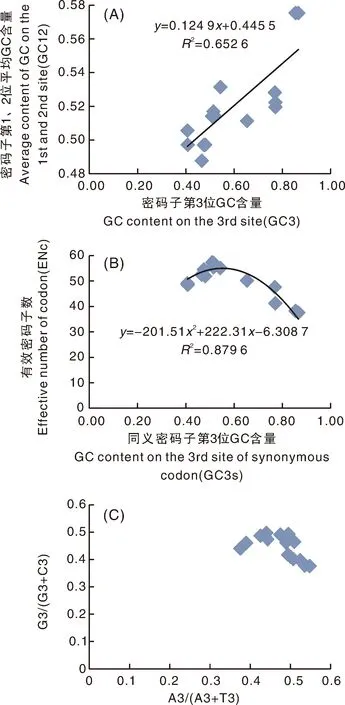
图7 PEBP中性绘图(A)、ENc-plot(B)和PR2-plot(C)分析Fig.7 Neutrality plot (A), ENc-plot (B) and PR2-plot (C) analysis of PEBP
从ENC对 GC3s的分布图7-B中可以看出,18个物种PEBP家族基因分布范围不大,表明PEBP基因密偏性不仅受突变压力的影响,且受突变压力影响程度相近。
PR2分析(PR2 bias plot analysis) (图7-C),从横坐标来看,分布于0.5区域的左右两侧表明密码子对G、C没有显著的偏性。从纵坐标来看,分布集中在<0.5的区域说明密码子对A、T具有一定的偏性。由此推断突变压力与自然选择等其他压力在不同物种PEBP家族进化过程中均发挥一定作用。
R语言构建不同物种PEBP家族基因RSCU的层次聚类分析(图8)结果表明,不同物种对于GGC、AGG、AGA、AGC、AGU、UGC、GAG、AAG、UAC、GCC、CCA、CUC的偏好性超过其他密码子。
以蕙兰成苗期、花蕾期、盛花期的根、叶、花等组织的总RNA做为模板,分析了蕙兰基因的表达模式。结果表明(图9),基因在蕙兰盛花期叶中表达量最高,在花蕾期花蕾中表达量次之,在盛花期花葶中也有表达,在花蕾期叶、花葶和盛花期的花被片、合蕊柱中轻微表达,在苗期和子房中几乎不表达;在3个生长阶段的表达量顺序是盛花期>花蕾期>成苗期。
3 讨论
植物中,PEBP家族基因主要参与种子发育、萌发、休眠和花期调控等生理过程。本研究从蕙兰花蕾期叶片中克隆了1个PEBP家族基因,对应176个氨基酸,具典型PEBP结构功能域。氨基酸序列比对表明,该基因属于-like亚家族,与许多单子叶植物的类基因具有90%以上的同源性,其中与春兰、墨兰等的类基因具有99%以上的相似性; 氨基酸序列保守性强。而该基因与曾报道的蝴蝶兰、石斛的序列差异相对较大。
生物信息学分析发现,CfPEBP具有15个磷酸化位点,Corbit等研究表明,PEBP也具多个磷酸化位点,二者预测结果一致。亚细胞定位预测表明该蛋白极可能是一种细胞质蛋白或微体蛋白,也可能定位于细胞核。前人研究中,陆地棉1、2以及大豆1均位于细胞质和细胞核,这与本研究预测结果一致。
密码子是生物体内遗传信息传递的基本环节,密码子偏好性分析可用于进一步理解物种的遗传进化。本研究通过计算RSCU确定了GGC、AGG、AGA、AGC、AGU、UGC、GAG、AAG、UAC、GCC、CCA、CUC密码子为PEBP家族基因中的高频密码子。前人研究认为,基于密偏性的聚类分析未必能确切反映物种间亲缘关系的远近,也有研究表明,利用密码子偏好性聚类分析可以一定程度上的反映基因特殊个体进化规律,是物种关系进化分析对系统发育分析的有益补充。此研究中,基于不同植物PEBP ORF核苷酸序列的聚类,比基于密偏性的聚类更符合植物学分类。前者将同科同属的物种聚在一起,同源关系最近。两种聚类分析有差异,后者可以作为前者聚类分析的补充。基于ORF序列和密偏性相结合的聚类方法更利于提高分析结果的可靠性,更能客观地表示物种的进化。根据密码子偏好性的改造利用研究也比较普遍,柏锡等根据马铃薯密偏性及高表达优越密码子分析结果, 对组织型纤溶酶原激活剂基因(t-PA,GenBank登录号M15518) 核苷酸序列进行改造, 使其在密码子使用上具有马铃薯基因的特点。杨江科等将脂肪酶基因(lipA-syn)经密码子优化后在毕赤酵母GS115中诱导表达72 h后,发酵液酶活达176.0 U·mL,蛋白质含量为143.7 mg·L,较出发基因分别提高了10.8倍和5.6倍,实现了该基因的高效表达。

图8 PEBP基因的同义密码子相对使用度(RSCU)的层次聚类分析Fig.8 Hierarchical cluster analysis of relative synonymous codon usage (RSCU) of PEBP genes

G0:成苗期根,Y0:成苗期叶,G1:花蕾期根,Y1:花蕾期叶,T1:花蕾期花葶,L1:花蕾期花蕾,Y2:盛花期叶,E2:盛花期花萼,B2:盛花期花瓣,C2:盛花期唇瓣,R2:盛花期合蕊柱,F2:盛花期子房,T2:盛花期花葶。G0: Root at adult seedling stage,Y0: Leaf at adult seedling stage,G1: Root at bud stage,Y1:Leaf at bud stage,T1: Inflorescence rachis at bud stage,L1:Bud at bud stage,Y2:Leaf at full-blossom stage,E2:Calyx ,B2:Petal ,C2:Lip petal ,R2:Gynostemium,F2:Ovary,T2: Inflorescence rachis at full-blossom stage.图9 CfPEBP在蕙兰各组织器官中的表达Fig.9 Expression of CfPEBP in the tissues of Cymbidium faberi
基因属于-lik亚家族,-like亚基因家族基因参与春化、自主、光周期、赤霉素、年龄和光敏等多条调控途径的关键节点。该基因在表达较高的部位是盛花期的叶和花蕾期的花蕾,其次是盛花期的花葶。黑喉石斛在盛花期的叶片中表达量也特别高。孙崇波等研究表明,蕙兰在幼嫩子房中的表达量较高,在侧瓣中的表达量次之,在唇瓣、萼片和蕊柱中的表达量则很少。与之相比,本研究更全面地探讨了基因在不同时期不同组织中的相对表达。FT同源基因在植物中过表达能够阻抑营养生长,从而使营养芽转向花芽分化,从而将植物花期提前,在烟草中异源表达蕙兰中的基因能促进烟草提前开花。蕙兰中的PEBP基因的功能需要进一步研究,本文蕙兰基因的生物信息学分析也为其功能研究提供了很好的理论基础。

