红枣多糖羧甲基化修饰及其抗氧化活性研究
符玉霞,郭 欣,魏亚博,邓小蓉,雷用东,刘萍萍,张 建
(石河子大学食品学院,新疆石河子 832000)
红枣(Mill.)通常被称为红枣或大枣,是枣树的果实,属于鼠李科,原产于中国,由于其营养丰富且具有多种药用价值,2002 年被国家卫生健康委员会列为药食同源食品。此外,红枣中含有多种重要的生物活性成分,如:维生素C、多酚、黄酮、多糖、环核苷酸,在人体保健和疾病防治方面可以发挥重要作用。植物多糖特性独特,在临床上多用于增强机体免疫力与抗氧化能力,调节机体糖代谢等。多糖是红枣的主要生物活性成分,具有抗疲劳、免疫调节、抗氧化、抗肿瘤、保肝、降血糖和胃肠保护等作用。
多糖的分子修饰逐渐成为研究热点之一。羧甲基化修饰是指多糖分子链上引入羧甲基基团的反应,修饰后,多糖的理化性质和组成结构发生了改变,对其活性有较大的影响,主要体现为修饰后的多糖生物活性增强,更具有研究意义。再加上其所需设备简单、反应条件温和、投资少、成本低,所以本文采用此方法开展试验。希望通过对红枣多糖的分子修饰,提高原有生物活性或增加新活性,扩大多糖利用范围,并应用于功能食品领域,有利于实现红枣产业的高值化应用。
本研究以一氯乙酸为羧甲基化试剂,NaOH 为反应溶剂,通过单因素和响应面对羧甲基化条件进行了优化,利用红外光谱和扫描电镜图对其进行了分析。考虑到对红枣多糖进行羧甲基化修饰的目的是提高其抗氧化活性,以DPPH、羟基自由基清除率及还原力和Fe螯合能力为指标,探究羧甲基化修饰对多糖抗氧化的影响,以期为红枣多糖分子修饰及其抗氧化特性改善提供一定的理论依据和技术指导。
1 材料与方法
1.1 材料与仪器
红枣多糖(纯度为60%) 西安泽郎生物科技有限公司;透析袋(截留分子量:8000~14000 Da) 上海源叶生物科技有限公司;大孔吸附树脂AB-8 天津市光复精细化工研究所;三氯乙酸 天津市风船化学试剂科技有限公司;正丁醇、硫酸 天津市富宇精细化工有限公司;过氧化氢 成都市科隆化学有限公司;邻苯三酚、硫酸亚铁、氢氧化钠 天津市鑫铂特化工有限公司;菲啰嗪、水杨酸、抗坏血酸、三氯化铁 国药集团化学试剂有限公司;磷酸氢二钠 天津市盛奥化学试剂有限公司;磷酸二氢钠 天津市光复科技发展有限公司;一氯乙酸 上海麦克林生化科技有限公司。
H2500R-2 型冷冻离心机 北京澎昆博远科贸发展有限责任公司;RE-52 型旋转蒸发仪 上海亚荣生化仪器公司;ENK-PRO 型酶标仪 美国Bioteck公司;NJF-120-01 型扫描电子显微镜 苏州晋松计量仪器有限公司;Nicolet IS 10 型傅里叶变换红外光谱仪 美国Thermo 公司;HX-10-50B 型真空冷冻干燥机 上海圣科仪器设备有限公司。
1.2 实验方法
1.2.1 红枣多糖前处理
1.2.1.1 蛋白质的脱除 采用Sevage 法脱除红枣多糖中的游离蛋白质。取0.05 g/mL 的粗多糖溶液,按体积3:1 比例加入Sevage 试剂(氯仿与正丁醇3:1,v/v),放入恒温振荡培养箱中,充分振荡30 min,使蛋白质充分变性。4000 r/min 离心10 min,待分层完全后除去水层和试剂层交界处的变性蛋白质,取出上层多糖液。反复操作5~8 次直至中间变性蛋白层几乎消失。将脱蛋白后的糖液进行蒸发浓缩、干燥、称重,分析蛋白含量,计算蛋白脱除率和多糖保存率。

1.2.1.2 脱色 准确称取活化的大孔树脂20 g 于250 mL 锥形瓶,然后向其中加入100 mL 浓度为0.05 g/mL 脱蛋白红枣多糖溶液,置于摇床中,225 r/min、室温振荡24 h,抽滤,取滤液测定其脱色后在420 nm 处的吸光度值,计算色素脱除率和多糖保存率。

1.2.1.3 多糖含量的测定 参考王迎香等的方法,准确量取浓度为0.2 mg/mL 葡萄糖标准液0.1、0.2、0.4、0.6、0.8、1.0、1.2 mL 于试管,补水至2.0 mL,加1.0 mL 质量浓度5%的苯酚,滴加5.0 mL 浓硫酸,摇匀,静置30 min,待其温度降低后,于490 nm处测其吸光度,以2.0 mL 水按同样显色操作为空白。同一浓度标准溶液重复测定3 次,以葡萄糖浓度为横坐标,吸光度值为纵坐标,制作葡萄糖标准曲线。得到线性回归方程:y=0.8589x+0.0068,其中=0.991,x 为葡萄糖标准品的浓度,y 为对应浓度下的吸光度值。
取2.0 mL 适宜浓度的红枣多糖,加1.0 mL 质量浓度5%的苯酚,滴加5.0 mL 浓硫酸,摇匀,静置30 min,待其温度降低后,于490 nm 处测其吸光度,并根据标准曲线计算多糖含量。
1.2.1.4 蛋白质含量的测定 参考曹泽虹等和杨静等的方法,量取浓度为0.2 mg/mL 蛋白标准品溶液0.1、0.2、0.3、0.4、0.5、0.6 mL 分别置试管中,加蒸馏水补至1.0 mL,分别加5.0 mL 考马斯亮蓝试剂,混匀,于30 ℃恒温水浴5 min,冷却至室温。另以蒸馏水1.0 mL,同上操作为空白对照,在595 nm处测量吸光度值。同一浓度的标准溶液分别重复测定3 次。以蛋白质浓度为横坐标,以吸光度值为纵坐标,绘制标准曲线,得到线性回归方程:y=0.7817x+0.0425,其中=0.9956,x 是蛋白标准品的浓度,y 为不同浓度下测得的吸光度值。
红枣多糖溶液稀释至适当浓度,取1.0 mL 于试管中,加入5.0 mL 考马斯亮蓝溶液,混匀,于30 ℃恒温水浴5 min,冷却至室温,在595 nm 处测量吸光度值,并根据标准曲线计算红枣多糖溶液中蛋白含量。
1.2.2 羧甲基化红枣多糖的制备 参照陈栅和程浩羧甲基化改性的方法,准确称取0.8 g 除杂后的红枣多糖于锥形瓶中,加入50 mL 一定浓度的NaOH搅拌1 h,使其碱化完全。加入一定量的一氯乙酸,置于一定温度水浴锅中反应5 h,冷却,用冰乙酸调节pH 为7.0,透析3 d,冷冻干燥(-50 ℃,72 h),获得羧甲基化红枣多糖。
1.2.2.1 单因素实验 a.NaOH 浓度对羧甲基取代度的影响:将50 mL 浓度为1.0、1.5、2.0、2.5、3.0、3.5 mol/L 的NaOH 加入红枣多糖中,搅拌30 min,再加入50 mL 质量浓度为3%的一氯乙酸,在80 ℃水浴锅中反应5 h,制备羧甲基化红枣多糖,测定羧甲基取代度,研究NaOH 浓度对红枣多糖的羧甲基化修饰的影响。
b.温度对羧甲基取代度的影响:向红枣多糖中加入3 mol/L 的NaOH 和质量浓度为3%一氯乙酸各50 mL,分别在50、60、70、80、90 ℃下制备羧甲基化红枣多糖,测定羧甲基取代度,研究反应温度对红枣多糖的羧甲基化修饰的影响。
c.一氯乙酸添加量对羧甲基取代度的影响:在红枣多糖中加入50 mL 浓度3 moL/L 的NaOH 和50 mL 质量浓度为1%、2%、3%、4%、5%的一氯乙酸,在70 ℃下制备羧甲基化红枣多糖,测定羧基取代度,研究一氯乙酸添加量对红枣多糖的羧甲基化修饰的影响。
1.2.2.2 响应面试验 在单因素实验的基础上,采用三因素三水平Box-Behnken 的实验设计方法(表1),以A:一氯乙酸添加量;B:温度;C:NaOH 浓度为自变量,取代度为因变量,利用响应面分析软件Design-Expert8 建立数字回归模型,确定红枣多糖羧甲基化的最佳条件。
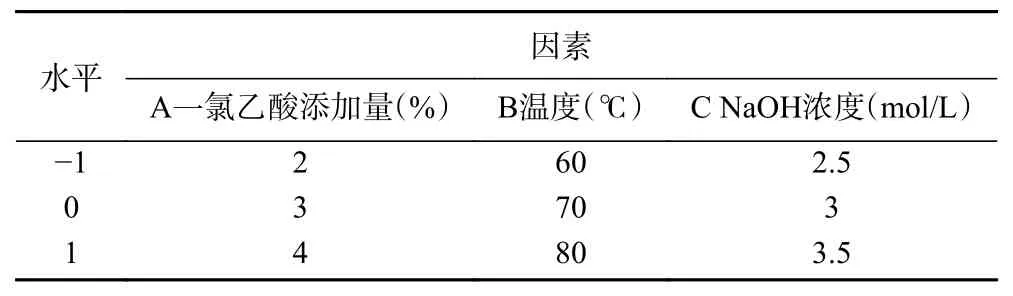
表1 试验设计因素与水平Table 1 Experimental design factors and levels
1.2.2.3 羧甲基取代度的测定 参照张洋婷和房斐等的方法。取10 mg 羧甲基化红枣多糖,向其中加入10 mL 0.01 mol/L 的NaOH,搅拌30 min 使其完全溶解,滴1~3 滴酚酞,然后用0.01 mol/L 的HCl 滴定,以红色消失且30 s 不变色为滴定终点,计算公式为:

式中:DS 为羧甲基取代度;A 为羧甲基含量(%);W 为羧甲基化红枣多糖质量(g);C为NaOH浓度(mol/L);V为NaOH 体积(mL);C是HCl 的浓度(mol/L);V为样品滴定过程中消耗HCl 的体积(mL)。
1.2.3 红枣多糖结构表征
1.2.3.1 傅里叶红外光谱(FTIR) 分别称取2 mg 羧甲基化修饰前后的红枣多糖,加200 mg KBr 粉末研磨均匀,压片处理,分析4000~500 cm波数下红外光谱图。
1.2.3.2 扫描电镜(SEM) 取适量羧甲基修饰前后的红枣多糖样品固定于载物盘上,喷金处理后置于仪器内,观察多糖样品微观形态,拍摄不同倍数电镜照片,进行分析。
1.2.4 红枣多糖抗氧化活性测定
1.2.4.1 DPPH 自由基清除作用 配制浓度为0.04 mg/mL 的DPPH 溶液和不同浓度(1、2、3、4、5 mg/mL)修饰前后红枣多糖溶液。试管中依次加入2 mL DPPH 溶液,2 mL 不同浓度的红枣多糖溶液或者V,摇匀,室温放置30 min,测定其在517 nm处的吸光度值,V为阳性对照,蒸馏水为空白对照,计算清除率(S)。
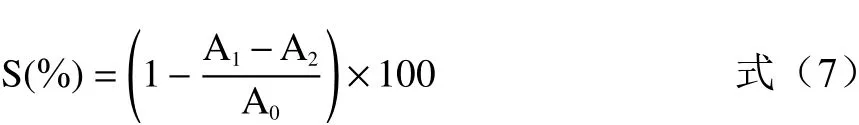
式中:A为反应液的吸光度值;A为不加DPPH 时多糖液自身的吸光度值;A为空白对照DPPH 溶液加蒸馏水。
1.2.4.2 羟基自由基清除作用 分别在试管中加入2 mL 不同浓度(1、2、3、4、5 mg/mL)的红枣多糖溶液,依次加入2 mL 6 mmol/L FeSO和2 mL 9 mmol/L水杨酸,再加入2 mL 2.4 mmol/L 过氧化氢,摇匀,静置10 min,离心10 min,测其在510 nm 处的吸光度值,Vc 为阳性对照,蒸馏水为空白,计算清除率(S)。

式中:A为样品液的吸光度;A为不加显色剂HO样品本底的颜色;A为空白对照液的吸光度。
1.2.4.3 Fe的螯合能力 分别取2 mL 不同浓度的(1、2、3、4、5 mg/mL)红枣多糖液,加入2 mL 蒸馏水,2 mmol/L 的FeCl0.1 mL 和5 mmol/L 的菲啰嗪溶液0.2 mL,25 ℃水浴10 min,测其在562 nm处的吸光度值,EDTA Na2 为阳性对照,蒸馏水为空白,计算Fe螯合能力。
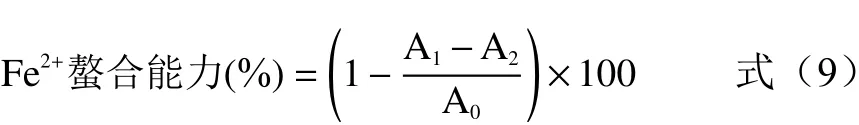
式中:A为样品溶液反应后的吸光度值;A为蒸馏水代替FeCl溶液的吸光度值;A为蒸馏水代替反应中样品溶液的吸光度值。
1.2.4.4 总还原力测定 分别在试管中加入0.2 mol/L pH6.6 的磷酸盐缓冲液2 mL,2 mL 不同浓度(1、2、3、4、5 mg/mL)的红枣多糖液,2 mL 1%的铁氰化钾,混合均匀后于50 ℃水浴锅中反应20 min,取出后加入2 mL 10%的三氯乙酸终止反应,然后离心10 min,取2 mL 上清液,加2 mL 蒸馏水,0.4 mL FeCl,混匀静置10 min,在700 nm 处测定其吸光度值,吸光度值越大表明还原能力越强。
1.3 数据处理
本实验数据均重复测定三次,采用Design-Expert8 进行响应面试验设计,Excel 2021 和SPSS 25 统计分析软件对实验数据进行处理,结果表示为平均值±标准偏差。使用Origin 85 作图软件对实验数据进行作图。
2 结果与分析
2.1 红枣多糖的脱蛋白脱色工艺研究
2.1.1 红枣多糖中蛋白质的脱除 如图1 所示,随着脱蛋白次数的增加,红枣多糖中蛋白脱除率逐渐增大,游离蛋白含量不断减少,多糖保存率逐渐减小,多糖含量不断减少,当经过6 次蛋白脱除时,蛋白脱除率为74.5%,多糖保存率为70.8%,当进行7 次脱蛋白时,蛋白脱除率为76.4%,而多糖保存率急剧下降为57.5%,综合蛋白脱除率和多糖保存率,确定脱蛋白最佳次数为6 次,此时游离蛋白多数已经脱除,且多糖保存率较高。
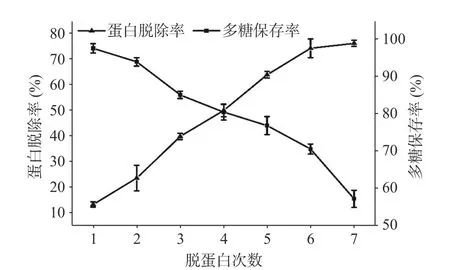
图1 蛋白脱除率和多糖保存率Fig.1 Protein removal rate and polysaccharide retention rate
2.1.2 红枣多糖的脱色 利用AB-8 大孔树脂脱色后,红枣多糖液脱色率可达87.4%,多糖保存率为72.80%,多糖的损失主要是在脱色过程中,大孔树脂吸附一定量多糖所致。图2 是不同浓度脱色前后红枣多糖溶液,可清晰观察到多糖液颜色发生了明显的变化,未脱色多糖溶液的颜色随浓度的增加越来越深,呈黄褐色,但是通过脱色处理后,多糖溶液的颜色明显变浅,而且随着浓度的增大没有明显变化,呈浅黄色,说明多糖中的色素物质基本上被清除干净,不影响后续实验的进行。

图2 脱色前后不同浓度多糖溶液Fig.2 Polysaccharide solution with different concentration before and after decolorization
2.2 羧甲基化红枣多糖制备单因素实验
2.2.1 NaOH 浓度对羧甲基取代度的影响 图3 是红枣多糖羧甲基修饰过程中,NaOH 浓度对羧甲基取代度的影响趋势图。可观察到NaOH 浓度从1 mol/L逐渐增加到3 mol/L 时,羧甲基取代度显著提高(<0.05);当NaOH 浓度为3 mol/L 时,取代度可达1.024。当NaOH 浓度大于3 mol/L 时,取代度降低,这可能是强碱性条件下,多糖易降解,且当一氯乙酸和NaOH 达到一定浓度时会发生副反应,不利于羧甲基修饰,因此确定最佳NaOH 浓度为3 mol/L。

图3 NaOH 浓度对羧甲基取代度的影响Fig.3 Effect of sodium hydroxide concentration on degree of carboxymethyl substitution
2.2.2 温度对羧甲基取代度的影响 图4 是羧甲基红枣多糖制备中,反应温度对取代度的影响趋势图。当反应温度从50 ℃增加到70 ℃时,取代度显著增大(<0.05),70 ℃时,取代度达到最大值1.047。当温度大于70 ℃时,取代度不断下降,这表明在一定的温度范围内,温度升高有利于羧甲基化,温度过高不利于羧甲基修饰,这可能是温度过高,会使氯乙酸和多糖发生降解,阻碍羧甲基化的进程,从而降低了羧甲基化取代度,因此确定70 ℃为反应最佳温度。

图4 温度对羧甲基取代度的影响Fig.4 Effect of temperature on degree of carboxymethyl substitution
2.2.3 一氯乙酸添加量对羧甲基取代度的影响 图5是红枣多糖羧甲基修饰过程中,一氯乙酸添加量对取代度的影响趋势图。当一氯乙酸添加量为从1%增加到3%时,羧甲基取代度逐渐增大,当一氯乙酸添加量为3%时,最大取代度可达1.014。大于3%时随添加量的增加取代度急剧降低,这可能是因为过量一氯乙酸的加入,消耗了一定量NaOH,使得反应体系pH 降低,不利于反应的进行,因此确定一氯乙酸添加量为3%。
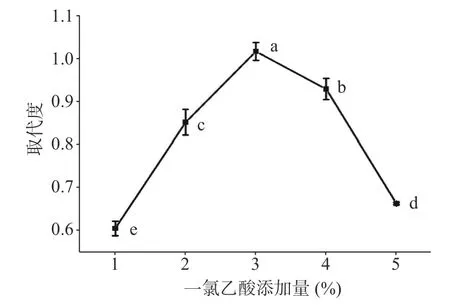
图5 一氯乙酸添加量对羧甲基取代度的影响Fig.5 Effect of monochloroacetic acid addition amount on degree of carboxymethyl substitution
2.3 羧甲基化红枣多糖制备响应面试验
2.3.1 响应面优化试验 响应面试验结果如表2 所示。对试验数据进行多元回归分析,得出羧甲基化红枣多糖的取代度预测响应Y 为:Y=1.05-0.014A-6.500E-003B-0.059C-0.023AB+4.750E-003AC+0.14BC-0.37A-0.19B-0.27C。用值和值衡量模型系数的显著性,结果见表3。本试验中,值为142.52 说明模型值较高,值(<0.0001)较低,表明该模型具有高度显著性,就纯误差而言,失拟项(=0.1390)不显著,这表明模型方程适合羧甲基化红枣多糖的取代度测定。模型决定系数(=0.9946),表明建立的模型适用。变异系数(C.V=4.04%)较低,表明试验值的精度和可靠性较高,以值为依据,检验各系数的显著性,值越小,对应系数越显著。显著性标注如表3 所示。BC 和A、B、C均为极显著(<0.01),其他因素间相互作用都不显著(>0.05),说明BC 间相互作用对羧甲基化取代度影响较明显。
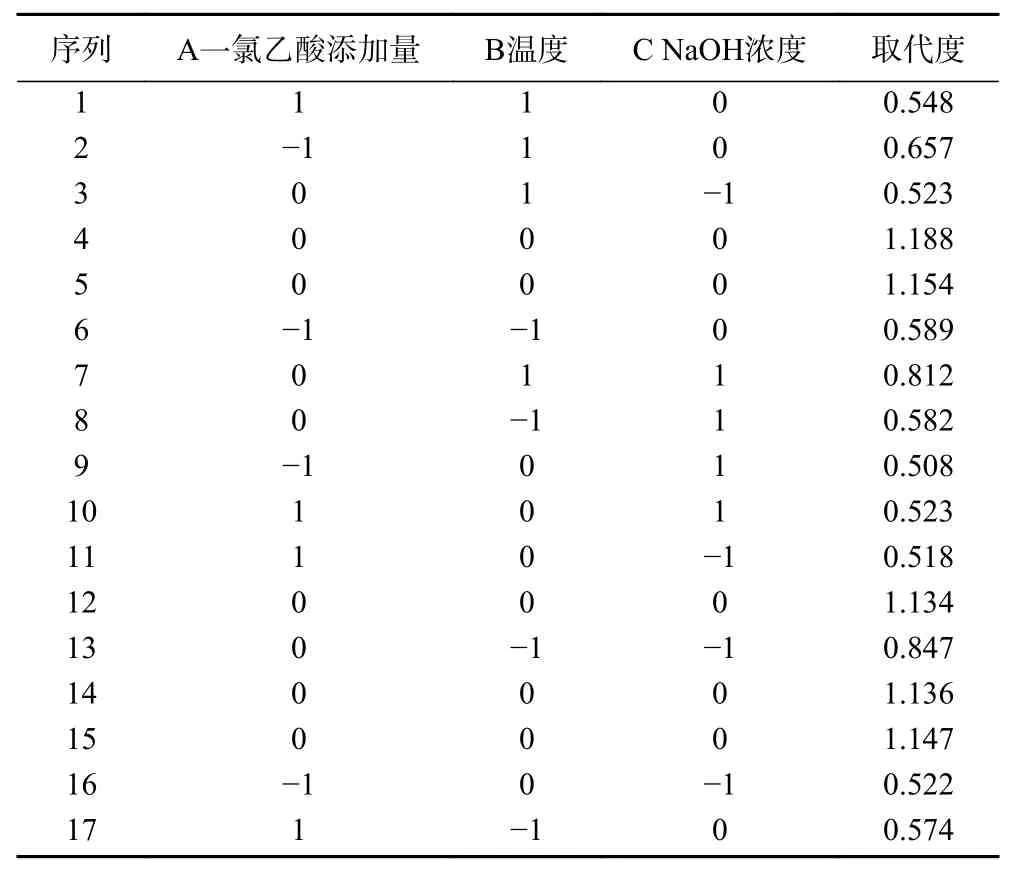
表2 响应面优化试验结果Table 2 Response surface optimization test results
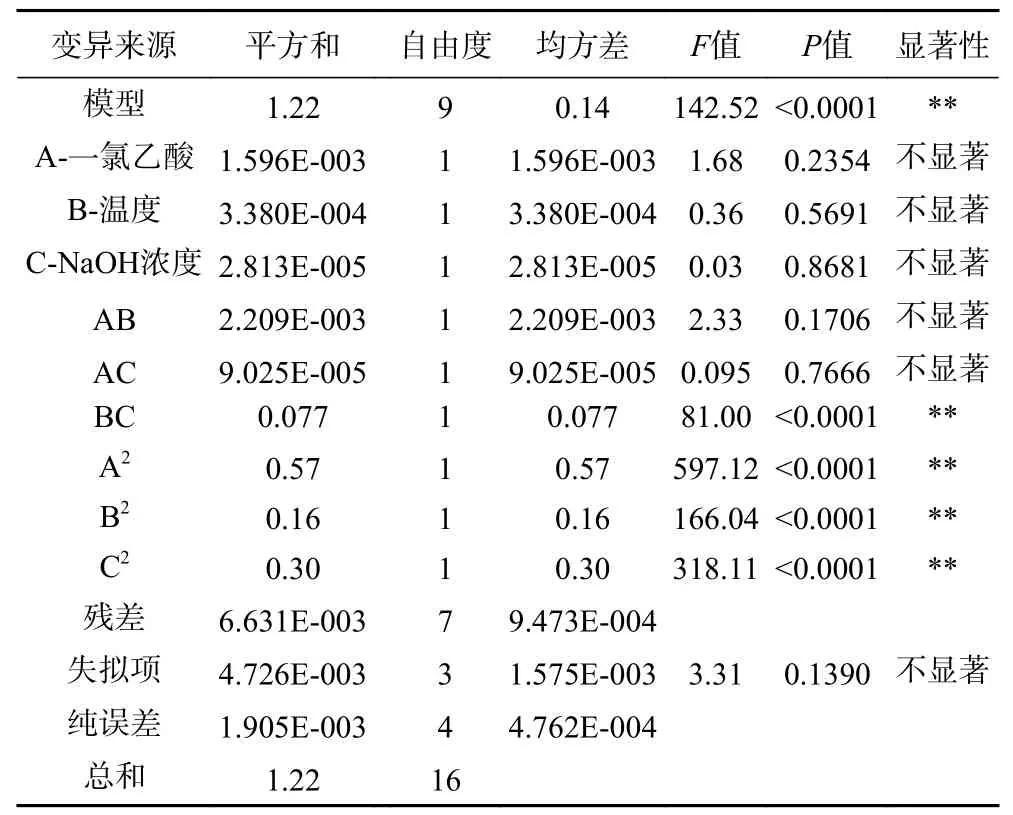
表3 回归模型方差分析Table 3 Regression model variance analysis
2.3.2 响应面分析与验证试验 图6 是红枣多糖羧甲基化修饰响应面图,通过3D 图,观察曲面的倾斜度确定两者对响应值的影响程度,倾斜度越高,即坡度越陡,说明两者交互作用越显著。另外,从3D 图的颜色可以做一个初步判定,随着变化趋势的剧烈增加,其颜色也呈加深趋势。响应面等高线图可以直观地反映各因素对响应值的影响,以便找出最佳工艺参数以及各参数之间的相互作用,等高线中的最小椭圆的中心点即是响应面的最高点。此外,等高线的形状可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反。结合图6,得出AB和AC 之间的相互作用对红枣多糖的羧甲基化修饰具没有显著性影响,BC 相互作用对红枣多糖羧甲基化修饰有显著性影响。

图6 各因素交互作用的响应面图Fig.6 Response surface diagram of interaction of various factors
根据响应面软件分析得红枣多糖羧甲基化修饰预测最佳工艺为:一氯乙酸添加量3.49%,温度69.52 ℃,NaOH 浓度3 mol/L,取代度预测值为1.1519。为了方便操作,最后确定红枣多糖羧甲基化修饰的最佳条件为:一氯乙酸添加量3.5%,NaOH 浓度为3 mol/L,温度为70 ℃。在该条件下,进行三次重复试验,其取代度结果分别为1.154、1.183、1.135,平均值为1.157,均优于其他组合,表明最优方法组合合理可用。
2.4 红枣多糖的结构表征
2.4.1 傅里叶红外光谱分析 图7 为羧甲基化修饰前后红枣多糖在4000~500 cm波长范围内的光谱图。由图可知,3371.38 cm和3388.27 cm是O-H的拉伸振动引起的,表明红枣多糖存在分子内氢键。2921.99 cm和2931.23 cm是C-H 不对称伸缩振动引起的,1720.41 cm是由于酯或羧基中C=O 的拉伸振动引起,表明可能存在糖醛酸或乙酰基。1411.81 cm对称C-O 拉伸振动引起的,1155.29 cm和1157.06 cm是C-O-H 和C-O-C 结构产生振动吸收引起的。1024.14 cm和1025.93 cm为-OH的O-H 变角振动,919.99 cm和923.72 cm为-吡喃糖的吸收峰。852.49 cm和869.72 cm为-吡喃糖的吸收峰,由此推测红枣多糖是-和-构型共存的吡喃型甘露糖苷酸性杂多糖。783.05 cm和761.73 cm是吡喃型特征吸收峰。羧甲基修饰后出现了新的吸收峰1592.89 cm和1421.26 cm,1592.89 cm是羧甲基中 COO-的拉伸振动,1421.26 cm处的吸收峰为羧甲基化的特征吸收峰。且-OH 特征吸收峰明显减弱,说明-OH 基团被取代,综上所述,表明红枣多糖成功引入了COO-基团,羧甲基化修饰成功。
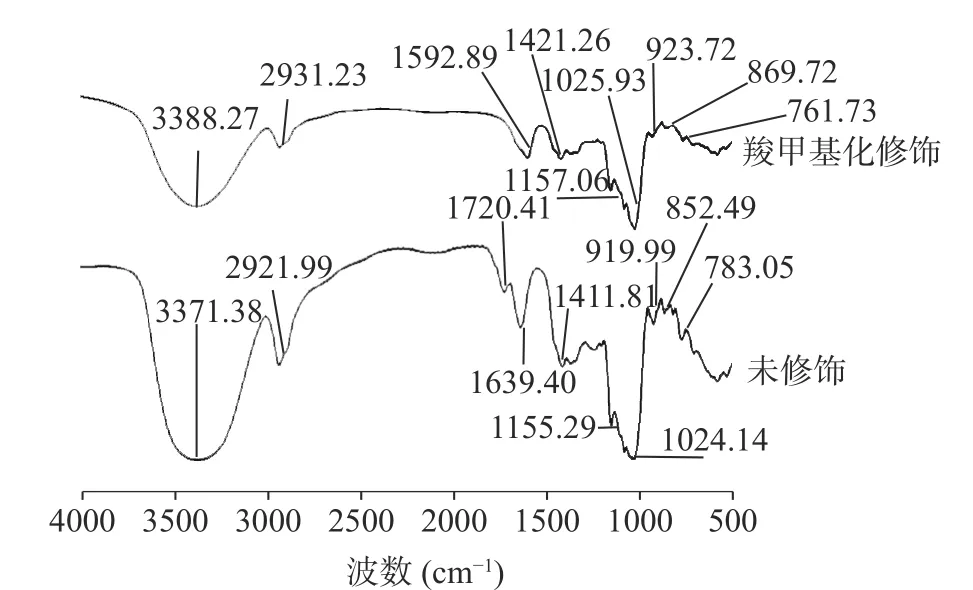
图7 傅里叶红外光谱图Fig.7 Fourier infrared spectroscopy
2.4.2 SEM 分析 由图8 扫描电镜观察可得:红枣多糖的微观形态发生明显的变化,主要在于颗粒大小、表面光滑程度、松散程度。未修饰的红枣多糖表面呈蜂窝状,有许多小孔,颗粒较大,呈块状,视觉效果较粗糙。羧甲基修饰过的红枣多糖表面较光滑,颗粒很小,呈片状。扫描电镜图表明羧甲基修饰可以改变多糖的微观形态,这可能是因为多糖结构发生变化造成的。

图8 扫描电镜图Fig.8 Scanning electron microscopy
2.5 红枣多糖抗氧化活性测定
2.5.1 羧甲基修饰红枣多糖对DPPH 的清除能力的影响 图9 为羧甲基化修饰红枣多糖对DPPH 自由基的清除能力,Vc 为阳性对照组。如图所示,随着浓度的增大,未修饰和羧甲基化修饰的红枣多糖对DPPH 自由基都有较强的清除作用,但清除能力均低于Vc,并且清除能力随着多糖浓度的增大逐渐加强,呈现剂量依赖性。此外,羧甲基化修饰后的红枣多糖的清除能力显著高于未修饰多糖(<0.05)。随多糖浓度的增加,羧甲基化修饰的红枣多糖对DPPH 自由基的清除作用显著增大。当浓度为5 mg/mL 时几乎和Vc 持平,达到了93.83%,而Vc 清除率为95.5%,未修饰的红枣多糖清除率为53.85%。此结果表明羧甲基化修饰可以显著提高红枣多糖对DPPH 自由基的清除作用。

图9 红枣多糖对DPPH 的清除作用Fig.9 Scavenging effect of Ziziphus jujuba polysaccharide on DPPH
2.5.2 羧甲基修饰红枣多糖对羟基自由基清除率的影响 如图10 所示,红枣多糖对羟基自由基有较强的清除作用,随着多糖浓度的增大,清除作用逐渐增强,呈剂量依赖性增加,羧甲基化修饰的红枣多糖对羟基自由基的清除作用显著提高(<0.05)。当浓度为5 mg/mL,羧甲基化修饰多糖羟基清除率44.7%,未修饰29.25%,表明羧甲基化修饰可提高红枣多糖对羟基自由基的清除作用。其原因可能是在糖基上引入取代基,可以使一些本来没有活性的化合物具有了活性,而且这些引入多糖取代基的方法都会大大地提高多糖的活性。

图10 红枣多糖对羟基自由基的清除作用Fig.10 Scavenging effect of Ziziphus jujuba polysaccharide on hydroxyl radical
2.5.3 羧甲基修饰红枣多糖对Fe的清除率的影响图11为羧甲基化修饰前后红枣多糖对Fe的螯合作用。低浓度时,未修饰与羧甲基化修饰的红枣多糖对Fe的螯合作用都比较低,其原因可能是低浓度范围,未修饰和羧甲基多糖均表现出较弱的清除活性。随着多糖浓度增大羧甲基化修饰的红枣多糖对Fe的螯合作用明显强于未修饰的。同时,螯合能力也逐渐增强,呈现浓度依赖性。表明羧甲基化修饰可以提高红枣多糖对Fe的螯合能力。

图11 红枣多糖对Fe2+螯合作用Fig.11 Chelating effect of Ziziphus jujuba polysaccharide on Fe2+
2.5.4 羧甲基修饰红枣多糖对总还原力的影响 图12体现羧甲基化修饰前后红枣多糖的还原力变化。从图可表明,红枣多糖具有一定的还原力,但其还原力远低于阳性对照Vc。随着浓度的增大,未修饰和羧甲基化修饰的红枣多糖的还原力都有所增加,且呈剂量依赖性。通过羧甲基化修饰的红枣多糖的还原力明显高于未修饰的红枣多糖,表明羧甲基化修饰可以提高红枣多糖的还原力,但由于红枣多糖自身还原能力较弱,修饰前后红枣多糖的还原力较V而言都较弱。

图12 红枣多糖的还原力Fig.12 Reducing power of Ziziphus jujuba polysaccharide
3 结论
红枣粗多糖通过除蛋白,脱色得到除杂红枣多糖,经羧甲基化修饰,通过单因素和响应面试验,确定一氯乙酸的添加量为3.5%,温度为70 ℃,NaOH 浓度为3 mol/L 时,修饰程度最佳,其羧甲基取代度可达1.157。红外光谱分析显示,修饰后-OH 吸收峰减弱,且出现了羧甲基化的特征吸收峰1592.89 cm和1421.26 cm,表明红枣多糖羧甲基化修饰成功。SEM 结果显示,羧甲基修饰过的红枣多糖表面比较光滑,颗粒小,呈片状,未修饰的多糖呈蜂窝状,表面较粗糙。DPPH 自由基,羟基自由基和还原力的测定结果显示,羧甲基化修饰的红枣多糖对DPPH、羟基自由基的清除率和还原力都有较明显的提高。通过对红枣多糖的羧甲基化修饰,可提高红枣多糖的抗氧化活性,为红枣多糖的进一步发展提供了理论依据,将有利于红枣多糖在食品和医药行业的广泛应用。

