一株鹅星状病毒变异毒株的基因组特征与致病性分析
吕 炫,贾北平,祝 萌,于胜祖,张 淼,王 蓓,朱英奇,张云凯,王 晴,王桂军*
(1. 安徽农业大学动物科技学院,合肥 230036; 2. 安徽省皖西白鹅原种场有限公司,六安 237158)
近年来,随着我国养殖产业的迅速发展,各种动物疾病有着不断增多的趋势,如病毒性疾病、细菌性疾病和寄生虫病等。其中,2016年以来导致雏鹅痛风的新型鹅星状病毒病已经成为限制养鹅产业健康发展的疾病之一。
鹅星状病毒是一种无囊膜的二十面体的单股正链RNA病毒,病毒直径28~30 nm。禽星状病毒基因组全长6.9~7.9 kb,包含3个开放阅读框(分别编码ORF1a、ORF1b和ORF2蛋白),5′和3′非编码区和一个多聚A尾。新型鹅星状病毒的分离和培养比较困难,目前该病毒的培养主要在鹅胚肾细胞、LMH细胞和9~11日龄的鹅胚,但在LMH细胞上无法产生细胞病变。
目前所研究的新型鹅星状病毒分离于2017—2021年间,在其致病性、生物学特征以及致病机制方面均有一定研究。为进一步丰富对新型鹅星状病毒的研究,本研究对2021年所采集的鹅星状病毒阳性病料进行分离,并对分离的毒株进行全基因测序,分析其2基因核苷酸和氨基酸同源性以及编码的衣壳蛋白与以往年份毒株的氨基酸变异位点的差异,同时构建系统发育树,分析该毒株与其他分离毒株的遗传进化关系。
1 材料与方法
1.1 病毒的分离鉴定
取采集保存的发病雏鹅的肾和肝组织,按照1∶5的比例加入无菌PBS进行研磨,收集病料研磨液加入青霉素和链霉素,反复冻融3次。12 000 r·min、4 ℃ 离心10 min后取上清,0.22 μm滤器过滤后于-80 ℃ 冰箱保存备用。
健康鹅胚在孵化箱孵化至10日龄后,通过绒毛尿囊膜途径接种200 μL无菌病毒液,弃去24 h内死亡的鹅胚,其余鹅胚死亡后及时进行处理。观察7 d后,未死亡鹅胚于4 ℃ 冰箱处死,收集胚体和尿囊液进行传代,直至稳定致死鹅胚。
LMH细胞密度达到80%后,弃掉培养液,加入含有200 μL病毒液的培养基37 ℃ 孵育2 h后,弃去培养基。加入1% FBS的DMEM-F12培养基孵育72 h后,利用本实验室所建立的方法,进行病毒的IFA鉴定。
1.2 GASTV ZM株鹅星状病毒的全基因组扩增
根据GenBank收录的新型鹅星状病毒全基因组(GenBank accession number:MF772821)序列设计7对引物,对鹅星状病毒全基因组进行分段扩增,PCR产物胶回收后连接pMD19-T载体,委托南京擎科生物科技有限公司测序。利用Chromas和DNAMAN软件拼接后得到ZM株鹅星状病毒全基因组。
1.3 遗传进化分析
利用MegAlign软件分析鹅星状病毒ZM株2基因核苷酸和氨基酸同源性,同时将2基因编码的氨基酸与2014—2020年间分离株进行比对,分析氨基酸变异位点。利用MEGA 7软件,将鹅星状病毒GASTV-ZM分离株全基因组与以往禽星状病毒分离株和哺乳动物星状病毒分离株全基因组进行系统发育分析。
2 结 果
2.1 病原分离
无菌病毒液通过绒毛尿囊膜途径接种10日龄鹅胚,盲传3代后可稳定致死鹅胚。剖解鹅胚可见绒毛尿囊膜有白色絮状沉淀,胚体水肿,体表出血严重,肝呈斑驳样坏死。
2.2 病毒IFA检测结果
利用本实验室制备的鹅星状病毒衣壳纤突蛋白多克隆抗体,进行IFA鉴定,结果显示LMH细胞感染F3代鹅胚尿囊液,在LMH细胞质中均可检测到绿色特异性荧光,阴性对照组LMH细胞未见荧光信号(图1)。表明已成功利用鹅胚分离到GASTV-ZM株鹅星状病毒。
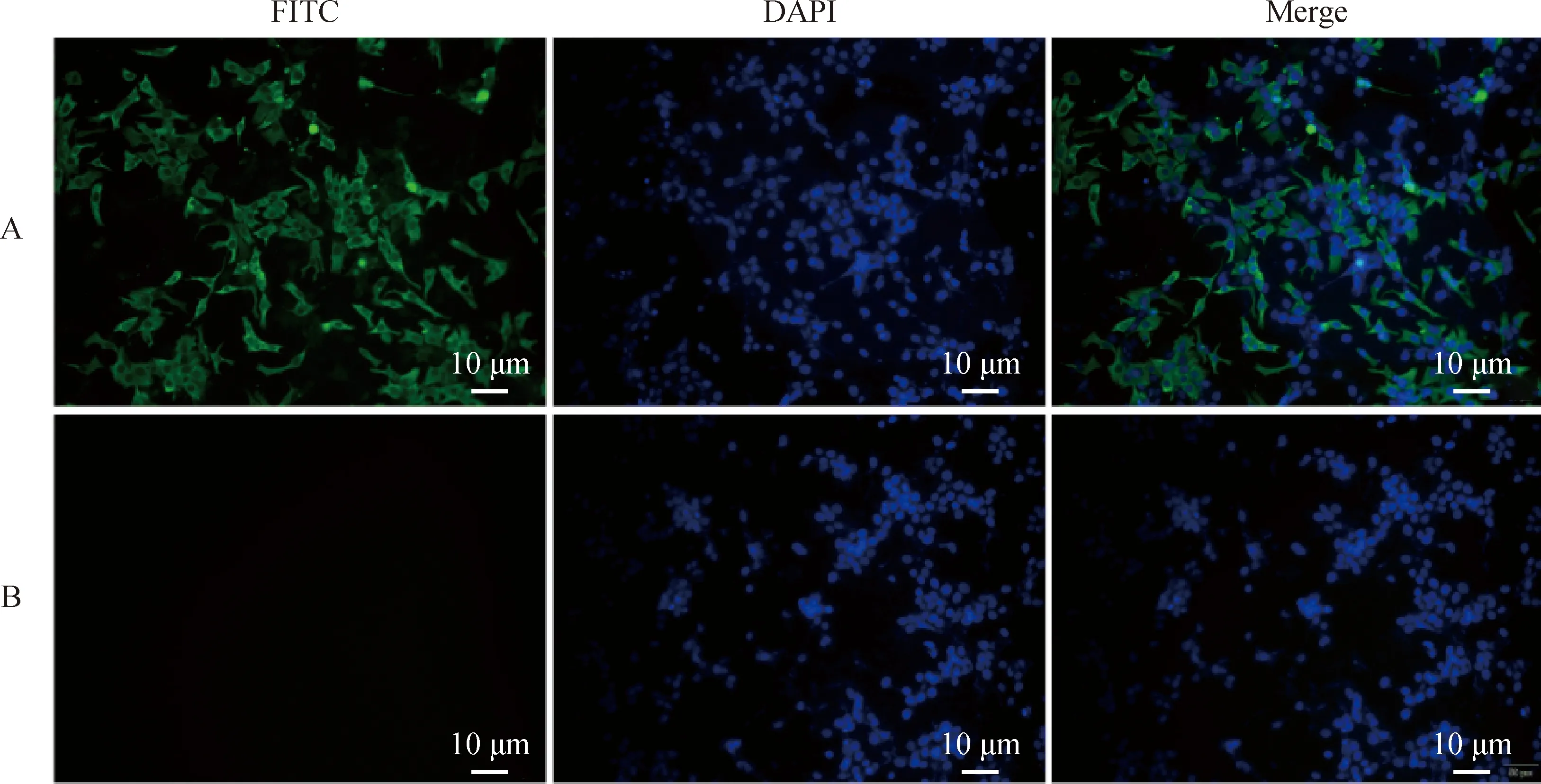
A. F3代鹅胚分离的ZM病毒;B. 对照组。FITC. 异硫氰酸荧光素;DAPI. 4’,6-二脒基-2-苯基吲哚;Merge. 融合A. ZM virus isolated from goose embryo of F3 generation; B. Control group. FITC. Fluorescein isothiocyanate; DAPI. 4’,6-diamidino-2-phenylindole; Merge. Merge图1 间接免疫荧光细胞化学染色法检测鹅星状病毒Fig.1 Indirect immunofluorescence cytochemical staining for detection of goose astrovirus
2.3 全基因测序结果分析
本研究分离的鹅星状病毒ZM株(GenBank accession number:MZ648231)基因组全长7 175 nt,其中包括10 nt的5′UTR和236 nt的3′UTR,包含3个开放阅读框,分别为1、1和2基因,其中1a基因为3 255 nt,1b基因为1 551 nt,两者编码鹅星状病毒非结构蛋白,包含跨膜域、丝氨酸蛋白酶、卷曲螺旋、病毒基因组连接蛋白、核定位信号以及RNA依赖性RNA聚合酶。2基因为2 115 nt,编码病毒衣壳蛋白。
2.4 遗传进化分析
2.4.12基因核苷酸和氨基酸同源性及编码蛋白的变异位点分析 将不同年份所分离的鹅星状病毒与2021年ZM分离株的2基因进行核苷酸和氨基酸同源性分析。如表1所示,ZM株2基因核苷酸和氨基酸与2014—2020年间分离毒株的同源性分别为96.7%~98.9%和96.9%~99.0%。

表1 ORF2基因同源性和氨基酸变异位点分析
2021年分离株GASTV-ZM与2014—2020年间中国分离毒株在2基因编码蛋白氨基酸序列有较为显著的差异,其中3个氨基酸突变位点与以往存在显著差异,60(V-I)、97(L-P)、228(A-S)。其他突变主要集中在36(Y、H-S)、229(Q-P)、289(A-T)、376(T-A)、456(E-D)、540(L-Q)、614(A-N)。
2.4.2 鹅星状病毒遗传进化分析 将鹅星状病毒GASTV-ZM株与GenBank已发表的禽星状病毒和哺乳动物星状病毒在全基因组核苷酸序列水平进行比对分析,并绘制遗传进化树。结果如图2,GASTV-ZM株与2016年以来在我国流行的新型鹅星状病毒处于同一进化分支,与2020分离株HNSQ-6株和XT1株同源性较高。与以往鹅星状病毒FLX株、AHDY株和SCCD株处于同一进化分支不同的进化亚分支。同时哺乳动物星状病毒(人星状病毒)与禽星状病毒(包括鸭星状病毒、鸡星状病毒)处于不同的进化分支。

图2 基于星状病毒全基因组遗传进化分析Fig.2 Phylogenetic tree based on the whole genome of astrovirus
3 讨 论
禽星状病毒感染可引起鸡肾炎、火鸡肠炎和鸭致死性肝炎等临床疾病。自2016年以来,在安徽、江苏、山东等省份流行一种以鹅痛风为特征的新型鹅星状病毒病。Zhao等研究表明,鸡星状病毒可感染LMH细胞并产生细胞病变,但是新型鹅星状病毒感染LMH细胞并不能产生细胞病变,但是可以在细胞上进行稳定传代。本研究分离的ZM株通过绒毛尿囊膜途径接种9~11日龄鹅胚,盲传3代后可以稳定致死鹅胚,可导致胚体表面明显出血,肝呈斑驳样坏死,部分鹅胚内可见明显的尿酸盐颗粒沉积。病毒的IFA鉴定可见,鹅胚分离毒株可以检测到特异性的绿色荧光。表明新型鹅星状病毒ZM株可以在鹅胚上增殖,为后续进一步研究该病毒提供模型。
禽星状病毒的2基因编码其衣壳蛋白,衣壳蛋白作为其主要结构蛋白,在蛋白水解成熟、病毒传染性、病毒与宿主抗体和补体相互作用及病毒入侵宿主细胞中发挥重要作用。本研究通过分析2基因核苷酸和氨基酸同源性发现,2014、2016和2017年间分离株与ZM株的核苷酸同源性和氨基酸同源性分别在96.7%~98.3%和96.9%~98.4%,2018、2019和2020年间分离株与ZM株的核苷酸同源性和氨基酸同源性分别在97.2%~98.9%和97.0%~99.0%。表明2021年ZM分离株与2018~2020年分离株在核苷酸和氨基酸水平上同源性高于2014~2017年间的分离株。同时2基因编码的衣壳蛋白与以往毒株存在多个氨基酸突变,包含3个独立的氨基酸突变,结合遗传进化分析发现,ZM株与我国流行的新型鹅星状病毒处于同一进化分支。表明新型鹅星状病毒存在进一步变异的可能。
4 结 论
本研究从临床发病雏鹅上成功分离到1株新型鹅星状病毒ZM株,在鹅胚上可以稳定传代。遗传进化分析表明ZM株与近几年新型鹅星状病毒分离株同源性高,且与新型鹅星状病毒处于同一进化分支,存在进一步变异的可能。为进一步研究ZM鹅星状病毒的致病性和致病机制奠定基础。

