干扰SERBP1表达对山羊鼻甲骨原代细胞增殖、周期及凋亡的作用
徐颂为,向 华*,张焕容*,杨 璐,王宪军,撒朗文朱,朱江江
(1.西南民族大学畜牧兽医学院,成都 610041; 2.青藏高原动物遗传资源保护与利用 四川省重点实验室,成都 610041)
羊传染性脓疱皮炎俗称“羊口疮”,是由羊口疮病毒(Orf virus,ORFV)引起的一种急性、接触性、嗜上皮性的人兽共患传染病,既能造成严重的经济损失,又威胁着人类健康。ORFV属于痘病毒科副痘病毒属,为双股DNA病毒,由末端的可变基因区(001-008和112-134)和中间保守的核心基因区(009-111)组成。其中125基因编码蛋白(ORFV125)能够抑制细胞凋亡,然而对于其机制尚不清楚。深入探讨ORFV125蛋白抑制细胞凋亡的分子通路对于揭示ORFV的致病机制具有重要作用。蛋白质CGI-55,又被称为SERBP1(SERPINE mRNA binding protein 1)或PAIRBP1(PAI1 RNA-binding protein),是一种被精氨酸甲基化修饰的RNA结合蛋白,修饰后的SERBP1蛋白可改变其亚细胞定位以及影响与其他蛋白的相互作用。对于SERBP1蛋白功能的研究目前主要集中在人源上,如2003年,Peluso发现1可通过与孕激素受体膜复合物结合进而激活细胞内信号通路,从而抑制颗粒细胞凋亡。2006年,Lemos和Kobarg通过酵母双杂交试验鉴定出SERBP1蛋白与CHD-3(chromo-helicase-DNA-binding domain protein)、Daxx(death domain associated protein)等9种细胞转录调控蛋白存在相互作用,推测SERBP1蛋白可能参与细胞转录调控过程。2014年,Costa等发现,1基因可下调细胞内与mRNA代谢和转录相关基因的表达,导致细胞周期的G期出现阻滞现象。2016年,Guo等研究表明,过表达1后可促进肿瘤细胞的增殖。可见SERBP1蛋白在mRNA代谢和转录、细胞周期、细胞凋亡、细胞增殖等方面发挥重要作用。
近期研究发现,SERBP1蛋白过表达可抑制由内质网压力引起的细胞凋亡过程。酵母双杂交技术显示,1与125存在相互作用,且125具有抑制细胞凋亡的作用。推测,ORFV可能通过SERBP1蛋白参与调控细胞的周期及凋亡,然而目前尚无山羊1基因序列及其蛋白在调控山羊鼻甲骨原代细胞凋亡作用的相关报道。同时,山羊鼻甲骨原代细胞常被作为羊口疮病毒的增殖和致病机制研究的理想细胞类型之一。本研究选用简州大耳羊为试验动物,RT-PCR技术克隆山羊1基因序列并进行生物信息学分析,利用实时荧光定量PCR技术检测1基因在不同组织的表达水平;通过构建干扰RNA,并将其转染山羊鼻甲骨原代细胞探究SERBP1蛋白对细胞增殖、细胞周期、细胞凋亡的作用,以及对细胞凋亡相关基因的影响。为进一步深入研究1基因功能,揭示125抑制细胞凋亡的分子机制提供重要的试验数据。
1 材料与方法
1.1 动物和组织来源
本试验所用动物为16只10月龄健康简州大耳羊,屠宰后立即收集山羊心、肝、脾、肺、肾、胰腺、大肠、小肠、瘤胃9个组织样本,使用已灭菌的DEPC水清洗后将组织用锡箔纸包好,迅速放入液氮罐中保存,备用。山羊鼻甲骨原代细胞由实验室前期试验分离获得,置于液氮中保存备用。
1.2 主要试剂
TRIzol试剂购自美国Thermo Fisher Science公司;Revert Aid First Strand cDNA Synthesis Kit 试剂盒、Premix Taq、SYBRPremix Ex Taq、DL2000 DNA Marker、pMD-19T Simple载体购自TaKaRa公司;DL5000 DNA Marker购自苏州宇恒生物科技有限公司;大肠杆菌DH5α感受态细胞购自昂羽生物公司;GET Extraction kit和Plasmid Mini Kit I购自OMEGA公司;胎牛血清购自QUACELL公司;MTT细胞增殖及毒性检测试剂、胰蛋白酶、双抗和PBS购自博士德生物公司,DMEM培养基购自Gibco公司;siRNA干扰片段由上海吉玛公司合成;Opti-mem减血清培养基、Lipofectamine转染试剂购自赛默飞世尔科技公司;细胞周期与细胞凋亡检测试剂盒购自北京四正柏生物科技有限公司;氯仿、异丙醇、二甲基亚砜等其他试剂均为国产生化试剂。
1.3 山羊SERBP1基因克隆及序列分析
按照TRIzol法提取简州大耳羊组织总RNA,测定RNA样品浓度以及OD/OD值,确保符合试验要求。按反转录试剂盒说明书要求将总RNA反转录为cDNA,保存备用。根据GenBank中山羊1基因预测序列(XM_018045378.1),利用Primer Premier 5设计引物,引物由生工生物工程(上海)有限公司合成,序列见表1。以山羊脾组织cDNA为模板,使用上、下游引物进行PCR扩增。PCR反应体系:Tap PCR Master Mix9(2×)12.5 μL,上、下游引物(10 μmol·L)各1.0 μL,模板cDNA 1.0 μL,ddHO 9.5 μL。PCR反应条件:95 ℃预变性3 min,95 ℃变性15 s,63 ℃退火15 s,72 ℃延伸25 s,共35个循环,72 ℃延伸5 min。PCR产物用1.5%琼脂糖凝胶电泳检测正确后,使用GET Extraction kit胶回收试剂盒对目的片段进行回收,并将回收产物连接至pMD-19T Simple载体,转化DH5α感受态细胞,阳性菌落PCR鉴定正确后,扩大培养提取质粒并送至上海生工生物工程股份有限公司测序,将测序正确的重组质粒命名为pMD19-1。按照王宪军等的方法对所得序列进行生物信息学分析。
1.4 检测山羊SERBP1基因组织表达差异分析
选择16只健康简州大耳羊的9个组织(心、肝、脾、肺、肾、大肠、小肠、胰腺、瘤胃)和鼻甲骨细胞,分别对每个样本提取总RNA并反转录获得cDNA。根据“1.3”克隆获得的1基因序列,利用Primer Premier 5设计特异性RT-qPCR引物,RT-qPCR检测1基因在各组织中的表达差异。选择泛表达转录子基因(Ubiquitously-Expressed Transcript,)作为试验的内参基因,引物序列见表1。

表1 引物信息
1.5 山羊鼻甲骨原代细胞的分离培养及SERBP1 siRNA的转染
参考文献[12]的方法进行山羊鼻甲骨原代细胞的分离培养。使用眼科剪将鼻甲骨组织剪碎,使之成为体积约1 mm的块状。DMEM(不含血清)冲洗后,1 000 r·min、5 min离心,反复几次至上清液澄清,然后将少量含体积分数为15% FBS的DMEM培养基小心滴加置组织块周围,将六孔板置于37℃,5% CO的条件下培养2 h。等组织块和六孔板全部贴壁后沿壁加入2 mL营养液,24 h后换液继续培养。等细胞培养至细胞贴壁80%~90%后,使用0.125%胰蛋白酶中消化20 s后继续培养,待长满后以1∶2进行传代培养。待传至第六代,将细胞按照(1~5)×10个·cm的接种量接种于12孔培养板中,次日待细胞生长至80%融合时,按Lipofectamine3000转染试剂说明书进行转染,具体操作步骤参考王江林等的方法。培养48 h后,TRIzol法提取收集到的细胞总RNA,反转录成cDNA,利用RT-qPCR检测1基因的mRNA表达水平,筛选有效的siRNA干扰片段。试验设置3个重复。山羊3条1-siRNA序列由上海吉玛基因公司设计合成,引物序列见表2。同时,以基因作为内参基因。
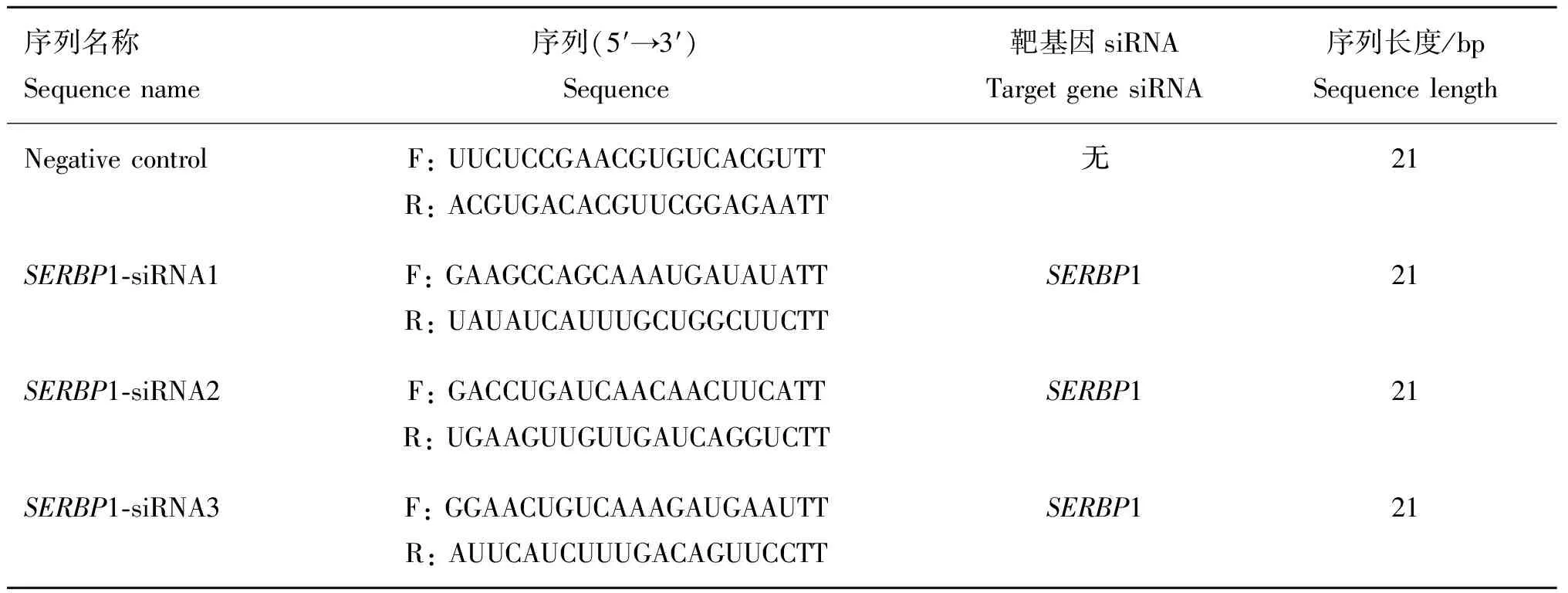
表2 siRNA的引物序列
1.6 干扰SERBP1对山羊鼻甲骨原代细胞增殖的影响
将第6代山羊鼻甲骨原代细胞接种于96孔培养板,次日待细胞生长至80%时,按照“1.5”的方法进行转染。培养24、48、72、96 h后,按照MTT试剂说明书,每孔加入10 μL的MTT溶液,培养箱中继续培养4 h后,弃上清,每孔加入100 μL二甲基亚砜,振荡10 min溶解结晶,酶标仪选择490 nm波长检测各孔光吸收OD值,每天在相同的时间测定1次,根据每组测定的OD值的平均值绘制细胞生长曲线。每组设5个重复孔,试验重复3次。
1.7 干扰SERBP1对山羊鼻甲骨原代细胞周期的影响
参照“1.5”方式进行转染,转染48 h后,按照细胞周期检测试剂盒说明书,胰蛋白酶消化细胞,离心收集沉淀细胞,加入1 mL预冷的PBS溶液重悬细胞,再次加入4 mL预冷的95%乙醇,混匀后在4 ℃条件下固定过夜,离心收集沉淀细胞,加入5 mL预冷的PBS溶液,重悬细胞,再次离心收集沉淀细胞,随后向每管细胞样品中加入0.4 mL的碘化丙啶染色液,充分重悬细胞,37 ℃避光条件染色30 min,使用流式细胞仪进行检测。
1.8 干扰SERBP1对山羊鼻甲骨原代细胞凋亡的影响
同样参考“1.5”方式进行转染,转染48 h后,收集上层清液,按照细胞凋亡检测试剂盒说明书,使用不含有EDTA的胰蛋白酶消化细胞,加入上层清液,离心收集沉淀细胞。加入1 mL 4 ℃预冷的PBS,重悬细胞,再次离心收集沉淀细胞。向沉淀细胞中加入500 μL Binding Buffer进行重悬,加入5 μL Annexin V/FITC混匀后于室温避光孵育5 min,加入10 μL的碘化丙锭溶液(浓度为μg·mL),并加400 μL PBS,立即上流式细胞仪进行检测。
1.9 干扰SERBP1对山羊鼻甲骨原代细胞凋亡相关基因的影响
根据GenBank公布的山羊凋亡相关基因(KJ782303.1)、-2(KJ782304.1)、3(NM_001286089.1)、7(XM_018041622.1)序列以及牛凋亡相关基因53(DQ656491.1)、211(NM_001075310.1)、1(XM_027564618.1)序列,利用Primer Premier 5.0软件分别设计引物,引物序列见表3。利用RT-qPCR检测干扰1对细胞凋亡相关基因的mRNA表达水平,选择作为试验的内参基因。

表3 凋亡相关基因的引物序列
1.10 数据统计与分析
对实时荧光定量数据采用2方法进行处理。利用SPSS 18.0对数据进行单因素方差分析,采用Duncan’s法对各组织mRNA表达进行多重比较。<0.05表示差异显著,<0.01表示差异极显著。
2 结 果
2.1 山羊SERBP1基因CDS区的克隆、鉴定及生物信息学分析
经克隆测序得到一条长1 293 bp的1基因序列,包含5′UTR 44 bp,CDS区1 179 bp,3′UTR 70 bp,编码392个氨基酸,起始密码子为ATG,终止密码子为TAA(图1A)(GenBank登录号:MZ389322)。胶回收产物经转化后,菌落PCR鉴定得到与预期1基因大小相符的条带(图1B)。
A. 山羊 SERBP1 克隆的凝胶电泳图;B. 山羊 SERBP1 克隆的质粒凝胶电泳图。M. DL5000 DNA Marker、DL2000 DNA Marker;1. SERBP1 目的条带;N. 阴性对照A. Gel electropherogram of the goat SERBP1 clone; B. Plasmid gel electrophoresis of goat SERBP1 clone. M. DL5000 DNA Marker, DL2000 DNA Marker; 1. SERBP1 target band; N. Negative control图1 山羊SERBP1基因克隆Fig.1 Cloning of SERBP1 in goat
SERBP1蛋白分子式为CHNOS,为稳定的疏水性蛋白(图2A),蛋白分子质量为43.04 ku,不存在信号肽(图2B),无跨膜结构域(图2D)。 SERBP1蛋白中α螺旋占比13.27%,无规则卷曲占比76.28%和延伸链占10.46%(图2C), 三级结构结果如图3A。该蛋白主要包括两种磷酸位点,分别是17个丝氨酸(Serine)、10个苏氨酸(Threonine)(图2E)。亚细胞定位显示SERBP1蛋白主要存在于细胞核(78.3%)。与SERBP1蛋白可能存在相互作用的蛋白包括:RPL8(ribosomal protein L8)、RPS29(ribosomal protein S29)、SND1(staphylococcal nuclease domain-containing protein)、IFRD2(interferon related developmental regulator 2)、RPL26(ribosomal protein L26)、FMR1(fragile x mental retardation 1)、RPS5(ribosomal protein S5)、RPL29(ribosomal protein L29)、GTF3C6(general transcription factor IIIC subunit 6)、RPL18(ribosomal protein L18)(图3B)。系统进化树显示,山羊和预测绵羊、牛、猪的亲缘关系较近,与绵羊亲缘关系最近,与生物分类学保持一致(图3C)。
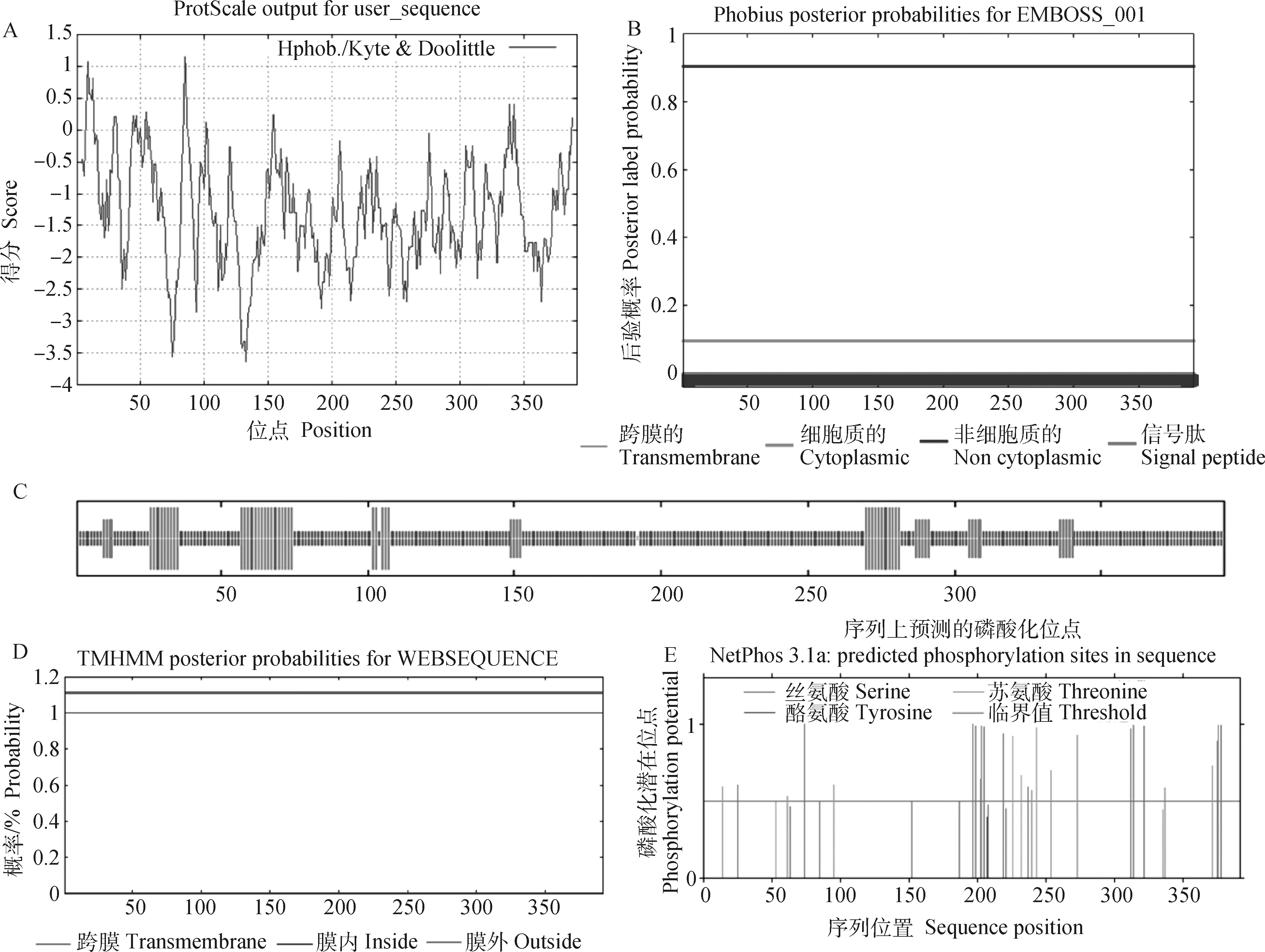
A.山羊SERBP1蛋白质疏水结构预测;B.山羊SERBP1蛋白的信号肽分析;C.山羊SERBP1蛋白质二级结构分析,长竖线代表α螺旋,中竖线代表延伸链,短竖线代表代表无规卷曲;D.山羊SERBP1蛋白跨膜结构预测;E.山羊SERBP1蛋白磷酸化位点预测A. Prediction of hydrophobic structure of goat SERBP1 protein; B. Signal peptide analysis of goat SERBP1 protein; C. Secondary structure prediction of goat SERBP1 protein, the long vertical lines represent alpha helix, the middle vertical lines represent extended strand, the short vertical lines represent random coil; D. Prediction of transmembrane structure of goat SERBP1 protein; E. Prediction of SERBP1 protein phosphorylation sites in goat图2 山羊 SERBP1 蛋白生物信息学分析Fig.2 Bioinformatics analysis of SERBP1 protein in goats
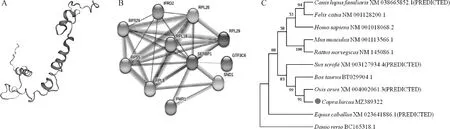
A. 山羊SERBP1蛋白三级级结构预测;B. 山羊SERBP1蛋白与其他蛋白相互作用网络;C. 不同物种间SERBP1蛋白的系统进化树A. Tertiary structure prediction of goat SERBP1 protein; B. The interaction network of goat SERBP1 with other proteins; C. Phylogenetic tree of SERBP1 protein among different species图3 山羊SERBP1蛋白生物信息学分析Fig.3 Bioinformatics analysis of SERBP1 protein in goats
2.2 山羊SERBP1基因的组织表达差异分析
结果显示(图4),1基因在9个组织及鼻甲骨细胞中均有表达,其中胰腺中表达量最高,脾、肝、鼻甲骨细胞次之,达到了极显著和显著水平(<0.01或<0.05),而在肾、肺、小肠、大肠表达量最低。
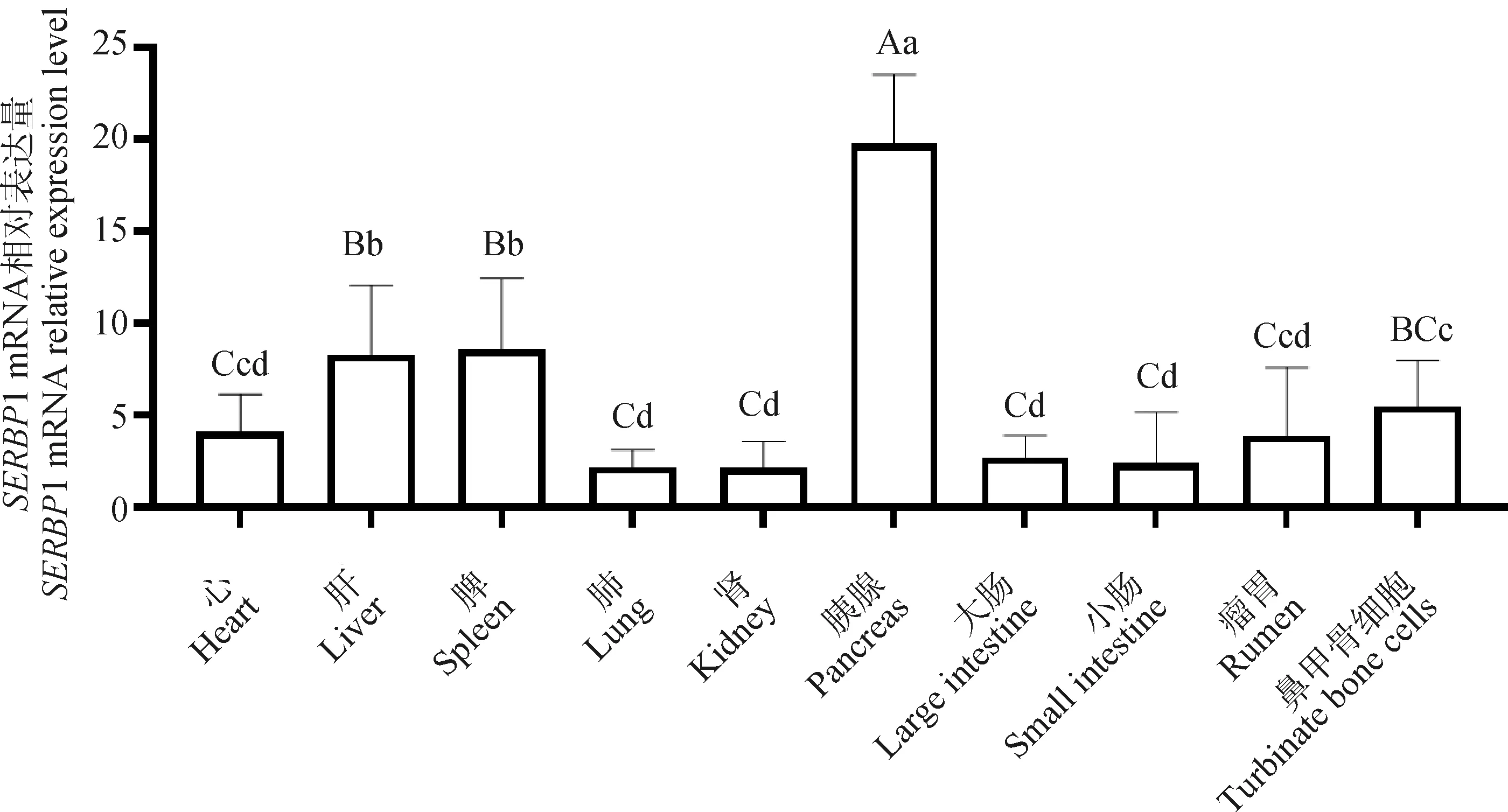
不同大写字母表示数据间差异极显著(P<0.01);不同小写字母表示差异显著(P<0.05)Different uppercase letters indicate highly significant difference between data (P<0.01); Different lowercase letters indicate significant difference (P<0.05)图4 山羊SERBP1基因的组织表达谱Fig.4 Tissue expression profile of goat SERBP1
2.3 SERBP1干扰效率的确定
RT-qPCR检测结果表明(图5A),与对照细胞组表达水平相比,1-siRNA1下调1表达量为70%,1-siRNA2和1-siRNA3分别下调35%和46%。因此,1-siRNA1对1表达水平的干扰效果更好,达到了极显著水平(<0.01),后续试验选用1-siRNA1。
2.4 siRNA干扰SERBP1对山羊鼻甲骨原代细胞增殖的影响
试验结果见图5B,与对照细胞组相比,转染1-siRNA1片段的山羊鼻甲骨原代细胞48 h后增殖受到了一定程度的抑制,随着时间的延长,其抑制作用也极显著增加(<0.01)。
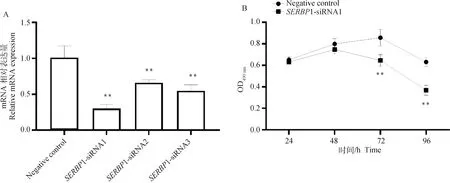
A. SERBP1基因干扰效率检测; B. siRNA干扰SERBP1基因对山羊鼻甲骨细胞增殖的影响。**. P<0.01A. Interference efficiency detection of SERBP1 gene; B. The effects of siRNA interference with SERBP1 gene on the proliferation of goat turbinate bone cells. **. P<0.01图5 siRNA干扰SERBP1的筛选及其对山羊鼻甲骨细胞增殖的影响Fig.5 The screening of siRNA interfering SERBP1 and its effect on the proliferation of goat turbinate bone cells
2.5 siRNA干扰SERBP1对山羊鼻甲骨原代细胞周期的影响
细胞周期检测结果显示(图6A),G/G期细胞数,与对照细胞组((69.61±0.02)%)比较,1-siRNA1组G/G期细胞数((72.69±0)%)显著增加 (<0.05); 而G/M期细胞数,与对照细胞组((18.92±0.98)%)比较,1-siRNA1组G/M期细胞数((16.67±0.26)%)极显著减少 (<0.01);对于S期细胞数,与对照细胞组((11.48±1)%)比较,1-siRNA1组S期细胞数((10.56±0.25)%)无显著变化 (>0.05),可见细胞被阻滞于G/G期。
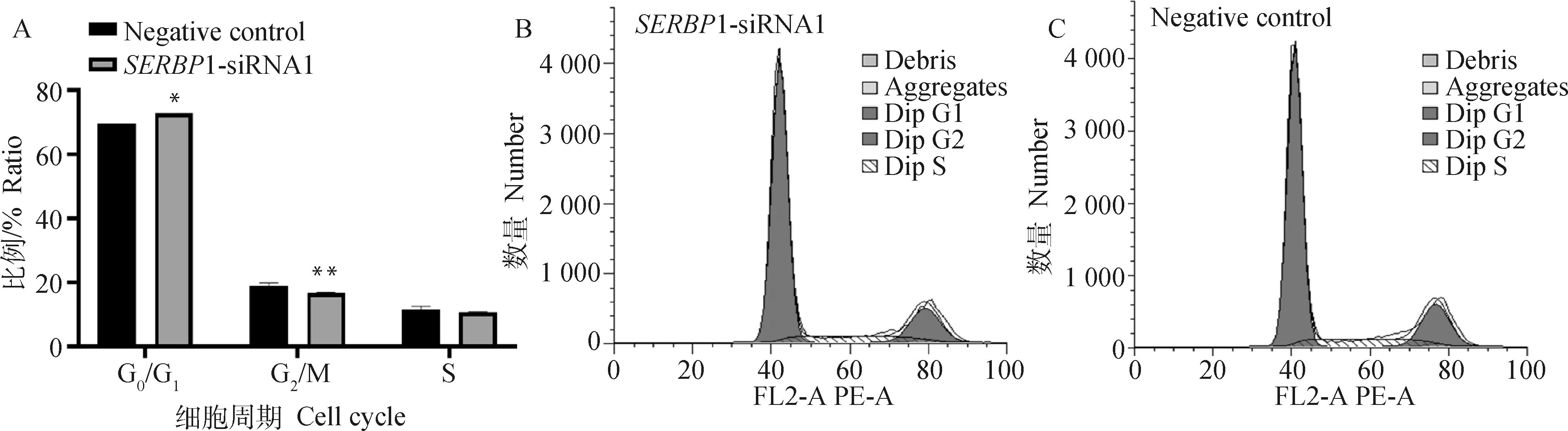
A. SERBP1-siRNA1和NC组不同期细胞数量对比;B. 试验组SERBP1-siRNA1山羊鼻甲骨原代细胞周期分布;C. 对照组NC山羊鼻甲骨原代细胞周期分布。*. P<0.05,**. P<0.01A. Comparison of the number of cells at different stages between the SERBP1-siRNA1 and NC groups; B. Experimental group SERBP1-siRNA1 goat primary turbinate bone cells cycle distribution; C. Control group NC goat primary turbinate bone cells cycle distribution. *. P<0.05, **. P<0.01图6 siRNA干扰SERBP1对山羊鼻甲骨细胞周期的影响Fig.6 The effects of SERBP1-siRNA1 on the cycle of goat turbinate bone cells
2.6 siRNA干扰SERBP1对山羊鼻甲骨原代细胞凋亡的影响
结果显示(图7A),转染对照细胞组的山羊鼻甲骨细胞的早期凋亡率是(1.74±0.15)%,晚期凋亡率为(15.3±1.75)%,总凋亡率为(17.04±1.9)%。而转染的1-siRNA1山羊鼻甲骨细胞的早期凋亡率是(0.99±0.27)%,晚期凋亡率为(7.36±0.86)%,总凋亡率为(8.35±1.13)%,早期凋亡率显著低于对照细胞组(<0.05),晚期和总凋亡率极显著低于对照细胞组(<0.01)。因此,siRNA干扰1基因后可抑制细胞凋亡。
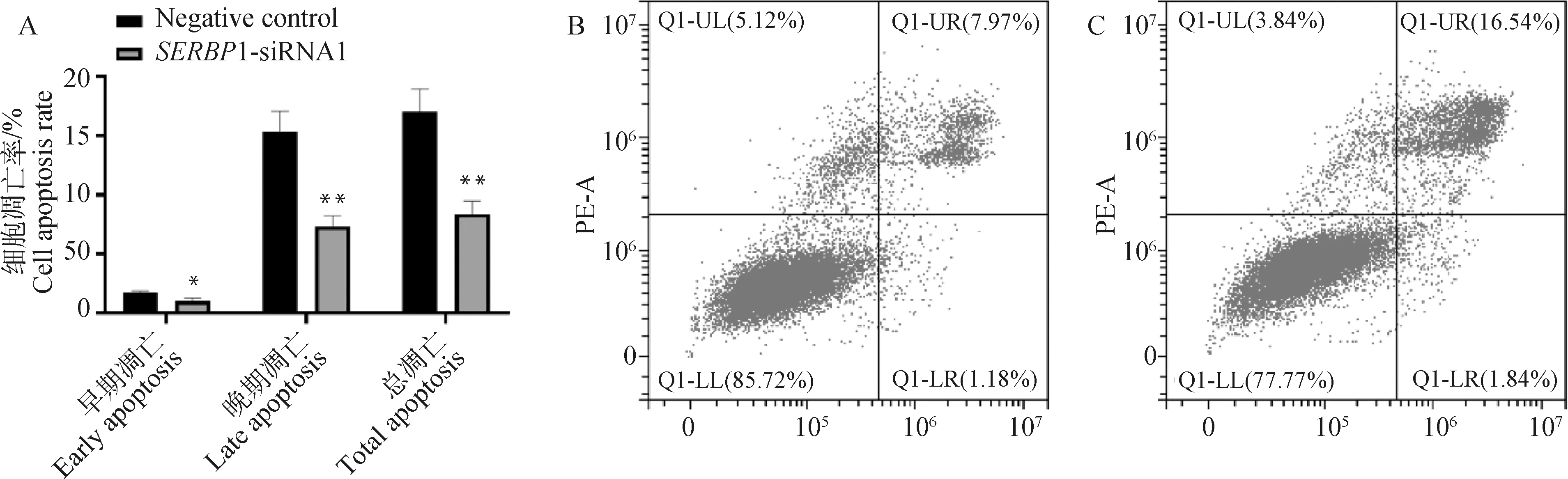
A. SERBP1-siRNA1和NC组细胞凋亡比例对比;B. 试验组SERBP1-siRNA1山羊鼻甲骨原代细胞凋亡情况;C. 对照组NC山羊鼻甲骨原代细胞凋亡情况。*.P<0.05,**. P<0.01A. Comparison of apoptosis rate of SERBP1-siRNA1 and NC groups; B. Experimental group SERBP1-siRNA1 goat primary turbinate bone cells apoptotic; C. Control group NC goat primary turbinate bone cells apoptotic. *.P<0.05,**. P<0.01图7 siRNA干扰SERBP1对山羊鼻甲骨细胞凋亡的影响Fig.7 The effects of SERBP1-siRNA1 on apoptosis of goat turbinate bone cells
2.7 siRNA干扰SERBP1对山羊鼻甲骨原代细胞凋亡相关基因的影响
由图8可以看出,与对照细胞组相比,siRNA干扰1后可导致山羊鼻甲骨细胞内促凋亡基因3和211 mRNA表达量极显著下降(<0.01),、7 mRNA表达量显著下降(<0.05),而-2、53、1 mRNA表达量无显著变化(>0.05)。

*.P<0.05,**. P<0.01图8 siRNA干扰SERBP1基因对凋亡相关基因表达的影响Fig.8 The effect of siRNA interference SERBP1 gene on the expression of apoptosis-related genes
3 讨 论
目前国内外关于1基因的研究在人方面较多,但未见有关山羊1基因的研究报道。本研究以简州大耳羊为研究对象,首次克隆得到山羊1基因序列1 293 bp,其中CDS区长1 179 bp,编码392个氨基酸。氨基酸的一级结构分析发现,1不存在信号肽,且无跨膜区,推测其为非分泌性蛋白,此研究结果与Peluso等报道的人SERBP1蛋白不具有跨膜结构域的结果是一致的。蛋白亚细胞定位的预测对揭示其生物学功能具有重要的参考意义。目前关于SERBP1的亚细胞定位存在一定的争议,如2003年,Lemos等研究发现,人源的SERBP1蛋白可穿梭于Hela细胞的胞质和胞核之间,且受到蛋白甲基化的影响。亚甲酸盐处理引起的蛋白甲基化,可导致人源SERBP1蛋白发生核质穿梭,被胁迫从Hela细胞的胞质向胞核转移,最终定位于细胞核。而早期文献预测,当SERBP1蛋白定位于细胞核内时,其主要功能为参与细胞的转录调控,而当定位于细胞质内时,可能与(PAI-1) mRNA的稳定性有关。本研究亚细胞定位预测结果显示,山羊SERBP1蛋白主要存在于细胞核内,因此推测,该蛋白在细胞核内可能参与基因的转录调控作用,具体功能仍需进一步的研究确定。
STRING交互式数据库是一种基因、蛋白质相互作用关系检索的可靠工具,能够帮助研究者获得覆盖范围广的预测的相互作用关系信息,从而构建蛋白质相互作用网络。从蛋白互作关系来看,预测显示SERBP1蛋白可能与RPL8、RPS29、SND1、IFRD2、RPL26、FMR1、RPS5、RPL29、GTF3C6、RPL18等蛋白存在相互作用,且以上预测相互作用的蛋白常被报道参与调控细胞增殖、细胞凋亡、细胞迁移、基因转录及mRNA翻译等。如,2004年,Liu等研究表明,干扰29可以促进结肠癌HCT-116细胞的凋亡;2010年张军等研究表明,过表达29会抑制成纤维细胞增殖,并促进细胞凋亡;2016年齐阳研究发现,过表达RPS5蛋白能抑制肝癌细胞迁移和肝癌干细胞样细胞的产生。2019年Yu等研究表明,下调1可显著抑制胶质瘤细胞的增殖和侵袭;2021年杨贵研究表明,过表达8可以明显促进Hela细胞凋亡。而前期研究SERBP1蛋白的功能发现其主要在基因表达、mRNA代谢水平、细胞周期、细胞增殖、细胞凋亡方面等发挥着重要作用。因此,结合与SERBP1蛋白相互作用的蛋白功能来看,进一步推测SERBP1蛋白可能普遍与这几类蛋白存在联系,进而共同参与细胞周期、细胞增殖、细胞凋亡等方面的调控。基因在不同组织中的表达规律可为研究该蛋白的功能提供试验依据。本研究发现,1基因在山羊的心、肝、脾等9个组织及鼻甲骨细胞均有表达,且在胰腺中表达量最高。2003年Lemos等研究表明,1在人正常组织中均有表达,其中在心和骨骼肌中表达最高。而Serce等发现,1在人类正常乳腺组织中大量表达,而在骨骼肌和心组织检测到相对较低的表达水平。因此推测,1基因在不同的物种组织间表达量的差异可能和其在不同物种组织中的功能差异相关。胰腺为一种特殊的实质器官,在细胞转录调控、mRNA代谢等过程中发挥着重要作用,而SERBP1蛋白同样在mRNA代谢和转录水平发挥作用,进一步推测SERBP1蛋白可能在山羊胰腺中发挥着重要的生物学功能。
当细胞DNA发生损伤时,细胞会通过其周期蛋白共同调节细胞周期进程,被阻滞在某个细胞周期,为DNA的损伤修复争取时间。同时,DNA损伤较轻时,细胞倾向于G/G期阻滞,而当损伤较重时,则启动G/M期阻滞,从而有利于自身存活,而当损伤非常严重时,细胞DNA出现链断裂,进而面临细胞凋亡。本研究结果显示,干扰1基因后可导致山羊鼻甲骨细胞的增殖能力下降,细胞发生G/G期阻滞,推测此种现象的产生可能为DNA的损伤修复赢取时间,且该结果与Cao等和马金亮等的研究结果相符。同时,从干扰1基因对细胞凋亡的结果来看,转染48 h细胞凋亡率显著降低。因此,进一步推测干扰1基因后,细胞增殖能力的降低后导致DNA的损伤进行修复,从而抑制了细胞的凋亡作用,此结果与Peluso等报道的研究相符。
细胞凋亡是细胞程序性死亡的一种方式,通过这种方式能有效地去除受损细胞,从而维持机体的正常生命活动。在细胞凋亡信号通路中,通过许多不同的信号传递系统传递凋亡信号,引起细胞凋亡,其中多种蛋白参与凋亡的信号通路调节,例如:Bcl-2、Casepases、P53、BCL2L11和PARP1。Caspase3是细胞凋亡过程中的最终执行者,其激活可促进细胞凋亡。在本研究中,siRNA干扰1基因后下调基因3 mRNA表达,其基因表达量的变化与细胞凋亡率的变化规律是一致的,进而导致细胞的凋亡作用受到抑制。当细胞DNA损伤时,1基因可以过度激活导致3的激活,随后被激活的3和1发生断裂从而介导细胞凋亡。本研究结果显示,干扰1基因后细胞内基因1 mRNA表达无显著变化。因此推测,干扰1基因后,鼻甲骨细胞内可能存在其他基因参与调控1基因的表达,导致细胞凋亡作用受到抑制。但siRNA干扰1基因后抑制鼻甲骨细胞凋亡的具体机制尚不清楚,有待进一步研究。
4 结 论
山羊1基因cDNA全长1 293 bp,包含5′UTR 44 bp,CDS区1 179 bp,3′UTR 70 bp,编码392个氨基酸,在胰腺中表达水平最高。1基因可能通过调控凋亡相关蛋白Caspase3、Caspase7、BCL2L11和Bax参与山羊鼻甲骨原代细胞凋亡调控。研究结果为进一步深入研究1基因功能,揭示125抑制细胞凋亡的分子机制提供重要的试验数据。

