红芪多糖-1-1的分离纯化及其调节抗生素诱导小鼠肠道菌群失调的最佳剂量分析
董嘉琪,张旺东,姚万玲,薛 姣,刘莹发,魏彦明,纪 鹏
(甘肃农业大学动物医学院,兰州 730070)
胃肠道定植的微生物种类繁多、数目巨大,构成了复杂的消化道微生态系统,其中,仅细菌的种类就达1 000种之多,其总量可达人类细胞总数的10倍。 它们对机体消化、能量代谢、肠道免疫系统的发育均具有重要的调节作用。在畜牧生产中,抗生素长期大量使用会引起肠道菌群失调,进而导致畜禽免疫力降低及二次感染等问题。此外,断奶等应激诱发的菌群失调可导致仔猪生长性能下降、免疫力降低,犊牛腹泻率增加等。人类肠道菌群失调也可诱发多种疾病,有研究表明,当机体肠道菌群失调时,会导致糖尿病患者病情加剧,炎症性肠病发病率提高,肠道菌群长期紊乱还会导致结直肠腺瘤风险增加。此外,肠道菌群失调还会影响情绪行为的调控等。为提高畜牧业生产力、控制肠道菌群失调相关疾病的发生,开发新型产品以维持和改善肠道微生态已成为现今研究的热点,微生态调节剂等产品己经在生产、生活中广泛应用。
目前研究表明,中药也可扶植胃肠道正常菌群生长,提高机体免疫力。近年来,植物或中药多糖对肠道菌群调节作用的研究备受国内外关注,如香菇多糖、黄芪多糖、人参多糖等。它们可为肠道微生物的生存提供必需的营养素,同时糖类被微生物降解后产生的短链脂肪酸也可调节肠道pH并给机体提供能量,对动物机体健康具有重要意义。红芪为甘肃省道地药材,古代本草学家将红芪统称为黄芪,直到20世纪80年代发现红芪中含有黄芪不具有的成分1-3-羟基-9-甲氧基紫檀烷,具有较好的抑菌作用,使得红芪的药效学研究引起国内研究者的重视。1985年中国药典将红芪从黄芪项中移出,成为一味单独的中药。据报道,红芪多糖具有提高免疫、抗氧化、降血糖、抗辐射、抗肿瘤等多方面的功效,但关于其调节肠道菌群的作用鲜见报道。而且不同来源的多糖因分子量、化学结构以及纯度方面的差异,对机体产生的效用以及作用的最佳剂量会有所不同。
本试验将红芪粗多糖分别用DEAE-52和Sephadex G-100进行分离纯化得单一多糖,用来调节灌服抗生素鸡尾酒(氨苄西林、万古霉素、甲硝唑、新霉素)小鼠的肠道菌群,通过16S rDNA高通量测序技术分析不同剂量的纯化红芪多糖对肠道菌群的影响,筛选出调节肠道菌群的最佳有效剂量,以期为红芪多糖调节肠道菌群的临床用药提供依据。
1 材料与方法
1.1 试验试剂与仪器
1.1.1 主要试剂 Sephadex G-100和DEAE-52,购自美国Whatman公司;标准品:岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡萄糖醛酸、甘露糖醛酸、古罗糖醛酸、D-氨基半乳糖盐酸盐、盐酸氨基葡萄糖,购自Sigma公司;三氟乙酸和甲醇,购自ANPEL公司;氨苄西林、新霉素、万古霉素、甲硝唑、两性霉素B,购自上海麦克林公司。
1.1.2 主要仪器 ICS5000离子色谱系统,美国Thermo公司;7890A-5977B气质联用仪,美国安捷伦公司;DZ5-WS多管架自动平衡离心机,长沙湘仪离心机仪器有限公司;iMark型酶标仪,美国BIO-RAD公司;RM2245切片机,德国Leica公司;Olympus DP-71显微照相系统,日本Olympus公司。
1.2 试验药物的制备
利用实验室已建立优化的红芪粗多糖提取方法制备红芪多糖。对红芪粗多糖经DEAE-52纤维素柱分离纯化得到的多糖RHPS-1(Radix Hedysari polysaccharide-1,RHPS-1),经Sephadex G-100凝胶色谱柱进一步纯化,采用苯酚-硫酸法跟踪检测,绘制吸收曲线,收集主峰部分,冷冻干燥得多糖RHPS-1-1。
1.3 多糖含量的测定
多糖含量采用苯酚-硫酸法测定。
1.4 多糖的纯度鉴定及分子量测定
采用凝胶渗透色谱法测定RHPS-1-1的相对分子质量。以市售不同分子量(1、5、10、50、150、200、400 ku)的右旋糖酐为参照建立方法。样品完全溶解于超纯水中,通过0.45 μm滤器过滤后进样。
1.5 单糖组成分析
采用高效阴离子交换色谱法(high-performance anion-exchange chromatography,HPAEC)进行单糖组成测定。
1.5.1 样品前处理 精确称量红芪多糖样品5 mg, 加入1 mL 2 mol·LTFA酸溶液,105 ℃加热6 h,氮气吹干。加入甲醇清洗,再吹干,重复甲醇清洗2~3次。加入无菌水溶解,转入色谱瓶中待测。
1.5.2 色谱条件 采用DionexCarboPacPA10(250×4.0 mm,10 μm)液相色谱柱;进样量为5 μL。流动相A(0.1 mol·LNaOH),流动相B(0.1 mol·LNaOH,0.2 mol·LNaAc),流速0.5 mL·min;柱温为30 ℃;洗脱梯度:0 min A相/B相(95∶5,V/V),30 min A相/B相(80∶20,V/V),30.1 min A相/B相(60∶40,V/V),45 min A相/B相(60∶40,V/V),45.1 min A相/B相(95∶5,V/V), 60 min A相/B相(95∶5,V/V)。
1.6 多糖的甲基化分析
1.6.1 样品衍生化 称取红芪多糖样品10 mg,加入1 mL一级水溶解,再加入1 mL 100 mg·mL碳二亚胺,反应2 h。加入1 mL 2 mol·L的咪唑,再分别加入1 mL 30 mg·mL的NaBH和1 mL 30 mg·mL的NaBD,反应3 h。加入100 μL冰醋酸终止反应。透析样品48 h,透析完成后冷冻干燥样品,进行甲基化处理。
1.6.2 样品甲基化处理 冻干样品中加入500 μL DMSO溶解。加入1 mg NaOH,孵育30 min。加入50 μL碘甲烷溶液反应1 h。加入1 mL水和2 mL二氯甲烷,涡旋混匀,离心,弃水相。重复水洗3次。吸取下层二氯甲烷相并蒸干。加入100 μL 2 mol·LTFA,121 ℃反应90 min。30 ℃蒸干。加入50 μL 2 mol·L氨水,50 μL 1 mol·LNaBD,混匀,室温下反应2.5 h。加入20 μL乙酸终止反应,氮气吹干,250 μL甲醇洗2次,氮气吹干。加入乙酸酐250 μL,涡旋混匀,100 ℃反应2.5 h。加入1 mL水静置10 min。加入500 μL二氯甲烷,涡旋混匀,离心,弃水相。重复水洗3次。取下层二氯甲烷相,上机检测。
1.6.3 色谱条件 采用Agilent气相色谱-质谱联用仪测定多糖结构。进样量为1 μL,分流比为10∶1, 载气为高纯氦气;柱温箱的初始温度为140 ℃保持2.0 min,以3 ℃·min程序升温至230 ℃,保持3 min。质量扫描范围(m·z): 30~600。
1.7 红外光谱分析
用傅里叶变换红外光谱仪以1 cm分辨率在4 000~400 cm内扫描红芪多糖的吸收峰。
1.8 动物试验
SPF级C57BL/6小鼠90只,6~8周龄,体重18~22 g,雄性,由兰州兽医研究所实验动物中心提供(许可证号:SYXK(甘)2020-0010)。试验过程中遵循动物伦理福利相关规定,并经甘肃农业大学实验动物伦理委员会批准。按国家标准对实验动物进行饲养,环境温度控制在(18±2)℃,相对湿度为50%~60%,12 h光照/12 h黑暗,小鼠自由采食和饮水。小鼠适应性喂养1周后,将90只C57BL/6小鼠随机分为正常对照组、模型组、自愈组,12.5、25、50、100、200和400 mg·kg的红芪多糖干预组,每组10只。模型组、自愈组和不同剂量红芪多糖干预组参考文献[25-27]复制模型:小鼠口腔灌服抗生素鸡尾酒(由4种抗生素和1种抗真菌药组成,将氨苄西林100 mg·kg、万古霉素50 mg·kg、甲硝唑100 mg·kg、新霉素100 mg·kg和两性霉素B 1 mg·kg溶于灭菌蒸馏水中,现用现配),每天2次,每次间隔12 h,连续14 d,建立小鼠肠道菌群失调模型,正常对照组灌服等量的生理盐水。造模结束后,将模型组小鼠处死,各红芪多糖治疗组分别灌服12.5、25、50、100、200和400 mg·kg的RHPS-1-1进行治疗,正常对照组、自愈组给予等量的生理盐水,每天1次,连续14 d。
1.9 样品采集
试验结束后,将各组小鼠禁食12 h,眼球采血处死,取盲肠内容物立即放入液氮中,-80 ℃储存。取心、肝、脾、肺、肾、脑置于4%中性甲醛溶液中固定。
1.10 检测指标
1.10.1 小鼠体重的检测 试验期间每2 d称量每只小鼠的体重,以各组小鼠的平均体重变化率为指标,检测不同处理对小鼠体重的影响。
1.10.2 肠道菌群高通量测序分析 盲肠内容物16S rDNA检测由杭州联川生物技术股份有限公司完成,根据说明书,使用 E.Z.N.A.Stool DNA Kit分离试剂盒从样品中提取总DNA,选取细菌16S rDNA的V3-V4区进行基因扩增与测序。所用引物序列为:341F(5′-CCTACGGGNGGCWGCAG-3′),805R (5′-GACTACHVGGGTATCTAATCC-3′)。扩增反应体系为:Phusion Hot start flex 2× Master Mix 12.5 μL、Forward Primer 2.5 μL、Reverse Primer 2.5 μL、Template DNA 50 μL、ddHO 25 μL。扩增反应条件:98 ℃,30 s;(98 ℃,10 s; 54 ℃,30 s;72 ℃,45 s)×35次循环;72 ℃,10 min。 所有PCR产物经纯化、定量和均一化处理后,构建测序文库,利用Illumina NovaSeq平台进行高通量测序。
1.10.3 生物信息学分析 用QIIME2分析菌群α多样性(Chao1、Shannon、Goods_coverage和Simpson),使用R软件vegan进行β多样性分析,包括主成分分析和聚类分析,<0.05 表示有统计学意义。
1.10.4 各脏器指数 称量心、肝、脾、肺、肾和脑的重量,计算各脏器指数(mg·g)。

1.10.5 病理组织学观察 取固定于4%中性甲醛溶液中的各脏器样品进行流水冲洗24 h,脱水、透明、浸蜡、包埋、切片和HE染色,中性树胶封片。采用Olympus DP-71显微镜进行观察并拍照。
1.11 统计学分析
利用软件Chromeleon处理色谱数据;用SPSS 22.0统计软件对各组间数据进行单因素方差分析,正常和模型组差异菌群分析比较采用LSD法,其他事后比较采用邓肯法,试验数据以“均值±标准差(Mean±SD)”表示,<0.01表示差异极显著,<0.05表示差异显著。
2 结 果
2.1 RHPS-1的纯化
将红芪粗多糖过DEAE-52离子交换柱,用蒸馏水洗脱,在30~60管之间洗出现一个峰,合并洗脱液,浓缩、冷冻干燥,得RHPS-1;将RHPS-1组分经Sephadex G-100凝胶色谱柱纯化,在18~55管之间洗出一个峰(图1),合并洗脱液,浓缩、冷冻干燥,得RHPS-1-1,回收率为64.98%,糖含量为99.12%。

图1 RHPS1-1的Sephadex G-100凝胶色谱柱洗脱图Fig.1 Chromatographic elution on RHPS1-1 by Sephadex G-100 gel column
2.2 RHPS-1-1的纯度测定及相对分子质量分布
RHPS-1-1的重均分子量为19.420 ku;RHPS-1-1的多分散系数(Mw/Mn)为1.31,接近于1,两级分布均为单一对称峰,说明RHPS-1-1为均一多糖。
2.3 RHPS-1-1的单糖组成分析
高效阴离子交换色谱分析显示RHPS-1-1主要由葡萄糖(99.20%)组成,还含有少量的阿拉伯糖(0.19%)和葡萄糖醛酸(0.21%)(图2)。

A. 标准品离子色谱图;B. RHPS-1-1离子色谱图;标准品:岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡萄糖醛酸、甘露糖醛酸、古罗糖醛酸、D-氨基半乳糖盐酸盐、盐酸氨基葡萄糖A.Ion Chromatogram of standard samples; B. Ion Chromatogram of RHPS-1-1; Standards: Fuc(Fucose); Rha(Rhamnose); Ara(Arabinose); Gal(Galactose); Glc(Glucose); Xyl(Xylose); Man(Mannose); Fru(Fructose); Rib(Ribose); Gal-UA(Galacturonic Acid); Glc-UA(Glucuronic Acid); Man-UA(Mannuronic Acid); Gul-UA(Guluronic Acid); D-GalN(D-Glucosamine hydrochloride); GluN(Glucosamine)图2 标准品和RHPS-1-1的离子色谱图Fig.2 Ion chromatogram of standards and RHPS-1-1
2.4 RHPS-1-1的甲基化分析
甲基化的RHPS-1-1样品的GC-MS分析结果如表1所示。在RHPS-1-1中,以1,4-D-Glcp连接类型为主,有少数1,6-D-Glcp连接。此外,还发现少量的1,3,4-D-Glcp、1,2,4-D-Glcp和1,4,6-D-Glcp连接,表明存在少量的分支。根据甲基化分析的结果,可以推断RHPS-1-1具有1,4-D-Glcp连接的葡聚糖结构,在O-2或O-3处可能存在Glcp分支,T-D-Glcp为糖链末端。
2.5 RHPS-1-1的红外光谱分析
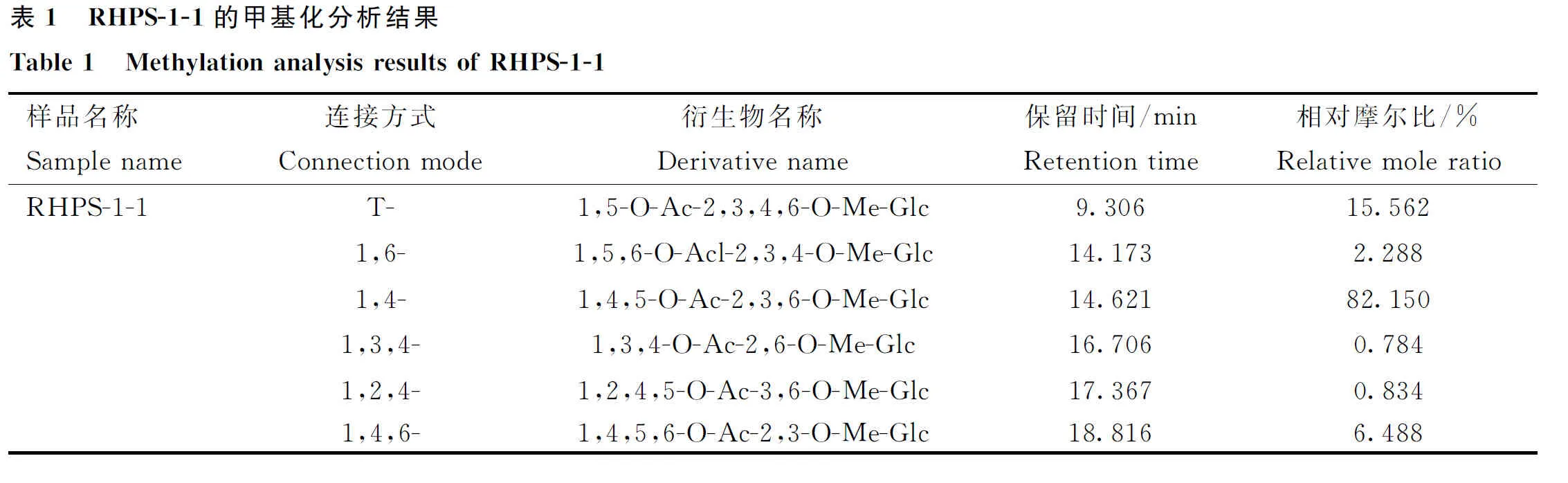
如图3所示,红芪多糖RHPS-1-1在3 600~3 200、 3 000~2 800、1 400~1 200和1 200~700 cm范围内的吸收峰是多糖的特征吸收峰。RHPS-1-1在波数3 280 cm处都具有强而宽的吸收峰,是由糖环中的O—H键的变角振动引起的;在波数2 930 cm处具有中等强度的吸收峰,是由于C—H的拉伸振动,这些特征峰也均为典型的多糖特征峰。RHPS-1-1在1 630 cm处的吸收峰表示与水结合的峰,1 340 cm处的吸收峰表示C—O的拉伸振动。在990.0 cm处的吸收峰表示D-葡萄吡喃糖的非对称环伸缩振动。在843 cm处的吸收峰表示RHPS-1-1是α构型糖苷键。上述吸收峰为植物多糖的特殊吸收峰。
图3 RHPS-1-1的红外光谱图Fig.3 Infrared spectrum diagram of RHPS-1-1
2.6 红芪多糖对各组小鼠体重的影响
试验过程中各组小鼠体重变化率均呈逐渐上升趋势(图4A)。第22和28天各组小鼠体重变化率组间差异显著(<0.05),其余天数各组之间无显著性差异(>0.05)。与正常对照组相比,自愈组小鼠体重变化率在第22和28天时均显著下降(<0.05), 经RHPS-1-1治疗后,除RHPS-1-1 200 mg·kg组小鼠体重变化率在22 d时显著上升(<0.05), 其他组在第22和28天时小鼠体重变化均上升,但差异不显著(>0.05)。
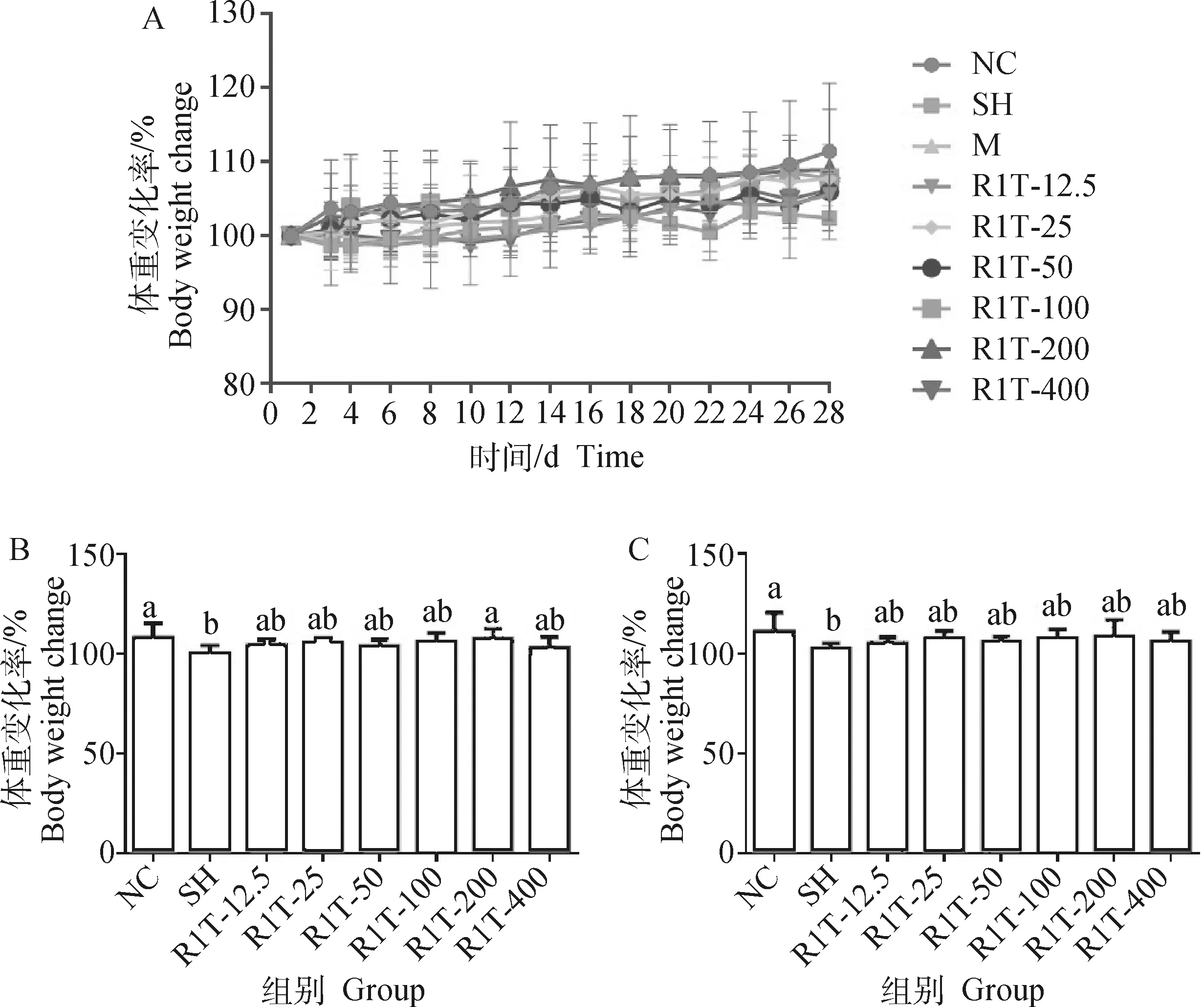
A. 整个试验过程中各组小鼠的体重变化率;B. 第22天各组小鼠的体重变化率;C. 第28天各组小鼠的体重变化率。NC. 正常对照组;SH. 自愈组;M. 模型组;R1T-12.5、R1T-25、R1T-50、R1T-100、R1T-200和R1T-400分别代表剂量为12.5、25、50、100、200和400 mg·kg-1 RHPS-1-1给药组。相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。下同A. Body weight change of mice in each group throughout the experiment; B. The body weight change of mice in each group on day 22; C. The body weight change of mice in each group on day 28. NC. Normal control group; SH. Self-healing group; M. Model group; R1T-12.5, R1T-25, R1T-50, R1T-100, R1T-200 and R1T-400 respectively represent 12.5, 25, 50, 100, 200 and 400 mg·kg-1 of RHPS-1-1 treatment groups. The same letter means no significant difference (P>0.05), different letters mean significant difference (P<0.05). The same as below图4 各组小鼠的体重变化率Fig.4 Change rate of body weight in each group
2.7 正常对照组和模型组肠道菌群结构分析
2.7.1 正常和模型组肠道菌群分布 通过分类学分析,共鉴定出10个门。正常对照组所有样本中的最优势菌门为拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes),变形菌门(Proteobacteria)和放线菌门(Actinobacteria)的丰度占比次之,另外,其他一些丰度较低的门也被检出;模型组样本菌群较为单一,几乎为变形菌门(Proteobacteria)(图5A)。为进一步验证分类学差异,本研究对top5的优势菌属进行了表征,发现正常对照组所有样本中_unclassified占比较大,而模型组所有样本中克雷伯菌属()占比较大(图5B)。
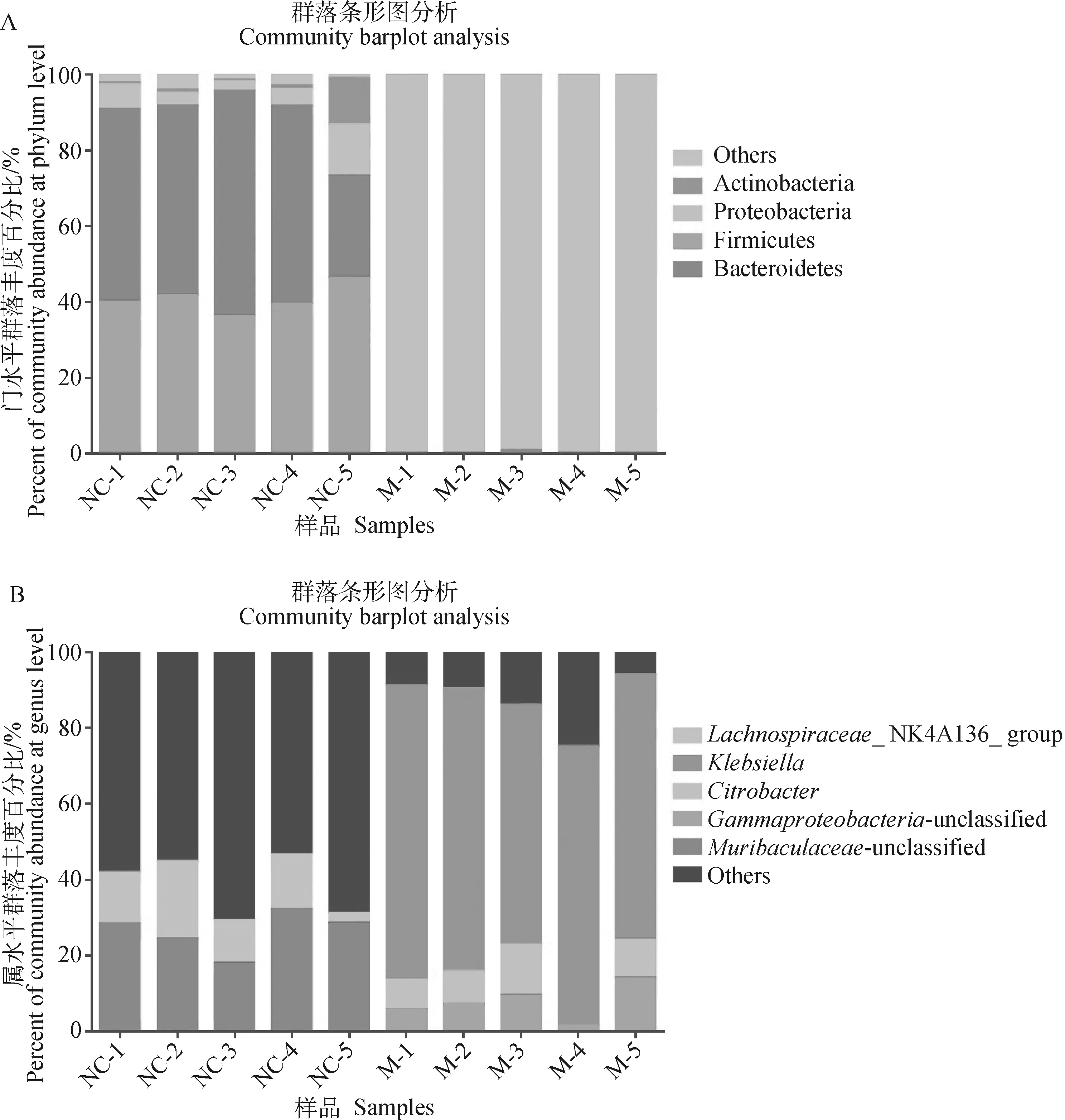
A. 门水平的肠道菌群分布相对丰度;B. 属水平的肠道菌群分布相对丰度。NC-1~5. 正常对照组小鼠编号;M-1~5. 模型组小鼠编号A. Relative abundance of intestinal flora at phylum level; B. Relative abundance of intestinal flora at genus level; NC-1-5. The number of mice in normal control group; M-1-5. The number of mice in model group图5 正常对照组和模型组门和属水平的肠道菌群分布Fig.5 Intestinal flora distribution at phylum and genus levels in normal control and model groups
2.7.2 正常对照组和模型组差异菌群分析 在门水平上,与正常对照组相比,模型组拟杆菌门和厚壁菌门相对丰度极显著降低(<0.01),放线菌门显著降低(<0.05),变形菌门极显著升高(<0.01)(图6A~D)。在属水平上,与正常对照组相比,模型组_NK4A136_group相对丰度极显著降低(<0.01),克雷伯菌属极显著升高(<0.01)(图6E~F)。

A. 拟杆菌门;B. 厚壁菌门;C. 变形菌门;D. 放线菌门;E. 克雷伯菌属;F. Lachnospiraceae_NK4A136_group。*. P<0.05; **. P<0.01A. Bacteroidetes; B. Firmicutes; C. Proteobacteria; D. Actinobacteria; E. Klebsiella; F. Lachnospiraceae_NK4A136_group. *. P<0.05; **. P<0.01图6 正常对照组和模型组门和属水平差异菌群分析Fig.6 Analysis of differential flora at phylum and genus levels in normal control and model groups
2.8 除模型组外的肠道菌群多样性分析
2.8.1 Alpha多样性分析 由图7可知,与正常对照组相比,自愈组小鼠肠道菌群Chao1指数显著降低(<0.05),经RHPS-1-1治疗后,R1T-25组显著升高(<0.05),R1T-50、R1T-200、R1T-400组均显著降低(<0.05),其余各组无显著性变化(>0.05)(图7A);与正常对照组相比,自愈组小鼠肠道菌群Shannon指数无显著变化(>0.05),经RHPS-1-1治疗后,R1T-200、R1T-400组Shannon指数显著下降(<0.05,图7C),其余各组无显著性变化(>0.05);Goods_coverage和Simpson指数各组之间差异不显著(>0.05,图7B、7D)。

A. Chao1 指数;B. Goods_coverage; C. Simpson指数;D. Shannon指数A. Chao1 index; B. Goods_coverage; C. Simpson index; D. Shannon index图7 除模型组外的各组小鼠肠道菌群alpha多样性分析Fig.7 Alpha diversity analysis of intestinal microflora in mice of each group except model group
2.8.2 Beta多样性分析
2.8.2.1 主成分分析:由图8可知,正常对照组和自愈组完全分离,菌群结构差异较大;R1T-25组和正常对照组重合度最高,菌群结构差异较小,其余各治疗组均与正常对照组菌群结构差异较大。

图8 除模型组外的各组小鼠肠道菌群PCA分析Fig.8 PCA analysis of intestinal flora of mice in each group except model group
2.8.2.2 各组小鼠肠道菌群UPGMA聚类树分析:通过各组小鼠门和属水平的聚类分析图(图9)可得出,正常对照组与自愈组间样本的距离较大,表明两组间肠道菌群结构有较大差异;经RHPS-1-1治疗后,R1T-25组与正常对照组间样本的距离最小,表明两组间肠道菌群结构有高度的相似性。该结果与PCA的聚类结果较为紊合。
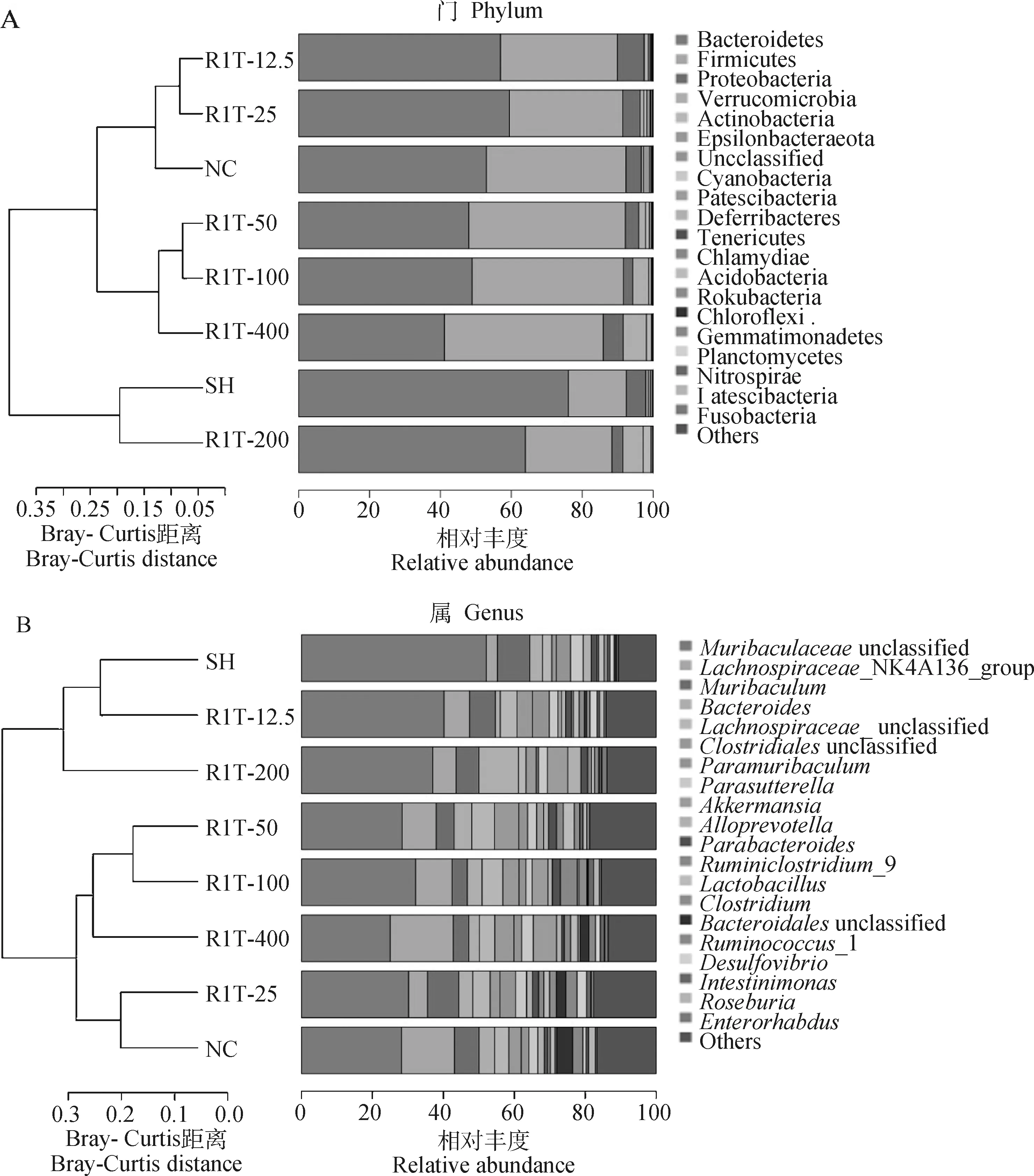
A. 门水平;B.属水平A. Phylum level; B. Genus level图9 除模型组外的各组肠道菌群UPGMA聚类树分析Fig.9 UPGMA clustering tree analysis of intestinal flora in each group except model group
2.9 除模型组外的肠道菌群结构分析
2.9.1 门和属水平肠道菌群分布 在门水平上,厚壁菌门和拟杆菌门是小鼠肠道菌群中最主要的优势菌门,其相对丰度在所有样本中占比最大(图10A)。在属水平上,_unclassified是肠道微生物中的绝对优势菌(图10B)。与正常对照组相比,自愈组中_unclassified增加。与自愈组相比,各治疗组_unclassified减少。
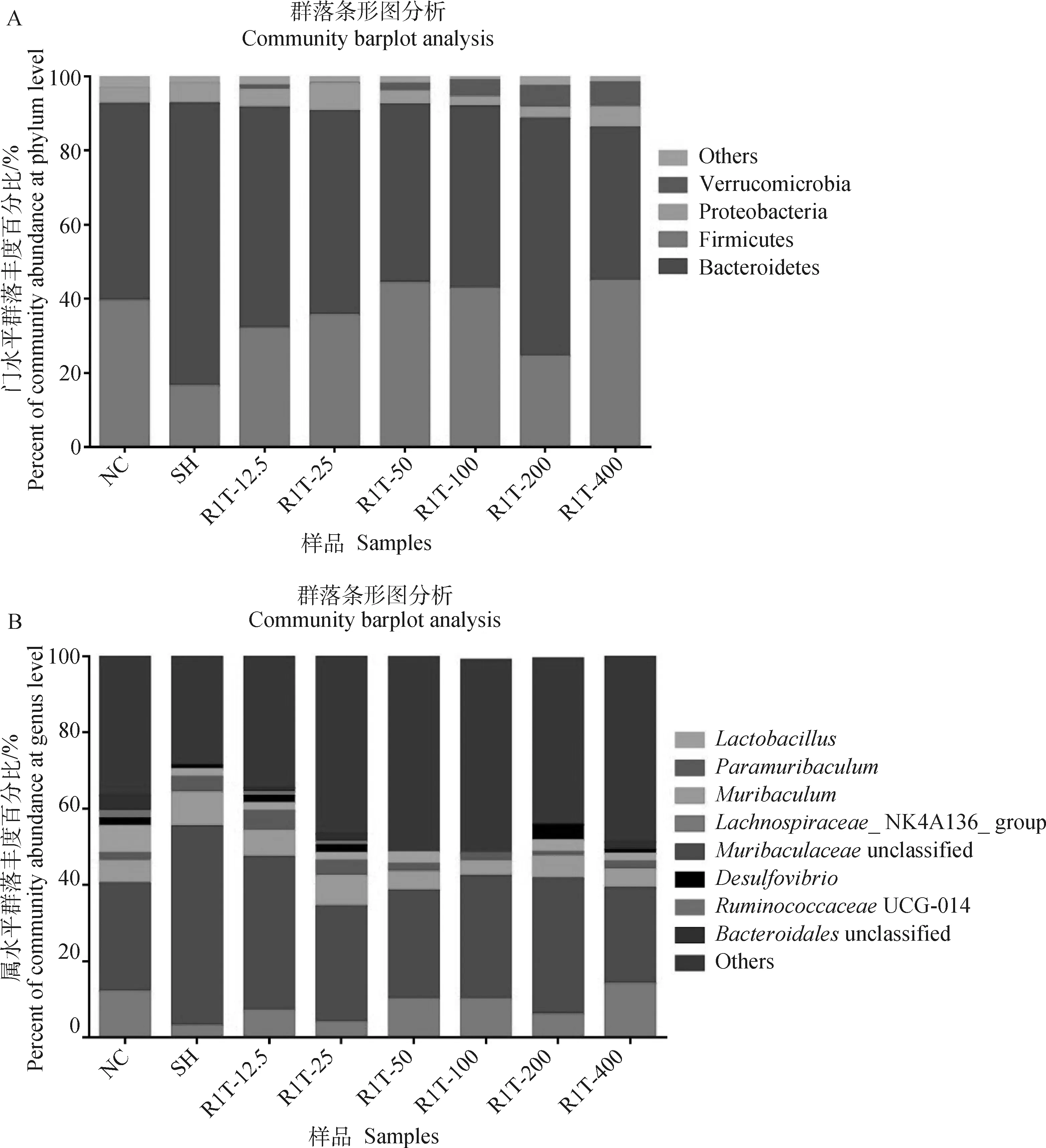
A. 门水平;B.属水平A. Phylum level; B. Genus level图10 除模型组外的各组小鼠门和属水平的肠道菌群分布Fig.10 Intestinal flora distribution at phylum and genus levels in mice of each group except model group
2.9.2 门和属水平差异菌群分析 在门水平上,与正常对照组相比,自愈组拟杆菌门相对丰度显著升高(<0.05),厚壁菌门相对丰度显著降低(<0.05),二者比值(拟杆菌门/厚壁菌门)也显著升高(<0.05);RHPS-1-1治疗后,各剂量组的拟杆菌门相对丰度和二者比例均显著降低(<0.05),厚壁菌门相对丰度除R1T-200组无显著变化外,其余各剂量组均显著升高(<0.05)。与正常对照组相比,R1T-12.5、25、50、100组的拟杆菌门差异不显著(>0.05);除R1T-200组的厚壁菌门显著降低外(<0.05),其余差异不显著(>0.05);各治疗组的拟杆菌门/厚壁菌门差异不显著(>0.05)(图11A~C)。
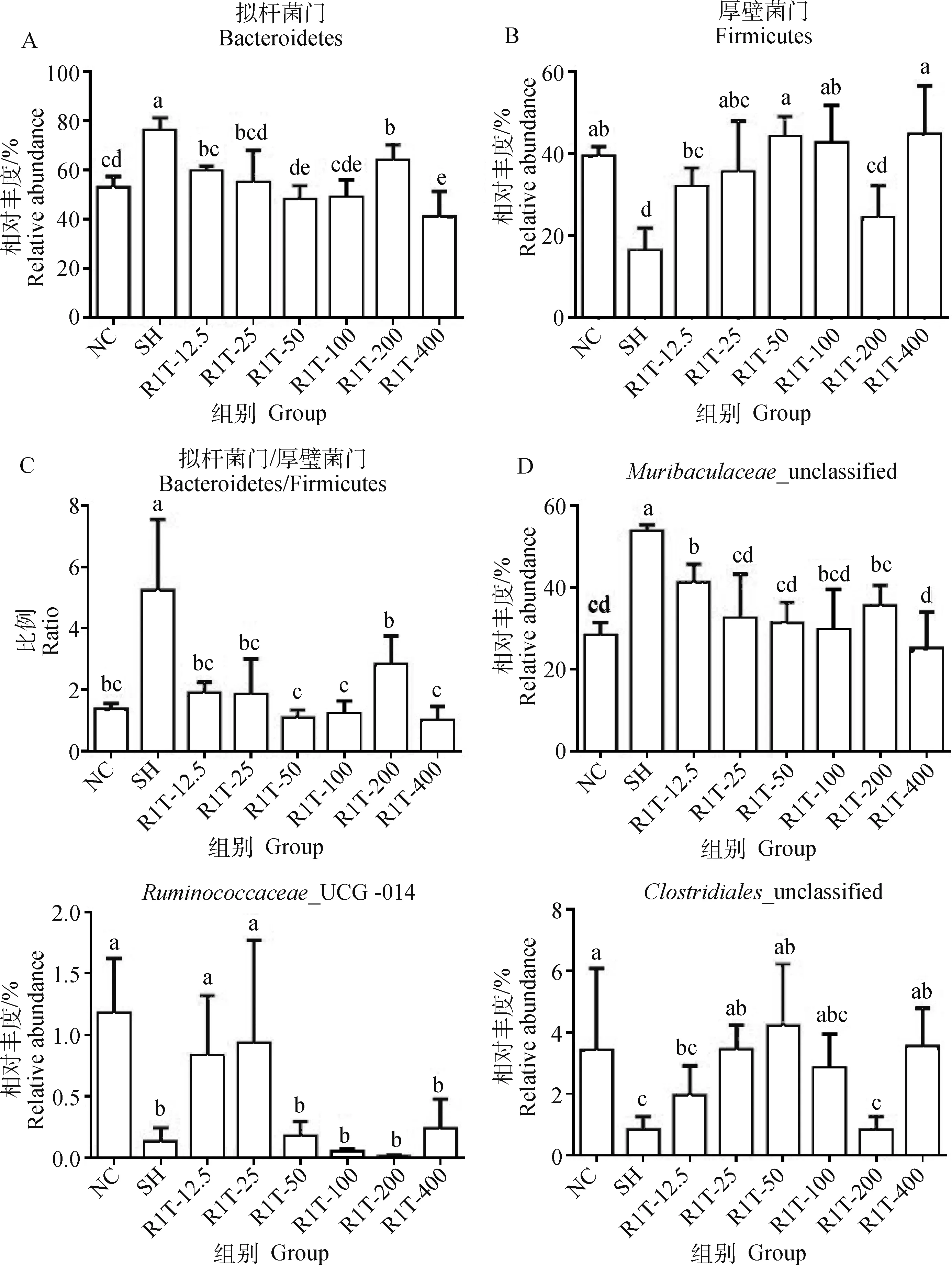
A.拟杆菌门;B. 厚壁菌门;C. 拟杆菌门/厚壁菌门;D. Muribaculaceae_unclassified;E. Ruminococcaceae_UCG-014;F. Clostridiales_unclassifiedA.Bacteroidetes; B. Firmicutes; C. Bacteroidetes/Firmicutes; D. Muribaculaceae_unclassified; E. Ruminococcaceae_UCG-014; F. Clostridiales_unclassified图11 除模型组外的各组小鼠门和属水平差异菌群分析Fig.11 Differential flora analysis at phylum and genus levels of mice in each group except model group
在属水平上,与正常对照组相比,自愈组_unclassified相对丰度显著升高(<0.05),_UCG-014和_unclassified相对丰度显著降低(<0.05)。经RHPS-1-1治疗后,各剂量组_unclassified均显著降低(<0.05);R1T-12.5和R1T-25组_UCG-014相对丰度显著升高(<0.05),其余各剂量组均无显著性变化(>0.05);R1T-12.5、R1T-100和R1T-200组_unclassified相对丰度无显著性变化(>0.05),其余各剂量组均显著升高(<0.05)。与正常对照组相比,R1T-12.5组的_unclassified相对丰度显著升高(<0.05);R1T-12.5和25组的_UCG-014相对丰度差异不显著(>0.05),其余各组差异显著(<0.05);R1T-25、50、100和400组的_unclassified相对丰度差异不显著(>0.05),其余各组差异显著(<0.05,图11D~F)。
综上,从门和属的总体水平上可以看出,R1T-25组菌群的回调效果最好。
2.10 红芪多糖对各组小鼠脏器的影响
与正常对照组相比,自愈组小鼠肝脏指数显著下降(<0.05),经25 mg·kgRHPS-1-1治疗后,显著上升(<0.05)。心脏、脾脏、肺脏、肾脏和脑指数3组间均无显著性差异(>0.05,表2)。

表2 RHPS-1-1对肠道菌群失调小鼠主要器官指数的影响(Mean±SD)
正常对照组、自愈组和25 mg·kgRHPS-1-1治疗组小鼠心肌细胞排列整齐,形态正常;胞核清晰呈椭圆形,着色较浅,位于肌纤维的中央,肌纤维间无炎性细胞浸润(图12A~C),且3组间无显著变化;肝小叶结构完整,以中央静脉为中心,肝细胞索和肝血窦向周围呈放射状排列;肝细胞形态清晰,核大而圆,居中,胞浆丰富(图12D~F),且3组间无显著变化;脾组织结构完整,红、白髓区界限清晰,小梁结构正常,脾索和脾窦结构清晰,淋巴细胞排列紧密、结构完整(图12G~I),且3组间无显著变化;肺泡结构完整,细胞核明显,肺泡无塌陷及破裂,肺泡充盈适度,无渗出液及炎症细胞浸润(图12 J~L),且3组间无显著变化;肾单位结构清晰,肾皮质迷路结构明显,肾小体结构完整,肾小球位于小体中央且结构完整,囊腔大小正常,肾小管上皮细胞排列规律(图12M~O),且3组间无显著变化;脑海马区细胞排列整齐、密集,核圆而大,核仁清晰,胶质细胞无增生,间质无水肿现象(图12Q~R),且3组间无显著变化。
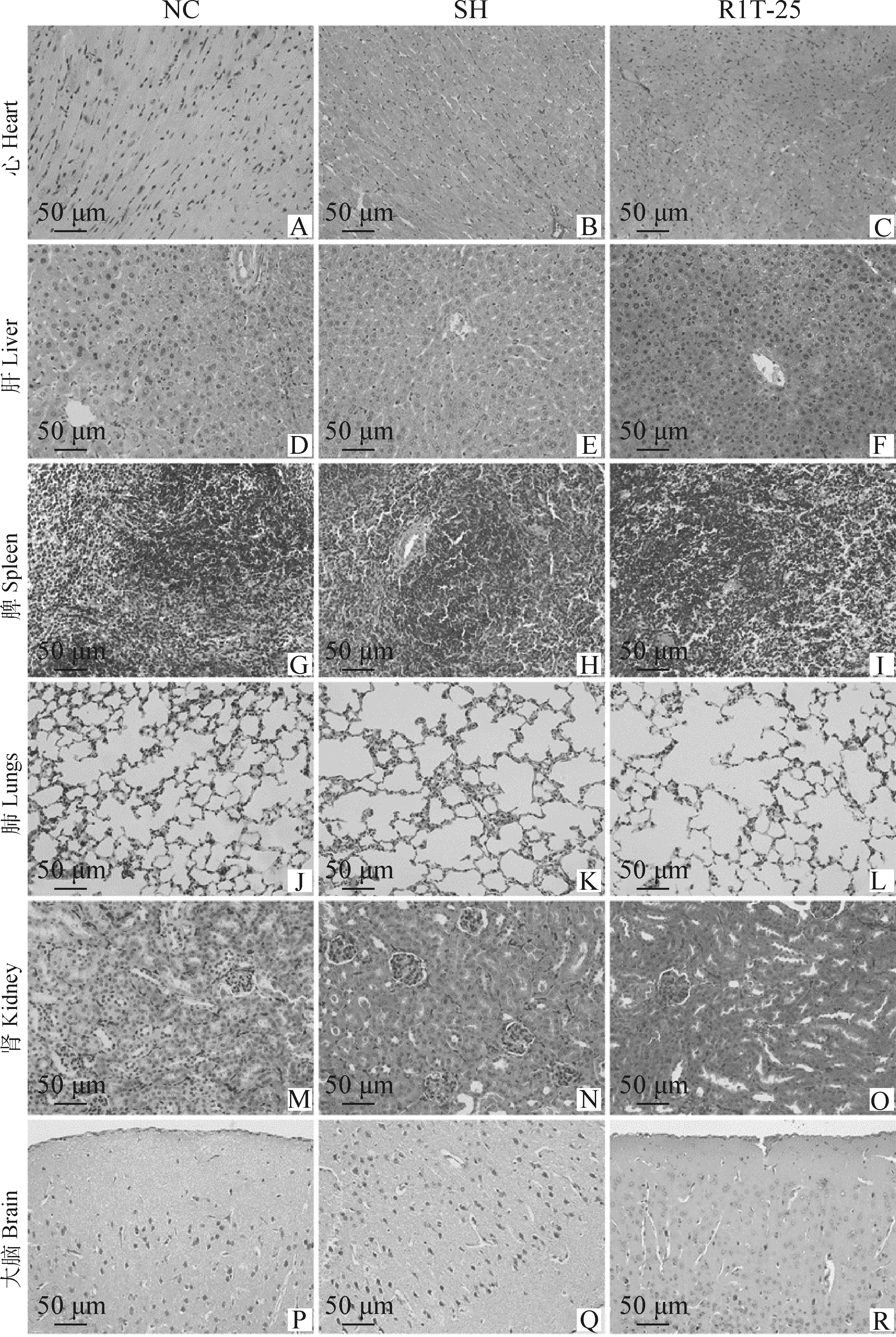
A~C.心;D~F.肝;G~I.脾;J~L.肺;M~O.肾;P~R.大脑A-C. Heart; D-F. Liver; G-I. Spleen; J-L. Lung; M-O. Kidney; P-R. Brain图12 各组小鼠主要脏器组织病理变化(HE染色,400×)Fig.12 Histopathological changes of main organs of mice in each group(HE staining, 400×)
3 讨 论
本研究分离纯化所得的RHPS-1-1的重均分子量为19.420 ku,其单糖组成主要为葡萄糖,主链连接方式为1,4-D-Glcp,这与陈同强和石义凯从红芪中提取的多糖在单糖组成和主链连接方式上均相似,但分子量存在差异,而本研究获得的RHPS-1-1支链较少,易溶解,能较好地进入细胞,从而发挥生物学作用,表明本研究所提取的RHPS-1-1具有较高的生物活性。
本研究用RHPS-1-1对抗生素鸡尾酒法建立的小鼠肠道菌群失调模型进行菌群调控,结果发现模型组小鼠肠道内优势菌群拟杆菌门、厚壁菌门、放线菌门几乎耗竭,而变形菌门丰度比例显著上升,表明小鼠肠道菌群严重失调,造模成功。自愈组相比正常对照组Chao1指数显著降低,说明抗生素可降低肠道菌群的多样性,且不能自行恢复,这与Kaur等的研究结果相一致。经不同剂量RHPS-1-1治疗后,RIT-25组Chao1指数提高程度最大,且PCA和UPGMA聚类分析结果表明,R1T-25组的肠道菌群组成与正常对照组最接近。提示以25 mg·kgRHPS-1-1给药对肠道菌群紊乱小鼠的调控效果最佳,这可能与多糖浓度有关,在适量浓度下多糖可作为能源物质为微生物提供营养,但当浓度过高时,会导致部分菌群细胞内外产生物理性渗透压,使细胞内水分流失,导致死亡。综上,说明25 mg·kgRHPS-1-1为调节小鼠菌群失调的最佳剂量。
本研究结果显示,在门水平上,自愈组相比正常对照组拟杆菌门相对丰度显著升高,厚壁菌门显著降低,拟杆菌门与厚壁菌门的丰度比(拟杆菌门/厚壁菌门)也显著升高,这与Rodrigues等研究相一致。厚壁菌门和拟杆菌门是人体内的优势菌门。有研究报道,厚壁菌门能帮助机体有效地吸收食物中的热量,并逐渐转化为脂肪,还可调控能量贮存基因的表达;而拟杆菌门擅长分解碳水化合物,使人和动物不易肥胖。因此,本研究中自愈组小鼠在22和28 d体重下降,可能与拟杆菌门丰度升高,厚壁菌门丰度降低,两者丰度比值升高有关。另外,两者比值升高还与一些疾病相关,例如糖尿病、结肠腺瘤性息肉、脑出血等。本研究所复制的菌群失调模型,是否有相关疾病的风险还有待进一步研究。经RHPS-1-1治疗后,各剂量组的拟杆菌门相对丰度和二者比例均显著降低,厚壁菌门显著升高,说明RHPS-1-1对抗生素造成的肠道菌群失调具有调节作用。在属水平上,自愈组_UCG-014和_unclassified相对丰度相比正常对照组显著降低,这与Park等和Cho等研究结果一致。另外本研究还发现,自愈组中有害菌_unclassified相对丰度增多。经RHPS-1-1治疗后,R1T-25组_UCG-014和_unclassified相对丰度显著升高,_unclassified显著降低。有研究报道瘤胃菌属的_UCG-014和梭菌科的_unclassified属于肠道益生菌,可抑制有害菌的生长。同时梭菌科的某些细菌可产生短链脂肪酸,维持大肠的正常功能和结肠上皮细胞的形态和功能。因此,RHPS-1-1调节肠道菌群可能是促进了肠道有益菌的生长,抑制了有害菌的生长。
另外,肠道菌群失调后还会导致细菌和内毒素移位,进而引起内源性感染和内毒素血症,造成多器官衰竭。本研究发现,器官指数在自愈组相比正常对照组只有肝脏指数显著下降,其他脏器无变化;进一步的组织病理学观察发现,各主要组织器官无明显的病理损伤。有文献报道,肠道菌群失调会诱发肝硬化等肝疾病,至于本研究中所建立的抗生素鸡尾酒致菌群失调模型是否在分子水平和代谢水平上对肝及其他脏器造成影响还有待进一步深入研究。经RHPS-1-1治疗后,R1T-25组的肝脏指数显著上升,说明RHPS-1-1具有一定的保护肝的作用或通过其他途径恢复了肝组织的功能。
4 结 论
本研究纯化所得RHPS-1-1为一种植物葡聚糖,且给药剂量为25 mg·kg时,对抗生素鸡尾酒诱导的小鼠肠道菌群紊乱,在提高肠道菌群稳定性和多样性、促进肠道益生菌增殖、有效抑制有害菌过度繁殖等方面具有显著调节作用;同时此剂量的RHPS-1-1可以回调由抗生素诱导肠道菌群失调所致的肝脏指数下降。

