沙门菌烈性噬菌体的分离鉴定、生物学特性及基因组分析
岑 鑫,阳亭亭,赵尊福,文永平,张焕容*
(1. 西南民族大学畜牧兽医学院,成都 610041; 2成都大学食品与生物工程学院,成都 610106)
沙门菌是一种无荚膜、无芽胞的革兰阴性杆菌,两端钝圆。迄今为止,全世界已发现2 600多种血清型。禽沙门菌病主要有鸡伤寒、鸡副伤寒、鸡白痢等。沙门菌作为一种常见的食源性致病菌,可引起人和动物急性胃肠炎、食物中毒、败血症等。沙门菌病的流行不仅阻碍了畜禽养殖业的发展,对人类健康及公共卫生安全也带来严重威胁。应用抗生素是防治沙门菌感染的主要手段之一,但抗生素的长期、广泛和不合理使用,使沙门菌耐药性日益增强,导致抗菌药物的治疗效果大大下降。寻找新型杀菌物质替代抗生素,从而有效防治沙门菌病已成为研究热点。
噬菌体是一种能够特异性裂解细菌的病毒,具有严格的宿主特异性,能够杀灭宿主细胞且不产生耐药性,具有指数增殖、广泛分布、研发时间短等优点。沙门菌噬菌体不会对正常菌群产生影响,也不会对环境造成污染,属于天然、安全的抑菌剂。近年来,噬菌体作为一种新型抗菌剂,在食源性病原菌感染防治、控制病原菌的传播以及治疗耐药性细菌感染等方面都取得了巨大的进展。在耐药菌株不断出现、新型抗菌制剂研发不能满足耐药菌控制需要的状况下,噬菌体防治提供了一个新的方向。地球上约有10个噬菌体,丰富度极高,在一些生态系统中,噬菌体的数量大约超过细菌10倍。而目前分离研究的噬菌体远少于自然界存在的噬菌体,因此,噬菌体的研究仍存在许多未知领域。本研究分离鉴定禽源沙门菌噬菌体,并研究其生物学特性和基因组信息,以期为研制沙门菌特异性抗菌制剂奠定基础。
1 材料与方法
1.1 材料
20株沙门菌(2株卡斯特鲁普和18株鼠伤寒沙门菌),编号为1~20,由西南民族大学微生物实验室分离鉴定。从成都市某鸡场采集污水样品用于分离噬菌体。胰蛋白胨、酵母提取物、NaCL、琼脂粉、SM缓冲液、PEG 8000、0.22 μm无菌一次性针头式滤器、病毒基因组DNA/RNA提取试剂盒均购自生工生物工程(上海)股份有限公司、透射电镜(型号JEM-1400PLUS,日本电子JEOL)。
1.2 噬菌体的分离鉴定
1.2.1 噬菌体富集 将采集的污水1 000 mL混匀后静置4 h,收集上层液体,加入CaCl至终浓度1 mol·L,7 000 ×离心15 min,取100 mL上清液经0.22 μm滤膜过滤除菌,得到滤液。将上述100 mL滤液加入100 mL 2×LB液体培养基于500 mL 的灭菌锥形瓶中混合,同时加入1 mL对数生长期的宿主菌沙门菌(浓度1×10CFU·mL),160 r·min、 37 ℃振荡培养8 h。
培养液经6 000 ×离心15 min,取上清,0.22 μm 滤膜过滤除菌得到滤液,分别加入100 μL处于对数生长期的20株指示菌(浓度1×10CFU·mL) 混匀,160 r·min、37 ℃振荡培养8 h。此富集过程重复3次,得到疑含噬菌体的培养液。
1.2.2 双层琼脂平板法验证 取10 mL无菌EP管,吸取200 μL疑含噬菌体的培养液和100 μL指示菌(浓度1×10CFU·mL),室温孵育5 min, 加入6 mL的50 ℃左右的LB半固体培养基(胰蛋白胨1 g、酵母0.5 g、氯化钠0.5 g、琼脂0.75 g, 以100 mL培养基为例),充分混匀后迅速倒入LB固体平板中,待其凝固后形成双层琼脂平板,倒置放入37 ℃恒温培养8~10 h,观察噬菌斑的形成情况。
1.2.3 噬菌体的纯化 采用双层琼脂平板法纯化初次分离的噬菌体。选取形状规则、透亮、边缘整齐的单个噬菌斑,用接种环挑取并浸泡于500 μL的SM缓冲液中,4 ℃过夜,次日取出10 μL浸出液适当稀释,采用双层琼脂平板法得到第一代纯化后的噬菌体。重复以上方法进行连续多次培养,待琼脂板上的噬菌斑透亮,形态、大小一致,纯化6代以上,得到纯化的噬菌体。
1.3 噬菌体生物学特性研究
1.3.1 噬菌体裂解谱测定 以双层平板噬斑法检测噬菌体对20株不同血清型的禽源沙门菌的裂解情况。取10 mL无菌EP管,吸取200 μL噬菌体裂解液和100 μL宿主菌菌液(浓度1×10CFU·mL),室温孵育5 min,加入6 mL的50 ℃左右的LB半固体培养基,充分混匀后迅速倒入LB固体中,待其凝固后倒置放入37 ℃恒温培养8~10 h,观察有无噬菌斑形成。
1.3.2 噬菌体效价测定 取纯化后的噬菌体裂解液100 μL10倍连续稀释,加入100 μL宿主菌菌液混合均匀,混合物接种双层琼脂平板后培养8 ~ 10 h,测定噬菌斑数量,根据公式计算噬菌体效价。每个稀释度重复3次。噬菌体效价(PFU·mL)=噬菌斑数×稀释倍数×10。
1.3.3 噬菌体透射电镜观察 取噬菌体悬液10 μL (1×10PFU·mL)滴于铜网上,静置15 min, 立即用滤纸吸干,用2 %磷钨酸溶液染色5 min, 滤纸吸去染液,待其自然干燥后,置于透射电镜下观察噬菌体形态。
1.3.4 噬菌体热稳定性和pH稳定性测定 取装有130 μL噬菌体裂解液(1×10PFU·mL)EP管分别于30、40、50、60、70、80 ℃水浴中作用30和60 min,水浴结束后,立即将EP管冰浴冷却至室温,进行适当稀释,采用双层琼脂平板法,测定噬菌体效价,评价噬菌体对温度的耐受性。试验重复3次。
用盐酸(1 mol·L)和氢氧化钠溶液(1 mol·L) 调节LB液体培养基的pH分别为1、2、3、4、5、6、7、8、9、10、11、12和13,然后分别吸取100 μL 噬菌体裂解液(约10PFU·mL)加入900 μL不同pH的LB液体培养基,置于37 ℃恒温水浴锅中作用1 h。作用完毕,将混合液进行10倍连续稀释,用双层琼脂平板法测定噬菌体效价,评价噬菌体的pH稳定性。试验重复3次。
1.3.5 最佳感染复数测定 将细菌培养至对数生长期(约1×10CFU·mL),用平板计数法测定菌液浓度,重复3次取其平均值。将噬菌体裂解液和菌液,按感染复数(MOI)分别为0.000 1、0.001、0.01、0.1、1、10、100、1 000的比例混合,混合液置160 r·min、37 ℃摇床培养6 h。用0.22 μm的滤器过滤除菌后得到噬菌体,采用双层琼脂平板法测定噬菌体效价。以噬菌体效价最高的比例为最佳感染复数。试验重复3次。
1.3.6 一步生长曲线测定 按最佳MOI 0.000 1,加入500 μL的菌液和500 μL的噬菌体裂解液,混匀后,在37 ℃条件下,静置孵育15 min,6 800 ×离心5 min,弃上清,用LB液体培养基洗涤两次;6 800×离心5 min,弃上清,加入5 mL 37 ℃预热LB液体培养基重悬沉淀,37 ℃恒温摇床160 r·min振荡培养;从0~100 min每间隔5~10 min取样,每个时间点重复3次取平均值。以感染时间为横坐标,噬菌体效价为纵坐标,绘制一步生长曲线;计算出噬菌体的潜伏期、暴发期和裂解量,裂解量=暴发末期噬菌体效价/感染初期宿主菌浓度。
1.4 噬菌体分离株生物信息学分析
1.4.1 噬菌体增殖培养、浓缩及基因组提取 按最佳MOI加入4 mL沙门菌菌液和10 mL噬菌体裂解液,于400 mL LB液体培养基中,在37 ℃、180 r·min振荡培养18 h。增殖培养后将培养液于4 ℃、6 800 ×的条件下离心20 min,取上清;加入 NaCl使其终浓度为1 mol·L,待其溶解后冰浴1 h,使噬菌体颗粒和细菌碎片分离;培养物在4 ℃、 6 800×的条件下离心20 min,将上清液移至灭菌的锥形瓶中,按10%的比例加入PEG 8000,上下颠倒使其充分溶解,注意动作轻缓,过夜冰浴使噬菌体颗粒充分形成沉淀;次日,将培养物在10 000×、 4 ℃条件下离心10 min回收噬菌体颗粒,弃上清后,将离心管倒置流干多余液体,加入2 mL SM缓冲液重悬沉淀;噬菌体液经0.22 μm滤器过滤除菌后,按1∶1的比例加入2 mL氯仿缓慢震荡1 min, 在蛋白质与氯仿充分作用后在4 ℃、960 ×条件下离心15 min,此步骤重复操作2~3次,除去噬菌体裂解液中的蛋白质,最后得到噬菌体浓缩液,用于噬菌体基因组的提取。用病毒基因组DNA/RNA提取试剂盒提取噬菌体基因组,用1%琼脂糖凝胶电泳检测所提取基因组纯度,且用于测序的基因组含量≥2 μg。
1.4.2 全基因组测序及生物信息学分析 委托赛默百合生物科技有限公司对提取的噬菌体基因组进行全基因组测序,并对噬菌体基因组进行拼接,得到完整的基因组序列。应用EditSeq对全基因组组分分析;采用tRNAscan-SE 预测全基因组中的tRNA; 使用ORF finder预测噬菌体的ORF,用Smart Blast对预测的ORF进行验证并注释,进行碱基序列相似性比对及编码基因的注释。最后将基因组上传至 NCBI获得序列号。选择噬菌体全基因组序列中的末端大亚基酶基因序列在NCBI中进行比对,用MEGA7.0软件构建进化树,和其他同源性较高噬菌体的末端大亚基酶核酸序列构建系统发育进化树,选取亲缘性较近的9个沙门噬菌体的内溶素基因序列,在移除终止密码子后,使用ClustalW进行比对;比对结果导入Datamonkey,根据官网推荐选择FEL方法,在分支选择时选择所有,最后计算每个密码子的KaKs均值,检测选择位点。
2 结 果
2.1 噬菌体的分离鉴定及生物学特性
2.1.1 噬菌体分离纯化结果 采用双层琼脂平板法,以20株沙门菌为指示菌,从污水样本中分离出1株噬菌体。纯化6代后,在双层琼脂平板上形成形状规则、边缘整齐、大小相近的透明噬菌斑,直径约为1.5 mm(图1),将分离得到的噬菌体命名为S5。
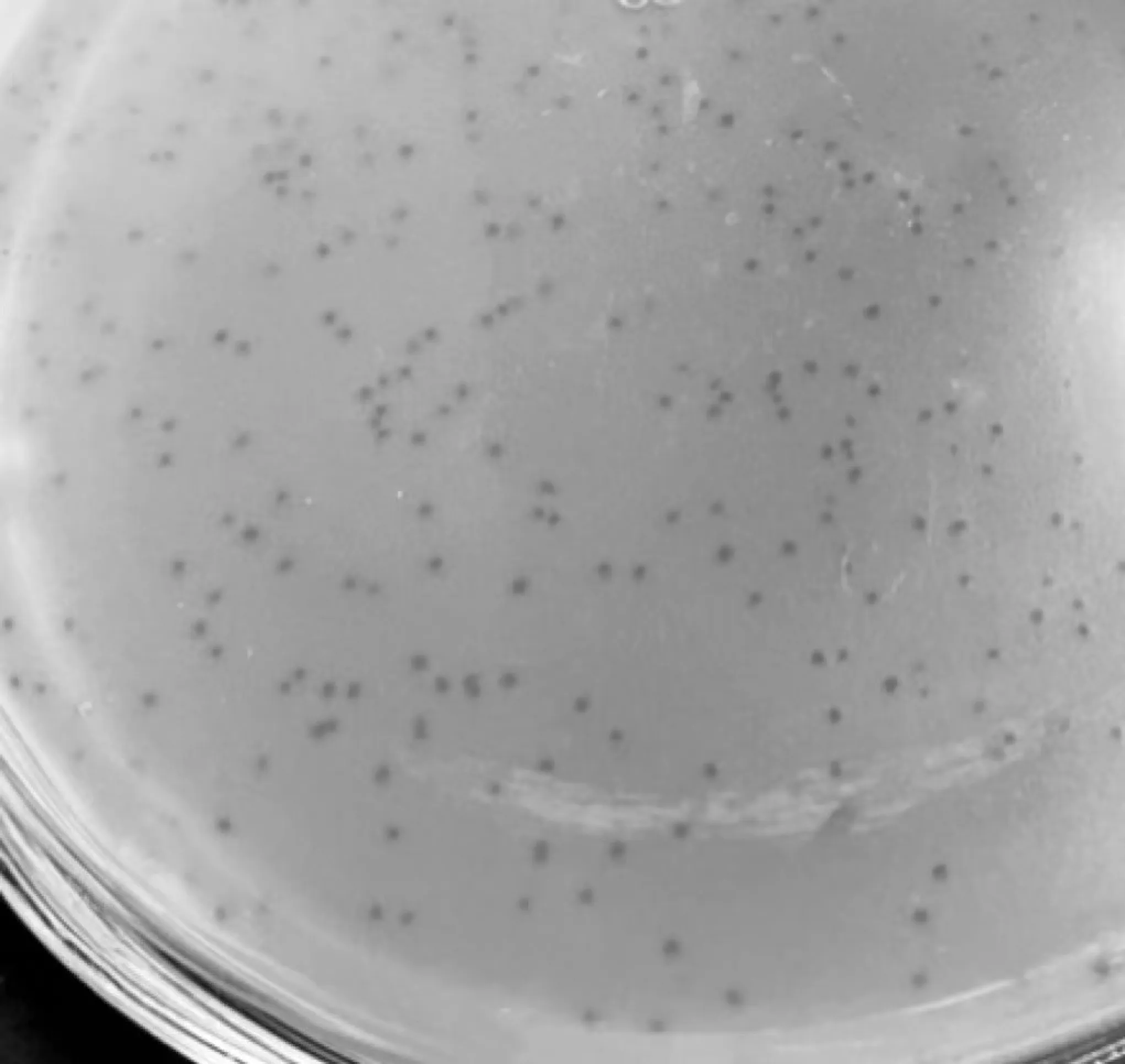
图1 噬菌体S5噬菌斑Fig.1 Plaque of phage S5
2.1.2 噬菌体裂解谱 噬菌体S5可成功裂解20株沙门菌中的15株,包含2株卡斯特鲁普和13株鼠伤寒沙门菌。表明噬菌体S5能裂解两种不同血清型的沙门菌,裂解率达到75%(15/20),其裂解谱较广,属于宽裂解谱噬菌体。
2.1.3 噬菌体效价 噬菌体S5纯化6代后,将噬菌体裂解液10倍连续稀释,通过双层琼脂平板法测得噬菌体S5效价为8×10PFU·mL。
2.1.4 噬菌体透射电镜观察结果 噬菌体负染后透射电镜观察,结果如图2所示,噬菌体S5头部呈正二十面体对称,直径为50 nm,具有一长度为200 nm的尾部。根据国际病毒分类委员会分类规则,该噬菌体属于有尾噬菌体目、长尾噬菌体科的成员。
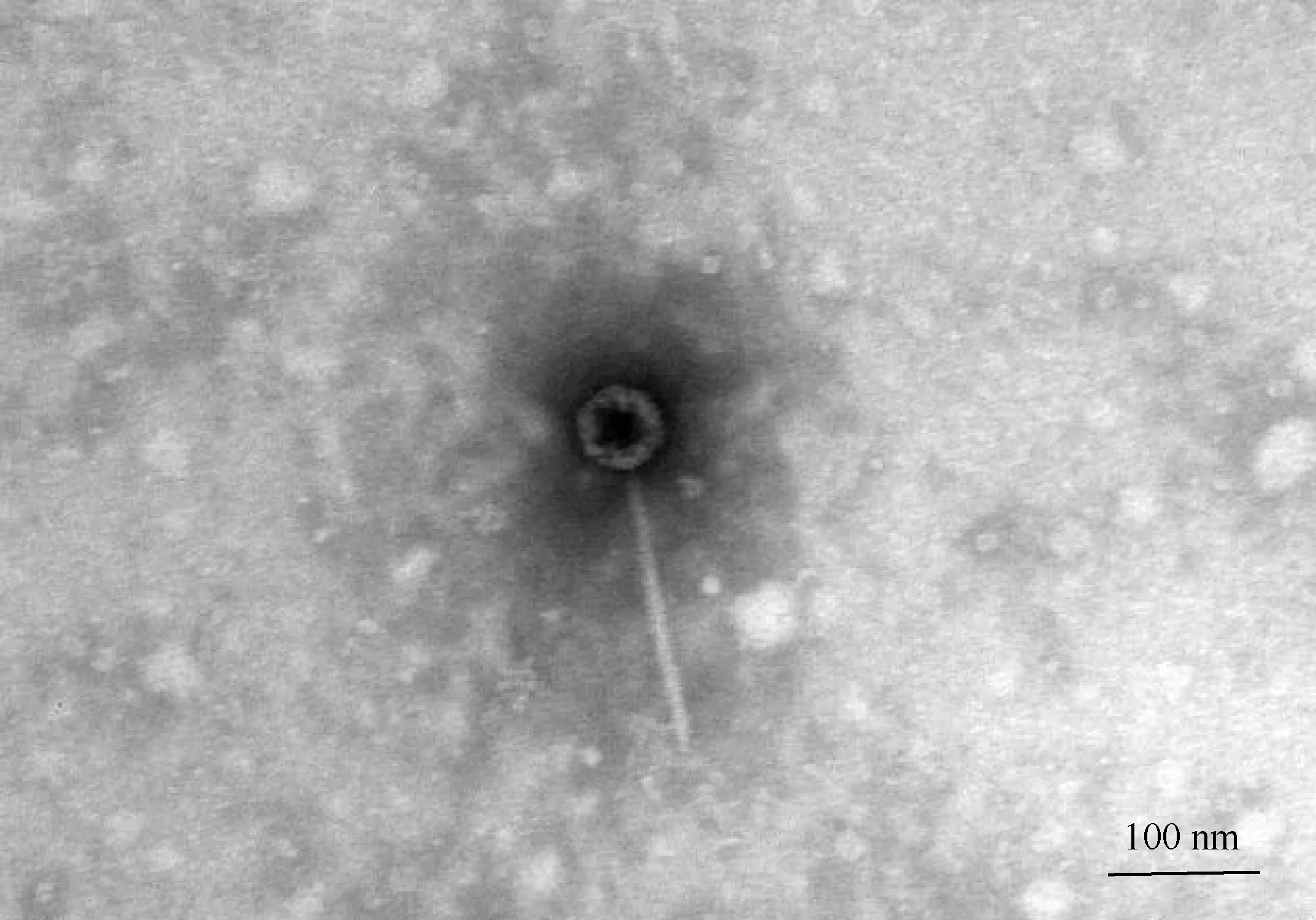
图2 噬菌体S5透射电镜图Fig.2 Transmission electron micrograph of phage S5
2.1.5 噬菌体热稳定性 温度对噬菌体S5的影响结果如图3所示,在30~60 ℃,噬菌体S5活性基本保持稳定,具有较好的耐热性。当温度高于60 ℃时,噬菌体效价随着温度的升高而降低,作用的时间越长则效价越低;当作用温度高达70和80 ℃时,噬菌体失活。
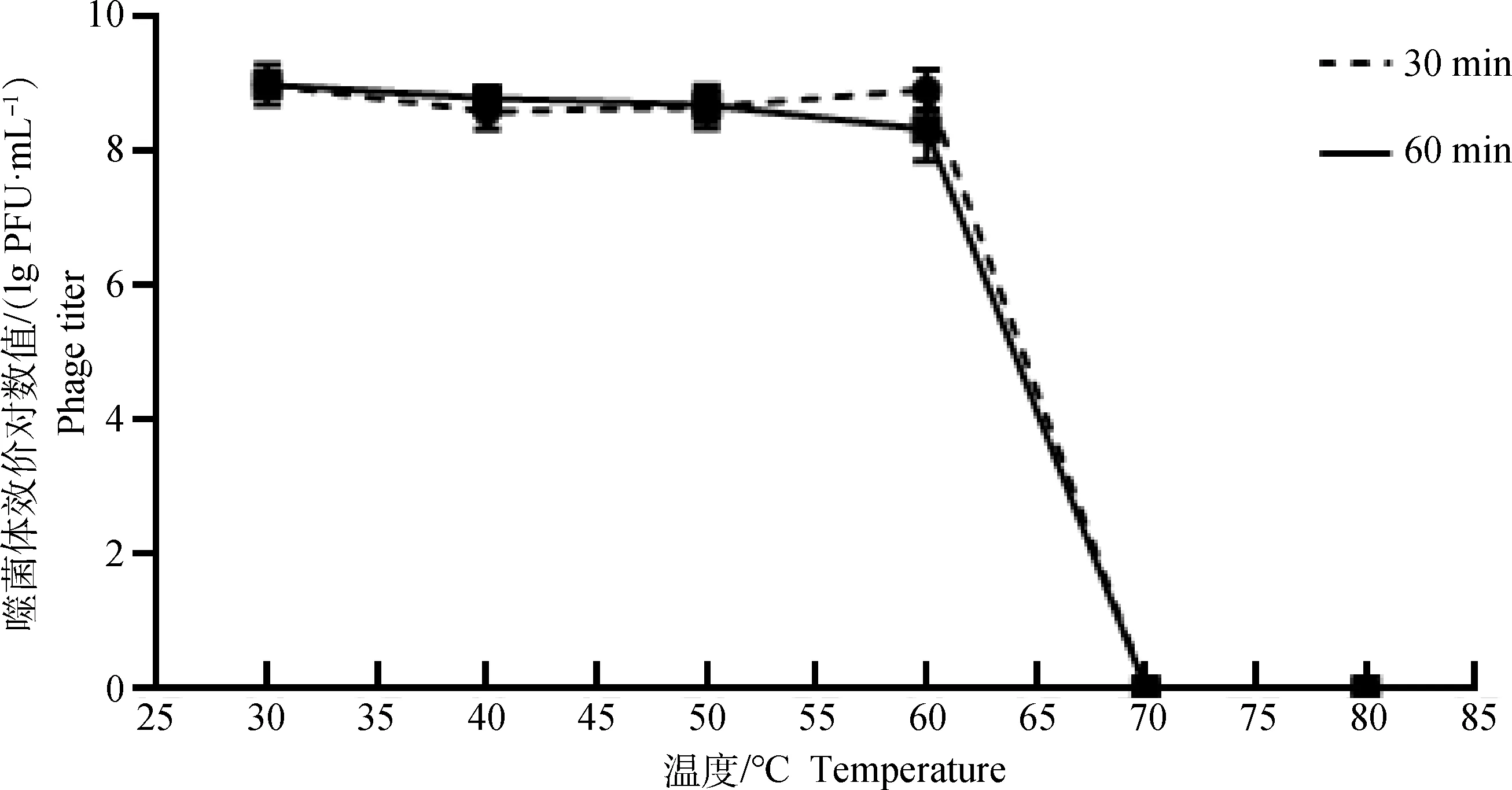
图3 噬菌体S5的热稳定性测定Fig.3 Determination of thermal stability of phage S5
2.1.6 噬菌体对酸碱的耐受性 噬菌体的活性随不同的酸碱环境发生变化。由图4可知,噬菌体S5经不同pH作用1 h后,在pH 4.0~11.0时酸碱度对其活性影响不大,在pH 9.0~11.0时噬菌体活性达到最高,为最适pH;当在pH 1.0~3.0和pH 13.0时,噬菌体活性完全丧失,结果显示噬菌体S5对酸碱耐受性较好。
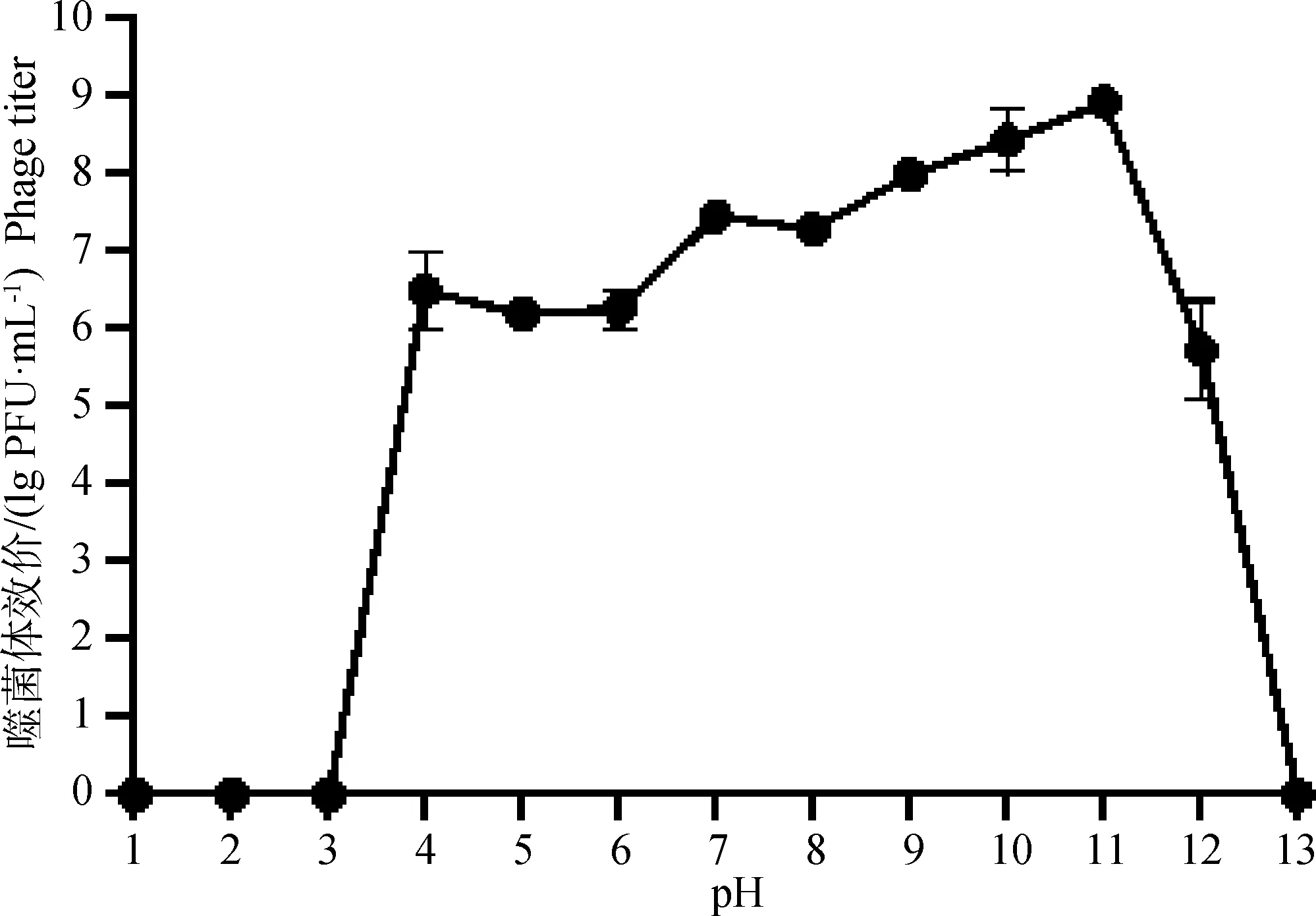
图4 噬菌体S5的pH稳定性测定Fig.4 Determination of pH stability of phage S5
2.1.7 噬菌体最佳感染复数 最佳感染复数测定结果显示,当感染复数为0.000 1时,噬菌体效价最高,达到2.5×10PFU·mL。当感染复数为0.000 1时,噬菌体S5感染宿主菌后噬菌体效价增殖倍数为4.16×10(噬菌体增殖倍数=增殖噬菌体数÷最初噬菌体数)。因此噬菌体S5的最佳感染复数为0.000 1。
2.1.8 噬菌体一步生长曲线 按照MOI为0.000 1的比例绘制的一步生长曲线,如图5所示。噬菌体感染宿主菌后5 min内(潜伏期)效价基本保持不变;在感染宿主菌后5~100 min内,噬菌体大量增殖,暴发期约为95 min,平均裂解量为50 PFU·cell。
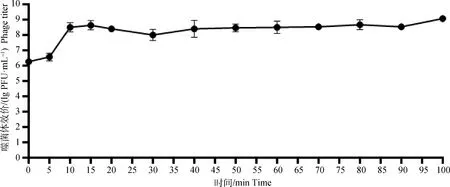
图5 噬菌体S5的一步生长曲线测定Fig.5 One-step growth curve determination of phage S5
2.2 噬菌体生物信息学分析结果
2.2.1 提取的噬菌体基因组 提取的噬菌体基因组进行琼脂糖凝胶电泳检测,1%的琼脂糖凝胶检测片段>5 000 bp(图6所示)。
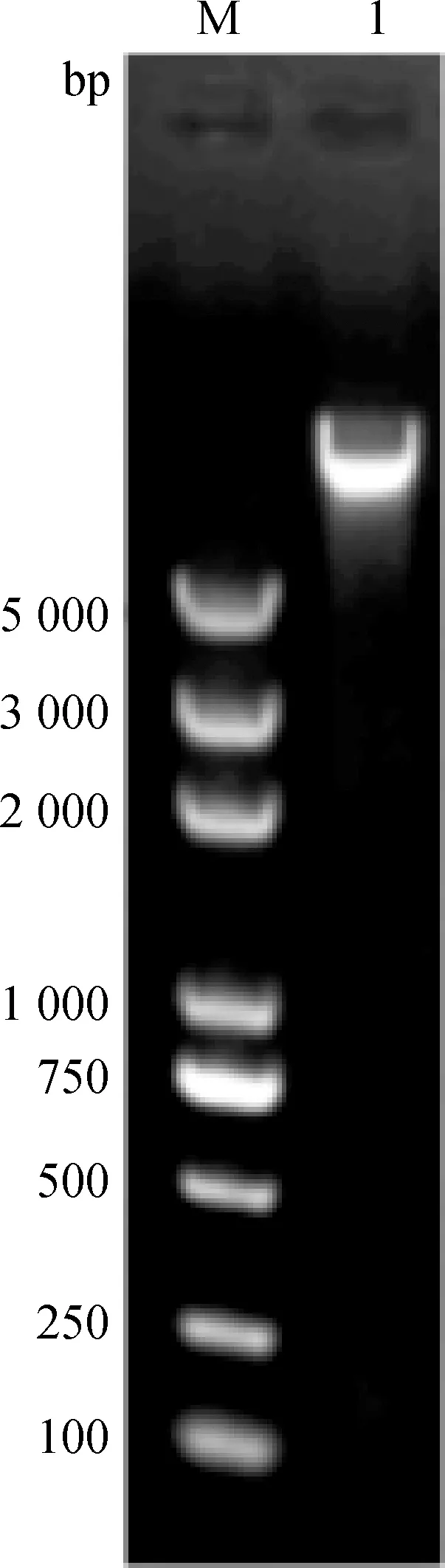
M. DL5000相对分子质量标准;1.噬菌体DNAM. DL5000 marker; 1. Phage DNA图6 噬菌体基因组电泳鉴定结果Fig.6 ElectropHoresis identification results of phage DNA
2.2.2 噬菌体全基因组生物信息学及编码氨基酸的二级结构预测 经全基因组测序及生物信息学分析,噬菌体S5基因组序列全长为72 519 bp。碱基分布为A(29.84%)、T(30.71%)、G(19.53%)、C(19.91%),GC 平均含量为39.45%,核酸类型为线型dsDNA。将噬菌体全基因组核酸序列提交GenBank,获取的登录号为OM908766。根据BLASTn比对,与沙门菌噬菌体phage FSL SP-058(72 394 bp, KC139517.1)和沙门菌噬菌体phage FSL SP-076(72 098 bp,KC139520.1)相似性较高,分别为95.88%、95.93%,覆盖率均为93%。Blastn结果显示,该噬菌体为有尾噬菌体目、长尾噬菌体科。用tRNAscan-SE在线软件预测tRNA,发现噬菌体基因组上含有9个编码tRNA的序列,分别转运Arg(精氨酸)、Asn(天冬酰胺)、Ser(丝氨酸)、Ile(异亮氨酸)、Met(蛋氨酸)、Ser(丝氨酸)、Tyr(酪氨酸)、转运Pro(脯氨酸)。预测的结构如图7所示。噬菌体基因组中的tRNA能弥补宿主菌中缺少的tRNA,使得噬菌体可以提高翻译裂解酶等蛋白质的效率。有研究表明,裂解性噬菌体比温和性噬菌体含有更多的tRNA,tRNA越多噬菌体的裂解性越强。因此,噬菌体S5是一株烈性噬菌体。
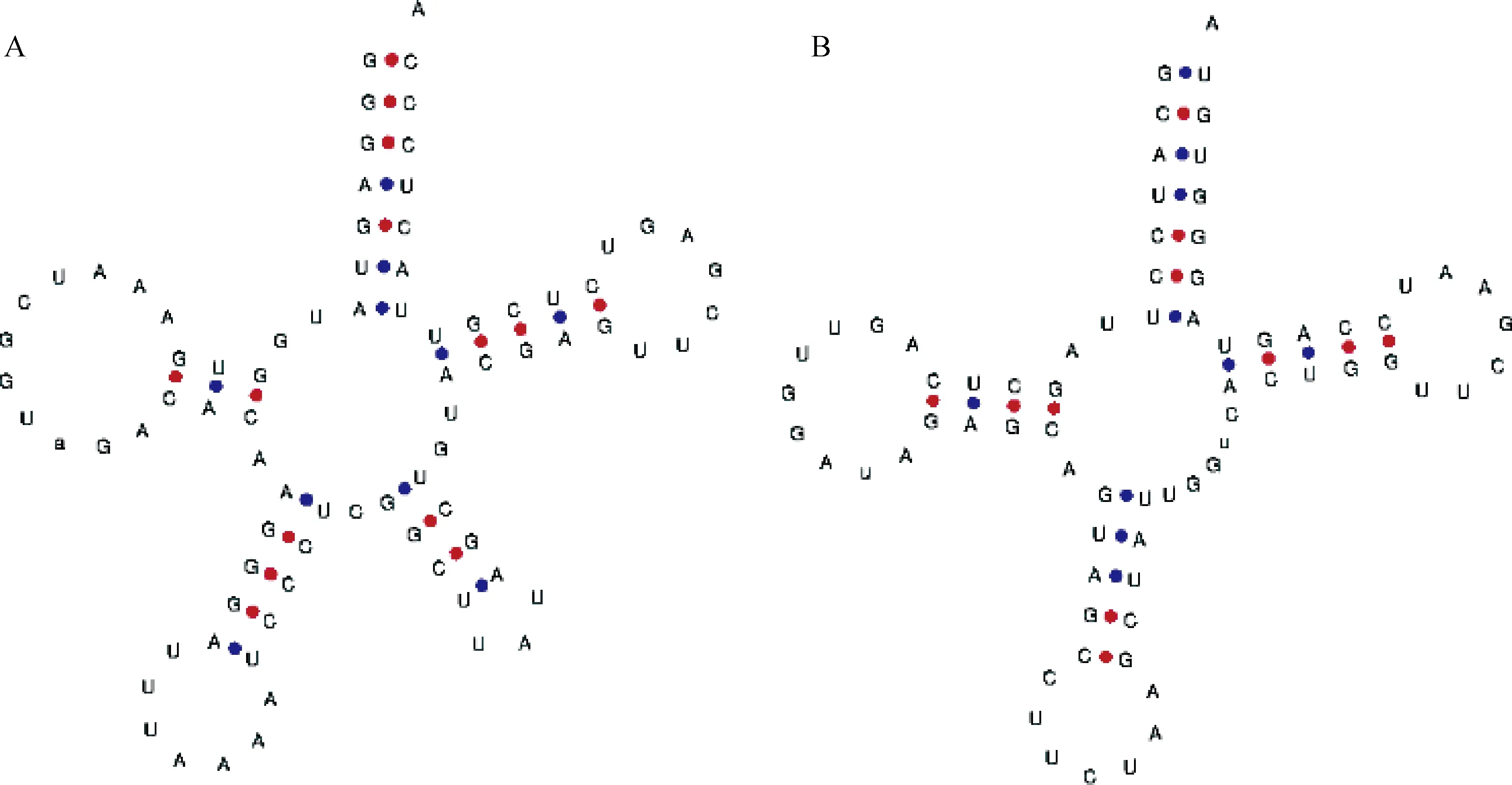
A.编号1预测的tRNA结构;B.编号2预测的tRNA结构;C.编号3预测的tRNA结构;D.编号4预测的tRNA结构;E.编号5预测的tRNA结构;F.编号6预测的tRNA结构;G.编号7预测的tRNA结构;H.编号8预测的tRNA结构;I.编号9预测的tRNA结构A. Predicted Id1 tRNA structure; B. Predicted Id2 tRNA structure; C. Predicted Id3 tRNA structure; D. Predicted Id4 tRNA structure; E. Predicted Id5 tRNA structure; F. Predicted Id6 tRNA structure; G. Predicted Id7 tRNA structure; H. Predicted Id8 tRNA structure; I. Predicted Id9 tRNA structure图7 噬菌体S5基因组中预测的tRNA结构Fig.7 Structure of the predicted tRNA in the phage S5 genome
2.2.3 预测的噬菌体基因组ORF及其功能注释结果 将噬菌体S5基因组预测的ORF在NCBI中进行比对,预测ORF的起始位置、片段具体长度和功能(详见OSID开放科学数据与内容)。根据基因组序列共预测出109个ORF,最长的ORF编码10 788 aa,最短的ORF编码79 aa。根据其功能注释可将其分为5个模块:裂解模块、DNA包装模块、结构组成模块、假定蛋白模块和核酸复制与调控模块。DNA包装模块主要包括protease(ORF23),噬菌体结构组成模块主要包括tailspike protein(ORF20、ORF21)、major coasid protein(ORF33)、domain-containing protein(ORF48),这些蛋白组成了噬菌体的头部、颈部和尾部,尾部纤维蛋白有助于噬菌体吸附宿主菌,尾部附着催化剂还能在细胞壁上形成空洞,把遗传物质注入宿主细胞内。核酸代谢与复制模块包括virion RNA polymerase(ORF39)、single-standed DNA binding protein(ORF46)、AAA family ATPase(ORF47)、putative flavin-dependent thymidylate synthase(ORF51)、ATP-dependent DNA helicase dda(ORF56)、Serine/threonine-protein phosphatase(ORF59)、Deoxyuridine 5′-triphosphate nucleotidohydrolase(ORF73)等。与噬菌体裂解功能相关的基因有lysis protein(ORF26)、endolysin(ORF27)等。其中,内溶素(endolysin)是噬菌体编码的一类能够裂解细菌的细胞壁水解酶,在噬菌体感染细菌的后期发挥重要作用,它能从细菌内部迅速裂解细菌细胞壁,帮助子代噬菌体释放到胞外。内溶素具有快速和独特的作用方式、杀灭病原体的高度特异性、细菌耐药性发展的低概率和蛋白质性质。其中,还有85个假定蛋白未知其功能,还需要进一步研究证实,其可视化基因组注释图谱如图8所示。
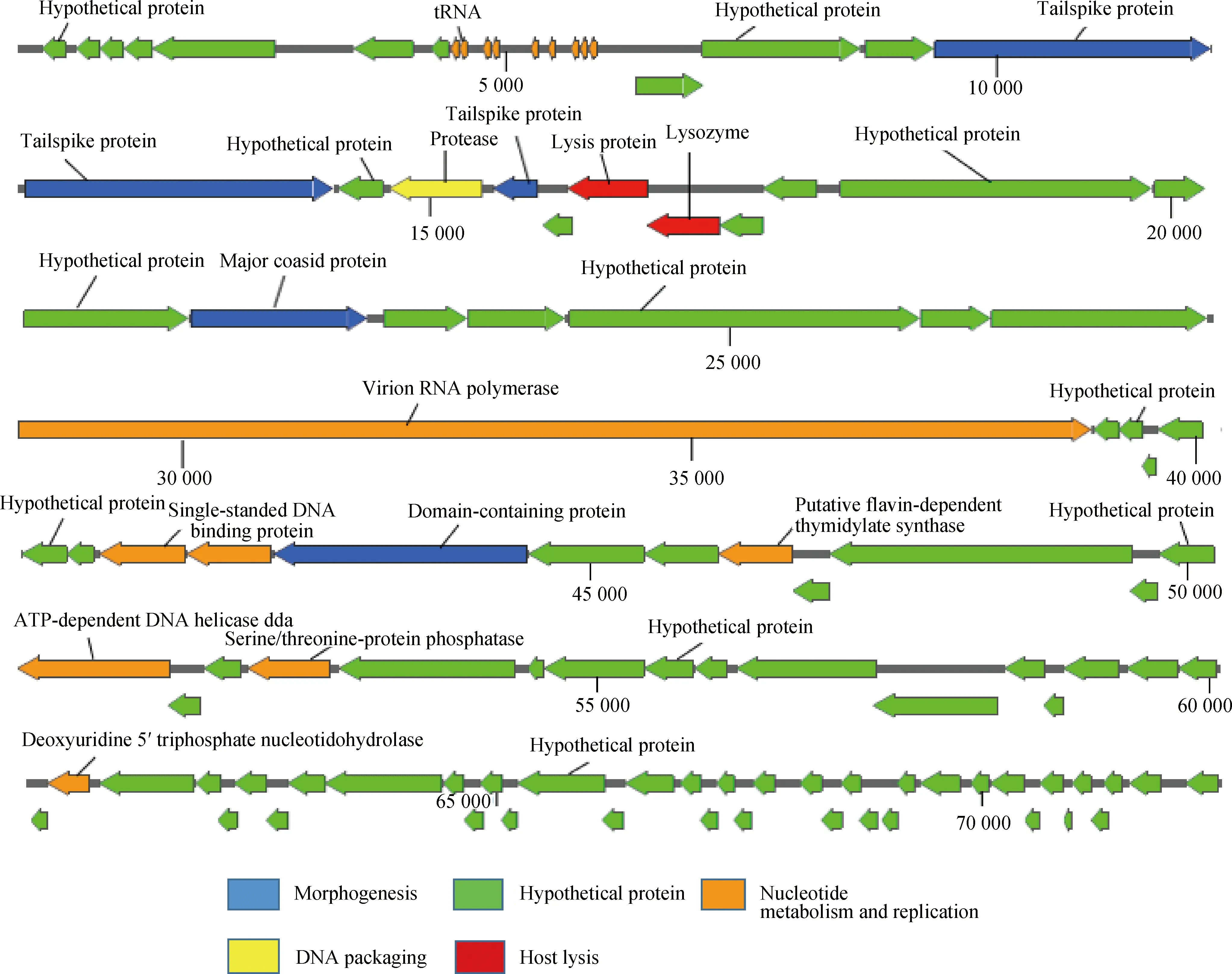
图8 噬菌体S5基因组注释图谱Fig.8 Genome annotation map of phage S5
2.2.4 噬菌体S5的同源性分析结果 选取噬菌体裂解蛋白的末端大亚基酶(terminase large subunit)基因序列,和其他同源性较高的噬菌体的末端大亚基酶序列构建系统发育进化树,找出亲缘性较近的噬菌体。结果如图9所示。从图中可以看出,噬菌体S5与phage FSL SP-076亲缘关系最近,且在同一分支上,可能是因为其宿主菌相同且都属有尾噬菌体目、长尾噬菌体科。
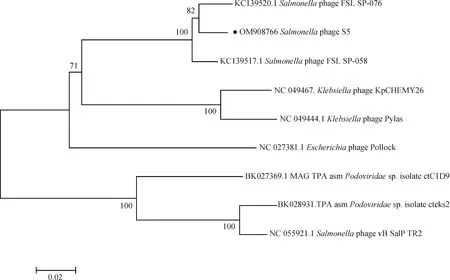
图9 噬菌体S5进化树Fig.9 Phylogenetic tree of phage S5
2.2.5 噬菌体S5内溶素基因的选择压力分析结果 利用NCBI选取与噬菌体S5亲缘性较近的9株沙门菌噬菌体,将Endolysin基因序列移除终止密码子以后,使用ClustalW进行比对;比对结果导入Datamonkey,根据官网推荐选择FEL方法,选择所有分支,最后计算出每个密码子的KaKs均值。
将噬菌体S5的内溶素基因的序列经Datamonkey检测分析可知,没有正向选择位点和中性选择点数,计算出输入序列的240个密码子的KaKs值,根据≤0.1过滤,得到62个氨基酸位点。所有位点都受到负选择压力,其结果表明,内溶素(endolysin)是噬菌体编码的一类能够裂解细菌的细胞壁水解酶,在噬菌体功能基因中非常重要,在感染细菌的后期发挥着重要作用,不会发生可能影响蛋白质功能的非同义突变。
3 讨 论
本研究分离的1株效价较高的宽裂解谱沙门菌烈性噬菌体S5,其温度及酸碱耐受能力强于赵影等、Ahiwale等分离的沙门菌噬菌体。若作为噬菌体制剂,基本不会受胃酸的影响,也可以抵抗较高的环境温度。噬菌体S5的最佳MOI为0.000 1,表明该噬菌体在较低浓度下就能起到高效的杀菌作用。MOI是研究噬菌体投入与产出量效关系的重要指标,较低的感染复数会降低应用成本,利于噬菌体产品的大规模生产及应用。噬菌体S5潜伏期约为5 min,表明噬菌体的复制效率高,裂解细菌的速度快。其暴发期约为95 min,平均裂解量为50 PFU·cell。与杨心怡等和王杰等分离出的噬菌体相比,S5潜伏期短,暴发期更长,裂解量大,能够在较短时间内杀死大量沙门菌,对沙门菌噬菌体的应用有积极意义。
用于生物防治的烈性噬菌体必须遗传背景清楚、杀菌能力强且不携带有害基因,否则可能造成有害基因在细菌间水平转移。本研究对沙门菌噬菌体S5进行全基因组生物信息学分析,预测到109个ORF,其中ORF27为编码内溶素(endolysin)的基因,内溶素是裂解酶的一种,噬菌体感染初期利用裂解酶降解细菌细胞壁肽聚糖从内部裂解宿主菌。本研究分离鉴定的噬菌体S5基因组上含有9个编码tRNA的序列,是一种强裂解性噬菌体。有研究表明,拥有tRNA基因的噬菌体,其宿主范围较广,而不是简单地感染一个特定的宿主,噬菌体S5能裂解卡斯特鲁普和鼠伤寒两种不同血清型的沙门菌也证实了这一结论。噬菌体S5未发现携带任何已知的溶源性相关基因,如编码整合酶(integrase)或阻遏蛋白(repressors)等的基因,利用ResFinder预测噬菌体S5基因组中无抗生素抗性基因,利用ViruG lenceFinder预测噬菌体S5基因组中不存在毒力基因,该结果从遗传背景上证实噬菌体S5应用于菌体治疗应该是安全的。
4 结 论
分离鉴定了1株宽谱高效价的沙门菌烈性噬菌体,具有较宽的温度以及酸碱耐受范围、繁殖活性强的特性。全基因组序列测定结果表明,该噬菌体携带9个编码tRNA的基因序列,且未发现携带任何编码抗生素耐药因子、细菌毒力因子等有害产物的基因,具有较高的应用安全性,为进一步开发沙门菌噬菌体制剂提供了科学依据。

