牡丹炭疽病菌拮抗内生细菌的分离鉴定及促生作用
石 杨, 吕长平, 帅佳琪, 毛 咪, 江莉娜
(1.湖南农业大学风景园林与艺术设计学院,湖南长沙 410128; 2.湖南农业大学园艺学院,湖南长沙 410128;3.湖南省中亚热带优质花木繁育与利用工程技术研究中心,湖南长沙 410128)
牡丹为芍药科(Paeoniaceae)芍药属()多年生落叶灌木,具有极高的药用、观赏、油用价值。但在长期的人工栽培中,牡丹病虫害的发生日益严重,影响了牡丹的利用价值。牡丹炭疽病为牡丹的主要病害之一。在湿热的夏季,牡丹叶片病害尤为突出。
目前主要使用化学药剂防治牡丹炭疽病,但在使用过程中不仅会造成环境污染,而且极容易使病原菌产生抗药性。由于微生物农药具有高效、低毒、环保及来源广等优点,使其受到研究者的广泛关注。目前用于防治的微生物主要有拮抗放线菌、拮抗真菌和拮抗细菌。植物内生菌是指在植物生活史的一定阶段或全部阶段生活于健康植物各种组织和器官的细胞间隙或细胞内的微生物类群。相比较于其他生防菌,植物内生菌所处的环境相对稳定,不易受外界温度、紫外辐射等因素的影响,能够在植物体内长期定殖,其独特的优势使其越来越多地应用于生防菌的研发。丁东玲等从药用牡丹内部分离得到的短小芽孢杆菌()具有拮抗金黄色葡萄球菌的作用。
本研究拟从湖南农业大学花卉基地内健康牡丹的茎和根中分离、筛选、鉴定牡丹炭疽病菌拮抗菌株,并评估其拮抗能力,同时探究其对植物的促生特性。以期为进一步研究病原菌与内生菌的互作奠定基础,为牡丹炭疽病防治提供新的途径。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 2019年12月,于湖南农业大学花卉基地内采集生长健壮的凤丹、紫绣球、湘西粉3个牡丹品种的茎和根,带回实验室进行内生菌的分离。胶孢炭疽菌自行从发病的牡丹叶片中分离获得。
1.1.2 试验试剂 马铃薯葡萄糖琼脂(PDA)培养基、营养(NA)培养基、R2A培养基、-1,3-葡聚糖培养基、羧甲基纤维素钠(CMC)培养基、酪蛋白培养基。
PKO培养基:10 g葡萄糖、5.0 g Ca(PO)、0.5 g (NH)SO、0.2 g NaCl、0.2 g KCl、0.03 g FeSO、0.03 g MgSO·7HO、0.03 g MnSO、20 g酵母膏、20 g琼脂、1 L蒸馏水,pH 值为6.8~7.0。
阿须贝氏培养基:0.2 g KHPO、0.2 g MgSO、0.2 g NaCl、5 g CaCO、10 g甘露醇、0.1 g CaSO、18 g 琼脂、1 L蒸馏水。
金氏(King)培养基:20 g蛋白胨、1.5 g MgSO、1.15 g KHPO、15 mL CHO、0.1 g-色氨酸、1 L 蒸馏水。
比色液:1.5 mL 0.5 mol/L FeCl、30 mL HSO、50 mL蒸馏水。
以上试剂均来自北京酷来博科技有限公司,细菌提取试剂盒[天根生化科技(北京)有限公司,DP302-02]。
1.2 试验设计
1.2.1 内生菌的分离 内生菌的分离、纯化参照了Zhao等的方法进行,将平板上长出的单菌落保存于试管斜面中备用。
1.2.2 内生菌对牡丹炭疽病菌的拮抗筛选 采用五点对峙法测试内生细菌对炭疽病的拮抗作用。将内生细菌转接于NA和R2A液体培养基中,28 ℃、120 r/min振荡培养72 h,制备拮抗菌菌悬液,备用。在炭疽菌菌落边缘用打孔器取带有菌丝的菌饼,并将其接入空白PDA平板正中央,同时以病原菌为中心,距离菌饼2.5 cm处,3个点上分别接入20 μL内生细菌菌悬液。将只接入病原菌菌饼作为空白对照,重复3次,28 ℃培养7 d左右,待对照组的菌丝长满平板时,用十字交叉法测量菌落直径。
内生菌拮抗病原菌抑菌率按如下公式进行计算:
抑菌率=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-菌饼直径)×100%。
1.2.3 拮抗菌发酵液抑菌试验 将筛选出的最具拮抗作用的拮抗菌接种于液体培养基中,28 ℃、120 r/min 摇床培养3 d。将菌悬液分装于离心管中,12 000离心10 min,上清液通过0.22 μm无菌过滤器。将拮抗菌株的无菌发酵上清液按4 ∶1的比例倒入 65 ℃ 固体培养基中并倒平板,将不加无菌发酵上清液作为对照;在平板中央接种牡丹胶孢炭疽菌菌饼(直径6 mm),设置3个重复。28 ℃恒温培养,待对照病原菌长满培养皿时,用十字交叉法测量菌落直径,并计算无菌发酵上清液对病原菌生长的抑制率。
采用离体牡丹叶片接种:从花卉基地的健康牡丹植株上选取长势一致的牡丹叶片。清水冲洗 1 min,用高温消毒后的棉球蘸取75%的乙醇正反擦拭牡丹叶片,再用棉球蘸取无菌水进行擦拭,用无菌发酵液浸泡牡丹叶片30 min,并用无菌水作对照,用针刺叶片造成伤口,并在伤口上接种牡丹炭疽病菌菌饼,菌丝面贴近伤口,每张叶片接种1个菌饼,将处理的叶片放于准备好的保鲜盒中,每盒2张叶片,加无菌水至滤纸完全浸润,盖上盒盖,每个处理10张叶片,28 ℃下保湿培养,每天观察接种伤口情况,并根据滤纸的保水情况增加无菌水以保证盒内湿度。待病斑不再扩大后,观察记录。牡丹叶片面积病变比例=(-)×100,其中:为对照组牡丹叶片病变面积;为发酵上清液处理组牡丹叶片病变面积。
1.2.4 优良拮抗菌的鉴定 形态学鉴定:将纯化后的优良内生拮抗细菌接于NA和R2A培养基,37 ℃培养3 d,观察描述菌落形态,18~24 h菌龄时进行革兰氏染色并在显微镜下观察。
分子生物学鉴定:细菌DNA按照细菌DNA快速提取试剂盒提供的方法进行提取。PCR扩增引物选用细菌16S rDNA通用引物(27F:5′-A G A G T T T G A T C C T G G C T C A G-3′;1492R:5′-G G T T A C C T T G T T A C G A C T T-3′)。PCR产物检测委托北京擎科生物科技有限公司进行,将所得到的16S rDNA序列经过校对与BLAST中的GenBank序列采用 MEGA4.0软件以邻接法构建菌株系统发育树。
1.2.5 促生能力测定 IAA(吲哚乙酸)分泌能力的测定参照Patten等的方法;溶磷能力测定参照许进娇等的方法;固氮能力测定参照崔月贞等的方法。
1.2.6 拮抗细菌代谢分泌物测定-1,3-葡聚糖酶活性测定:将筛选的优良拮抗菌接种于-1,3-葡聚糖培养基中,每株拮抗菌3次重复,28 ℃培养 3 d。测定透明圈直径与菌落的直径,并计算其比值(值)。纤维素酶活性测定参照张平等的方法。蛋白酶活性测定:将拮抗菌接种于酪蛋白培养基中,每株拮抗菌重复3次,28 ℃条件下培养 3 d。然后测定透明圈与菌落直径,并计算其比值(值)。
1.2.7 数据分析 试验数据采用Excle及SPASS 3.0软件进行差异显著性分析。
2 结果与分析
2.1 牡丹炭疽病菌拮抗菌的筛选
将分离出的细菌与牡丹炭疽病菌进行对峙培养,共筛选出拮抗细菌9株(表1)。其中菌株 FJ1.3、ZJ1.5、XG1.4、ZJ1.4的抑菌效果最好,生长抑制率分别为51.39%、48.15%、41.67%、36.11%。因此选用FJ1.3、ZJ1.5、XG1.4、ZJ1.4菌株为牡丹炭疽病菌拮抗优势内生菌株。
表1 不同内生菌菌株对病原菌的抑制效果
2.2 拮抗内生菌对病原菌的抑制
本试验通过菌丝抑制法,测定最具拮抗作用的4株拮抗菌无菌发酵液对病原菌的抑制作用。结果表明(表2),菌株FJ1.3的无菌发酵液对病原菌最具抑制作用,抑制率为35.13%,其次是菌株ZJ1.4,抑制率为34.54%。

表2 拮抗菌发酵液对病原菌的抑制效果
优良拮抗菌株对牡丹炭疽病菌的离体防效试验(表3)结果表明,菌株FJ1.3病斑显著小于清水对照。接种5 d后,菌株FJ1.3对牡丹炭疽病的防效达到47.06%。其次为菌株ZJ1.4,防效为22.48%。
表3 拮抗菌对牡丹炭疽病的防治效果
2.3 拮抗菌株的鉴定
2.3.1 形态学鉴定 4株优良拮抗菌在37 ℃培养3 d后,4株菌株菌落形状不规则,菌落不透明,菌株FJ1.3、ZJ1.5表面湿润无光泽,菌株ZJ1.4、XG1.4表面湿润有光泽,扁平,菌株ZJ1.5颜色为浅黄色,其余菌株均为白色(表4)。革兰氏染色后,经显微镜观察发现,4株菌株都为革兰氏阳性菌。4株拮抗菌都符合芽孢杆菌属()特征。

表4 株优良拮抗菌的形态特征
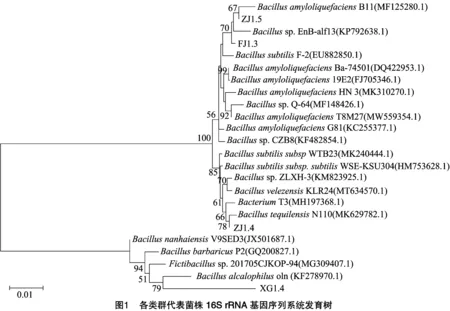
2.3.2 分子生物学鉴定 将4株优良炭疽病菌拮抗菌进行测序后,登录NCBI数据库,通过BLAST对测序结果进行比对分析,并构建系统发育树。结合系统发育分析结果(图1),菌株FJ1.3最相似菌株为枯草芽孢杆菌(),相似性为99.50%。菌株ZJ1.5最相似菌株为解淀粉芽孢杆菌(),其相似性为99.50%。菌株ZJ1.4最相似菌株为特基拉芽孢杆菌(),相似性为99.60%。菌株XG1.4最相似菌株为嗜碱芽孢杆菌(),相似性为96.33%。
2.4 拮抗菌促生潜能的测定
所筛选出的4株菌株在与比色液结合后呈现出不同深度的红色,表明4株菌株均具备分泌IAA的能力,颜色越深,分泌IAA能力越强。菌株ZJ1.5分泌IAA能力最强,IAA浓度高达17.02 mg/L,菌株FJ1.3分泌IAA能力次之,为16.94 mg/L(表5)。筛选出的4株拮抗细菌在无氮培养基中能正常生长,故都具有固氮能力(图2)。4株拮抗细菌在PKO培养基上生长无明显溶磷圈,表明其不具备溶磷能力(图3)。

表5 拮抗细菌分泌IAA能力测定
2.5 拮抗细菌代谢分泌物的测定
拮抗细菌ZJ1.5、FJ1.3、ZJ1.4、XG1.4生长过程中都具有产蛋白酶的能力(图4),酶产量最高的为菌株ZJ1.5,其透明圈直径与菌落直径的比值达到5.67(表6)。在CMC培养基上,3株菌株ZJ1.5、ZJ1.4、FJ1.3均能生长出菌落,并使菌落周围的刚果红颜色消失而形成透明圈(图5),其中酶产量最高的为菌株FJ1.3,其透明圈直径与菌落直径的比值达到22.50(表7)。在-1,3-葡聚糖培养基上,4株菌株均不能使培养基中的蓝色消失,表明4株菌株均不能产生-1,3-葡聚糖酶(图6)。
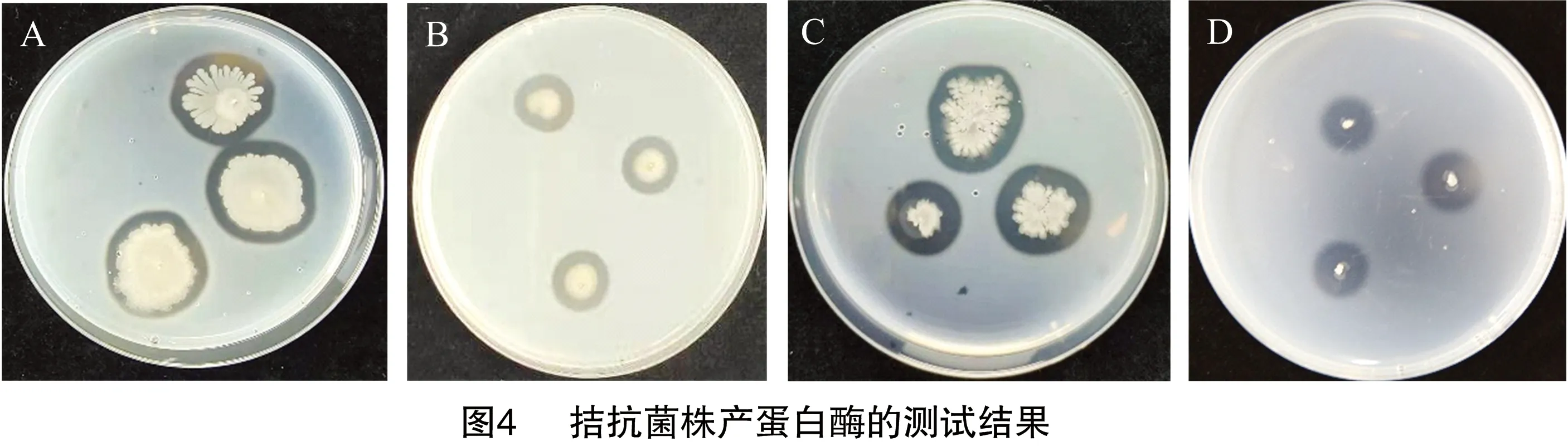
表6 拮抗菌株产蛋白酶的测定结果
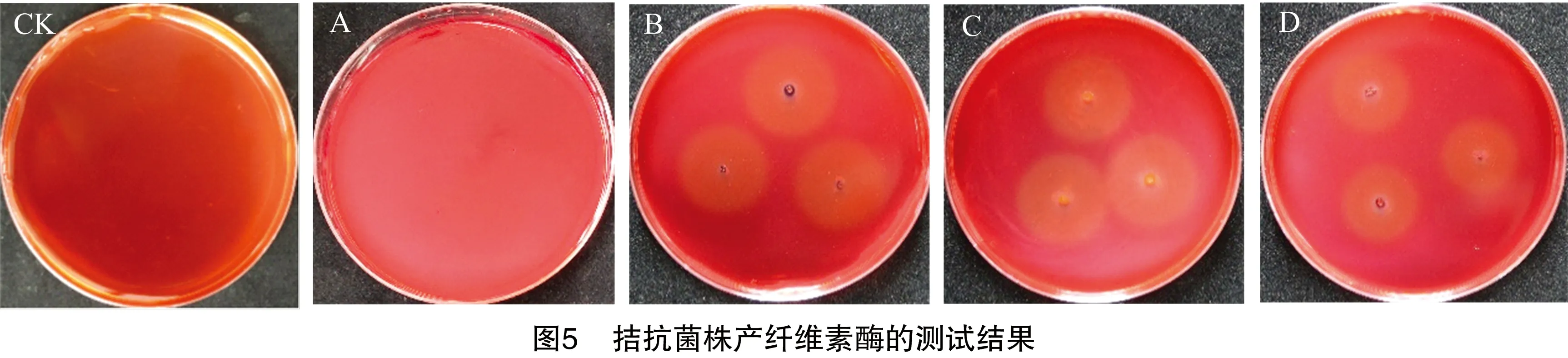
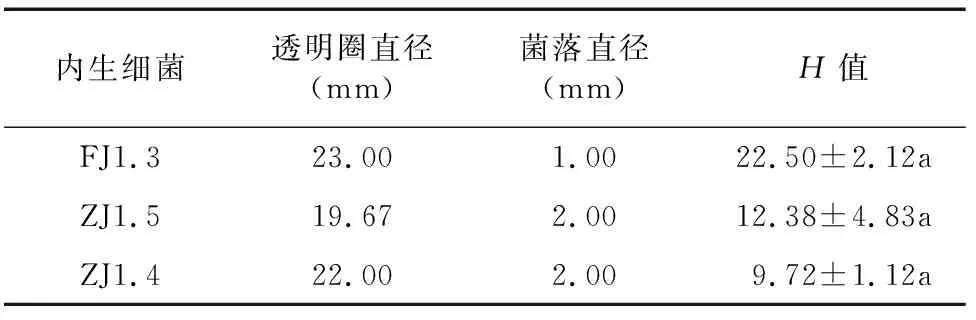
表7 拮抗菌株产纤维素酶的测定结果
3 结论与讨论
3.1 内生细菌的促生作用
由于植株内部环境条件不易受改变,容易定殖,不易受到外界环境因素的影响,漫长的进化选择使植株体内的组分相对固定。Gaiero等研究发现,植株内生和根际微生物可以通过溶磷、固氮、分泌IAA等方式直接影响植物的新陈代谢,从而对植株的生长发育产生影响。目前研究者从多种植物体内都分离出对植株具有促生作用的内生细菌,如黄瓜内生菌枯草芽孢杆菌可通过固氮和产铁载体的作用来促进黄瓜种子萌发和幼苗的生长;野大豆内生细菌普罗威登斯菌属()具有溶磷能力,溶磷量为46 mg/L,且具有产IAA能力,达到19.97 mg/L,1-氨基环丙烷-1-羧基(ACC)脱氨酶活性达到8.59 μmol/(mg·h),菌株处理小麦10 d后,促生效果最显著,株高、根长、叶干质量与根干质量分别增加58.46%、81.89%、54.87%、29.9%。
本试验筛选的优良菌株都可产生IAA和固氮能力,但都不具有溶磷能力。在本试验的研究中发现菌株分泌IAA的量存在差异。本试验菌株ZJ1.5最相似菌株为解淀粉芽孢杆菌,产生IAA量最高,达17.02 mg/L,其次为菌株FJ1.3,其最相似菌株为枯草芽孢杆菌,产IAA量为16.94 mg/L,但两者之间产IAA量差异不显著。从野大豆中分离出的内生细菌假单胞菌(sp.)产IAA为19.97 μg/mL,对水稻幼苗具有明显的促进作用。这些研究与本试验结果基本一致,表明宿主植物内定殖了大量产生IAA的内生菌资源。刘丽辉等从南方野水稻中分离出的内生细菌织片草螺菌()产IAA能力高达29.97 mg/L,固氮酶活性高达494.14 nmol/mL,有力地支持了本研究结果。
3.2 内生细菌的拮抗作用
植物与微生物关系紧密,通过构建根际微生物区系,植物根部分泌的代谢物可驱使植物生长和发生防御反应,而细菌基因组特性决定了其对宿主的适应性。近年来,利用植物内生菌来抑制植物病原微生物进行生物防治的研究在国内外已展开,这些研究为牡丹炭疽病的生物防治提供了新的思路和借鉴。本研究从牡丹的根和茎中分离出了64株内生细菌,经过筛选测试,牡丹内生菌菌株FJ1.3、ZJ1.4、ZJ1.5、XG1.4对牡丹炭疽病菌具有较强的拮抗作用。抑菌率在36%以上,其中 FJ1.3 的抑菌率达到51.39%。无菌发酵液试验中抑菌率最高的菌株为FJ1.3,达到35.13%,其次是菌株ZJ1.4,抑菌率为34.54%。在离体叶片防效试验中防治效果最佳的菌株为FJ1.3,防效为47.06%。牡丹内生菌接种处理牡丹炭疽病菌,出现抑制炭疽病菌菌丝生长的现象,可能原因是内生菌与病原菌对峙过程中产生了化感物质及胞外代谢产物,如解毒酶、水解酶类等。陈思宇等的研究支持这个解释,水稻纹枯病菌拮抗细菌通过产生蛋白酶和嗜铁素对水稻纹枯病菌产生抑制作用。本试验初步探究了拮抗牡丹炭疽病菌的内生细菌的代谢分泌物。4株优良拮抗细菌都具有分泌蛋白酶和纤维素酶的能力,而不具有分泌-1,3-葡聚糖酶的能力。Kamensky等研究支持了这一结论,发现蛋白酶能够对菌核病和灰霉病产生抑制作用。Singh等研究发现,类芽孢杆菌产生-1,3-葡聚糖酶,可破坏枯萎病病原菌的细胞壁,导致菌丝自溶、断裂。本研究仅对内生菌代谢分泌物进行初步探索,对内生菌代谢酶活性还需进一步探索。

