QRS时限变化对心脏再同步化治疗后全因死亡及心源性猝死的预测价值
承燕, 张常莹, 李宗斌, 赵晓溪, 王如兴
(南京医科大学附属无锡人民医院心血管内科,江苏 无锡 214023)
心脏再同步化治疗(cardiac resynchronization therapy,CRT)是心力衰竭的器械治疗方法之一。2021年欧洲心脏病学会发布的心脏起搏和CRT治疗指南推荐对经过药物优化治疗后仍有心力衰竭症状、左室射血分数(left ventricular ejection fraction, LVEF)≤35%且QRS 时限(QRS duration, QRSd)≥130 ms的患者可考虑行CRT以缓解症状和降低病死率[1]。但CRT应答率只有约三分之二,仍待进一步提高[2]。QRSd作为心脏电不同步的指标之一被指南推荐用于CRT适应证的评估。然而,研究表明术前QRSd与CRT反应性并非呈线性关系,且部分研究未发现其对CRT反应性有预测价值[3-5]。有研究探索手术前后QRSd的变化(ΔQRSd)与CRT反应性及预后的关系,但是结论存在矛盾[6-7]。总体而言,目前关于CRT的研究主要围绕其反应性,而对生存预后研究较少。本文就ΔQRSd对CRT后全因死亡及心源性猝死的预测价值进行探索。
1 资料和方法
1.1 研究对象
收集2011年3月至2020年12月南京医科大学附属无锡人民医院置入CRT(CRT-P或CRT-D)的患者66例。CRT植入指征:① 经过指南指导的药物治疗后美国纽约心脏病协会(New York Heart Association,NYHA)分级仍≥Ⅱ级,LVEF≤35%,且QRSd≥130 ms;② 有永久性起搏器植入术指征,LVEF为36%~50%,预计起搏比例>40%。所有手术均由同一团队完成。遵循心血管植入型电子器械术后随访要求常规随访,有症状时增加随访次数。该研究符合2013年修订的《赫尔辛基宣言》的原则。
1.2 资料收集
回顾性收集患者的性别、年龄、诊断、用药、超声心动图、起搏器程控资料等信息。合并症纳入冠心病、心房颤动、高血压、糖尿病、慢性阻塞性肺病、慢性肾功能不全。用药纳入螺内酯、血管紧张素转化酶抑制剂(ACEI)/血管紧张素受体拮抗剂(ARB)/血管紧张素受体脑啡肽酶抑制剂(ARNI)、β受体阻滞剂、地高辛、胺碘酮、他汀类药物。起搏器程控资料纳入心房颤动、室性心动过速、抗心动过速起搏、电复律或电除颤治疗等信息。
1.3 心电图参数测量
收集患者CRT术前及术后双心室起搏(已优化AV和VV间期)的12导联体表心电图,由一名对患者临床资料不知情的研究者测量QRSd以及根据Straus标准诊断完全性左束支传导阻滞(complete left bundle branch block,CLBBB)。Straus标准为QRSd≥140 ms(男)或≥130 ms(女);V1和V2导联呈QS或rS;在V1、V2、V5、V6、Ⅰ和aVL导联中≥2个连续导联存在QRS顿挫或切迹[8]。QRSd测量方法为从心电图中最早出现的 QRS波(或从起搏钉)开始到最晚的QRS波结束[9]。ΔQRSd= QRSd术后-QRSd术前。
1.4 终点事件
终点事件为心源性猝死和全因死亡。心源性猝死包括死亡原因为泵衰竭和恶性心律失常,以及发生电除颤或电复律事件。全因死亡包括任何原因的死亡。
1.5 统计分析
应用SPSS 22.0和X-tile 3.6.1统计软件进行统计学分析。计量数据的正态性分布使用Shapiro-Wilk检验评估。正态分布的计量数据用均数±标准差表示,两组间比较使用两样本t检验;非正态分布的计量数据用中位数(四分位数间距)表示,两组间比较使用Mann-WhitneyU检验。计数数据用例(%)表示,组间比较采用χ2检验或Fisher 精确检验。中位随访时间采用reverse Kaplan-Meier分析。使用Cox生存分析筛选CRT后全因死亡及心源性猝死的独立预测因子。在一般临床特征中筛选P<0.1的因素进行单因素Cox回归分析。单因素Cox回归分析中筛选P<0.05的变量进入多因素Cox回归分析。ΔQRSd的最佳截断值使用X-tile 3.6.1软件进行分析。按ΔQRSd最佳截断值分组后与CRT后全因死亡及心源性猝死的关系采用Kaplan-Meier生存分析和Log Rank检验判断。采用双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 全因死亡的预测因子
去除右室双部位起搏和希浦系统起搏后,本研究共纳入有完整随访资料的患者66例,平均年龄为(65±10)岁,71%为男性,中位随访时间72个月,死亡15例。死亡组和存活组在性别、年龄、NYHA心功能分级、CLBBB、冠心病、高血压、心房颤动、慢性阻塞性肺病、慢性肾功能不全、糖尿病、术前左房内径、术前左室舒张末内径(LVEDd)、术前LVEF、用药(ACEI/ARB/ARNI、螺内酯、β受体阻滞剂、地高辛、胺碘酮、他汀类药物)和CRT-D比例间差异均无统计学意义(P均>0.05),见表1。单因素Cox回归分析提示ΔQRSd和CLBBB与全因死亡相关;多因素Cox回归分析提示ΔQRSd是全因死亡的预测因子(HR=1.019,95%CI:1.004~1.035,P=0.014),见表2。

表2 CRT后全因死亡的单因素及多因素Cox回归分析
2.2 心源性猝死的预测因子
66例患者中有16例发生心源性猝死,其中11例最终死亡。心源性猝死组和无心源性猝死组在性别、年龄、NYHA心功能分级、冠心病、高血压、心房颤动、慢性阻塞性肺病、慢性肾功能不全、糖尿病、术前左房内径、术前LVEDd、术前LVEF、用药和CRT-D比例间差异均无统计学意义(P>0.05),见表3。单因素Cox回归分析提示ΔQRSd和CLBBB与心源性猝死相关;多因素Cox回归分析提示ΔQRSd(HR=1.016,95%CI:1.002~1.031,P=0.024)和CLBBB(HR=0.211,95%CI:0.065~0.682,P=0.009)均是心源性猝死的预测因子,见表4。

表3 CRT后有/无心源性猝死患者的一般临床特征
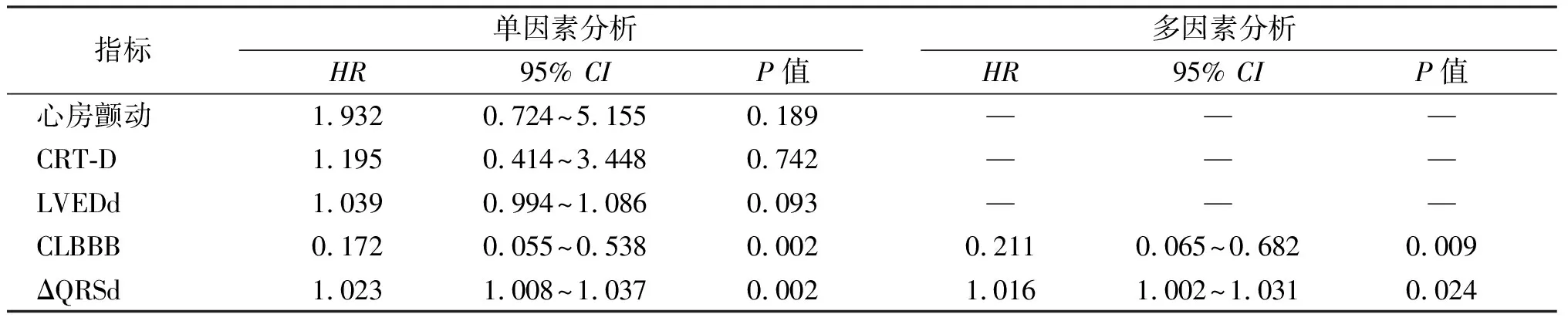
表4 CRT后心源性猝死的单因素及多因素Cox回归分析
2.3 ΔQRSd预测全因死亡及心源性猝死的最佳截断值
X-tile软件分析ΔQRSd对全因死亡和心源性猝死预测的最佳截断值均为0 ms(图1)。按ΔQRSd截断值分组,ΔQRSd>0 ms组7例,ΔQRSd≤0 ms组59例。两组在性别、年龄、NYHA心功能分级、CLBBB、冠心病、高血压、心房颤动、慢性肾功能不全、慢性阻塞性肺病、糖尿病、术前左房内径、术前LVEF、用药和CRT-D比例间差异均无统计学意义(P>0.05);ΔQRSd>0 ms组的LVEDd显著高于ΔQRSd≤0 ms组(P<0.001),术前QRSd显著小于ΔQRSd≤0 ms组(P=0.001),见表5。Kaplan-Meier生存分析显示ΔQRSd>0 ms是CRT后全因死亡、心源性猝死、5年生存率及5年心源性猝死率的预测因子(P值分别为<0.001、<0.001、0.01和<0.001),见图2。

图1 QRS时限变化对CRT后全因死亡(A)和心源性猝死(B)预测的最佳截断值

表5 QRSd增宽和不增宽患者的一般临床特征

图2 ΔQRSd变化与全因死亡、心源性猝死、5年生存率以及5年心源性猝死率的Kaplan-Meier生存分析
3 讨论
本研究显示CRT后QRSd增宽者术前LVEDd较大而QRSd较小;CRT后QRSd增宽是全因死亡和心源性猝死的独立预测因子。相比既往的研究,本研究的随访时间较长,中位随访时间达72个月,可以提供全因死亡及心源性猝死方面更为可靠的数据。本研究使用X-tile统计软件探索CRT后ΔQRSd预测全因死亡及心源性猝死的最佳截断值,更为精确可靠,能给临床工作一些启示。
QRSd联合CLBBB的标准下CRT无应答率仍较高,所以人们对新心电图指标的探索一直在进行[10]。ΔQRSd对CRT反应性的预测值得关注。一些研究发现CRT后自身QRSd变窄与心脏解剖逆重构相关,QRSd变窄程度大的患者CRT应答率较高[11-12]。本研究中也有2例CRT超反应患者术后传导阻滞消失且左室结构功能恢复至正常,提示CRT对心脏电重构、功能重构和结构重构的作用[13]。有研究提示心脏传导速度越慢,CRT后左室每搏做功增加越大[14]。本研究CRT后QRSd不增宽者术前LVEDd较小而QRSd较大,提示心肌传导速度较术后QRSd增宽者慢。尽管CRT后QRSd不增宽者LVEF的改善程度大于QRSd增宽者,但在本研究中尚未达到统计学差异。原因可能如下:① 术后QRSd的性质与既往不同。既往研究的QRSd通过缩短AV间期以排除自身融合因素[15-16]。而本研究术后QRSd为优化过AV和VV间期的QRSd。研究表明与常规设置相比,通过AV和VV进行融合优化后QRSd的缩短幅度更大,可实现更大的左室重构[17-18]。本研究中CRT后QRSd增宽者只有11%,CRT应答率高达85%(术后LVEF升高>5%),超反应率更是高达63%(术后LVEF升高≥15%或术后LVEF>45%)。② 本研究以全因死亡和心源性猝死为研究终点,ΔQRSd的截断值及分组也是以此为依据,而非左室功能学的指标。③ 左室功能学指标的改善并不等同于全因死亡和心源性猝死风险的降低。现有的研究表明CRT可以降低心力衰竭患者的全因死亡和因心力衰竭恶化死亡,但不降低心力衰竭患者心脏猝死风险[19]。无论症状、左室功能还是左室结构重构的改善都不等同于长期预后的改善[20]。部分原因为心外膜起搏可以引起 QTc增加,增加室性心律失常的风险[21]。
ΔQRSd与CRT后生存预后关系的研究远远少于ΔQRSd与CRT反应性关系的研究。尽管各研究间方法细节不同,总体而言结果提示术后QRSd较宽与不良生存预后相关。但是对于ΔQRSd的最佳截断值没有进行探索[15-16,22]。就现有文献,本研究为目前随访时间最长的探索ΔQRSd预测CRT后全因死亡及心源性猝死的研究,随访资料相对最为完整。
本研究还发现CLBBB是心源性猝死的预测因子;而在全因死亡的预测上,单因素分析有统计学差异,多因素分析未达到统计学差异。一项纳入560例CRT患者的研究平均随访了(46±28)个月,发现75.2%的CLBBB患者、36.9%的非CLBBB患者和96.9%的右室起搏患者在CRT后出现QRSd缩短(排除自身融合因素),但仅在CLBBB患者中表现出对预后的预测价值,在非CLBBB患者中QRSd缩短没有带来预后的改善[16]。而CLBBB患者中,有无电轴右偏其预后亦有差异[22]。与既往研究不同,本研究严格按照Straus标准诊断CLBBB,而非传统CLBBB标准。本研究中CLBBB患者占61%,其中95%的患者CRT后QRSd不增宽。由于病例数量的限制,尽管本研究不足以在考虑CLBBB的基础上探索ΔQRSd的预测价值,但是仍然提示CLBBB这一因素对预后有影响。
综上所述,本研究显示CRT后QRSd增宽是全因死亡和心源性猝死的独立预测因子。临床工作中,要注意术前筛选QRSd可能通过CRT改善的患者、术中将电极导线放置在合适的位置以尽可能缩短QRSd,术后通过AV和VV进行融合优化最小化QRSd。后期仍需要大样本量的研究进一步探索ΔQRSd的影响因素及其对预后的影响。

