尿酸通过下调lncRNA MIR22HG的表达促进前列腺癌细胞增殖及迁移
李安苏, 邵世和, 王秀平, 朱华姿, 胡建鹏
(1. 江苏大学医学院,江苏 镇江 212013; 2. 江苏大学附属人民医院泌尿外科,江苏 镇江 212002)
2021年全球癌症统计数据显示,前列腺癌是男性发病率第一,死亡率第二的恶性肿瘤[1],该病目前已知致病因素有遗传易感性、饮食、环境因素、慢性炎症、免疫失调等[2]。有报道指出,在良性前列腺增生患者中,高尿酸与血清前列腺特异抗原成正相关[3]。一项长期随访研究发现,高尿酸与前列腺癌的发生相关,是疾病发生的重要预测因子[4]。深入的机制研究证实[5-6],尿酸作为一种抗氧化剂,可以促进肿瘤细胞的增殖、迁移。长链非编码RNA(lncRNA)是一类长度大于200 nt的非编码RNA分子,可以在表观遗传、转录水平或转录后水平等多种层面调控基因表达,进而广泛参与肿瘤的发生发展[7]。近期越来越多的研究证明,lncRNA作为抑癌或者原癌基因,广泛参与肿瘤细胞的增殖、转移、凋亡及血管生成[8-10]。Shen等[11]研究发现lncRNA MIR22HG在前列腺癌中表达下降,且高表达的患者预后更好,这提示其可能调控前列腺癌的进展。本研究旨在探究尿酸与前列腺癌细胞MIR22HG表达的关系,并进一步分析两者在前列腺癌细胞增殖、迁移中的作用,为前列腺癌的诊治提供依据。
1 材料与方法
1.1 主要实验试剂
尿酸购自美国Sigma公司,溶于1 mmol/L的NaOH中,之后用PBS配制成5 mmol/L尿酸溶液,并用细胞培养基稀释成浓度为400 μmol/L备用。胎牛血清、DMEM均购自美国Gibco公司。pcDNA、pcDNA-MIR22HG,si-NC、si-MIR22HG购自上海吉玛公司。Lipofectamine 3000转染试剂购自美国Invitrogen公司。RNA分离试剂、CCK-8、逆转录试剂盒HiSript Ⅲ RT Super Mix、实时定量PCR试剂盒ChamQ Universal SYBR qPCR Master Mix均购自中国诺维赞公司。细胞周期蛋白D1(Cyclin D1)、细胞周期蛋白依赖性激酶抑制因子(P21)、细胞周期蛋白依赖性激酶4(CDK4)、GAPDH兔抗人一抗和HRP标记的羊抗兔二抗均为美国Proteintech公司产品。
1.2 细胞培养与处理
前列腺癌DU145细胞购自上海细胞库,并培养于含10%胎牛血清的DMEM中,培养条件为37 ℃、5% CO2,以 1×106个/孔接种于 6 孔培养板,待细胞融合度达70%~80% 时,进行后续实验。根据文献报道[12]和前期预实验结果,选取400 μmol/L尿酸用于后续研究中处理DU145细胞。
对照组用上述高糖培养基培养,尿酸处理组加入含400 μmol/L尿酸的培养基,处理48 h后进行后续实验。
转染组细胞按说明使用Lipofectamine 3000试剂进行转染,按分组每孔加入10 μL si-MIR22HG或si-NC,2.5 μg pcDNA或 pcDNA-MIR22HG,待培养48 h后收集RNA、蛋白及细胞行后续研究。si-MIR22HG序列为CCCUUAGCAAACCAUAACATT,si-NC序列为UUCUCCGAACGUGUCACGUTT。
pcDNA-MIR22HG过表达+尿酸刺激实验分组:pcDNA组(转染pcDNA)、UA+pcDNA组(转染pcDNA+400 μmol/L尿酸)和UA+pcDNA-MIR22HG组(转染pcDNA-MIR22HG+400 μmol/L尿酸),待培养48 h后收集RNA、蛋白及细胞行后续研究。
1.3 CCK-8法检测前列腺癌DU145细胞的增殖能力
按照“1.2”中的方法处理细胞后,收集各组细胞,以2×103/孔接种到96孔板培养12 h后,更换培养液,在相应组中加入400 μmol/L尿酸培养48 h后,加入10 μL CCK8孵育1 h,在酶标仪450 nm处测量光密度(D)值。
1.4 蛋白质印迹法检测细胞周期相关蛋白表达水平
收集各组前列腺癌DU145细胞,用RIPA裂解液提取细胞总蛋白,BCA法检测蛋白质浓度。蛋白质变性后进行SDS-PAGE,80 V 1 h后增加电压至120 V再电泳1 h; 300 mA转膜2 h后,将凝胶分离的蛋白质转移到PVDF膜上。PVDF膜洗涤后5%脱脂牛奶封闭1 h;分别加入兔抗人Cyclin D1(1 ∶1 000)、P21(1 ∶1 000)、CDK4(1 ∶1 000)、GAPDH(1 ∶1 500)一抗,4 ℃孵育过夜。洗膜4次,每次15 min,加HRP标记的羊抗兔二抗(1 ∶2 000)室温孵育1 h,TBST洗膜4次,每次15 min,洗膜完毕后加入ECL发光底物曝光。
1.5 qRT-PCR检测前列腺癌DU145细胞中MIR22HG表达水平
使用RNA分离试剂提取细胞总RNA,NanoDrop 3000检测RNA浓度。之后使用HiSript Ⅲ RT Super Mix两步法逆转录试剂将提取的RNA逆转录成cDNA,ChamQ universal SYBR qPCR Master Mix进行qPCR,反应条件:95 ℃ 1 min,95 ℃ 15 s,55 ℃ 30 s,72 ℃ 30 s;共40个循环。GAPDH作为内参。MIR22HG引物序列:上游5′-TGGAGACCAGTGAAGGACCA-3′,下游5′-ACATCTCGGAGGCAGAA-AGC-3′;GAPDH引物序列:上游5′-GCACCGTCAAGGCTGAGAAC-3,下游5′-TGGTGAAGACGCCAGTGGAC-3′。通过2-ΔΔCt方法计算MIR22HG相对表达量。
1.6 Transwell法检测前列腺癌DU145细胞的迁移能力
收集各组DU145细胞,使用无血清DMEM重悬细胞,调整细胞密度为2×105个/mL。选择直径8 μm的Transwell小室进行实验,上室加入200 μL细胞悬液,下室加入含10%胎牛血清的培养基。孵育48 h后取出小室,使用4%多聚甲醛固定,0.1%结晶紫染色,最后在光学显微镜下计数穿膜细胞并统计。
1.7 统计学分析

2 结果
2.1 尿酸促进前列腺癌DU145细胞的增殖及迁移能力
CCK-8检测结果显示,400 μmol/L尿酸可以明显促进DU145细胞的增殖(t=7.45,P<0.01)。蛋白质印迹结果显示,400 μmol/L尿酸处理后DU145细胞Cyclin D1(t=9.22,P<0.01)和CDK4蛋白表达明显升高(t=16.91,P<0.01),P21蛋白表达明显降低(t=10.77,P<0.01)。Transwell检测结果显示,与对照组相比,尿酸处理组DU145细胞的迁移细胞数显著增多(t=24.61,P<0.01)。见图1。
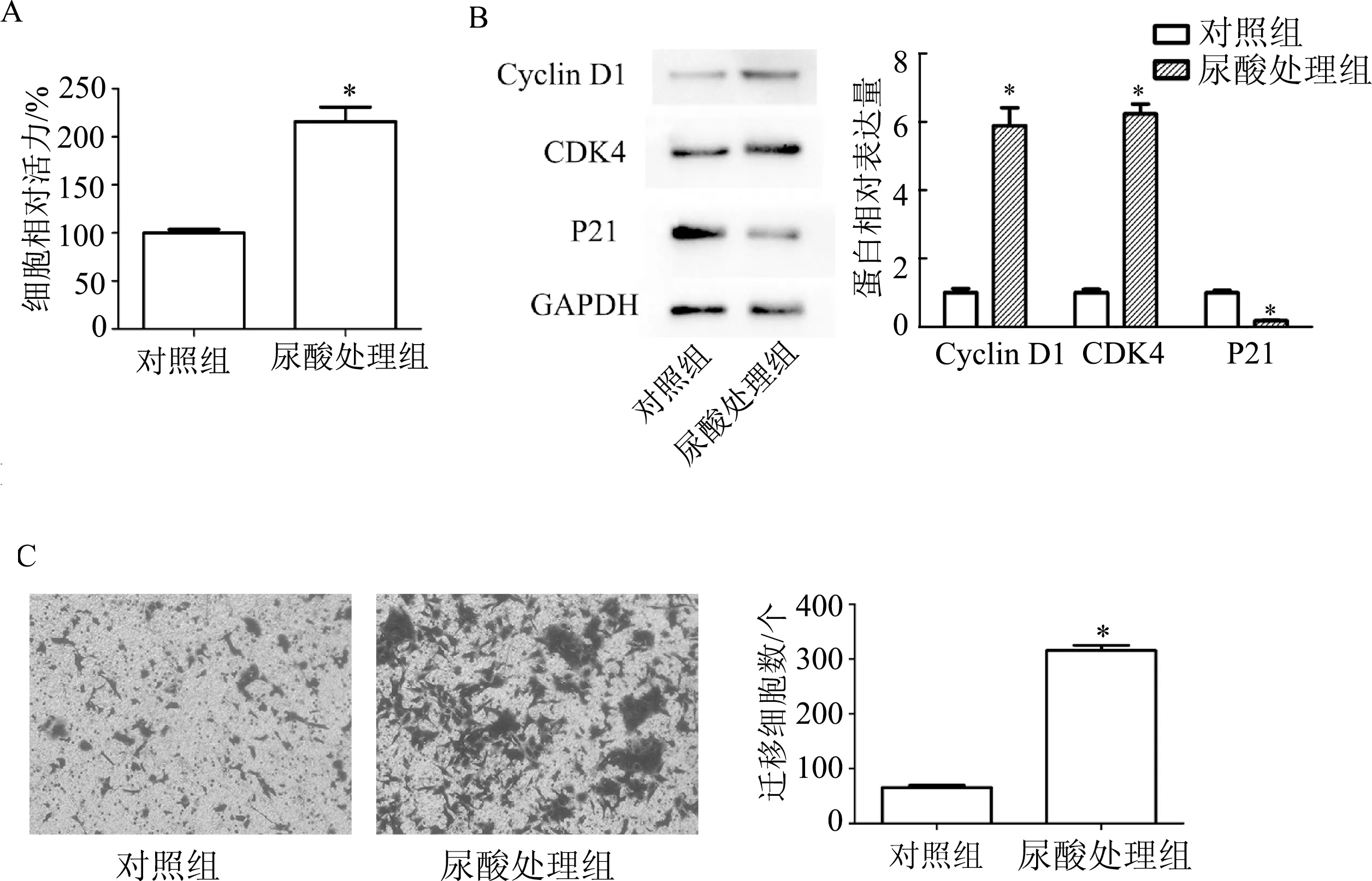
A: CCK-8检测细胞增殖能力;B:蛋白质印迹检测细胞周期相关蛋白;C:Transwell检测细胞迁移能力(×200)。*:P<0.01,与对照组比较
2.2 尿酸下调前列腺癌DU145细胞中MIR22HG的表达水平
用400 μmol/L的尿酸处理DU145细胞48 h后,qRT-PCR检测结果显示,尿酸处理组DU145细胞中MIR22HG相对表达量较对照组明显下降(t=10.16,P<0.01)。见图2。
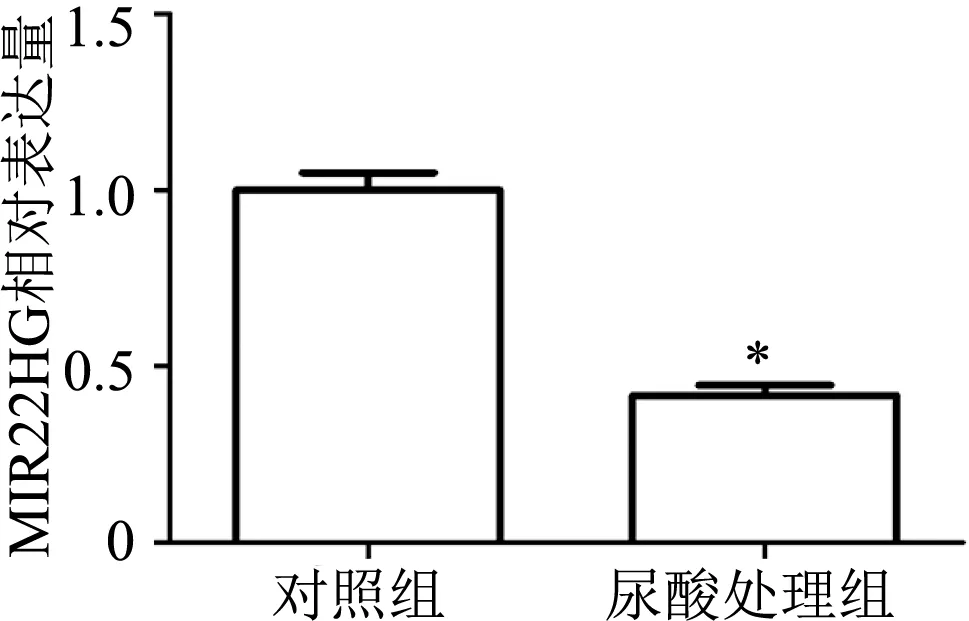
*:P<0.01,与对照组比较
2.3 过表达MIR22HG抑制前列腺癌DU145细胞增殖和迁移
与pcDNA组相比,转染MIR22HG过表达质粒后,MIR22HG表达显著升高(t=4.96,P<0.01);细胞增殖能力明显降低(t=6.76,P<0.01);Cyclin D1(t=8.39,P<0.01)和CDK4(t=8.49,P<0.01)表达明显降低,P21表达明显升高(t=7.34,P<0.01);迁移细胞数明显减少(t=7.97,P<0.01)。见图3。
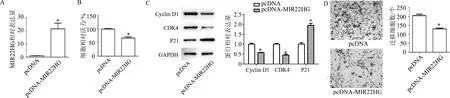
A:qRT-PCR检测细胞内MIR22HG表达水平;B: CCK-8检测细胞增殖能力;C:蛋白质印迹检测细胞周期相关蛋白;D:Transwell检测细胞迁移能力(×200)。*:P<0.01,与pcDNA组比较
2.4 敲减MIR22HG促进前列腺癌DU145细胞增殖和迁移
转染48 h后检测结果显示,与si-NC组相比,转染si-MIR22HG后,MIR22HG表达显著降低(t=5.43,P<0.01);细胞增殖能力明显升高(t=6.14,P<0.01);Cyclin D1(t=8.23,P<0.01)和CDK4蛋白(t=5.53,P<0.01)表达明显升高,P21蛋白表达明显降低(t=6.13,P<0.01);迁移细胞数明显增多(t=7.29,P<0.01)。见图4。
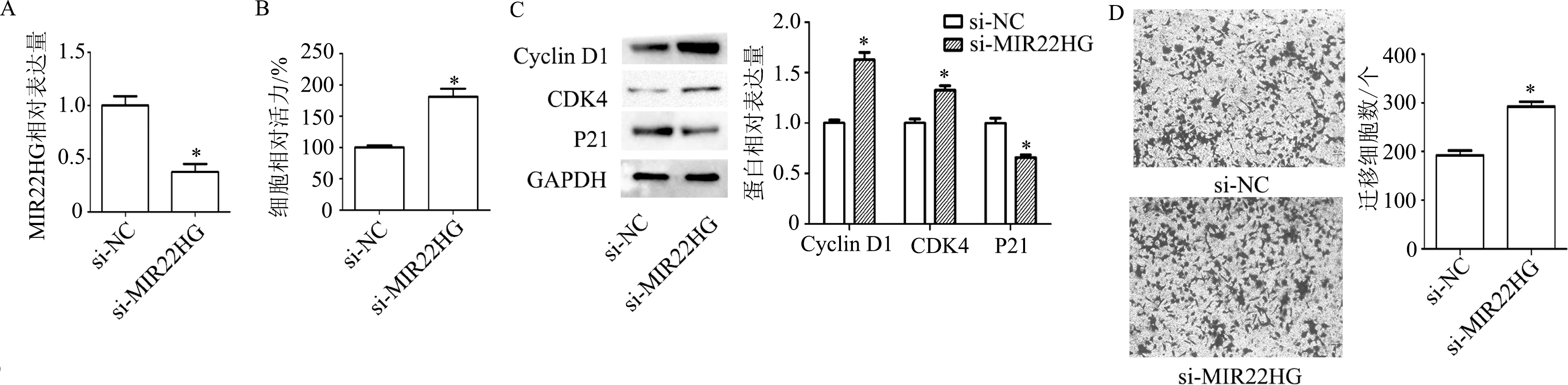
A:qRT-PCR检测细胞内MIR22HG表达水平;B: CCK-8检测细胞增殖能力;C:蛋白质印迹检测细胞周期相关蛋白表达;D:Transwell检测细胞迁移能力(×200)。*:P<0.01,与si-NC组比较
2.5 过表达MIR22HG可以逆转尿酸对DU145细胞增殖及迁移能力的促进作用
转染48 h后结果显示,与UA+pc-DNA组相比,UA+pcDNA-MIR22HG组细胞增殖能力明显下降(F=44.83,P<0.01);Cyclin D1和CDK4表达明显降低,P21表达明显升高(F值分别为25.29、43.80、12.66,P均<0.01);迁移细胞数明显减少(F=26.80,P<0.01)。见图5。
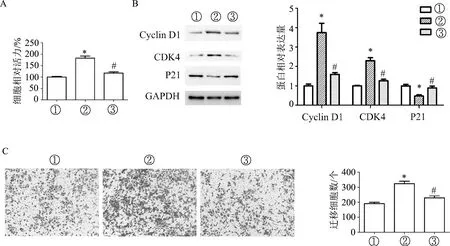
A:CCK-8检测细胞增殖能力;B:蛋白质印迹检测细胞周期相关蛋白的表达水平;C:Transwell检测细胞迁移能力(×200)。①: pcDNA组; ②: UA+pcDNA组; ③: UA+pcDNA-MIR22HG组。*:P<0.01,与①比较;#:P<0.01,与②比较
3 讨论
尿酸是嘌呤代谢途径的最终产物,具有多种生物活性,可通过调控氧化应激、慢性炎症,进而在肿瘤发生发展中发挥重要调控作用[4]。另一方面,尿酸作为促氧化剂,通过进入正常细胞促进肿瘤细胞的增殖及迁移,在活性氧和炎症应激的介导下,促进肿瘤的发生[5-6]。尿酸与多种肿瘤的发生、预后、进展密切相关。研究表明,肝癌患者尿酸升高,提示预后不良[13]。尿酸可作为胰腺癌诊断和预后的生物标志物,其水平升高与患者死亡率升高密切相关[14]。高尿酸可作为头颈部癌诊断的分子标志物,且与患者不良预后相关[15]。在前列腺癌的研究中,尿酸的作用机制并不明确。Kolonel等[16]通过对7889名男性的10年随访,发现高尿酸与前列腺癌的发生呈正相关。Hammarsten等[17]的研究证明尿酸是前列腺癌发生的危险因素之一。与此同时,也有一些临床随访数据指出,尿酸可能与前列腺癌的发生无关[18],甚至在前列腺癌的发展中发挥保护作用[19]。尿酸在前列腺癌研究中的矛盾结果,可能与临床样本的选择差异、统计方法的不同相关。本研究结果显示,尿酸刺激后,前列腺癌细胞的增殖及迁移能力显著增强,这也证实了尿酸对前列腺癌的促进作用。此结果为靶向尿酸用于前列腺癌的临床治疗提供了新的理论依据,然而尿酸调控前列腺癌细胞增殖、迁移的相关分子机制尚未明确。
近年来,随着高通量测序技术的开展,大量的非编码RNA(ncRNAs)被发现。随着对其功能的深度探索,研究者发现这些ncRNAs可以调控机体的生理、病理进程[20]。LncRNA是ncRNA中的重要一员,其转录本长度超过200个核苷酸。研究发现,lncRNA具有组织和细胞特异性,其表达受到精确调节,在肿瘤的发生发展中发挥重要作用[10]。张鹤腾等[9]发现lncRNA SPATA3-AS1在胃癌组织中高表达,且其表达水平与胃癌淋巴结转移及肿瘤TNM分期相关。敲减lncRNASPATA3-AS1后胃癌细胞增殖、迁移及侵袭等能力减弱。Li等[21]通过体内体外实验证明,lncRNA-DLEU2在进展期前列腺癌组织中表达升高,且与患者预后呈负相关,其能够靶向miR-582-5p-SGK1信号轴,进而促进前列腺癌细胞的增殖、侵袭和迁移。近期,一系列研究指出MIR22HG在肿瘤中发挥重要的抑癌作用。MIR22HG低表达预示肝癌患者临床预后较差[22]。MIR22HG在乳腺癌中呈低表达,上调其表达可以抑制乳腺癌细胞的增殖与迁移[23]。与正常结肠组织相比,癌组织内MIR22HG表达下调,且过表达MIR22HG可以促进T细胞浸润进而增强结肠癌免疫治疗的疗效[24]。MIR22HG作为一种重要的抑癌因子,其与前列腺癌的研究较少。Shen等[11]通过生物信息学分析发现,MIR22HG在前列腺癌组织中表达下降,且与前列腺癌患者生存预后相关。本研究证明MIR22HG是调控前列腺癌细胞的关键分子,过表达MIR22HG可以抑制前列腺癌细胞的增殖和迁移能力,而敲减MIR22HG可以促进其增殖和迁移能力。尿酸是否通过影响MIR22HG而发挥促进前列腺癌增殖和迁移的作用尚无报道。在我们的研究中,尿酸处理后,前列腺癌细胞内MIR22HG的表达降低,表明尿酸对MIR22HG具有负调控作用。进一步实验结果提示过表达MIRR22HG后,尿酸对前列腺癌细胞增殖和迁移能力的促进作用被逆转。
综上所述,本研究初步证明MIR22HG是参与调控尿酸诱导前列腺癌细胞增殖和迁移的重要分子,然而尿酸作为调控肿瘤的重要因素,除了lncRNA,其下游可能有多种分子的参与。同时,lncRNA具有复杂的调控模式,MIR22HG具体通过调控何种分子,也有待于进一步的探索。

