白蛋白结合型紫杉醇联合顺铂化疗对中晚期宫颈癌患者的影响
孙 艳
江西省九江市第三人民医院妇科 332004
宫颈癌确诊时,多处于中晚期,具有肿瘤体积较大、复发转移率高、切除较困难等特点,使后续治疗效果不理想,为延长生存期,多行化疗治疗,可使肿块缩小,最大限度杀灭转移的肿瘤细胞、清除肿瘤组织。顺铂为细胞周期的非特异性药物,可抑制癌细胞DNA复制过程,并损伤其细胞膜上的结构,有较强的广谱抗癌作用,但易在体内蓄积产生肾毒性,因此,常联合紫杉醇脂质体(L-PTX)进行化疗治疗,L-PTX吸收率较高,可有效杀死局部肿瘤及转移瘤细胞,但靶向性及生物利用度较低,不能有效抑制肿瘤血管新生,降低其恶性程度[1]。白蛋白结合型紫杉醇(Nab-PTX)是白蛋白(Nab)—紫杉醇(PTX)复合物,以Nab为介导,通过利用肿瘤摄取营养的生物机制,使药物聚集到肿瘤部位,提高其细胞中PTX浓度,联合顺铂化疗应用于中晚期宫颈癌患者可能会有效抑制血管新生,降低肿瘤恶性程度。基于此,本文探讨了Nab-PTX 联合顺铂化疗应用于中晚期宫颈癌患者对血管新生指标的影响,报道如下。
1 资料与方法
1.1 一般资料 经医院伦理委员会批准,患者及家属签署知情同意书,选取2019年2月—2021年3月于我院就诊的宫颈癌患者72例,按随机数字表法分为对照组和观察组,各36例。对照组:年龄36~54岁,平均年龄(44.13±5.27)岁;体重44~73(59.12±6.37)kg;肿瘤分期:中期26例,晚期10例。观察组:年龄35~53岁,平均年龄(44.06±5.21)岁;体重46~75(60.35±6.47)kg;肿瘤分期:中期24例,晚期12例。两组上述资料对比差异无统计学意义(P>0.05),具有可比性。纳入标准:(1)符合宫颈癌诊断标准[2];(2)处于宫颈癌中晚期;(3)首次入院治疗。排除标准:(1)对辅助治疗药物过敏者;(2)合并梅毒、乙肝等传染性疾病;(3)有宫颈癌手术史者。
1.2 方法 对照组患者给予L-PTX(南京绿叶制药,H20030357,30mg/瓶)联合顺铂化疗:L-PTX总剂量为175mg/m2,静滴,滴注时间>3h;顺铂注射液(锦州九泰,H21020213,10mg/支)总剂量为60mg/m2,充分水化后输注,滴注时间>1h。观察组患者给予Nab-PTX(江苏恒瑞医药,H20183378,30mg/瓶)联合顺铂化疗:Nab-PTX总剂量为175mg/m2,静脉输注时预先配置Nab-PTX 100mg与0.9%氯化钠液20ml,静滴时间>0.5h,患者无明显不适后,将75mg Nab-PTX与0.9%氯化钠液以5∶1比例配置,输注0.5h。顺铂用法同对照组。两组均以21d为1个疗程,治疗2个疗程,观察至手术开始。
1.3 观察指标 (1)血管新生指标:于化疗前、化疗6周后,次日抽取患者空腹静脉血10ml,离心机(济南来宝医疗,DD-5M)分离得血清,使用全自动化学分析仪(深圳艾伟迪,AFS-1000),采用放射免疫法测定基质金属蛋白酶-9(MMP-9)、血管内皮生长因子(VEGF)、缺氧诱导因子-1α(HIF-1α)水平。(2)肿瘤标志物指标:于化疗前、化疗6周后,同上离心,使用酶标分析仪(青岛聚创环保集团,JC-1086A)及配套试剂盒,行酶联免疫吸附实验(ELISA)测定癌胚抗原(CEA)、鳞状上皮细胞癌抗原(SCC-Ag)、细胞角蛋白19片段抗原(CYFRA21-1)、糖类抗原125(CA125)水平。(3)免疫应答指标:于化疗前、化疗6周后,次日抽取患者空腹静脉血3ml,使用流式细胞仪(贝克曼,CytoFLEX)测定辅助性T细胞17(Th17)细胞比率、调节性T细胞(Treg),计算Th1/Treg比值。(4)不良反应:对比两组化疗期间骨髓抑制、恶心呕吐、周围神经症状、过敏反应等发生情况。

2 结果
2.1 两组血管新生指标对比 化疗后观察组MMP-9、VEGF、HIF-1α水平低于对照组(P<0.05),见表1。
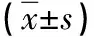
表1 两组血管新生指标对比
2.2 两组肿瘤标志物指标对比 化疗后观察组CEA、CYFRA21-1、CA125、SCC-Ag水平低于对照组(P<0.05),见表2。

表2 两组肿瘤标志物指标对比
2.3 两组免疫应答指标对比 化疗后观察组Treg水平低于对照组,Th17、Th17/Treg水平高于对照组(P<0.05),见表3。
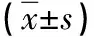
表3 两组免疫应答指标对比
2.4 两组不良反应发生情况对比 两组骨髓抑制、恶心呕吐、周围神经症状、过敏反应等不良反应发生率对比差异无统计学意义(P>0.05),见表4。

表4 两组不良反应发生情况对比[n(%)]
3 讨论
宫颈癌早期症状不明显,出现症状时多处于中晚期,由于恶性程度较高,肿瘤常发生转移,因此,常行化疗治疗以降低肿瘤恶性程度,延长生存周期。L-PTX是PTX以脂质体作为载体的化疗药物,组织相容性与细胞亲和力强,可有效抑制干细胞有丝分裂,阻止肿瘤增殖,但生物利用度差,且肿瘤细胞中血药浓度低,不能达到有效抑制肿瘤血管新生及降低肿瘤负荷作用[3]。有研究发现[4],相比于L-PTX,选用Nab-PTX进行化疗头颈肿瘤的疗效更好,不良反应发生率更低。
MMP-9、VEGF、HIF-1α与肿瘤的血管新生过程有关,HIF-1α可诱导VEGF转录,促进血管内皮细胞增殖以及新生血管形成,同时诱导MMP-9生成,两者共同作用促进肿瘤内部血管增生[5]。CEA、CYFRA21-1、CA125、SCC-Ag等指标与肿瘤恶性程度有关。本文结果显示,化疗后观察组MMP-9、VEGF、HIF-1α水平及CEA、CYFRA21-1、CA125、SCC-Ag水平低于对照组(P<0.05),说明Nab-PTX 应用于中晚期宫颈癌患者化疗治疗可有效抑制肿瘤血管新生,降低肿瘤恶性程度。PTX属于四环二萜类化合物,通过结合游离微管蛋白,促进微管蛋白装配、抑制微管解聚而阻止肿瘤细胞有丝分裂过程,导致细胞凋亡;并可限制肿瘤血管生成、诱导相关细胞因子表达而抑制肿瘤细胞生长[6]。Nab-PTX是PTX以Nab为载体,Nab主要功能是运输营养物质,可通过肿瘤摄取营养物质时,增加对PTX的吸收,使肿瘤细胞中PTX浓度升高,加强对其血管新生的抑制作用,进而降低肿瘤恶性程度。
Treg、Th17参与细胞免疫耐受调节,Th17/Treg的平衡失调与肿瘤恶性程度增加有关。本文结果显示,化疗后观察组Treg低于对照组,Th17、Th17/Treg高于对照组(P<0.05),说明Nab-PTX可抑制肿瘤Th17/Treg细胞偏移,防止肿瘤免疫逃逸,减轻肿瘤负荷。Treg和Th17细胞通过诱导免疫抑制和血管生成促进肿瘤进展。朱冰鸥等人[7]的研究显示,Nab-PTX 化疗用于中晚期宫颈癌患者可缓解免疫抑制状态,促进Th17/Treg平衡恢复,降低免疫耐受性,发挥抗肿瘤作用,本文结果与之相似。
本文结果显示,两组周围神经症状、恶心呕吐、骨髓抑制、过敏反应等不良反应发生率对比差异无统计学意义(P>0.05),说明Nab-PTX应用于中晚期宫颈癌患者化疗治疗不会增加不良反应。Nab-PTX是130nm的Nab与PTX复合物,进入体内后会分解为10nm的小分子,通过白蛋白介导的胞吞作用进入体内,降低了对正常组织的毒性作用,因此不会导致严重不良反应的发生。温娜等人[8]的研究显示,Nab-PTX用于治疗晚期和复发子宫颈癌,Nab-PTX骨髓抑制、周围神经症状、过敏反应不良反应发生率均低于L-PTX,本文结果与之不符,可能是由于样本量较少及纳入对象之间存在差异导致的。
综上所述,Nab-PTX 联合顺铂化疗应用于中晚期宫颈癌患者中,可抑制血管新生,促进Th17/Treg平衡恢复,降低肿瘤恶性程度,改善机体炎症状态,并且不会增加不良反应,安全性较好。

