瑞巴派特辅助四联疗法对Hp相关性十二指肠溃疡患者肽类胃肠激素、胃蛋白酶原及MMP-9水平的影响
耿红芳,靳永辉,黄琮超,于泳
(鹤壁市人民医院 1.消化内科;2.核医学科;3.内科,河南 鹤壁 458030)
十二指肠溃疡(duodenal ulcer,DU)是由于胃酸、胃蛋白酶、幽门螺杆菌(helicobacter pylori,Hp)感染等引起发生于十二指肠部位的黏膜性病变。目前,临床上对于Hp 相关性DU 患者的治疗多应用四联疗法,可调节胃肠激素水平,但远期效果不理想[1]。研究表明,瑞巴派特可改善Hp 相关性DU 患者的免疫水平,调节胃内分泌情况[2]。本研究旨在探索瑞巴派特辅助四联疗法对Hp 相关性DU 患者肽类胃肠激素、胃蛋白酶原及基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)水平的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取鹤壁市人民医院2019 年2 月至2021 年2月89 例Hp 相关性DU 患者为研究对象,依据治疗方式不同分为四联组和联合组。四联组44 例,其中男29 例,女15 例;年龄31~47 岁,平均(38.00±3.67)岁;病程4~11 个月,平均(7.00±2.35)个月;溃疡直径1~2 cm,平均(1.62±0.15)cm。联合组45 例,其中男32 例,女13例;年龄31~45 岁,平均(37.00±3.75)岁;病程3~11 个月,平均(6.00±2.43)个月;溃疡直径1~2 cm,平均(1.57±0.21)cm。两组基线资料比较,差异无统计学意义(P>0.05),具有可比性。
纳入标准:①符合《消化性溃疡诊断与治疗规范(2016 年,西安)》[3]中DU 的诊断标准;②经胃镜、X 线钡餐等检查确诊;③均有Hp 感染;④患者及其家属均签署知情同意书等。排除标准:①胃或食道溃疡;②消化系统恶性肿瘤;③既往接受抗Hp 药物治疗;④精神障碍等。
1.2 方法
1.2.1 四联组 给予接受四联疗法治疗。行阿莫西林胶囊(珠海联邦制药股份有限公司中山分公司,国药准字H44021351,规格:250 mg/粒)口服治疗,4 粒/次,2 次/d;胶体果胶铋胶囊(山西振东安特生物制药有限公司,国药准字H20058476,规格:100 mg/粒)口服治疗,2 粒/次,2 次/d;泮托拉唑钠肠溶胶囊(湖南九典制药股份有限公司,国药准字H20093501,规格:40 mg/片)口服治疗,1 片/次,2 次/d;克拉霉素片(西安利君制药股份有限公司,国药准字H10960187,规格:250 mg/片)口服治疗,2 片/次,2 次/d。
1.2.2 联合组 增加瑞巴派特治疗。行瑞巴派特胶囊(重庆圣华曦药业股份有限公司,国药准字H20110123,规格:100 mg/粒)口服治疗,1 粒/次,3 次/d。
两组均持续治疗1 个月。
1.3 观察指标
①Hp 根除情况:比较两组治疗1 月末Hp 根除情况。应用碳14-尿素呼气试验,采集患者服用碳14 标记的尿素胶囊后呼出二氧化碳的量来检测是否Hp 感染,若大于100 则为阳性,即Hp 感染。②血清肽类胃肠激素及胃蛋白酶原:比较两组治疗前、治疗1 月末血清肽类胃肠激素及胃蛋白酶原。抽取患者清晨空腹静脉血5 mL,2 900 r/min 离心10 min,分离血清,应用酶联免疫吸附法测定胆囊收缩素(CCK)、血管活性肠肽(VIP)、生长抑素(SS)、肾上腺髓质素(AM)、胃蛋白酶原Ⅰ(PG Ⅰ)、胃蛋白酶原Ⅱ(PG Ⅱ)水平。③血清炎性因子:比较两组治疗前、治疗1月末血清炎性因子水平。抽取适量血清标本,采用酶联免疫吸附法测定白细胞介素-18(IL-18)、白细胞介素-1β(IL-1β)、可溶性血管细胞黏附分子-1(sVCAM-1)、MMP-9 水平。
1.4 统计学方法
参照SPSS26.0 统计学软件进行数据分析,以均数±标准差()表示计量资料,比较以t检验,采用百分率(%)表示计数资料,比较以χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 Hp 根除情况
四联组Hp 阴性32 例,联合组Hp 阴性41 例。联合组Hp 清除率91.11%(41/45)高于四联组72.73%(32/44),差异有统计学意义(χ2=3.929,P=0.048)。
2.2 两组血清肽类胃肠激素及胃蛋白酶原比较
两组治疗1 月末CCK、VIP、AM、PG I、PGⅡ水平较治疗前降低,联合组低于四联组;SS 水平较治疗前升高,联合组高于四联组,差异有统计学意义(P<0.05)。见表1。
表1 两组血清肽类胃肠激素及胃蛋白酶原比较()
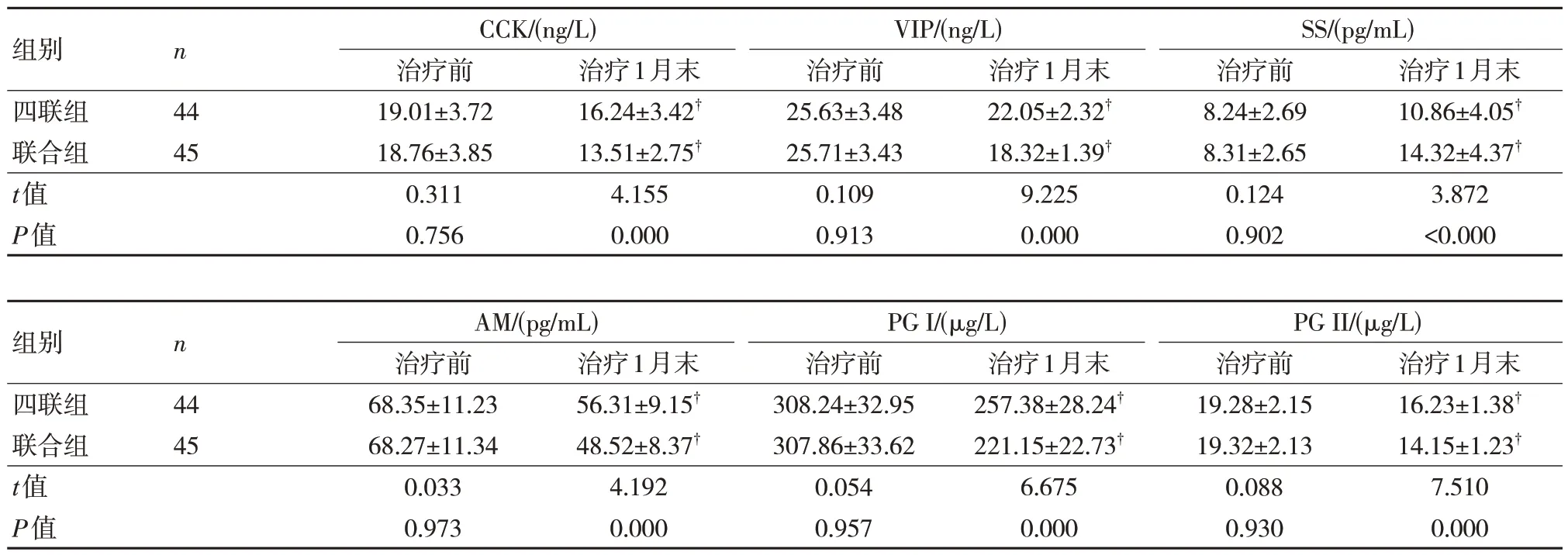
表1 两组血清肽类胃肠激素及胃蛋白酶原比较()
注:†与同组治疗前比较,P<0.05。
2.3 两组血清炎性因子比较
两组治疗1 月末sVCAM-1、MMP-9、IL-18、IL-1β 水平较治疗前降低,联合组低于四联组,差异有统计学意义(P<0.05)。见表2。
表2 两组血清炎性因子比较()

表2 两组血清炎性因子比较()
注:†与同组治疗前比较,P<0.05。
3 讨论
DU 属于消化性溃疡,是消化系统的常见疾病,多发生于十二指肠球部,发病率高于胃溃疡,多见于青壮年男性,Hp 感染为引起DU 的重要原因之一。现临床上对于Hp 相关性DU 患者的治疗,常应用四联疗法,可改善胃窦黏膜炎症程度,但Hp 根除效果较不理想[4]。研究指出,瑞巴派特可减轻Hp 相关性DU 患者的腹痛情况,促进溃疡愈合[5]。
由于DU 患者黏膜屏障受损,而Hp 可定植于胃黏膜上,并具有很强的定植能力,其对巨噬细胞等免疫细胞的活化具有诱导作用,促进促炎因子释放,加重溃疡。四联疗法对胃黏膜壁细胞H+-K+-ATP 酶的活性具有抑制作用,降低胃酸的分泌,促进溃疡愈合,但抗菌药物反复应用,致使Hp 变异风险增加,不利于Hp 清除[6]。瑞巴派特可提高消化道黏膜的血液流量,促进消化道黏液蛋白的生长,增加胃黏液分泌,对胃黏膜具有保护作用;并能刺激防御因子合成,降低侵袭因子释放,降低胃黏膜侵害;并竞争Hp 在消化道黏膜的附着点,使消化道黏膜环境不利于Hp 生长,降低Hp感染,提高Hp 清除效果[7]。研究显示联合组Hp清除率高于四联组,表明瑞巴派特辅助四联疗法可改善Hp 清除率。
结果显示联合组治疗1 月末CCK、VIP、AM、PG Ⅰ、PG Ⅱ水平低于四联组;SS 水平高于四联组,表明瑞巴派特辅助四联疗法可调节肽类胃肠激素及胃蛋白酶原水平。Hp 产生的尿素及氨可使胃蛋白酶消化作用减弱。应用四联疗法可在黏膜表面形成一层物理性保护膜,利于黏膜细胞恢复,促进溃疡愈合,间接调节胃蛋白酶原的表达,但长期应用可能致使耐药性增强,致使肽类胃肠激素水平的调节效果一般[8]。SS 可作用于G 细胞,对胃泌素的分泌发挥调节作用,其水平降低可促使溃疡的诱发甚至加重。AM 水平过高,可对内皮素的血管收缩发挥拮抗作用,不利于溃疡的愈合。而瑞巴派特可促进前列腺素E2 合成,利于胃黏膜上皮细胞再生,促使黏膜基底细胞向表面移行,利于蛋白合成,促进溃疡愈合,从而间接调节SS和AM 水平,并调节胃肠动力,改善VIP、CCK水平;且其可对丝裂原激活蛋白激酶及环氧化酶-2的表达进行调节,利于前列腺素E2 合成,从而增强胃黏膜屏障,降低因PG I、PG II 过量分泌而进入外周循环的几率,从而调节血清PG I、PG II水平[9]。
四联疗法应用阿莫西林、克拉霉素等抗生素,并配合泮托拉唑质子泵抑制剂,调节胃内PH 值,发挥抗菌作用,避免因Hp 产生的尿素及氨引起的高酸环境,减轻十二指肠炎症,但长期应用,可能出现恶心、腹部不适等发生[10]。联合瑞巴派特,虽然增加药物不良反应风险,但其为一种胃黏膜保护药,可对胃黏膜进行多靶点作用,对表皮生长因子的信号途径发挥调节作用,推动表皮生长因子以及受体的表达,促进机体氧自由基的清除,并可对络氨酸激酶进行激活,推动溃疡边缘表皮细胞的增殖、分化进程,利于胃肠黏膜发育、修复,提高黏膜上皮屏障作用;上调丝裂原激活蛋白激酶信号途径,刺激前列腺素和热休克蛋白表达,诱导一氧化氮合酶mRNA 的表达,对中性粒细胞的活化具有拮抗作用,抑制致炎因子分泌,进而调节炎性因子水平[11]。结果发现联合组治疗1 月末sVCAM-1、MMP-9、IL-18、IL-1β 水平低于四联组,表明瑞巴派特辅助四联疗法可调节血清炎性因子水平。
综上所述,瑞巴派特辅助四联疗法治疗Hp 相关性DU 患者,可调节血清炎性因子水平,提高Hp 清除效果,改善血清肽类胃肠激素及胃蛋白酶原水平,疗效优于四联疗法治疗,值得临床推广应用。

