完全腹腔镜胃癌根治术联合基于量化评估策略的 护理干预在胃癌患者治疗中的应用效果
孔荷香,芮鸿庆
(南京市高淳人民医院胃肠外科,江苏 南京 211300)
胃癌是源于胃黏膜上皮细胞的恶性肿瘤,通常与幽门螺杆菌感染、生活作息不规律等有关。当前临床对于胃癌的治疗多以腹腔镜辅助胃癌根治术(LAG)为主,其属于微创术式,可有效减少术中出血量,但对肿瘤组织切除后消化系统各离断组织的吻合效果不佳;而完全腹腔镜胃癌根治术(TLG)避免了因LAG手术视野暴露不佳而引起的吻合口过度牵拉问题,且该项手术未切断肠管,患者肠管神经的传递性得以保留,在吻合消化系统各组织间更具优势,目前已被逐步应用于临床胃肠外科的治疗中[1]。此外,基于量化评估策略的护理干预可通过对患者临床症状与实验室、影像检查结果等各方面进行综合评估,并列出患者当下最迫切的护理需求,对促进患者术后恢复具有一定作用[2]。基于此,本研究主要分析TLG联合基于量化评估策略的护理干预对胃癌患者术后恢复的影响,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析南京市高淳人民医院2019年10月至2021年10月期间收治的128例进行胃癌根治术的患者的临床资料,根据不同手术方法分为两组。腹腔镜组(64例)中男、女患者分别为34、30例;年龄35~68岁,平均(47.64±2.16)岁;体质量指数(BMI)19~24 kg/m2,平均(22.26±0.28) kg/m2;胃癌分型:腺癌45例,鳞癌19例。完全腹腔镜组(64例)中男、女患者分别为33、31例;年龄34~69岁,平均(47.77±2.70)岁;BMI 19~24 kg/m2,平均(22.23±0.25) kg/m2;胃癌分型:腺癌47例,鳞癌17例。两组患者一般资料比较,差异无统计学意义(P>0.05),组间可比。纳入标准:符合《肿瘤内科疾病临床诊疗学》[3]中的相关诊断标准,且经病理学检查确诊为胃癌者;肿瘤分期不超出Ⅲ期,且未发生远处转移者;术前3个月内无放疗、化疗治疗史者等。排除标准:伴急性胰腺炎、肠梗阻等疾病者;免疫功能低下者等。本研究经院内医学伦理委员会批准,所有患者均签署知情同意书。
1.2 研究方法
1.2.1 手术方法腹腔镜组患者实施LAG:行全身麻醉后,建立二氧化碳气腹,压力设置为12~15 mmHg(1 mmHg=0.133 kPa),然后于左侧腋前线肋缘2 cm处作一10 mm 穿刺孔作为主操作孔,另外,分别于脐下、左锁骨中线平脐1 cm处作10 mm、5 mm穿刺孔作为观察孔与辅助操作孔,完成后置入腹腔镜,探查机体肿瘤大小、位置、有无近处转移及与周围组织的关系后,彻底清扫胃系膜游离和淋巴结,完成D2根治术。然后在剑突下8 cm处作一4 cm的辅助切口,分离胃周血管,并清扫淋巴结,切断十二指肠,采用超声刀于残胃大弯与十二指肠处各开一小孔,并吻合残胃与十二指肠,完成消化道吻合,常规留置引流管,逐层缝合切口。完全腹腔镜组患者实施TLG:术前操作、病灶组织游离、病灶切除、淋巴清扫与腹腔镜组一致,完成D2根治术后,将脐下切口延长至3 cm,充分游离十二指肠,置入直线切割闭合器,离断待切除的胃体、十二指肠及近端胃体,于残胃大弯处与十二指肠后壁处各作一小切口,上提空肠,在腹腔镜下,使用直线切割闭合器将残胃与十二指肠吻合,检查吻合口无出血后关闭共同开口。两组患者均随访至术后3个月。
1.2.2 护理方法两组患者均接受进行基于量化评估策略的护理干预。①量化评估:通过查阅患者的病例资料,从临床症状、疾病相关生化检验、影像学检查情况等各方面对患者病情严重程度进行综合评估。②护理人员配置:根据患者病情严重程度进行人员配置,轻度患者配备主管护师或护师1名,中度患者配备护师和工作经验丰富的护士各1名,重度患者配备主管护师或护师、进修护师或低年资护士各1名。③实施护理干预:术前对患者进行常规禁食、禁水,并应用抗生素预防感染,手术前1晚和手术日清晨进行灌肠,手术日清晨插胃管,术后引流。④疼痛管理:准确评估患者术后疼痛程度,掌握止痛药的给药时机和方法,按照医嘱对患者进行镇痛干预。⑤术后活动指导:术后早期协助患者进行床上肢体被动运动,术后第2天根据术后恢复情况协助患者下地活动。⑥出院指导:做好对患者及其家属的健康宣教工作,包括日常饮食、活动锻炼、规范用药等,并对患者定期电话随访,对患者康复期间遇到的问题进行耐心解答。
1.3 观察指标①记录两组患者围术期相关指标,包括手术切口长度、手术时间、术中出血量、吻合时间、淋巴结清扫数量及肛门排气时间、住院时间。②采集两组患者术前与术后3 d空腹静脉血5 mL,离心(转速 3 000 r/min,时间15 min)后取血清,采用酶联免疫吸附实验法检测血清白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)、C-反应蛋白(CRP)水平。③分别于术前和术后3个月,采用欧洲癌症研究与治疗组织生命质量测定量表(EORTC QLQ-C30)[4]对患者的认知功能、社会功能、躯体功能、角色功能、情绪功能进行评价,每项总分均为100分,分数越高则生活质量越好。④比较两组患者住院期间感染、术后出血、吻合口瘘、吻合口狭窄等并发症发生情况。
1.4 统计学方法应用SPSS 22.0统计学软件分析数据,计数资料以[ 例(%)]表示,采用χ2检验;经K-S法检验证实符合正态分布的计量资料以(±s)表示,采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术相关指标比较完全腹腔镜组患者的切口长度与吻合时间、术后肛门排气时间、住院时间均显著短于腹腔镜组,术中出血量显著少于腹腔镜组,差异均有统计学意义(均P<0.05);而两组患者的手术时间、淋巴结清扫数量经比较,差异均无统计学意义(均P>0.05),见表1。
表1 两组患者手术相关指标比较(±s)

表1 两组患者手术相关指标比较(±s)
组别 例数 切口长度(cm) 手术时间(min) 术中出血量(mL) 吻合时间(min)淋巴结清扫数量(枚)肛门排气时间(d) 住院时间(d)腹腔镜组 64 7.89±0.98 210.65±32.27 194.38±25.48 39.08±4.36 20.47±4.38 3.98±0.68 12.98±3.82完全腹腔镜组 64 4.10±0.53 216.47±35.76 121.75±22.18 32.89±3.72 19.97±4.93 2.48±0.52 9.46±2.10 t值 27.214 0.967 17.200 8.640 0.607 14.018 6.460 P值 <0.05 >0.05 <0.05 <0.05 >0.05 <0.05 <0.05
2.2 两组患者炎症因子水平比较术后3 d两组患者血清TNF-α、CRP水平均显著高于术前,但完全腹腔镜组显著低于腹腔镜组;血清IL-10均显著降低,但完全腹腔镜组显著高于腹腔镜组,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者炎症因子水平比较(±s)

表2 两组患者炎症因子水平比较(±s)
注:与术前比,*P<0.05。TNF-α:肿瘤坏死因子-α;IL-10:白细胞介素-10;CRP:C-反应蛋白。
组别 例数 TNF-α(pg/mL) IL-10(ng/mL) CRP(mg/L)术前 术后3 d 术前 术后3 d 术前 术后3 d腹腔镜组 64 238.73±9.27 266.37±6.28* 49.72±2.74 31.83±5.73* 39.83±1.64 79.78±3.20*完全腹腔镜组 64 239.20±9.73 250.18±4.53* 49.64±2.59 37.20±5.03* 39.66±1.59 71.86±4.07*t值 0.280 16.727 0.170 5.634 0.595 12.238 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 两组患者EORTC QLQ-C30评分比较术后3个月两组患者EORTC QLQ-C30各项评分均显著高于术前,且完全腹腔镜组显著高于腹腔镜组,差异均有统计学意义(均P<0.05),见表3。
表3 两组患者EORTC QLQ-C30评分比较(±s , 分)
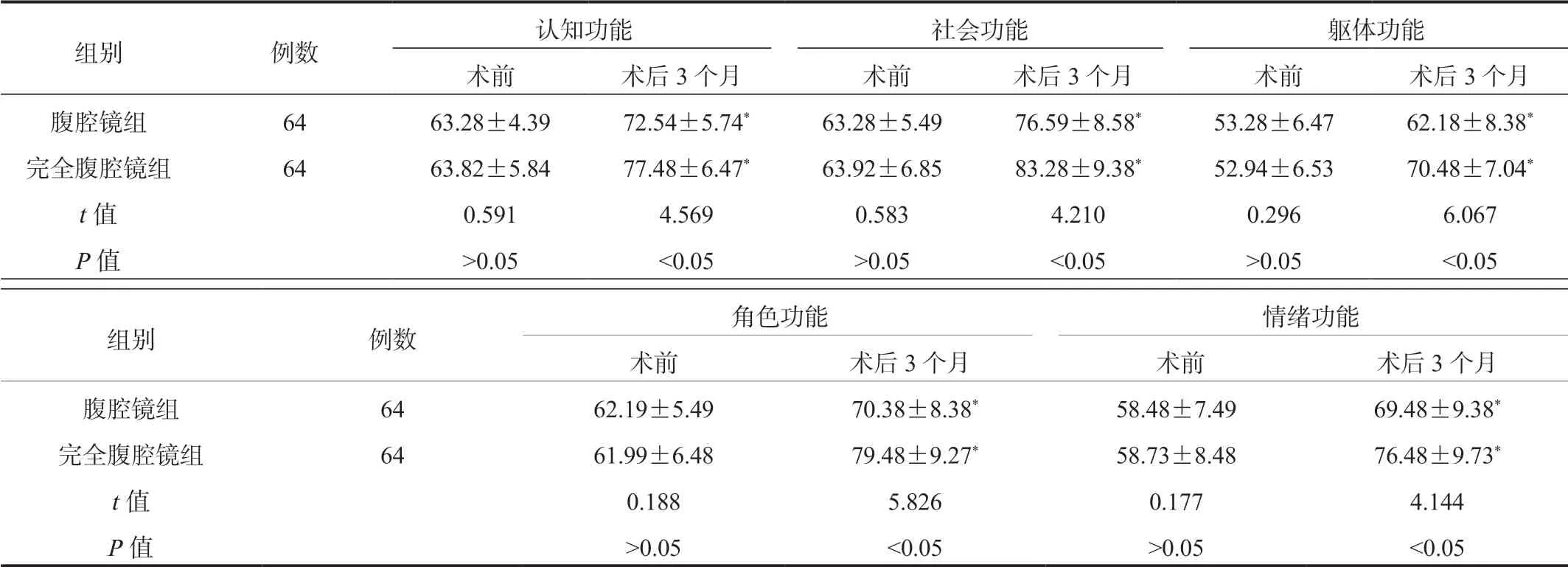
表3 两组患者EORTC QLQ-C30评分比较(±s , 分)
注:与术前比,*P<0.05。EORTC QLQ-C30:欧洲癌症研究与治疗组织生命质量测定量表。
2.4 两组患者并发症发生情况比较住院期间,两组患者并发症总发生率比较,差异无统计学意义(P>0.05),见表4。

表4 两组患者并发症发生情况比较[ 例(%)]
3 讨论
随着近年来微创技术的快速进展,LAG成为临床胃癌的主流手术方式,其切口小、疼痛轻,且恢复快。而近来研究发现,此术式亦存在弊端,即其手术视野、空间有限,增加了组织过度牵拉的风险,和外科微创理念仍存在 差距[5]。
LAG需要在剑突下作一8 cm手术切口,而TLG仅需将脐下1 cm处观察孔扩大至3 cm即可取出肿瘤标本,可有效降低切口长度和术中出血量,同时减少术中对机体组织的牵拉;另外,TLG在腹腔镜下取出肿瘤标本,未对标本产生挤压,避免对扩大的戳孔产生直接接触,发生肿瘤种植,因而可有效促进患者术后恢复,缩短患者术中吻合时间和住院时间,且未对机体造成二次伤害[6]。而基于量化评估策略的护理干预可通过对患者整体情况进行评估,并给予针对性的护理措施,早期协助患者进行被动运动和床下运动,有助于促进机体恢复,缩短住院时间[7]。本研究中,完全腹腔镜组患者切口长度与吻合时间、肛门排气时间、住院时间均显著短于腹腔镜组,术中出血量显著少于腹腔镜组,同时并发症有所减少,说明TLG胃癌患者可减轻手术损伤,促进患者术后恢复。
TLG术中吻合了未切断的肠管,肠管神经冲动传递的连续性未发生损伤且得以保留,有利于维持肠管的营养状态,另外,胃十二指肠吻合术有利于维护患者术后对食物的消化吸收,可快速改善患者术后的营养状况,以此提升生活质量。手术操作均会使机体发生创伤,而创伤可经多途径导致炎症介质大量释放,且术中创伤越大,其炎症反应越强烈,血清TNF-α、IL-10、CRP是较为敏感的炎症因子,对反映机体炎症反应程度有着重要的检测意义[8]。本研究中,术后3 d完全腹腔镜组患者血清TNF-α、CRP水平显著低于腹腔镜组,血清IL-10水平显著高于对照组;术后3个月生活质量各项评分均显著高于腹腔镜组,说明TLG可有效降低胃癌根治术后患者患者机体的炎症反应,并提高生活质量。原因可能是,TLG手术应用直线型切割吻合器便可完成吻合,不需要扩大切口,对系膜方向的判断、近端十二指肠的定位等更加准确,也可更清楚地辨别淋巴、神经及血管,减少了对机体组织造成的不必要的损伤,进而可促进患者术后恢复,提升患者生活质量[9]。此外,基于量化评估策略的护理干预可通过加强患者术后疼痛管理缓解因疼痛应激引起的炎症反应,促进术后恢复,进而提高患者的生活质量[10]。
综上,与LAG相比,TLG联合基于量化评估策略的护理干预可通过降低胃癌患者的炎症反应来促进其术后恢复,并能提高患者生活质量,且安全性较好,建议临床推广与应用。但本研究仍存在不足之处,如仅观察了胃癌患者术后3个月的临床效果,且本研究所纳入样本均选自同一医院中的同一个科室,未进行多中心样本选取,因此研究结果可能存在一定的偏差,仍需临床进行多中心与长时间的深入性研究。

