80例尿路感染患者血清C-反应蛋白、淀粉样蛋白、降钙素原水平的变化及其临床意义
沈永棋,梁水齐,王中雄
(1.广州医科大学附属第四医院检验科;2.广州医科大学附属第四医院康复医学科,广东 广州 511316)
尿路感染是由于病原体感染尿路并在其中大量繁殖导致的炎症性疾病,可造成患者出现发热、头痛、尿频等症状。细菌、病毒、支原体等感染都可引发尿路感染,其中以细菌感染最为常见,老人与儿童等免疫力低下人群更易受到感染。若能及时对尿路感染进行治疗,患者一般预后良好,但尿路感染临床症状无明显特异性,若不及时进行有效的治疗,将延误治疗时机,导致患者肾功能受到损伤,引发肾炎、肾脓肿,严重时甚至会发生败血症,影响患者生活质量与生命安全。因此,及时进行诊断并治疗是改善尿路感染病情、阻止病情进展的关键。感染性疾病均会出现炎症、免疫应答等生理特征,C- 反应蛋白(CRP)、淀粉样蛋白(SAA)、降钙素原(PCT)是常见的临床炎症检测指标,其中CRP为机体遭受损伤或病原微生物感染时,由肝脏细胞合成的一种急性时相反应蛋白,在临床上通常用于感染诊断鉴别;SAA是感染性疾病早期炎症的敏感指标,当机体发生慢性感染和炎症反应时,SAA的测定值会升高;PCT是诊断细菌感染特异性指标,对细菌感染敏感性高,并且能反映感染的严重程度,已被用作全身严重感染的重要观察指标[1-2]。在患者体内出现炎症应激时,以上指标水平均会出现不同程度上升。因此,本研究旨在通过对80例尿路感染患者血清中CRP、SAA、PCT的水平进行检测,研究其在临床辅助诊断尿路感染中的应用价值,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析2020年1月至2021年1月广州医科大学附属第四医院收治的80例尿路感染患者的临床资料,将其作为感染组;另回顾性分析同期进行体检的80例健康者的体检资料,将其作为健康对照组。感染组患者中男性34例,女性46例;年龄27~66岁,平均(45.52±8.75)岁。健康对照组研究对象中男性38例,女性42例;年龄27~66岁,平均(45.67±9.09)岁。两组研究对象性别、年龄等一般资料比较,差异无统计学意义(P>0.05),组间具有可比性。感染组患者纳入标准:符合《尿路感染诊断与治疗中国专家共识(2015版):复杂性尿路感染》[3]中关于尿路感染的诊断标准者;未患有其他感染性疾病者;无认知障碍,意识清醒,未合并严重精神性疾病者;无严重药物依赖史者等。排除标准:研究前1周内服用过抗生素或免疫制剂等药物者;合并有其他免疫系统疾病者;合并有肝肾功能不全者,混合菌株感染者等。本研究经广州医科大学附属第四医院医学伦理委员会批准。
1.2 检验方法
1.2.1 血清学指标检测入组后,于清晨抽取所有研究对象的空腹静脉血5 mL,以3 000 r/min转速离心10 min,取上层血清。采用量子点荧光免疫法检测血清PCT水平,采用免疫荧光层析法检测血清SAA水平,采用免疫散射比浊法检测血清CRP水平。
1.2.2 病原菌检验采集尿路感染患者清晨中段尿样本(患者自留),采用尿细菌培养法进行鉴定,将标本进行接种,接种培养基包括血液与麦康凯培养基,置于35 °C环境培养24 h,依据《全国临床检验操作规程(第4版)》[4]中的相关标准进行菌种分离,革兰氏阳性菌与革兰氏阴性菌菌落数分别以 >104 cfu/mL、>105 cfu/mL为有临床意义。2次真菌定量培养显示真菌菌落数均 >104 cfu/mL为有临床意义,使用全自动微生物分析鉴定系统(梅特勒托利多,型号:7000RMS)进行菌种鉴定,剔除同一患者同一部位重复菌株。
1.3 观察指标①比较两组研究对象血清CRP、SAA、PCT水平。②根据中段尿样本病原菌检测结果,将其分为革兰氏阳性菌感染(49例)、革兰氏阴性菌感染(25例)、真菌感染(6例),比较不同病原菌感染尿路感染患者血清CRP、SAA、PCT水平。③根据感染组患者的感染部位将其分为上尿路感染组(38例)与下尿路感染组(42例),比较不同感染部位患者血清CRP、SAA、PCT水平。④通过受试者工作特征(ROC)曲线评价CRP、SAA、PCT在尿路感染中的诊断价值。
1.4 统计学方法采用SPSS 22.0统计学软件分析处理数据,本研究计量资料经S-W法检验均符合正态分布,以(±s)表示,两组间比较采用独立t检验,多组间比较采用单因素方差分析;采用ROC曲线分析血清CRP、SAA、PCT对尿路感染的诊断价值。以P<0.05为差异有统计学意义。
2 结果
2.1 两组研究对象血清CRP、SAA、PCT水平比较感染组患者血清CRP、SAA、PCT水平均显著高于健康对照组,差异均有统计学意义(均P<0.05),见表1。
表1 两组研究对象血清CRP、SAA、PCT水平比较(±s)

表1 两组研究对象血清CRP、SAA、PCT水平比较(±s)
注:CRP:C- 反应蛋白;SAA:淀粉样蛋白;PCT:降钙素原。
组别 例数 CRP(mg/L) SAA(mg/L) PCT(μg/L)健康对照组 80 3.97±0.76 5.70±1.11 0.75±0.13感染组 80 39.32±14.76 115.78±20.45 3.15±1.02 t值 21.393 25.602 20.876 P值 <0.05 <0.05 <0.05
2.2 不同病原菌感染尿路感染患者血清CRP、SAA、PCT水平比较80例尿路感染患者中革兰氏阳性菌感染49例,占比为61.25%(49/80);革兰氏阴性菌感染25例,占比为31.25%(25/80);真菌感染6例,占比为7.50%(6/80)。革兰氏阳性菌、革兰氏阴性菌及真菌感染患者机体内血清CRP、SAA、PCT水平比较,差异均无统计学意义(均P>0.05),见表2。
表2 不同病原菌感染尿路感染患者血清CRP、SAA、PCT水平比较(±s)

表2 不同病原菌感染尿路感染患者血清CRP、SAA、PCT水平比较(±s)
组别 例数 CRP(mg/L) SAA(mg/L) PCT(μg/L)革兰氏阳性菌感染 49 44.69±17.58 118.84±22.26 2.98±0.64革兰氏阴性菌感染 25 37.03±12.74 113.46±21.42 3.11±0.71真菌感染 6 37.54±12.67 117.62±21.34 3.32±1.12 F值 2.142 0.500 0.776 P值 >0.05 >0.05 >0.05
2.3 不同感染部位患者血清CRP、SAA、PCT水平比较上尿路感染组患者血清CRP、SAA、PCT水平均显著高于下尿路感染组,差异均有统计学意义(均P<0.05),见表3。
表3 不同感染部位患者血清CRP、SAA、PCT水平比较(±s)
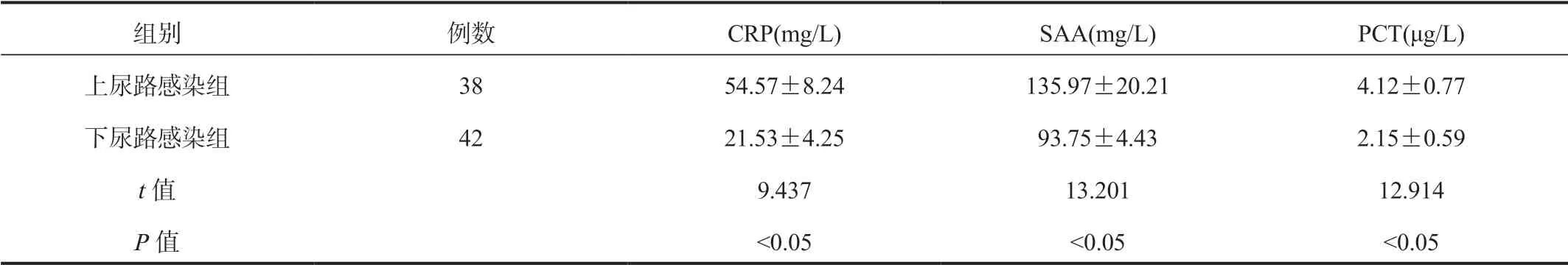
表3 不同感染部位患者血清CRP、SAA、PCT水平比较(±s)
组别 例数 CRP(mg/L) SAA(mg/L) PCT(μg/L)上尿路感染组 38 54.57±8.24 135.97±20.21 4.12±0.77下尿路感染组 42 21.53±4.25 93.75±4.43 2.15±0.59 t值 9.437 13.201 12.914 P值 <0.05 <0.05 <0.05
2.4 血清CRP、SAA、PCT对尿路感染的诊断价值将中段尿培养结果作为金标准,PCT的ROC曲线下的面积(AUC)显著高于SAA和CRP,且SAA显著高于CRP,其中PCT的约登指数最高,诊断价值最好,差异均有统计学意义(均P<0.05),见表4、图1。
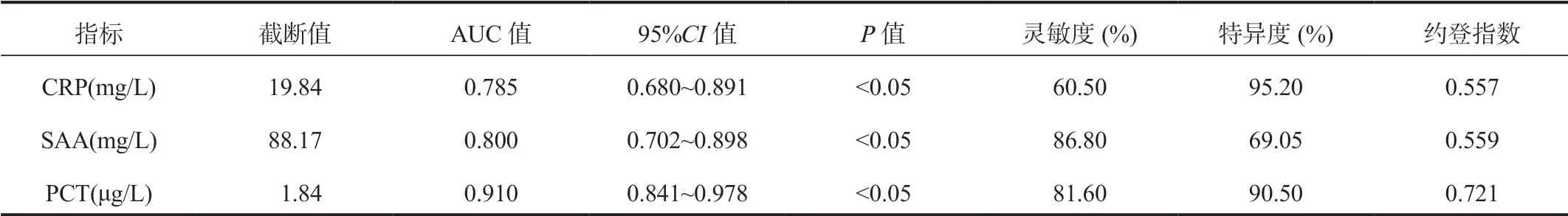
表4 血清CRP、SAA、PCT对尿路感染的诊断价值

图1 血清CRP、SAA、PCT诊断尿路感染的ROC曲线
3 讨论
尿路感染主要是由细菌感染所致,致病菌中大多属于条件致病菌,其在尿液中生长繁殖,并侵犯尿路黏膜或组织而引起损伤,根据泌尿系统生理结构,通常可分为上尿路感染和下尿路感染。上尿路感染主要指急、慢性肾盂肾炎及输尿管炎,下尿路感染主要包括膀胱炎和尿道炎。由于感染部位的不同,疾病的预后和治疗方案也存在差异[5]。目前,临床常用血常规与尿液检查诊断尿路感染,但血常规受抗生素等抗菌药影响较大,若患者自行服用药物会对检测结果造成较大影响[6]。中段尿病菌培养是诊断金标准,但培养时间过长,可延误治疗最佳时期[7]。因此,临床需要寻找一种能够准确快速检测的方法。
尿路感染病程中炎症反应的激活以多种炎症细胞因子的大量分泌为特征,这可能是由于尿路感染往往伴随炎症反应,激活人体免疫反应,致使机体内分泌大量炎症细胞因子,其中CRP、SAA、PCT均为常见的感染相关指标[8-9]。CRP主要在肝脏合成分泌,正常情况下水平较低,但在机体受到感染与组织损伤时,其水平会迅速升高,48 h内达到峰值,从而激活补体,增强巨噬细胞的吞噬作用,消除病原体与因感染不具备正常功能的细胞,减轻患者炎症反应,故CRP在临床中可以评价机体受感染与组织受损程度[10]。SAA由被激活的巨噬细胞和纤维母细胞在肝脏中合成,其作为一种特异性较高的急性相蛋白,在正常人血液中有少量存在,但当机体处于感染、炎症状态、组织损伤后的4~6 h内,SAA可迅速升高,且SAA半衰期短,随病情进展而变化迅速,在清除病原体后又能迅速降回正常水平,灵敏度较高,同时SAA在病毒、支原体、细菌感染时体内水平也有明显升高[11]。PCT是降钙素的前体蛋白,在健康者体内,PCT由甲状腺滤泡旁细胞合成,体内分泌量极少,但在受到感染的状态下,可直接由微生物毒素和/或间接通过体液因子或细胞介导的宿主反应刺激以肝、肾、肺等器官为主的几乎所有类型的组织细胞都可以产生PCT,从而在血清中检测出PCT含量明显升高[12]。本研究结果表明,感染组患者血清CRP、SAA、PCT水平均显著高于健康对照组,表明血清CRP、SAA、PCT水平在一定程度上反映了患者受感染状况,可根据上述指标变化对病情进行初步诊断,指导患者快速制定抗感染治疗方案。
既往研究结果表明,革兰氏阴性菌是导致尿路感染的主要致病菌,其次是革兰氏阳性菌[13]。在本研究受试的80例尿路感染患者中,其中革兰氏阴性菌占比最高(61.25%),其次是革兰氏阳性菌(31.25%),最后是真菌(7.50%);但本研究显示,革兰氏阳性菌、革兰氏阴性菌及真菌感染患者机体血清CRP、SAA、PCT水平比较,差异无统计学意义,说明感染菌种与尿路感染患者CRP、SAA、PCT水平变化不存在相关性,临床无法通过炎症因子水平的不同判断尿路感染患者致病菌类型。
上尿路感染与下尿路感染的常见临床症状和尿常规检查指标水平相似,故尿路感染的定位诊断颇为困难,但定位诊断是治疗与预后判定的重要依据。上尿路感染症状较下尿路感染全身症状与炎症反应更严重,上尿路感染的病因常有泌尿生殖道的结构或功能异常,或其他潜在病因,梗阻因素得不到解决,导致细菌大量繁殖,致梗阻部位以上的尿路组织防御屏障受损,加重病情,且上尿路感染细菌清除难,易造成反复感染[14]。本研究结果显示,上尿路感染组患者血清CRP、SAA、PCT水平均显著高于下尿路感染组,表明血清CRP、SAA、PCT水平可作为鉴别上、下尿路感染的指标,反映尿路感染患者感染部位情况,指导临床医师用药。且本研究中,血清CRP、SAA、PCT对尿路感染的诊断的AUC分别为0.785、0.800、0.910,均具有较优的诊断价值,其中PCT的约登指数最高,诊断效能较高。分析其原因为,PCT受自身免疫、过敏、病毒感染等影响不大,水平基本处于正常范围,在发生细菌、真菌、寄生虫感染等情况时出现明显升高,是预测细菌感染的有效指标,且其水平升高程度与细菌感染的持续发展呈正相关,相比于某些非感染因素也可引起CRP、SAA升高,PCT对于检测尿路感染具有更好的灵敏度与特 异度[15]。
综上,在发生尿路感染时,尤其是上尿路感染,患者血清CRP、SAA、PCT水平异常升高,对尿路感染均具有较高诊断价值,且以PCT的诊断价值最高,可为医师快速制定治疗方案进行抗感染治疗提供支持。

