PP2A的A/C亚基与多囊蛋白1抑制细胞增殖关系初步探讨
万烨东,杨慧欣,郝书弘,胡春梅,唐 艳*
(1.吉林大学第二医院 肿瘤血液科,吉林 长春130041;2.吉林大学第二医院 乳腺外科)
常染色体显性遗传性多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)是一种以多发囊肿形成为特征的遗传性肾病,主要是由编码多囊蛋白1(polycystin-1,PC1)和多囊蛋白2(polycystin-1,PC2)的PKD1和PKD2基因突变所致,其中,PKD1基因所致的ADPKD占该病谱系的85% 左右[1]。PC1是一种分子量较大的跨膜糖蛋白,包含基质相互作用的胞外大N端和激活G蛋白并与伴侣蛋白相互作用的胞内C端,并通过mTOR、MAPK、cAMP、JAK-STAT、Wnt等多种信号途径调节细胞转导[2]。
蛋白磷酸酶2A(protein phosphatase 2A,PP2A)是蛋白丝氨酸/苏氨酸磷酸酶家族中的一员,是由结构亚基PP2A-A(也称为PPP2R1A)、调节亚基PP2A-C(也称为PPP2CA)和催化亚基PP2Ab(包含B56α)组成的异源三聚体复合物[3],它是一种多功能酶,在细胞周期调控,形态以及发育中发挥作用。同时它又在信号转导的级联反应中与其他磷酸化酶和激酶相互作用,构成调节大分子从而调控下游信号转导[4]。
在PC1调节的细胞增殖中,雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通过磷酸化其下游靶蛋白来促进蛋白质合成(细胞增殖),调节下游蛋白质翻译。因S6 和 4EBP1是mTOR的底物,而PP2A通过使4EBP1 和 p70S6K去磷酸化调节翻译的起始,提示PP2A是mTOR调节其下游效应器的主要磷酸酶[5]。在最近的研究中,我们发现PC-1通过磷酸酶PP2A/B56α途径抑制细胞增殖[3],但对于PP2A的A/C亚基是否参与PC1介导的增殖抑制作用尚未进一步明确。在本研究中,我们初步探讨了PC1抑制细胞增殖与PP2A的A及C亚基的关系,从而进一步完善PC-1经磷酸酶PP2A/B56α抑制细胞增殖的研究。
1 材料与方法
1.1 细胞、质粒和试剂
人HEK293T细胞、空白对照质粒pEGFP和PC1基因重组质粒pEGFP-PC1-5TMC均来自Xing-Zhen Chen博士实验室。HEK293T细胞被置于含DMEM培养液的6孔板中孵育,并在该培养基中加入了L-谷氨酰胺,青霉素-链霉素和10%胎牛血清,环境温度保持在37℃,CO2浓度为5%。B56α抗体、PP2A-A抗体、PP2A-C抗体为Cell Signaling Technology 公司产品,PP2A-A,PP2A-C,PP2A-B56α的siRNA,小鼠单克隆抗HSP60(H-1)抗体及二抗购自美国圣克鲁斯生物技术公司。绿色荧光蛋白(GFP)单抗和辣根过氧化物酶标记的羊抗鼠IgG购自鼎国生物公司,用于对GFP标记后的转染细胞进行免疫印迹验证。Alarma Blue细胞增殖及细胞毒性检测试剂盒、转染试剂Lipofectamine 2000购自Invitrogen公司。用于细胞培养的DMEM培养液及胎牛血清购自长春尚宝生物公司。化学发光试剂盒购自美国Bio-Red公司。
1.2 转染
以2.0×104cells/孔密度接种6 孔细胞培养板,48 h后更换新鲜培养液,用无血清DMEM培养液分别稀释质粒pEGFP及pEGFP-PC1-5TMC,用Lipofectamine 2000 试剂进行转染。在37℃,5% CO2环境中6 h后,更换培养液为DMEM继续培养。
1.3 Western blotting法鉴定转染细胞
转染后24 h,各组细胞加入RIPA裂解缓冲液和蛋白酶抑制剂,冰上裂解30 min,12 000 g速度离心后取上清液,使用BSA试剂盒进行蛋白含量测定,后取80 μg蛋白进行SDS-PAGE凝胶电泳,转移到硝酸纤维膜上,5%脱脂奶粉室温封闭1 h后,1∶2 000加入GFP单抗4℃孵育过夜,TBST液清洗3次后,1∶500加入对应的辣根过氧化物酶标记的羊抗鼠IgG 4℃孵育过夜,按化学发光试剂盒说明书进行测定。
1.4 RNA干扰实验
PP2A-B56α亚基、A亚基和C亚基的siRNA被分别用来干涉HEK293T细胞中的PP2A-B56α,A亚基和C亚基基因,siRNA基因敲除的效率通过免疫印迹进行评估。
1.5 细胞增殖实验
较诸于国别文学,比较文学提供的是一种更为开阔的文学视域,让学者在探求不同国家之文学的同时,能够把文学作品放在世界文学的格局和世界文学发展的长河中进行观照,不仅能使我们更深入地了解自己国家和民族的文学,而且能对世界其他国家和民族的文学有“了解之同情”,从而知晓我们自身文学的特异之处,清楚别的国家的文学同我们自身文学的差异之所在,并能辨考其间相互影响的痕迹,或彼此共通的文学特质。有鉴于此,季羡林先生特别指出:
将HEK293T细胞瞬时转染PC1-5TMC至100 mm培养皿,转染24 h后,采用Alarma Blue细胞增殖及细胞毒性检测试剂盒按既往研究所述进行细胞增殖试验[3,6]。应用酶标仪检测各孔光密度值(optical density,OD),并计算细胞增殖率,细胞增殖率(%)=OD测试/OD对照×100%。
1.6 数据处理
数据以平均值±标准误表示,使用Sigma Plot 11软件对数据进行统计分析,P值小于0.05认为差异有统计学意义。
2 结果
2.1 PC1基因重组质粒转染HEK293T细胞株的鉴定
空白质粒及pEGFP-PC1-5TMC质粒上均携带有绿色荧光蛋白(GFP),采用GFP单抗用Western blotting法观察在分子量约68 KD大小处显示 pEGFP-PC1-5TMC蛋白条带,即pEGFP-PC1-5TMC质粒转染成功(图1)。
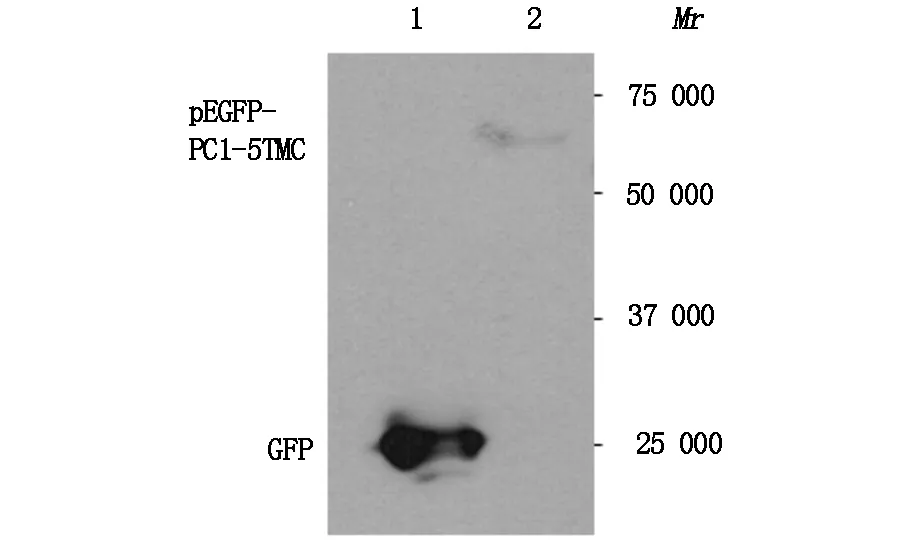
条带 1:空白对照组;条带 2:转染组.
2.2 PP2A各亚基基因干涉效果鉴定
以HSP-60为内参对照,Western blotting结果提示,与非干涉组相比,PP2A-A干涉组、PP2A-C干涉组以及B56α干涉组各自亚基表达水平下降(图2)。
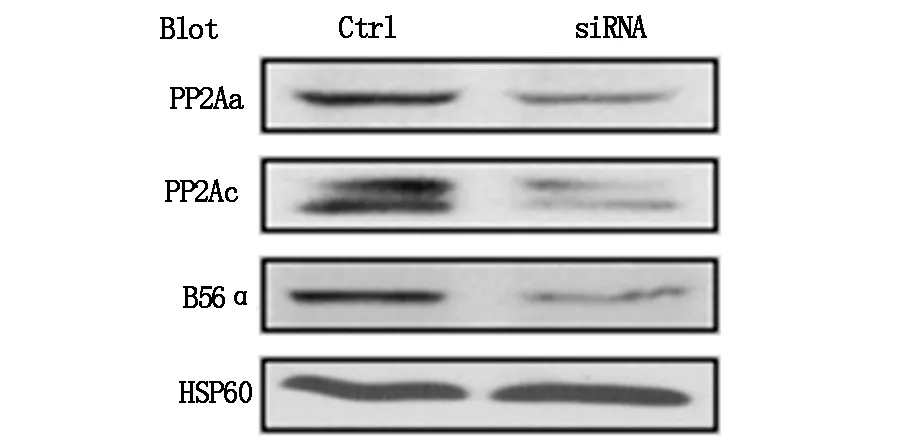
图2 Western blotting法验证各亚基表达
2.3 各组细胞增殖率
在既往研究中,我们证实PC-1抑制细胞增殖是PP2A/B56α依赖的[3],为了进一步明确PP2A的A和C亚基对该过程的影响,我们采用siRNA敲除后的PP2A 3个亚基及对照进行增殖实验来验证。结果显示PP2A-A或PP2A-C的敲除并不影响PC1-5TMC对细胞增殖的抑制,而B56α的敲除则消除了抑制作用(图3),从而支持PC1通过PP2A(B56α)而不是PP2A的A或C亚基抑制细胞增殖。
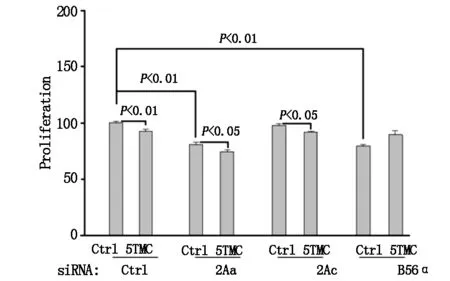
图3 Alarma Blue测定法比较各组细胞增殖抑制率
3 讨论
PC-1的异常改变是遗传性多囊肾病发病的关键因素之一,其多表达于远端肾单位和集合管中,通过多种途径调节肾上皮细胞的增殖活性。例如通过平衡Ca2+/cAMP浓度抑制肾上皮细胞增殖,负性调节mTOR及下游信号分子S6激酶和4EBP1/eIF4E抑制细胞生长等[5]。我们前期的研究证实了PP2A作为4EBP1和p70S6K的去磷酸化受体,参与了PC1通过mTOR途径介导的增殖抑制,且证明调节亚基B56α参与其中[3]。
PP2A作为异源三聚体复合物,还包含有结构亚基PP2A-A和催化亚基PP2A-C。其中,结构亚基PP2A-A是一段包含15个串联重复序列的支架蛋白,全长65 kDa,可分为α、β两型。催化亚基PP2A-C全长36 kDa,与PP2A-A亚基一同构成PP2A去磷酸化的核心酶[7]。B亚基家族之间的同源性非常低,具有组织、细胞及底物的特异性,其中B56是B亚基中基因最多样化的家族,其4个亚基在许多组织和细胞中差异性表达,PP2A的功能和活性主要依靠调节亚单位B56α[8]。
本研究为探讨PP2A-A和PP2A-C是否参与了PC1对细胞增殖的抑制,对PP2A各亚基进行了siRNA干预,并通过免疫印迹证实干扰后各组对应亚基的低表达;通过增殖实验我们发现PP2A-A或PP2A-C的敲除并不影响PC1-5TMC对细胞增殖的抑制作用,而B56α的敲除逆转了这种作用(图3),这支持并验证了PC1不是通过PP2A的A或C亚基,而是通过PP2A(B56α)抑制细胞增殖。
总之,本研究进一步验证了PP2A在PC1抑制的细胞增殖中发挥作用的具体亚基,为进一步研究PP2A介导的PC1抑制细胞增殖的研究提供了基础。

