丝瓜新品种(系)对枯萎病抗性的鉴定与评价
康玉妹 薛珠政 李永平 马慧斐 黄 昊
(福建省蔬菜遗传育种重点实验室/福建省农业科学院作物研究所//福建省蔬菜工程技术研究中心 福建福州 350013)
丝瓜(Lufa cylindrica)是夏季主要瓜类蔬菜作物之一,在各蔬菜产区均有种植。 长期以来,枯萎病一直是丝瓜生产上的主要病害之一[1]。 该病害是由尖孢镰刀菌丝瓜专化型侵染所致,属土传病害[2-16]。 枯萎病菌可以在作物种子上越冬,主要以菌丝、菌核、厚垣孢子在土壤、 病残体上及未经高温腐熟的肥料中越冬[17-19]。 该菌在土壤中能存活5 年或更长时间,腐生性强。 前人研究表明, 用农药化学防治该病效果欠佳, 目前最有效、 经济的措施是选育和种植抗病品种[20-26]。 为了解本所选育的丝瓜品种(系)对枯萎病的抗性水平,采用室内人工接种方法鉴定,初步评价丝瓜新品种(系)对枯萎病的抗性水平,以期为丝瓜枯萎病的抗性遗传改良、 选育抗病新品种和砧木新品种提供抗性材料。
1 材料与方法
1.1 供试材料
1.1.1 供试丝瓜自交系及品种3 个新品种及11 个自交系都是福建省农业科学院作物研究所自行选育,自2005 年起陆续从国内外收集丝瓜种质资源经过自交纯化按照育种目标筛选。 供试丝瓜品种(系)来源及系统序号见表1。

表1 供试丝瓜新品种(系)
1.1.2 供鉴定的病原菌菌株采自广州市钟落谭镇丝瓜产区的丝瓜枯萎病样, 经过广东省农业科学院植物保护研究所单孢分离,获得丝瓜枯萎病菌菌株,通过室内人工接种测定上述菌株的致病性, 保存致病力中等的菌株待用。 挑取少量带菌丝的培养基至PDA 上,活化培养,保存待用(编号为SPK-3)。
1.2 抗病性鉴定方法
1.2.1 育苗准备接种用丝瓜苗:每个品种(系)选完全成熟、籽粒饱满的种子200 粒,清洗后用温水浸泡8~10 h,之后将清洗干净的种子用湿布包裹,催芽于28~30℃、光照300 μmol/(m2·s)的恒温生化培养箱中,在每天早晚清洗种子各1 次,当80%种子露白,及时播于育苗盘(规格为5 cm×10 cm),于2021 年7 月26 日播种,干湿适中的育苗土覆盖1 cm,2 叶1 心苗龄进行人工接种。 土壤均经消毒处理后用于育苗。
1.2.2 枯萎病菌培养从菌种保存箱中取出病原菌SPK-3 菌株活化培养,于PDA 试管斜面上接种,待菌丝长出后,用接种针取出一小块接种于盛有PDA 培养基的三角瓶中,然后振荡培养3 d,25℃、180 r/min。用双层纱布过滤培养液,去除菌丝,以2 500~3 000 r/min离心10 min 后,滤液去上清液,然后灭菌水洗出沉淀的孢子,制成母液。 用纽鲍尔(Neubauer)血球计数板在显微镜下观察80 个格,对每个小格的孢子进行观察计数, 以其平均数乘以4 000 000, 得到孢子的数量(每毫升悬浮液中孢子量)。 将母液用双蒸无菌水稀释,每毫升含1×106个孢子悬浮液,待用。
1.2.3 接种方法采用苗期抗性鉴定技术进行人工接种抗性鉴定丝瓜枯萎病, 接种方法为伤浸根法。带土拔起2 叶1 心幼苗,用接种剪刀,轻轻伤根,然后在孢子悬浮液中浸入根系20 min,于营养盆中移植。每个品种(系)每个重复30 株苗,以双蒸无菌水作对照,3 次重复。
1.3 病情调查与评价
接种后,瓜苗病害发生情况隔天观察记录1 次,瓜苗充分发病,停止调查。 统计病情指数(DI)。 调查结果用DMRT 法, 根据病情指数进行差异显著性分析,评价品种抗性水平。 丝瓜病株病情分级标准:0 级,无病症;1 级,生长正常,胚轴或子叶出现轻微病症;3 级,影响生长,胚轴或子叶出现明显坏死斑,或1 片子叶黄化;5 级,2 片子叶黄化, 或1 片子叶枯死;7 级,植株部分萎蔫或停止生长,2 片子叶生长僵化;9 级,整株萎蔫,倒伏或枯死。
病情指数计算公式:DI(%)=Σ(病株数×该级代表值)/总株数×最高级代表值×l00。
丝瓜群体抗性水平评价标准如下。 高抗(HR):0<DI≤l5;抗(R):15<DI≤35;中抗(M):35<DI≤55;感(S):55<DI≤75;高感(HS):75<DI。
1.4 统计分析方法
应用DPS 统计软件处理原始数据, 差异显著性分析采用Duncan 氏新复极差法。
2 结果与分析
2.1 丝瓜枯萎病的显微镜观察情况
先直接观察菌落形态,将菌株筛选分离后,接种于PDA 平板上,28℃培养3 d,发现其菌丝具有条纹,菌丛呈淡紫色絮状,整个菌落中央淡紫色,平板背面带有深紫色的色素。 用倒置显微镜400 倍观察,可见其菌丝及分生孢子,分生孢子梗呈瓶颈状;小型分生孢子较多,呈椭圆至卵圆形,小型分生孢子具有1 个分隔;大型分生孢子有2~3 个分隔,形似镰刀(图1)。
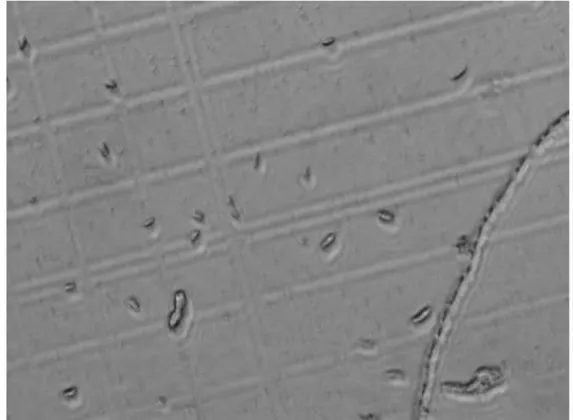
图1 丝瓜尖孢镰刀菌在倒置显微镜下观察情况
2.2 丝瓜枯萎病发病症状及分级标准
接种枯萎病菌的丝瓜苗, 其植株发病症状表现为由下至上子叶、真叶黄化,叶脉逐渐变黄,随后叶片变黄、萎蔫,茎基部褐色到褐色开裂,湿度大时长淡紫色菌丝霉状物,植株枯死,病株根尖及维管束变色不明显。 参考罗方芳等[1]的丝瓜枯萎病病情分级方法,根据症状特征建立分级标准(表2)。 丝瓜群体抗性水平评价标准见表3,分为HR、R、M、S、HS。

表2 丝瓜枯萎病病情分级标准
表3 丝瓜群体抗性水平评价标准
2.3 枯萎病病原菌致病性鉴定中丝瓜苗病害发生情况
于丝瓜幼苗上接种分离到的尖孢镰刀菌孢子悬液,结果表明,该菌株对丝瓜具有强致病性。 丝瓜植株接种孢子悬液3 d 后开始出现发病症状,7 d 后发病趋于严重。 发病时丝瓜由叶缘开始,逐渐向中脉扩展,病叶萎蔫,随后1~2 d 恢复,然后萎蔫病叶不再恢复,呈现萎蔫;自下而上发展,最下部叶片及其叶鞘处黄色,随后其他叶片相继发黄、萎蔫,植株倒伏,直至全株枯死,茎基部褐色至黑褐色开裂,湿度大时长淡紫色菌丝霉状物。 病株根茎剖开,即可见褐色或淡紫色斑点状坏死病变, 越近茎基部颜色越深, 病变一直延伸到根茎部。 接种孢子悬液的处理植株移栽10 d 后,死亡率高达70%,其中有90%丝瓜发病。 发病植株与健康植株相比较显著矮小,生长逐渐停止;接种该菌株的丝瓜植株移栽10 d 后,其地上部鲜重、地下部鲜重、 株高和茎围与对照处理均达到差异显著水平。 从发病部位重新分离病原菌,接种于尖孢镰刀菌加了蛋白胨的选择性培养基再次进行显微观察, 鉴定为尖孢镰刀菌(Fusarium oxysporum f. sp.melonis),根据科赫法则,证实该病原菌是被接入的尖孢镰刀菌菌株。
2.4 丝瓜自交系抗性鉴定
丝瓜自交系人工接种试验结果见表4。 参试的11 个丝瓜自交系接种枯萎病菌SPK-3 菌株10 d 后病情基本稳定。 其中SP15008 与SP11027、SP11011自交系间病情指数差异显著;SP11027、SP11011 自交系间病情指数差异不显著, 但这2 个自交系与SP08012、SP09001、SP08006 3 个自交系间病情指数差异显著;SP08012、SP09001、SP08006 3 个自交系间病情指数差异不显著, 但均与SP16015 自交系差异极显著;SP05008、SP11012、SP15006、SP15007 品系间病情指数差异不显著。

表4 丝瓜自交系对枯萎病抗性鉴定结果
根据丝瓜枯萎病抗性水平评价标准,参试的11个丝瓜自交系中,SP15008 对丝瓜枯萎病表现为高抗,SP11027、SP11011 对丝瓜枯萎病表现为抗病,SP08012、SP09001、SP08006 对丝瓜枯萎病表现为中抗病,SP16015 对丝瓜枯萎病表现为感病;SP05008、SP11012、 SP15006、 SP15007 对丝瓜枯萎病表现为高感。
2.5 丝瓜新品种抗性鉴定
丝瓜新品种人工接种试验结果见图2。 参试的丝瓜新品种福研2 号、福研3 号、福研6 号接种枯萎病菌SPK-3 菌株10 d 后病情基本稳定。 3 个新品种病情指数分别为47.7%、40.2%、57.5%, 差异不显著,35<DI≤55,都中抗枯萎病。

图2 丝瓜新品种抗性鉴定
3 结论与讨论
通过室内人工接种,鉴定评价了11 个丝瓜自交系及3 个杂交种的枯萎病抗性水平, 结果表明,SP08012、SP09001 和SP08006 这3 个自交系对枯萎病 表 现 为 中 抗,SP05008、SP11012、15006、15007 和SP15008 这5 个自交系对枯萎病表现为高感。 福研2 号、福研3 号、福研6 号这3 个新品种对枯萎病表现为中抗。 说明目前选育的丝瓜新品种(品系)大多数对枯萎病表现为抗或中抗, 可为丝瓜抗病育种提供新材料。
植株叶片变黄萎蔫是丝瓜枯萎病的主要病状,其病原为尖孢镰刀菌。 目前罗方芳等[1]进行了广东丝瓜主要品种对枯萎病抗性的鉴定与评价,丝瓜枯萎病抗性鉴定方法深入研究尚未见系统的报道。 丝瓜抗病育种的基础性工作之一是丝瓜抗枯萎病鉴定,而抗病育种的重要组成部分是室内人工接种。 育种工作者在建立了室内人工接种高效鉴定丝瓜抗枯萎病的方法后,及时掌握育种材料的抗感性,可以快速高效鉴定材料,其数量不受环境条件限制,可大批量筛选抗源,合理选配骨干亲本组合,并筛选抗病优良品种,在生产上应用推广。 因此本研究利用致病力较强的SPK-3 菌株,进行了丝瓜抗枯萎病鉴定评价方法的分析。 参照枯萎病茄果类抗性鉴定方法的研究,接种方法、接种浓度和接种苗龄3 个因素主要影响接种效果。 本研究设置了18 种处理,符合3×3×2 因子设计方法,深入分析这3 个影响因素及其相互的互作效应,确定其重要性依次为接种方法>接种浓度>接种时期。 4 叶1 心期与2 叶1 心期接种无显著性差异。 考虑到更早的时期进行鉴定则瓜苗较弱, 接种后不容易缓苗, 而在较早的时期进行鉴定可以节省时间和空间,接种适合在瓜苗2 叶1 心期时进行。 影响抗病鉴定的关键因子是接种方法,用1×106CFU/mL 左右的枯萎病孢子悬浮液可获得较好的鉴定效果,说明伤浸根法对接种浓度的高低不敏感, 即采用伤浸根法接种效果最好。 进行伤灌根接种时采用1×107CFU/mL或更高浓度才能达到较好的接种效果, 而仅仅直接将菌液灌入土壤中接种效果较差, 所以要求较高的病原菌孢子浓度用于伤灌根接种。 由于浸根法和伤灌根法均存在植株根系伤口,因此如果采用灌根法,为了省工省力,则必须应用1×107CFU/mL 或更大的接种浓度以保证足够的病原菌数量, 同时人为制造根系伤口, 以加速病原菌侵入。 根系受伤能够加速丝瓜枯萎病病原镰刀菌的侵染和症状表现。 丝瓜枯萎病抗性鉴定接种的推荐方法: 综合考虑各因素,采用伤浸根法接种, 接种时期为苗龄2 叶1 心期,在1×106CFU/mL 的孢子悬浮液中浸泡。 由于丝瓜种植具有多年不间断种植和区域性特点, 目前推广种植的丝瓜品种以抗和中抗枯萎病品种为主, 在长期与寄主作物互作过程中,丝瓜品种的抗病性降低,枯萎病菌发生致病性变异。 试验结果表明,选育的丝瓜品种(系)中多数具有抗枯萎病基因,但还有待于下一步分析这些抗病基因的种类及抗性机制等。 为此,需对资源的抗性水平与抗性机制进行研究, 为丝瓜生产的持续发展,广泛收集丝瓜种质资源,有针对性地培育出一系列具有不同抗性基因的丝瓜品种。

