可控自组装DNA折纸结构作为药物载体的研究进展
仵宇帅,尚颖旭,蒋 乔,丁宝全
(1.郑州大学河南先进技术研究院,郑州 450003;2.国家纳米科学中心,中国科学院纳米系统与多级次制造重点实验室,北京 100190)
恶性肿瘤是威胁人类健康的重大疾病之一. 手术治疗及化学药物治疗仍然是目前肿瘤治疗的主要手段. 虽然传统的小分子化疗药物已展现出较好的治疗效果,但是其溶解性差、特异性差和全身毒性强等问题会带来诸多副作用[1,2],限制了其更为广泛的应用. 近年来,蛋白质和核酸类药物在肿瘤治疗方面展现出巨大潜力[3],但其成本高、易酶解及靶向性差等问题仍然亟待解决[4]. 因此,开发高效低毒的药物递送载体具有重要意义.
理想的药物载体应具备以下特点:(1)能够增强药物稳定性,防止药物在体内发生化学降解或失活;(2)能够降低药物对正常组织的生物毒性或免疫刺激;(3)能够改善药代动力学,延长药物在体内的循环时间;(4)能够实现多种药物的共同递送、协同增效;(5)实现药物的精准靶向及可控释放. 纳米技术的快速发展为开发具有上述特性的纳米药物载体提供了丰富的材料选择. 脂质体[5~7]、聚合物[8,9]、无机纳米颗粒[10,11]、树枝状大分子[12]、胶束[13]、纳米乳液[14]和聚合物药物偶联物[15]等多种纳米材料已作为载体系统应用于多种药物的递送中,如脂质载体Doxil、DaunoXome 及聚合物载体Gliadel等[16]已被美国食品药品管理局(FDA)批准用于临床使用或临床试验的载体. 由于纳米级尺寸和功能化修饰带来的独特性质,纳米载体能够有效延长药物的体内半衰期,增加药物水溶性,提高其细胞摄取效率. 然而,大部分传统纳米载体的结构均一性不佳,难以进行多级次结构组装而实现丰富的功能;在一定程度上减弱了其在生理条件下的药物递送效果;大部分传统纳米载体缺乏对药物装载剂量、药物释放速率和药物代谢行为的精准控制. 此外,有些纳米载体的靶向性较差或具有一定生物安全性隐患. 因此,如何设计具有精确结构、能够实现药物高效装载以及可控释放的纳米材料载体,以提高药物的靶向性、有效性和生物安全性,是纳米药物载体平台构建面临的关键问题.
对于上述问题,结构DNA纳米技术(Structural DNA nanotechnology)作为一种新型的可控自组装技术为人们提供了一个新颖的解决方案. 在过去的几十年里,DNA分子作为一种可编程的自组装单元备受关注. 1982 年,Seeman 等[17]创造性地利用特定序列的DNA 分子构建出了稳定的四臂结纳米结构(Holliday juncture/junction),开启了结构DNA 纳米技术这一全新的科学领域. 此后,各种基于DNA 分子自组装的纳米结构陆续被设计构建出来. 由DNA 瓦片(DNA tiles)技术构建而成的DNA 水凝胶[18]、DNA 晶体[19~21],由DNA 单链自组装(Single-stranded tiles,SST)所形成的二维(2D)或三维(3D)结构等[22,23],由滚环扩增(Rolling circle amplification,RCA)组装得到的DNA 纳米花[24]、DNA 水凝胶[25]及DNA 交联聚合物[26]等结构,已被开发作为多功能载体用于细胞和活体的药物递送[27]. 2006 年,Rothemund 等[28]报道的DNA 折纸结构开启了DNA 纳米技术的新纪元. DNA 折纸技术利用一条长的脚手架链(Scaffold strand,约7000 nt)与数百条订书钉链(Staple strands)通过热退火过程,利用氢键、亲疏水性和静电力等分子间的弱相互作用,自组装为预先设计的二维或三维纳米结构. 这种组装方法简单易行,结构高度可控,显著降低了DNA纳米技术的门槛,为DNA纳米结构的广泛应用奠定了基础. 更重要的是,数百条序列完全可控的订书钉短链也使得DNA折纸纳米结构完全可寻址(Complete addressability),即整个纳米模板具有精确的定位能力,可以用于功能基团的位点特异性修饰. 精确排列蛋白质空间取向用于其结构的解析[29]、制备纳米级传感器以提高传感精度[30]、用于引导DNA逻辑计算[31]及作为构建等离子体纳米结构的模板以制备纳米光学器件等[32,33]. 在生命科学领域,DNA折纸技术在合成仿生微纳结构[34]及构筑可控酶催化反应容器[35]等领域也取得了一定的进展. 而利用可控自组装DNA折纸结构作为药物递送载体则是其最重要的应用之一.
由于肿瘤区域的增强渗透滞留效应(EPR)[36],流体力学尺寸通常在10~400 nm之间的DNA纳米结构可以在肿瘤区域富集,进而被细胞内化以发挥其调节生物功能的作用[37]. 不同于游离的单链或双链DNA分子,自组装的DNA折纸结构表现出更强的抗酶解能力和生理环境稳定性. 此外,其亲水性表面还可以修饰寡聚赖氨酸-聚乙二醇(Oligolysine-PEG)等聚合物[38],从而进一步提高其体内稳定性,降低其免疫原性. 作为药物载体,DNA折纸结构能够通过共价或非共价等化学作用对多种功能基团进行装载,如适配体、小分子化疗药物、核酸类药物、蛋白/多肽类药物和荧光基团等,用于实现其肿瘤靶向性或携带多种治疗功能成分. 可寻址性更是赋予其在纳米级尺寸精度下精准定位药物分子、精确控制药物上载量的能力. 在DNA折纸结构中引入刺激响应基团可使其能够对外界刺激,如近红外光、肿瘤微环境或细胞溶酶体内的酸性环境、肿瘤细胞表面特异性受体及肿瘤血管标志物等进行动态响应,从而构建出基于DNA折纸结构的智能递送载体. 这类载体在到达肿瘤微环境后,可以选择性地触发其结构发生构象变化或特定化学键的断裂,定位定量释放药物. DNA分子作为绝大多数生物体内存在的生物大分子,具有天然的生物相容性,为构建体内安全可控的药物递送载体提供了有力支持. 本文总结了近年来DNA折纸结构作为药物递送系统在疾病诊疗方面的应用;详细讨论了DNA折纸结构从单一药物载体到智能响应型纳米载体的发展历程;最后对DNA折纸载体的发展前景、现阶段面临的挑战以及可能的解决方法进行了展望与分析.
1 DNA折纸载体用于多种药物分子的递送
1.1 小分子药物
1.1.1 化疗药物分子 阿霉素(Doxorubicin)是肿瘤化疗中常用的药物之一,能够通过嵌入DNA 双螺旋,抑制生物大分子合成,从而杀伤肿瘤细胞. 与其它化疗药物类似,阿霉素虽然在临床使用中展示出良好的疗效,但其游离分子静脉给药仍存在靶向性差、毒副作用大等缺点;长期给药还可能导致肿瘤多药耐药性的产生[2]. 研究表明,多种经典的药物载体,如脂质体[39]、聚合物[40]和无机纳米颗粒[41]等均可用于阿霉素的递送,并取得了较好的效果,但这些载体本身仍然可能存在一定的安全性问题.
含有蒽环结构的阿霉素可以嵌入DNA 双螺旋中. 基于这一性质,Ding等[42]尝试使用DNA 折纸作为药物载体递送阿霉素[图1(A)]. DNA折纸中大量的双螺旋使得阿霉素具有较高的上载量,并且改善了阿霉素的水溶性以及细胞内化效果,在耐药的人乳腺癌细胞MCF-7 中展现了极强的细胞毒性. 之后,Ding等[43]系统研究了不同几何形状对DNA折纸载体活体分布的影响. 在静脉注射后,DNA折纸显示出较高的肿瘤富集特性,其中三角形DNA折纸表现出最佳的肿瘤被动靶向积累. 负载阿霉素的DNA折纸在荷瘤小鼠体内展现出明显的肿瘤抑制效果,且无明显毒副作用. Högberg 等[44]研究了负载阿霉素的管状DNA折纸结构对3种乳腺癌细胞的杀伤能力. 通过在管状DNA双螺旋结构中设计不同数量的碱基缺失,以此赋予DNA折纸结构不同程度的扭曲,从而改善DNA折纸载体的装载效率和药物释放能力. 相比于游离的阿霉素,DNA 折纸载体降低了药物的细胞清除率,并且对3 种不同的肿瘤细胞(MDA-MB-231,MDA-MB-468和MCF-7)均产生了明显的杀伤效果[图1(B)]. 2019年,Li等[45]将靶向配体2-[3-(1,3-二羧丙基)]-脲基戊二酸(DUPA)和阿霉素修饰到管状DNA折纸上,构建了一种具有靶向功能的DNA 折纸载体. 先将DUPA 共价连接到DNA 单链上,然后通过杂交修饰到DNA 折纸表面. 在靶向配体的帮助下,DNA折纸载体实现了选择性的细胞内化及杀伤,且其治疗效果与靶向配体修饰数量及细胞膜上受体数量呈正相关关系[图1(C)]. 与传统的静脉注射给药方式相比,透皮给药方式(Transdermal drug delivery)具有无创或微创的特性,并且可以绕过肝脏代谢途径,是一种便捷高效的给药方式. Xu等[46]探究了不同DNA纳米结构的透皮给药能力,发现8种不同形状和尺寸的DNA纳米载体均展现出不同程度的皮肤穿透能力,其中粒径为17 nm 的DNA 四面体具有最高的穿透深度(约350 μm). 与其它常用载体(脂质体或聚合物等)相比,DNA纳米载体装载的阿霉素的局部聚集提高了2倍以上,并且对黑色素瘤具有显著的抑制效果.
柔红霉素(Daunorubicin)也是一种临床常用的化疗药物,其作用机理与阿霉素类似. Castro等[47]利用棒状DNA折纸结构递送柔红霉素进行白血病治疗相关研究. 在相同浓度的柔红霉素处理下,DNA折纸载体增加了药物的细胞摄取量和滞留时间,并且显著提高了疗效. 这些成功的例子证明了DNA折纸结构用作小分子药物载体增强肿瘤治疗效果的广阔前景.
1.1.2 染料分子 荧光染料分子是研究药物载体的常用示踪分子,能够通过荧光显微镜使纳米结构可视化. 得益于成熟的化学合成技术,荧光染料小分子能以共价或非共价等多种方式连接在DNA分子的任意位置. 2012年,Ding 等[48]报道了一种无标记荧光方法用于探究DNA 折纸结构在细胞中的分布及稳定性. 选用咔唑双花青(Carbazole-based biscyanine)作为荧光分子,将其嵌入DNA双螺旋并发出强烈荧光. 当DNA折纸结构被破坏后,染料分子得以释放,进而导致荧光强度降低,以此来监控DNA折纸结构在细胞内的稳定性. 实验结果表明,DNA折纸结构的降解过程在细胞中持续长达60 h[图1(D)].2018年,Shih等[49]利用荧光分子标记方法研究了不同DNA折纸结构的细胞摄取能力. 将Cy5荧光分子共价连接到11 种不同的DNA 折纸结构上;通过与3 种不同的肿瘤细胞共孵育,发现致密性更强的DNA折纸结构具有更高的细胞内化效率,且同种结构的摄取动力学与细胞类型相关[图1(E)]. 最近,Cai等[50]使用放射性元素标记的DNA折纸结构探究了其在活体中的分布. 正电子发射断层扫描(PET)结果显示,64Cu标记的矩形DNA折纸结构在注射5 min后即在肾脏中迅速积累,并逐渐向膀胱转移.
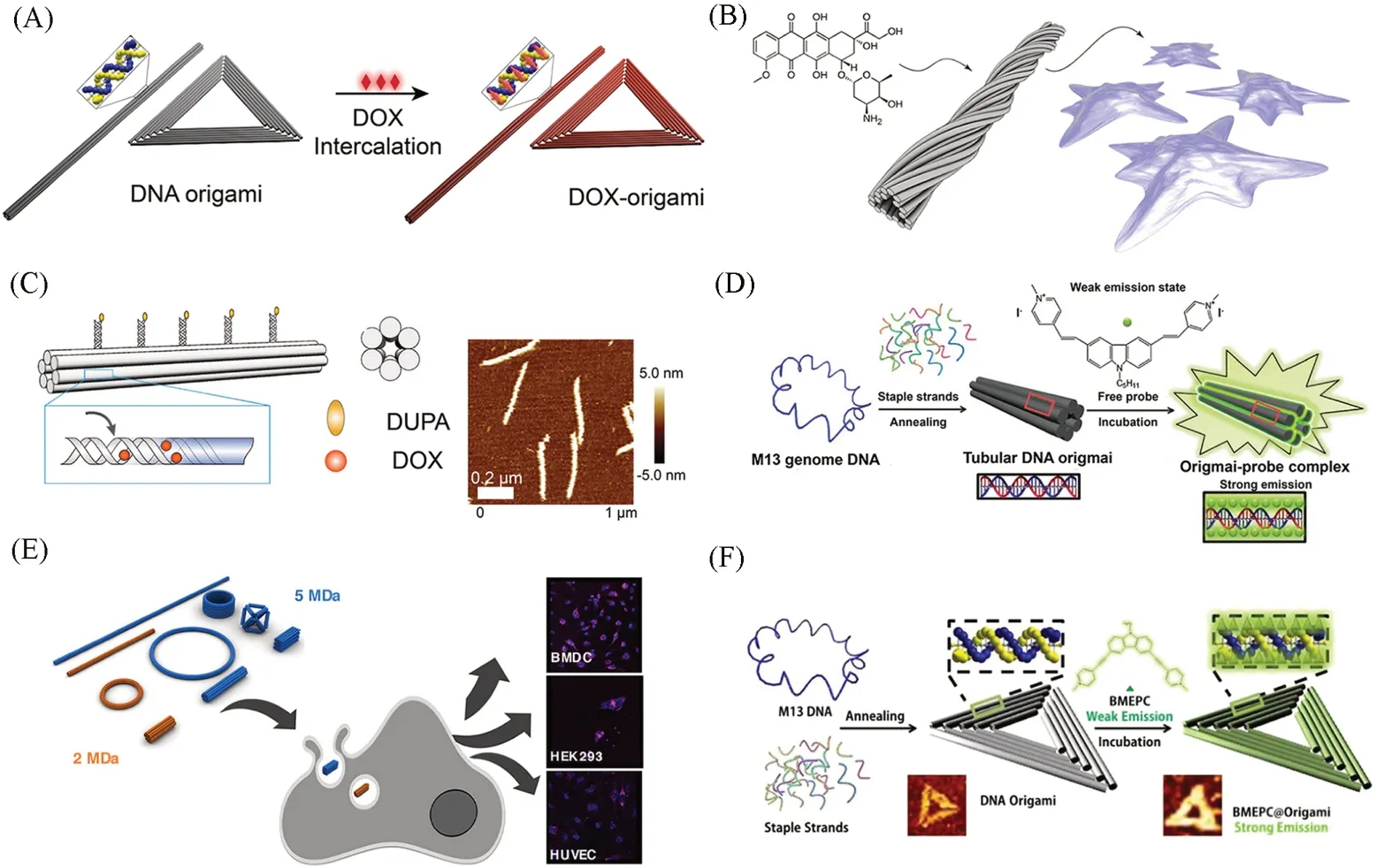
Fig.1 DNA origami as a doxorubicin carrier for circumvention of drug resistance(A)[42], DNA origami with tunable release properties for cancer treatment(B) [44], targeted DNA origami structure for doxorubicin delivery(C)[45], DNA origami with label⁃free fluorescent probe for visualization of the intracellular location(D)[48], the cellular uptake efficiency of DNA origami with different mass and shape(E)[49]and BMEPC loaded DNA origami for cancer photodynamic therapy(F)[52](A)Copyright 2012,American Chemical Society;(B)Copyright 2012,American Chemical Society;(C)Copyright 2018,American Chemical Society;(D)Copyright 2012,Royal Society of Chemistry;(E)Copyright 2019,Wiley Online Library;(F)Copyright 2016,American Chemical Society.
1.1.3 光触发分子 光动力治疗(PDT)利用光敏剂和分子氧在近红外光照射下局部产生大量活性氧,进而导致肿瘤细胞的死亡. 然而,受限于光敏剂的肿瘤穿透深度、实体瘤的缺氧环境和易光漂白等性质,游离的光敏剂难以实现较强的肿瘤杀伤能力.
咔唑衍生物BMEPC{3,6-[bis2-(1-methylpyridinium)ethynyl]-9-pentyl-carbazole diiodide}是一种可用于单光子和双光子成像的显影剂和光敏剂,可以被近红外光充分激发,高效产生活性氧[51]. 但BMEPC 在水中的溶解度很低,且容易聚集猝灭. 2015 年,Liang 等[52]尝试用DNA 折纸结构递送BMEPC,用于肿瘤细胞的光动力治疗. BMEPC 可以通过静电吸附和嵌插作用与DNA 分子结合,有效改善了其水溶性差和聚集猝灭的问题. 与游离的BMEPC分子相比,负载BMEPC分子的DNA折纸载体具有更高的细胞摄取能力,在近红外光照射下对人乳腺癌细胞MCF-7具有更强的杀伤效果[图1(F)].最近,Zhan等[53]开发了一种可用于肿瘤区域光声成像的DNA折纸载体. 巴诺蒽醌(AQ4N)作为光声成像探针和化疗药物被嵌入DNA双螺旋中. DNA折纸载体提高了AQ4N在血液中的循环时间和肿瘤富集的效率,提高了光声成像的质量,还可监测化疗药物导致的肿瘤缺氧状况.
1.2 大分子药物
1.2.1 功能核酸 未甲基化的CpG 序列(Cytosine-Phosphate-Guanosine motif)常见于细菌基因组,在哺乳动物基因组中比较罕见,因此会被免疫系统视为病原体入侵的信号,从而高效激活生物体的免疫反应. 其具体作用机制为CpG序列与免疫细胞的Toll样受体9(TLR9)相互作用,诱导生物体针对抗原产生强烈的免疫反应[54].
2011年,Liedl等[55]选用小鼠脾细胞测试了负载CpG序列的DNA折纸引起免疫反应的能力. 通过序列设计,62条CpG序列被装载到管状DNA折纸上. 与新鲜分离的小鼠脾脏细胞共孵育之后,DNA折纸载体显示出比脂质体转染更高的免疫刺激水平,使其产生更多的促炎因子,如白细胞介素-6(IL-6)和白细胞介素-12p70(IL-12p70),并且无明显的细胞毒性[图2(A)]. Rehberg 等[56]组装了DNA 纳米管作为CpG序列的递送载体. DNA纳米管基于DNA单链自组装的方法构建而成,每个DNA纳米管上包含48 条CpG 序列. 与巨噬细胞RAW264.7 孵育15 h 后,DNA 纳米管载体诱导了高效的免疫刺激. 此外,他们还探究了DNA纳米管在活体水平诱导免疫刺激的能力. 通过肌肉注射,DNA纳米管在几分钟内即被巨噬细胞内化,诱导白细胞募集到肌肉组织中,并激活周围细胞的NF-ĸB通路[图2(B)]. CpG序列在癌症的免疫治疗中也具有重要作用. Ding等[57]设计了管状DNA折纸载体,用于递送癌症相关抗原和2种佐剂(CpG和dsRNA),在小鼠体内实现了肿瘤抑制和长效的抗肿瘤免疫保护.
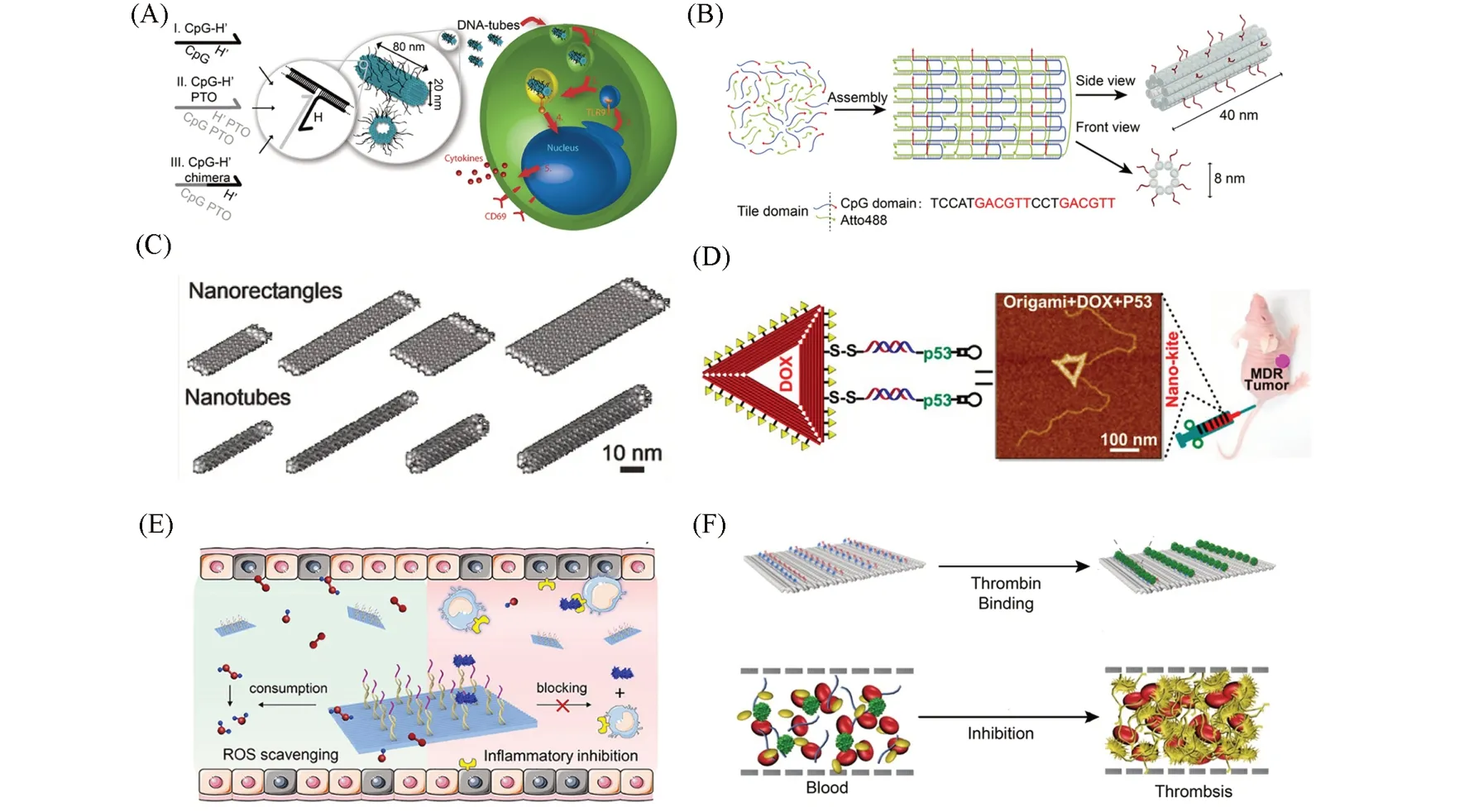
Fig.2 CpG motif⁃coated DNA origami for cellular immunostimulation(A)[55],DNA nanotube as intracellular CpG delivery vehicle(B)[56], Bcl2⁃targeting siRNA delivered by DNA nanoparticles for suppressing cancer cell growth(C) [61], DNA origami as a long chain nucleic acid delivery carrier for cancer combined therapy(D)[64],aptamer modified DNA origami for sequential therapy of acute kidney injury(E)[66]and DNA origami⁃based aptamer nanoarray for anticoagulation in hemodialysis(F)[67](A)Copyright 2011,American Chemical Society;(B)Copyright 2015,Elsevier;(C)Copyright 2017,Wiley Online Library;(D)Copyright 2018,American Chemical Society;(E)Copyright 2021,American Chemical Society;(F)Copyright 2020,Springer Nature.
RNA干扰(RNAi)疗法是一种由小干扰RNA(siRNA)介导的内在基因沉默途径,通过siRNA结合互补的mRNA来抑制其下游蛋白质的合成[58]. RNAi疗法以其极高的特异性受到越来越多的关注,但是作为一种核酸类药物,易酶促降解、内化效率低和体内半衰期短等问题仍然限制了RNA 疗法的广泛应用. 研究人元已经开发了多种递送材料如脂质体、聚合物及无机纳米颗粒等来提高siRNA的稳定性与内化效率,但是这些材料本身又会导致一定的细胞毒性及免疫反应等问题[59]. 因此,近年来生物相容性更好的核酸递送载体受到了广泛关注. 2012年,Anderson等[60]使用DNA四面体作为siRNA的递送载体,用于体内靶向基因沉默. 利用DNA 纳米结构的可编程性控制肿瘤细胞靶向配体(多肽或叶酸)在DNA四面体表面的朝向和密度. 在荷瘤小鼠模型中,叶酸修饰的DNA四面体(半衰期24.2 min)表现出比游离siRNA(半衰期6 min)更长的血液循环时间,并增强了其在肿瘤区域的富集. 将叶酸和抗荧光素酶siRNA修饰的四面体注射到KB异种移植肿瘤后,可以观察到明显的基因沉默,且无明显的免疫反应产生. Shin 等[61]基于模块化DNA 砖的方法构建了一系列不同尺寸矩形和管状DNA 纳米颗粒(DNPs).通过在DNPs表面延伸出一定长度的DNA单链来杂交靶向抗凋亡蛋白Bcl2的siRNA. 不同尺寸的DNA纳米颗粒均可以提高siRNA 的稳定性和细胞内化效率. 其中,尺寸越小的DNPs 可以更多地被肿瘤细胞内化,有效降低相关蛋白表达水平,抑制肿瘤细胞的生长. 负载siRNA的DNPs还在荷瘤小鼠体内展现出高效的基因沉默,抑制肿瘤的生长,并且无明显的生物毒性[图2(C)].
肿瘤多药耐药性(MDR)是癌症化疗过程中常见的问题之一,其可能的产生机制包括改变药物代谢途径、增加药物外排、减少药物摄取以及DNA损伤修复功能失衡等. 虽然对这些机制已经有了一定程度的研究,但尚未完全阐明. P-糖蛋白(Pgp)是一种跨膜ATP转运蛋白,可以促进很多化疗小分子外排出癌细胞. 研究表明,Pgp在肿瘤细胞内的表达明显上升是导致多种肿瘤细胞产生耐药性的重要原因之一[62]. 因此,靶向Pgp 进而抑制其发挥功能是逆转肿瘤多药耐药性的重要手段之一. 2018 年,Ding 等[63]设计了一种三角形DNA 折纸结构,用作RNAi 和阿霉素的共递送载体. 2 个MDR 相关基因(Pgp基因和Sur基因)的小发夹RNA和靶向基团MUC1被装载到DNA折纸载体上. 共递送载体提高了RNA的酶稳定性,在人乳腺癌细胞MCF-7中显示出高效的细胞摄取和基因敲除能力. 加载阿霉素后,共递送载体在荷瘤小鼠体内进行协同治疗,显著抑制了耐药性肿瘤的生长. 随后,又将DNA折纸结构作为线性肿瘤治疗基因p53和阿霉素的共递送载体[64][图2(D)],用于多药耐药性肿瘤的协同治疗. 反义核酸(ASOs)是一类可以与靶基因配对,进行基因表达调控的治疗型核酸,是癌症基因疗法的候选药物之一. Chu等[65]设计了一种多功能DNA折纸载体用于递送反义核酸和阿霉素等药物分子. 2种反义核酸(Pgp-ASO和Bcl2-ASO)和适配体MUC1通过位点设计被精确地组装在DNA折纸模板上. 在靶向适配体的作用下,DNA折纸载体被高效内化到癌细胞中,进而在细胞内进行基因调控,下调相关蛋白表达水平. 多功能的DNA载体在2种耐药癌细胞系(MCF-7R和HeLa-R)均显示出良好的细胞杀伤效果,表明其广谱的抗肿瘤效果.
适配体(Aptamer)通常是单链DNA/RNA分子,在体外经过配体指数富集的系统进化(SELEX)过程筛选得到,能够在复杂的生物环境中通过氢键、空间构型匹配等弱相互作用识别并结合特定的标志物,形成稳定的二级结构[66]. 鉴于其与DNA折纸结构的同源性,适配体可以很容易地通过序列延伸或碱基互补配对的方法连接到DNA折纸结构上. Ge等[67]开发了一种肾积累的DNA纳米装置,用于不同阶段急性肾损伤的治疗. 在矩形DNA折纸上修饰抗补体成分5a适配体(aC5a),在治疗前期DNA折纸可以清除肾脏的活性氧来缓解肾脏的氧化应激反应,随后其靶向结合C5a蛋白,抑制其活性从而阻断后续的炎症反应. 这种基于不同时间的贯序治疗在急性肾损伤小鼠模型中展现出明显的治疗效果[图2(E)]. 2020年,Ding等[68]开发了一种基于矩形DNA 折纸的DNA 纳米抗凝剂,旨在捕获血液中的凝血酶以提高血液透析过程中的抗凝效果. 2种凝血酶适配体(TBA15和HD22)被规律地排列在DNA折纸上. 通过不同的位点设计可以控制2种适配体的间距,当二者相距5.4 nm时,对凝血酶具有最高的捕获效率. 双适配体修饰的DNA折纸载体在人血浆、新鲜全血和小鼠模型中均可有效防止血栓的形成,并且显示出免疫惰性[图2(F)]. Li等[69]通过重组质粒的方法将适配体序列连接到M13脚手架上,而非DNA折纸结构的订书钉短链上,然后采用一锅法组装得到带有适配体的DNA折纸结构. 这种方法明显提高了适配体的抗酶解能力,并且整合了血小板衍生生长因子(PDGF)适配体的DNA 折纸载体,对乳腺癌细胞MDA-MB-231具有显著的抑制作用. 最近,基于适配体-受体高特异性和高亲和力的特性,Baker等[70]开发了一种特异性识别细胞表面蛋白的DNA分子信标,用于提高冷冻电镜断层扫描(cryoET)过程中的信噪比. 通过在DNA折纸结构上连接不同适配体,可以使其在复杂的生物环境中准确地结合目标分子. DNA分子信标能精确识别和定位目标结构,从而提高了膜囊泡、包膜病毒以及细胞在冷冻电镜下的成像分辨率.
1.2.2 多肽和蛋白 多肽和蛋白(抗原、抗体、免疫球蛋白等)同样能够作为药物用于多种疾病的治疗. 目前临床应用中的大多数蛋白候选药物仍然面临着靶向性差、酶促降解和膜通透性差等问题[71].多肽与蛋白可以通过多种共价或非共价的方式与DNA连接形成偶联物,如Click反应[72]、NHS/EDC反应[73]、生物素-链霉亲和素[74]、适配体-靶标[75]和抗原-抗体[74]等,这使得利用DNA折纸载体递送多肽和蛋白、调控生物功能成为可能.

Fig.3 Organizing antigen on DNA origami for B⁃cell activation(A)[76],clustering of death receptors using DNA origami sheets(B)[80], nanoscale FasL organization on DNA origami to induce cell apoptosis(C)[81], DNA origami carriers for intracellular delivery of RNase A(D)[83], DNA origami platform for cytokine delivery to alleviate acute kidney injury(E)[84] and DNA origami⁃based icosahedral shell system for virus trapping(F)[85](A)Copyright 2020,Springer Nature;(B)Copyright 2020,American Chemical Society;(C)Copyright 2021,Wiley Online Library;(D)Copyright 2019,American Chemical Society;(E)Copyright 2021,American Chemical Society;(F)Copyright 2021,Springer Nature.
利用DNA折纸结构强大的可控组装及定位修饰能力,可以在纳米尺度下精确地控制抗原间距,以探究抗原的不同分布对免疫细胞刺激水平的影响. Bathe 等[76]将不同数目的疫苗免疫原(eOD-GT8)修饰在DNA折纸结构上,旨在探究抗原数目、间距和亲和力对B细胞活化的影响. 利用DNA折纸的位点可寻址性,构建了修饰有不同数量和排布的eOD-GT8的DNA折纸载体. 在病毒样DNA折纸表面修饰最少5个抗原(间距20~30 nm)便可以最大化地活化B细胞,且DNA 折纸结构的刚性对B细胞的刺激水平也有重要影响[图3(A)]. Sevcsik等[77]将激动剂肽/主要组织相容复合物(pMHCs)通过生物素-链霉亲和素缀合到DNA 折纸模板上,发现2个间距为20 nm的pMHC是诱导T细胞发生信号传导的最低条件. Douglas等[78]开发了一种DNA折纸“钉板”,用于控制合成T细胞受体的空间排布. 使用癌症相关的嵌合抗原受体T细胞(CAR-T)模型,发现受体在DNA折纸钉板上的空间排布决定了细胞信号激活的灵敏度和动力学. 类似地,Teixeira等[79]利用线框DNA折纸结构研究发现,程序性死亡配体(PD-L1)的空间排布会对T细胞信号展现出不同程度的抑制效果. 以上研究证明了抗原的纳米级排布会影响免疫细胞活化效率,可能为纳米疫苗的设计提供参考原则. 利用DNA折纸结构组装肿瘤细胞相关配体可以用于激活肿瘤细胞凋亡信号. Högberg 等[80]开发了2 种不同的DNA 折纸结构作为跨膜肿瘤坏死因子(TNF)的组装模板. 通过控制TNF在DNA折纸模板上的相对距离,发现配体间距为5 nm是诱导肿瘤细胞发生凋亡的关键距离,这种排布的DNA 折纸载体在3 种不同的肿瘤细胞(MCF-7,SK-BR-3 和MDAMB-231)中均可有效诱导细胞凋亡[图3(B)]. Jungemann等[81]将死亡受体配体(FasL)通过生物素-链霉亲和素作用精确组装到矩形DNA折纸模板上. 相比于游离的FasL,相距为10 nm的六角形FasL排布明显加快了肿瘤细胞凋亡信号的传导,传导效率提高近100倍[图3(C)].
除了上述分子量较小的多肽类分子外,分子量较大的蛋白也可以通过DNA 折纸载体进行递送.Kjems等[82]开发了一种转铁蛋白修饰的DNA折纸载体,用于增强细胞内化效率. 利用蛋白质上的金属结合位点与NHS修饰的DNA 链进行偶联,可以将DNA 共价偶联至蛋白表面的特定位置,避免影响蛋白功能. 转铁蛋白的偶联显著增强了DNA折纸在癌细胞系KB中的内化效率,且其增幅与折纸表面转铁蛋白的数量呈正相关. Ding 等[83]报道了一种利用DNA 折纸载体递送核糖核酸酶A(RNase A)的方法. 采用经典的SMCC反应得到RNase A-DNA偶联物,通过碱基互补配对的方式将RNase A 负载到矩形DNA折纸上. 在整合癌细胞靶向的适配体后,递送系统的细胞内化效率得到增强,且对乳腺癌细胞系MCF-7 具有良好的杀伤效果[图3(D)]. 最近,Zheng 等[84]开发了一种递送白细胞介素-33(IL-33)的DNA折纸载体,用于急性肾损伤的免疫治疗. 先将IL-33通过化学连接剂3-(2-吡啶二硫代)丙酸N-羟基琥珀酰亚胺酯(SPDP)与巯基修饰的DNA链交联,所得偶联产物随后通过碱基互补配对组装到DNA折纸模板上. 通过静脉注射后,DNA折纸载体优先将IL-33递送至肾脏,诱导小鼠体内2型淋巴细胞分化(ILC 2s),并使调节性T细胞(T-reg)快速扩增. 与游离的IL-33相比,DNA折纸载体延长了IL-33在肾脏的停留时间,对急性肾损伤表现出更好的治疗效果[图3(E)]. 此外,利用DNA折纸结构的可编程性还可以开发更为高阶的结构. Dietz等[85]利用可编程的DNA三角块组装了内径高达280 nm的DNA二十面体外壳,构造了一种广谱的抗病毒平台. 在其内腔中偶联了乙型肝炎病毒抗体(anti-HBc17H7)之后,DNA二十面体外壳表现出特异性的病毒捕获能力,并显著抑制其毒性[图3(F)].
此外,DNA 折纸还可以用于溶菌酶的靶向递送来抑制细菌的活性[86],用于信号蛋白的精确排布[87],用于连接多种天然酶以控制其催化效率[88]等.
1.2.3 其它纳米颗粒 DNA纳米载体同样可用于递送多种无机纳米颗粒. 金纳米棒(AuNR)是长度为几十到几百纳米的棒状金纳米颗粒,由于其可控的表面等离子共振(LSPR)特性,在光热治疗中具有非常广阔的应用前景[89]. 此外,金纳米棒可通过金硫键与DNA链共价连接,为DNA折纸载体的递送提供了条件.
2015年,Ding等[90]将金纳米棒连接至DNA折纸表面,构建了一种双功能的纳米组装体,以探究其活体光热治疗功效. 与裸金纳米棒或管状DNA折纸载体相比,三角形DNA折纸载体显著增加了金纳米棒的细胞内化效率. 在808 nm的激光照射下,该组装体在细胞水平和活体水平上同时展现出良好的肿瘤细胞杀伤能力. 此外,该纳米组装体同样可作为光声成像(OAI)造影剂,用于肿瘤的光声成像[91].负载金纳米棒的DNA折纸可以促使探针进入肿瘤深部,提高了成像质量[图4(A)]. 之后,Ding等[92]设计并制备了一种多功能的DNA折纸平台,整合了阿霉素、金纳米棒及MUC1适配体等功能元件,在耐药性肿瘤细胞MCF-7R 中表现出优异的杀伤能力. 为了进一步提高金纳米棒光热治疗的效率,Zhu 等[93]开发了一种DNA 八面体折纸框架,精确组装了siRNA、阿霉素及金纳米棒等功能元件. 2 种siRNA可以抑制结缔组织生长因子(CTGF)和热休克蛋白(HSP72)的表达,提高了肿瘤细胞对化疗和光热治疗的敏感性. 在协同治疗的作用下,该DNA折纸载体显著下调了细胞内相关蛋白的表达水平,且在荷瘤小鼠模型中抑制了肿瘤的生长[图4(B)].
鉴于金纳米颗粒较高的电子衬度,Ke 等[94]将直径10 nm 的金纳米颗粒与不同尺寸的DNA 折纸结构相连,利用透射电子显微镜(TEM)来跟踪DNA 折纸在癌细胞中的内化路径,评估了DNA 折纸的形状、大小以及癌细胞种类对DNA 折纸细胞内化效率的影响[图4(C)]. DNA 折纸结构还可以用于量子点(QD)及氧化铁纳米颗粒(IONP)的纳米尺度排布. 2011年,Hughes等[95]利用生物素化的DNA折纸结构,构建了周期性排列的量子点阵列,但这种方法连接效率较低. 最近,Diaz 等[96]将肽核酸短链通过配位键固定到量子点的ZnS表面,随后通过碱基互补配对连接到DNA折纸模板上,对量子点实现了超过90%的捕获效率,并且由于肽核酸短链的可设计性,量子点的排布也更为可控[图4(D)]. 磁性氧化铁纳米颗粒(IONP)可以作为核磁共振(MRI)造影剂进行磁热治疗等应用,在生物医学方面具有广阔前景. Ke等[97]通过DNA折纸结构来控制IONP数量和距离,优化了MRI的对比率. 虽然诸如DNA折纸载体递送的量子点和氧化铁纳米颗粒尚未有疾病治疗方面的相关报道,但这些探索丰富了DNA折纸载体的应用领域,为纳米药物递送系统的发展提供了新思路.

Fig.4 DNA origami⁃gold nanorod hybrids for enhanced optoacoustic imaging and photothermal therapy(A)[91], DNA origami octahedron for dual enhancement of chemotherapy and photothermal therapy(B)[93], AuNP modified DNA origami structures for visualization of cellular uptake process(C)[94] and DNA origami with peptide⁃PNA for quantum dot conjugation(D)[96](A)Copyright 2016,Wiley Online Library;(B)Copyright 2021,Wiley Online Library;(C)Copyright 2018,American Chemical Society;(D)Copyright 2021,American Chemical Society.
2 智能响应型DNA折纸载体
将多种刺激响应功能基团引入DNA折纸结构中,可以从分子水平设计出针对不同刺激信号产生构象变化的智能响应型DNA折纸结构. 迄今,研究人员已经构建了多种动态响应结构,包括DNA单链控制开合的DNA折纸盒子[98]及光控底物合成通道[99]等. 利用某些疾病靶点作为刺激信号,智能DNA折纸载体可以选择性地在病患部位发生变构,进而释放药物,为所装载的药物提供更为充分的保护,并且减少递送过程中由于脱靶效应所产生的毒副作用,从而提高药物的靶向控释效果,在生物传感、成像和疾病治疗等领域具有广阔的应用前景.
Church 等[100]报道了一种基于DNA 折纸的桶状DNA 纳米装置,能感受细胞表面受体而响应性打开,从而实现内部载荷分子的可控释放. 桶状DNA纳米装置的两侧被延伸的DNA链与核酸适配体杂交而锁住,只有当DNA 纳米装置接触到细胞膜表面表达的相应受体时,适配体才发生构象变化,使DNA纳米装置打开,进而暴露内部载荷. 选用荧光标记的抗体Fab片段作为内部载荷,当适配体遇到人白细胞表面抗原时,DNA折纸桶打开,抗体与表面受体结合导致荧光增强. 当纳米桶的两侧被不同适配体锁住时,便得到了一种逻辑“AND”门编码的DNA纳米装置,需要细胞表面双阳性受体存在时,同时解锁2种核酸适配体才能打开DNA纳米桶,进而诱导细胞信号转导或发生凋亡[图5(A)]. 该工作将逻辑门控添加到DNA折纸结构中,在复杂的生物环境中可以控制内部载荷的定位释放,为智能药物递送体系的设计指明了方向. Bachelet等[31]基于这种结构设计了多种逻辑门(AND,OR,XOR,NAND,NOT,CNOT 和半加法器),并研究了其在蟑螂(Blaberus discoidalis)体内的动态相互作用. 2018 年,Zhao等[101]设计了一种智能DNA纳米机器,旨在将装载于其内腔的凝血酶递送到肿瘤血管. AS1411适配体作为靶向基团和响应基团,使DNA纳米机器在肿瘤血管处定位开启,进而暴露出其内部载荷凝血酶,导致血管阻塞并诱导肿瘤坏死. 在异种移植荷瘤小鼠模型和原发肺癌小鼠模型上的治疗实验均表明,该DNA 纳米机器可以选择性地在肿瘤区域暴露凝血酶,诱导肿瘤血管发生血栓,实现对乳腺癌、卵巢癌、黑色素瘤和肺癌等恶性肿瘤的生长抑制,延长了小鼠的生存期. 此外,DNA纳米机器在正常小鼠和巴马小型猪身上展示出良好的生物安全性和免疫惰性,证明其具备临床应用的潜力.

Fig.5 DNA origami barrel for targeted transport of different payloads(A)[100], DNA origami nanocapsule for pH⁃controlled opening and cargo exposure(B)[102],acid responsive DNA origami⁃based vaccine for cancer immunotherapy(C) [57], tubular DNA nanodevice as siRNA/doxorubicin vehicle for cancer combined therapy(D)[103], DNA origami nanofactory for RNA production and processing(E)[104] and DNA nanodevice⁃based logic gating triggered by antigen(F)[106](A)Copyright 2012,Springer Nature;(B)Copyright 2019,American Chemical Society;(C)Copyright 2020,Springer Nature;(D)Copyright 2020,Wiley Online Library;(E)Copyright 2020,American Chemical Society;(F)Copyright 2021,American Chemical Society.
DNA 三链体(DNA triplex)是由一条核酸单链通过Hoogsteen 碱基配对作用,与双螺旋DNA 中的一条链通过氢键相连接而形成的一种三链结构,具有酸响应变构的特性. 基于这一特性,Linko等[102]构建了DNA纳米胶囊,通过改变溶液pH能可逆地控制胶囊的开合. 通过荧光共振能量转移(FRET)验证了DNA纳米胶囊的受控开合并且暴露内部载荷分子(金球或酶)的过程. 此外,DNA纳米胶囊的FRET效率在低盐浓度下(近似于生理环境)没有受到影响,只是DNA折纸结构有轻微变形. 这表明DNA纳米胶囊可以在活体下使用,具备体内药物递送的可能[图5(B)]. 最近,肿瘤疫苗展现了肿瘤高效治疗的巨大潜力. Ding等[57]构建了一种基于DNA折纸结构的纳米疫苗,旨在递送肿瘤相关的抗原和佐剂.DNA纳米装置的内腔中封装了肿瘤相关抗原肽(OVA)和2种核酸类佐剂(dsRNA和环状CpG),整个装置被DNA三链体及其互补链通过碱基互补配对而锁定. 通过皮下注射,DNA纳米装置在抗原递呈细胞的溶酶体中酸化打开,从而暴露载荷以激活强烈的免疫反应,进而导致肿瘤消退. DNA纳米装置在荷瘤小鼠体内明显地刺激了免疫系统,导致部分免疫指标的上调,如细胞因子水平(TNF-α和IFN-γ)、CD80/86表达水平等,激活了抗原特异性T细胞,杀伤肿瘤细胞,在活体水平展示了对黑色素瘤、结肠癌等肿瘤的明显抑制作用. 此外,该DNA纳米装置还可在小鼠体内产生长效保护,抑制了肿瘤的复发[图5(C)].
还原型谷胱甘肽(GSH)可与二硫键相互作用使其断裂,通常在肿瘤细胞中高表达. 基于这一特性,Ding 等[103]构建了一种用于siRNA 和阿霉素等药物递送的管状DNA 折纸载体,用于克服肿瘤细胞的多药耐药性. 管状DNA纳米结构被一系列二硫键封锁,可以被胞质内的谷胱甘肽切割进而暴露其内腔中装载的2 种siRNA(siBcl2 和siPgp),诱导细胞死亡. 在与阿霉素的协同治疗作用下,该DNA 折纸载体显著下调了细胞内相关蛋白表达水平,并在荷瘤小鼠模型中显示出良好的治疗效果[图5(D)]. 智能DNA折纸载体还可以选择性地执行预设功能. Shih等[104]报道了一种桶状的DNA纳米工厂,可以自主生产和加工RNA. 利用DNA折纸圆筒作为底盘,通过特定的DNA模板、RNA聚合酶和RNA内切酶的空间排列,整合了滚环转录和RNA合成过程. 得益于DNA折纸的可寻址性和灵活性,DNA纳米工厂有序地排布了多种功能分子,从而实现RNA 的连续生产和加工[图5(E)]. Han等[105]构建了一种可用于人体血浆的自主血液抗凝的智能DNA纳米机器人. 桶状DNA折纸结构的内腔中包含由DNA链组成的输入传感器、阈值控制器和抑制剂发生器等功能模块,用于环境中凝血酶浓度的感知和捕获. 当凝血酶浓度达到一定阈值时,DNA纳米机器人可以自主地捕获凝血酶以降低环境浓度. 通过简单的算法和模块化的设计,DNA纳米机器人在体外和血浆中均表现出显著的抗凝效果. 这种可以用于智能监测和治疗的DNA折纸载体极大地推动了个性化和智能化治疗的发展. 最近,Dietz等[106]设计了一种抗原特异性响应的DNA二十面体折纸结构. DNA二十面体由20个相同的三角形DNA折纸块通过形状互补和Mg2+的桥接作用组装而成. 成壳后三角形块边缘修饰的抗原可以与二价IgG结合,使DNA二十面体可以抵抗低Mg2+环境. 当加入可溶性抗原将IgG置换下来后,DNA二十面体会发生解聚. 此外,将该结构用于抗原驱动的逻辑“AND”门的设计,在三角形块上修饰2种不同的抗原,只有当溶液中同时存在2种抗原时,才可以触发结构解聚. 这种可控解聚的DNA二十面体具有大尺寸的内腔,实现了乙型肝炎病毒的装载与可控释放[图5(F)].
3 总结与展望
随着结构DNA 纳米技术的飞速发展,DNA 折纸结构作为新型药物载体平台已经在生物医学领域展现出广阔的应用前景. 基于DNA 折纸技术的DNA 自组装材料具有优异的结构可设计性和可编程性、表面可修饰性及良好的生物相容性等独特性质,这些特性使其能够高效装载治疗成分,如小分子药物、适配体、核酸药物、蛋白质和无机纳米颗粒等. DNA折纸载体还可以有效解决药物溶解性差、靶向性差及生物毒性大等问题,进一步提高药物治疗效果. DNA折纸载体独特的性能使其具有精确的肿瘤靶向性、多功能性、化学稳定性以及可控药物释放的能力,在诸多方面切合肿瘤治疗的需求.
尽管有关这种新型自组装材料在生物医学领域的研究已经取得了诸多进展,但在其临床应用转化过程中仍然面临着大量挑战. 首先,DNA折纸载体的体内特性还待详细阐明,包括药代动力学、细胞内代谢途径、体内分布和清除机制等. DNA折纸结构作为具有负电荷的聚电解质组装体,相对较高的表面电荷密度可能对其在体内的循环、运输和清除行为产生较大影响. 此外,当DNA折纸结构进入血液循环后,可能会被蛋白冠包裹或巨噬细胞内吞而导致其失效. 聚乙二醇[107]和类肽[108]等阳离子外壳包裹的DNA 折纸结构已被证明能够改善其生理环境稳定性和体内循环半衰期. Shih等[49]证明了增加DNA结构的尺寸和紧密度可以提高其细胞内化的效率. Cai等[50]提出DNA折纸结构具有优先的肾富集效应. 这些结果均在一定程度上阐明了DNA折纸结构在体外和体内的特性. 其次,DNA折纸载体在体内的免疫原性也是一个重要的问题[109]. 虽然DNA 是一种天然存在于生物体内的材料,但在某些情况下,如结构中CpG 序列或某些特定序列的存在可能会引起免疫反应[110]. 这对所使用的DNA 链的序列设计提出了要求. 作为DNA折纸载体向临床应用发展的必要条件,大规模、高纯度制备上述DNA纳米结构也同样是一大挑战. 基于固相合成的方法得到的DNA短链成本往往较高. 而对于DNA折纸结构,除了数量众多的DNA 短链,M13 骨架链的大量制备更是限制了其大量生产. 针对这一问题,Dietz等[111]建立了一种利用生物技术大规模量产M13基因组及DNA短链的方法,将DNA折纸结构的生产成本降至0.18欧元/毫克. 这相对于使用固相合成的DNA短链,成本降低了3个数量级,极大地推动了DNA折纸载体向实际应用的发展.
随着对DNA折纸结构设计、药代动力学、体内代谢途径及与相关疾病靶点相互作用认识的不断加深,未来基于DNA折纸载体的递送系统有望实现个体化、定制化的疾病治疗,即基于患者的疾病种类而设计更安全、高效的个性化DNA纳米药物,以最大限度地达到精准治疗的效果. 可编程性和空间可寻址性也使得DNA纳米结构成为控制功能元件纳米尺度排列的最佳模板之一. 靶向配体或药物分子可以在DNA折纸模板预先设计好的位点精确自组装,其朝向和距离可以被精准控制,有望进一步诱导产生更强的治疗效果. 此外,基于DNA折纸结构的智能纳米机器可以针对肿瘤微环境或肿瘤细胞做出特异性响应,触发机械变构,以设计可用于级联药物递送、时空可控释放的DNA纳米平台. DNA纳米技术正处于高速发展时期,必将在未来的生物医学领域逐渐释放巨大潜力.

