慢性乙型肝炎妊娠患者应用替诺福韦酯进行母婴阻断的有效性和安全性评价
程芳 陈毅华 岳春霞 胡敏 齐明华
母婴垂直传播是乙型肝炎病毒传播的主要途径,因此,阻断乙型肝炎病毒的母婴传播,对于提高妊娠质量,具有重要意义。妊娠期是一个特殊的生理时期,在进行临床用药的时候,必须注意安全,谨慎用药,以免对胎儿的正常发育造成影响[1]。替诺福韦酯属于单磷酸腺苷类似物,是临床治疗乙型肝炎的常用药物,对于乙型肝炎病毒感染有较好的抗病毒效果[2]。该药物安全高效,对于妊娠患者较适用[3]。然而,部分患者对于治疗效果有担忧,不愿意在孕期接受抗病毒治疗。本院开展了这一方面的研究,为该治疗方案提供研究依据。报告如下。
1 资料与方法
1.1 一般资料 选取2018 年5 月~2019 年12 月本院入组“乙型肝炎母婴零传播”工程项目接受母婴阻断治疗的130 例慢性乙型肝炎妊娠患者作为研究对象,按照随机数字表对照法分为观察组和对照组,每组65 例。观察组患者年龄24~37 岁,平均年龄(29.12±6.55)岁;孕周24~29 周,平均孕周(26.12±1.33)周;初产妇43 例,经产妇22 例。对照组患者年龄25~37 岁,平均年龄(29.45±7.11)岁;孕周24~29 周,平均孕周(26.48±1.44)周;初产妇44 例,经产妇21 例。两组患者一般资料比较差异无统计学意义(P>0.05)。见表1。
表1 两组一般资料比较(,n)
注:两组比较,P>0.05
1.2 纳入及排除标准 纳入标准:符合慢性乙型肝炎诊断标准;患者HBeAg、HBsAg 均为阳性;孕24~28 周;胎儿发育正常,孕妇计划继续妊娠者;患者知情同意,签署相关文件。排除标准:接受过抗病毒治疗者;合并艾滋病者;合并甲型肝炎者;合并丙型肝炎者;合并丁型肝炎者;合并高血压、糖尿病等疾病者;合并其他病毒感染者。
1.3 方法 对照组接受常规保肝治疗:患者在妊娠中晚期口服替比夫定(北京诺华制药有限公司,国药准字H20070028),600 mg/次,1 次/d。服药直至产后3 个月。观察组在对照组治疗基础上联合替诺福韦酯[Aspen Port Elizabeth (Pty) Ltd,批准文号H20130589]治疗,替诺福韦酯300 mg/d,口服,至妊娠后3 个月。产妇分娩后,遵医嘱停药。新生儿在娩出后24 h 内需要根据乙型肝炎病毒母婴阻断方案进行联合免疫治疗,注射乙型肝炎疫苗10 μg、乙型肝炎免疫球蛋白100 U,而且要指导新生儿在1、6 月龄时分别注射1 次乙型肝炎疫苗10 μg。利用移动医疗工具“小贝壳App”随访12个月进行效果评价。
1.4 观察指标及判定标准 比较两组患者治疗前后血清ALT、HBV-DNA 水平以及治疗后不良反应发生情况;新生儿出生5 min 时Apgar 评分、乙型肝炎病毒感染情况。ALT 水平测定:采取全自动生化分析仪进行检测,经速率法检测ALT 水平,当ALT<40 U/L 时认为该指标水平正常。HBV-DNA 水平测定:采取聚合酶链式反应(PCR)法进行检测,试剂盒购买自罗氏公司。母婴传播阻断效果判断:在婴儿12 月龄的时候检测HBsAg 阴性,则认为阻断成功。
1.5 统计学方法 采用SPSS22.0 统计学软件处理数据。计量资料以均数±标准差()表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者治疗前后血清ALT、HBV-DNA 水平比较 治疗前,两组患者ALT、HBV-DNA 水平比较,差异均无统计学意义(P>0.05);治疗后,观察组患者血清ALT(27.03±4.99)U/L、HBV-DNA(2.53±0.39)IU/ml 均低于对照组的(52.18±7.34)U/L、(5.31±0.32)IU/ml,差异均具有统计学意义(P<0.05)。见表2。
表2 两组患者治疗前后血清ALT、HBV-DNA 水平比较()
注:与对照组比较,aP<0.05
2.2 两组新生儿Apgar 评分及乙型肝炎病毒感染情况比较 观察组新生儿出生5 min 时Apgar 评分为(9.66±0.32)分,与对照组的(9.58±0.35)分比较,差异无统计学意义(t=1.360,P>0.05);观察组新生儿在出生时、6 月龄、12 月龄时的HBsAg 阳性率、HBeAg 阳性率、HBV-DNA≥100 IU/ml 发生率均为0,对照组新生儿在出生时、6 月龄、12 月龄时的HBsAg 阳性率分比为13.85%、10.77%、10.77%,HBeAg 阳性率分别为12.31%、9.23%、7.69%,HBV-DNA≥100 IU/ml 发生率分别为12.31%、6.15%、6.15%;观察组新生儿在出生时、6 月龄、12 月龄时的HBsAg 阳性率、HBeAg 阳性率、HBV-DNA≥100 IU/ml 发生率均低于同期对照组,差异均具有统计学意义(P<0.05)。见表3。
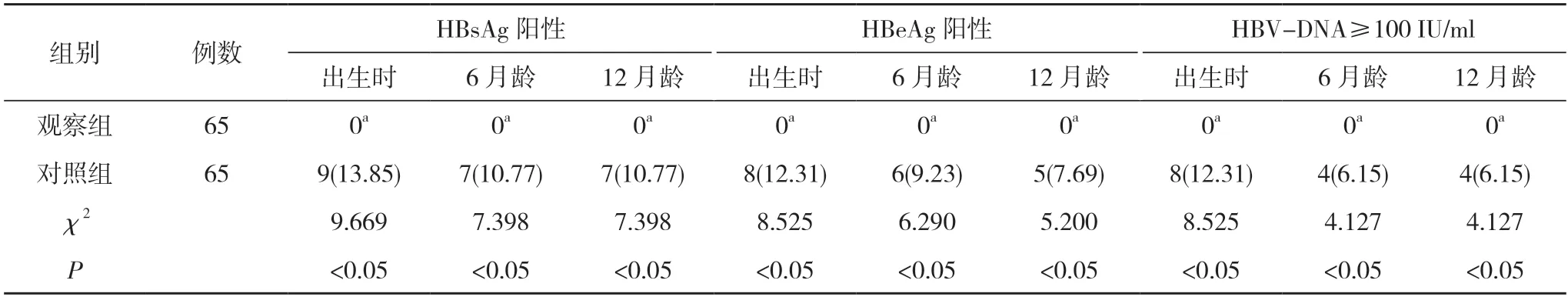
表3 两组新生儿乙型肝炎病毒感染情况比较[n(%)]
2.3 两组患者治疗后不良反应发生情况比较 两组患者治疗后均仅发生轻度不良反应,未经特殊处理自行消失。两组不良反应发生率比较,差异无统计学意义(P>0.05)。见表4。

表4 两组患者治疗后不良反应发生情况比较[n(%)]
3 讨论
慢性乙型肝炎发病率较高,属于传染性疾病的抑制,每年因乙型肝炎病毒感染而造成终末期肝病、原发病肝癌的患者超过60 万例[4,5]。有效的预防乙型肝炎病毒传染,是临床研究的重要难题之一,切断传播途径是最为有效的措施之一。
乙型肝炎母婴传播主要途径有多种,一种是母婴传播,感染乙型肝炎病毒的夫妻如有怀孕打算,应先寻求专业医生的指导,在孕前、孕中、产后接受治疗,从而有效地提高乙型肝炎阻断成功率[5,6]。一种是通过胎盘造成胎儿发生宫内感染,还有的情况是经阴道分娩或产钳助产造成的胎儿局部皮肤受损,从而使得少量母亲血液渗入而引起分娩期感染;另一种情况是分娩后,通过唾液或母乳把病毒传染给婴儿[7,8]。常规的母婴阻断方法是在妊娠期使用药物,以达到阻断效果。现阶段,技术比较成熟,母婴阻断成功率相对较高,我国的新生儿感染乙型肝炎病毒的情况已经大大下降[9,10]。随着技术的成熟,母婴阻断的普及,国家的乙型肝炎人口数量将会得到明显的控制。
HBV-DNA 可以直接反应机体中乙型肝炎病毒的复制程度,慢性乙型肝炎孕妇,其体内乙型肝炎病毒复制的活跃程度,直接影响到胎儿宫内乙型肝炎病毒感染的情况,可以认为该因素是母婴传播的独立危险因素[11,12]。本文研究结果显示,观察组患者血清ALT、HBV-DNA 均低于对照组,差异均具有统计学意义(P<0.05)。说明患者的血清ALT、HBV-DNA 水平得到较好的改善。观察组新生儿在出生时、6 月龄、12 月龄时的HBsAg 阳性率、HBeAg 阳性率、HBVDNA≥100 IU/ml 发生率均低于同期对照组,差异均具有统计学意义(P<0.05)。说明新生儿在HBsAg 阳性、HBeAg 阳性、HBV-DNA≥100 IU/ml 方面控制较好。观察组新生儿出生5 min 时Apgar 评分为(9.66±0.32)分,与对照组的(9.58±0.35)分比较,差异无统计学意义(t=1.360,P>0.05)。说明药物的使用并不影响新生儿的Apgar 评分。婴儿出生后注射乙型肝炎免疫球蛋白以及乙型肝炎疫苗,很难完全阻断乙型肝炎病毒的母婴传播。降低孕妇体内的HBV-DNA 水平,是阻断乙型肝炎病毒母婴传播的关键。替诺福韦酯在进入机体后,经水解作用,可以使得病毒DNA 丢失3'-OH,从而使得DNA 链延长受阻,达到抑制病毒复制的效果[13,14]。另外在安全性方面,两组不良反应发生率比较,差异无统计学意义(P>0.05)。可见加用替诺福韦酯不会明显增加不良反应,安全性令人接受。
总之,慢性乙型肝炎妊娠患者应用替诺福韦酯进行母婴阻断效果较好,可以改善血清ALT、HBV-DNA水平,降低新生儿在出生时、6 月龄、12 月龄时的HBsAg 阳性率、HBeAg 阳性率、HBV-DNA≥100 IU/ml发生率,不影响新生儿出生5 min 时Apgar 评分。

