集成MRI与3D-pCASL成像在颞叶内侧癫痫患者海马硬化诊断中的应用
摆玉财,李健,马耀兴,王爱军,闫梦楠,陈兵
颞叶内侧癫痫(medial temporal lobe epilepsy,MTLE)是一种临床常见的难治性癫痫类型,最主要的病理基础是海马硬化(hippocampal sclerosis,HS)[1],特征表现为海马内神经细胞丢失和胶质细胞增生[2]。对于伴有HS的MTLE患者,通常需要采用手术治疗才能解除癫痫的发作[3]。HS的典型MRI表现为海马体积减小、在T2WI或T2-FLAIR图像上信号增高,并常伴有颞角的增大以及海马齿状突浅平、内部暗色条纹变模糊等[4-5]。如果MRI能检测到海马的异常改变,且其与脑电图(electroencephalogram,EEG)和神经心理学等其它临床特征的改变一致,则可以避免侵入性检查。但目前MRI对于HS的诊断主要还是以视觉评估海马形态和信号改变的定性方法为主,近年来出现的集成磁共振成像(synthetic magnetic resonance imaging,SyMRI)技术,一次扫描可生成5种定量图谱和10种对比度的图像,可以定量分析硬化海马的信号特征。对于HS的诊断,通过定量测量可以识别常规MR图像上肉眼无法识别的细微变化,与视觉观察相比,定量分析可以提高对HS的检出率[6]。SyMRI在乳腺、脑肿瘤、骨骼肌肉及前列腺等方面已得到较广泛的应用[7-10],但在癫痫疾病方面的研究尚较少。除了SyMRI技术外,PET、SPECT和三维伪连续动脉自旋标记成像(three-dimensional pseudo-continuous arterial spin labelling,3D-pCASL)在MTLE致痫灶的定位诊断方面也具有较高价值[11-12],有研究结果表明, PET及SPECT可显示发作间期时MTLE-HS患者的海马呈低代谢及低血流灌注改变[13],但这2种检查方法需注射放射性药物,对人体具有一定的损伤。与PET和SPECT相比,3D-pCASL是一种通过标记内源性氢质子作为示踪剂的脑血流灌注成像技术,无需注射对比剂,成像速度快,且不会影响血液的生化特性。相关研究结果表明3D-pCASL所测得的脑血流量(cerebral blood flow,CBF)与PET测得的反映代谢特征的指标值之间具有很高的一致性[14]。因此,3D-pCASL在检测海马硬化中具有潜在的临床应用价值,可为临床提供可靠的血流灌注参数,为HS的诊断提供有价值的信息[15]。本研究通过SyMRI联合3D-pCASL技术对HS患者进行定量和定性分析,并评估各定量参数对MTLE-HS的诊断效能,旨在进一步提高对癫痫的影像诊断水平。
材料与方法
1.研究对象
以2020年10月-2022年12月因疑似癫痫在本院进行颅脑MRI扫描的249例患者作为总样本,经筛选,最终将经病理证实(2例)或MRI诊断(28例)的30例MTLE-HS的患者纳入本研究。其中,男12例,女18例;年龄9~55岁,平均(32.5±16.1)岁;左侧HS 9例,右侧HS 21例。MTLE的诊断参考国际抗癫痫联盟(ILAE)2014年诊断标准。同期纳入45例健康志愿者(正常对照组),其中男26例、女19例;年龄10~53岁,平均(26.5±12.4)岁。两组受试者的年龄和性别构成相匹配(年龄:t=1.806,P=0.075;性别:χ2=1.505,P=0.220)。
病例组纳入标准:①颞叶癫痫发作的典型临床症状;②EEG监测到颞叶异常癫痫波;③MRI检查显示有单侧HS的阳性表现;④既往无其它神经精神系统疾病。排除标准:①有脑肿瘤、外伤或手术史; ②有大脑先天性发育畸形;③脑血管性疾病。249例总样本中,剔除年龄>60岁(7例)、无颞叶癫痫临床症状或EEG未监测到颞叶癫痫波或MRI上在海马之外的部位发现阳性病灶(174例)、有外伤或手术史者(3例)、图像质量差(4例)及MRI无阳性表现者(31例),最终样本量为30例。
本研究经本院伦理审查委员会批准,所有纳入研究的患者签署了知情同意书。
2.MRI扫描方案
使用GE Signa Architect 3.0T磁共振扫描系统和48通道相控阵头颅线圈。患者取仰卧位,平静呼吸。扫描序列主要包括横轴面磁化准备快速梯度回波(magnetization prepared rapid acquisition gradient echo,MPRAGE)3D-T1WI、矢状面长回波链快速自旋回波采集(fast spin echo with an extended echo train acquisition,CUBE)FLAIR 3D-T2WI、横轴面3D-pCASL(标记后延迟时间为1.5 s)、垂直于海马长轴的斜冠状面T2WI和斜冠状面集成磁共振(magnetic resonance imaging compilation,MAGiC)。各序列主要扫描参数见表1。
3.图像分析
所有图像分别由两位副高及以上职称的神经放射医师采用单盲法独立分析,对HS的MRI诊断主要通过在斜冠状面高分辨率T2WI和T2-FLAIR图像上对HS形态和信号特征等进行视觉评估,重点关注海马的大小及T2WI信号,HS的典型MRI征象为海马体积减小及T2WI 上信号增高。本研究中将CUBE FLAIR 3D-T2WI薄层图像重建为层厚2.0 mm、层间距0.0 mm、与MAGiC图像保持一致的冠状面图像,海马内部细微结构(齿状突起、条纹)消失及颞角增宽作为HS的间接征象。
4.图像后处理
利用MR扫描仪配备的MAGiC后处理软件对原始扫描图像进行后处理分析,生成各项定量参数的图谱T1-mapping、T2-mapping和质子密度(proton density,PD)-mapping。由于海马结构的个体差异性,故采用人工方法,在各序列冠状位像上,根据海马形态,分别在海马的头、体和尾部三个层面勾画ROI,注意避开脑脊液邻近区域。为了保证在测量海马各结构时所有被试者的ROI的位置相对一致,我们参照Coan等[6]的研究方法,在斜冠状面MAGiC序列观察,将海马头部定义为颞叶侧副沟以内第一个可以看到侧脑室颞角的部分,此处可以适当将海马结构与杏仁核分开;海马体选取海马头部测量ROI所在层面之后的第6帧冠状面图像;海马尾的定义为海马体ROI所在层面之后的第4帧冠状面图像,在此可以见到四叠体板。将3D-pCASL获得的CBF图像,在GE AW4.7后处理工作站上将其与斜冠状面T2WI进行融合,以利于准确地确定海马头、体和尾部层面,保证勾画ROI的层面和位置与其它序列一致。最后,记录每例患者的各项定量参数(T1、T2、PD和CBF)值,计算每项参数在头、体和尾部测量值的平均值作为该侧海马的最终测量值。对照组取双侧海马测量值的平均值。
5.统计学分析
使用SPSS 25.0软件和MedCalc 19.0.4软件进行统计学分析。采用Kappa检验分析两位医师诊断HS的一致性。Kappa值>0.75为一致性强,0.75~0.40为一致性中等,<0.4为一致性差。对符合正态分布的计量资料采用均数±标准差表示,不符合者以M(Q1,Q3)表示,使用单因素方差分析(正态分布资料)或Kruskal-WallisH检验(非正态分布资料),对三组(患侧和其对侧HS及对照组HS)的各项定量参数值进行比较,进一步采用Bonferroni检验进行组间两两比较。对组间差异有统计学意义的参数,绘制其受试者工作特征(ROC)曲线来评价其诊断效能,并采用Delong检验比较各参数ROC曲线下面积(AUC)的差异。以P<0.05为差异具有统计学意义。
结 果
1.一致性分析
两位神经放射医师诊断海马硬化的一致性较好(Kappa=0.836,P<0.01)。
2.各组间定量参数值的比较
HS组、健侧组和对照组的各项定量参数的测量值及组间比较结果见表2。三组之间T1、T2和CBF值的差异均有统计学意义(P<0.05),而PD值的差异无统计学意义(P>0.05)。
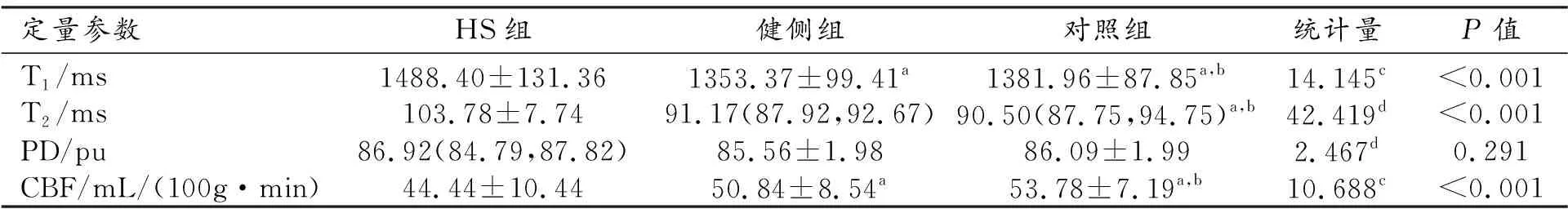
表2 三组的定量参数值及组间比较结果
进一步组间两两比较结果显示:HS组的T1和T2值高于健侧及对照组,CBF值低于健侧及对照组(图1),差异均有统计学意义(P<0.05)。健侧组与对照组之间T1、T2和CBF值的差异均无统计学意义(P>0.05)。
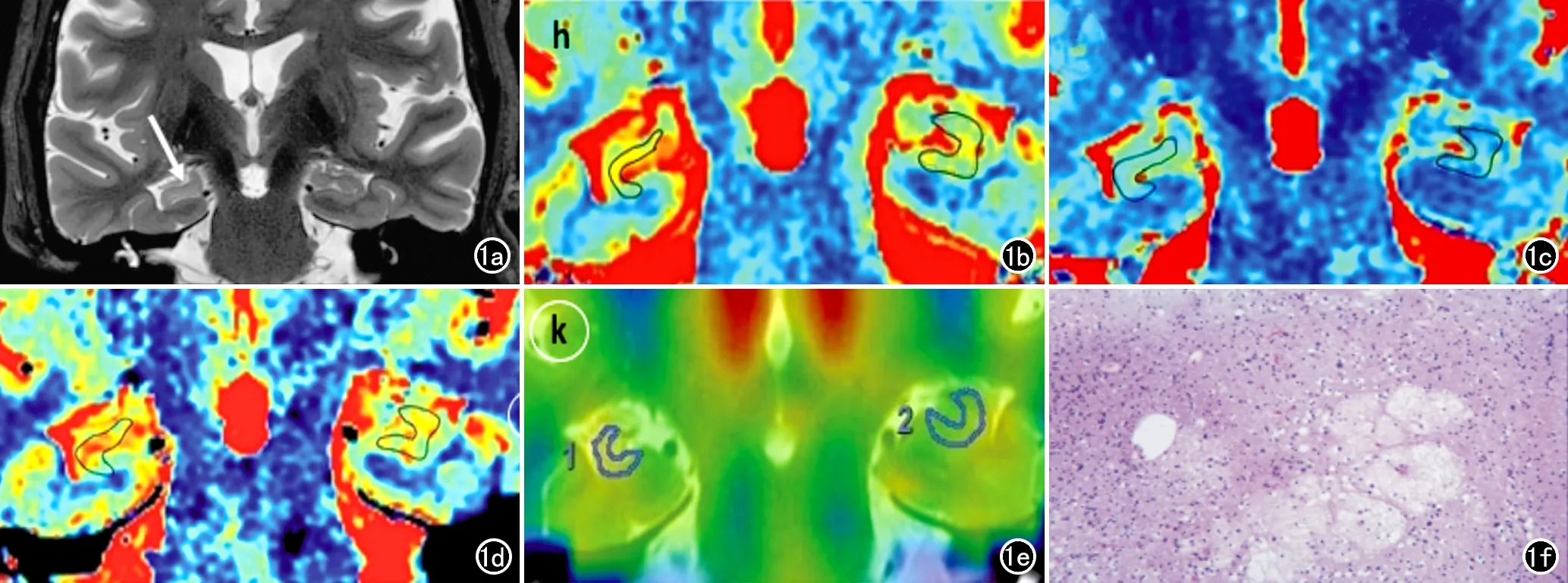
图1 患者女,50岁,有癫痫病史42年,经手术病理证实存在右侧HS。a)T2WI显示右侧海马体积缩小,信号增高,齿状突起浅平,条纹较对侧显示不清;b)放大的T1-mapping冠状面图像,右侧海马的T1值为1590ms,对侧正常海马的T1值为1379ms;c)放大的T2-mapping冠状面图像,右侧海马的T2值为109ms,对侧正常海马的T2值为87ms;d)放大的PD-mapping冠状面图像,右侧海马的PD值为89.1pu,对侧正常海马的PD值为87.4pu;e)CBF与冠状位T2WI融合图像,显示右侧海马灌注较对侧稍减低,右侧及对侧海马的CBF值分别为40.00和61.00mL/(100g·min);f)右侧海马病理切片镜下图像,可见部分神经元细胞灶性缺失和胶质细胞增生(HE,×100)。
3.各定量参数对HS的诊断效能
对三组间差异有统计学意义的参数进行ROC曲线分析,结果见表3和图2。T1、T2和CBF的AUC分别为0.759、0.899和0.770,以T2的AUC最大。Delong检验结果显示:T2和T1的AUC分别与CBF比较,差异均无统计学意义(P>0.05);T1与T2的AUC比较,差异具有统计学意义(P=0.0293),表明T2对MTLE-HS的诊断效能高于T1。当T2的截断值为97.67ms时,AUC最大,相应的诊断敏感度、特异度、阳性预测值和阴性预测值分别为80.0%、95.6%、92.3%和87.8%。
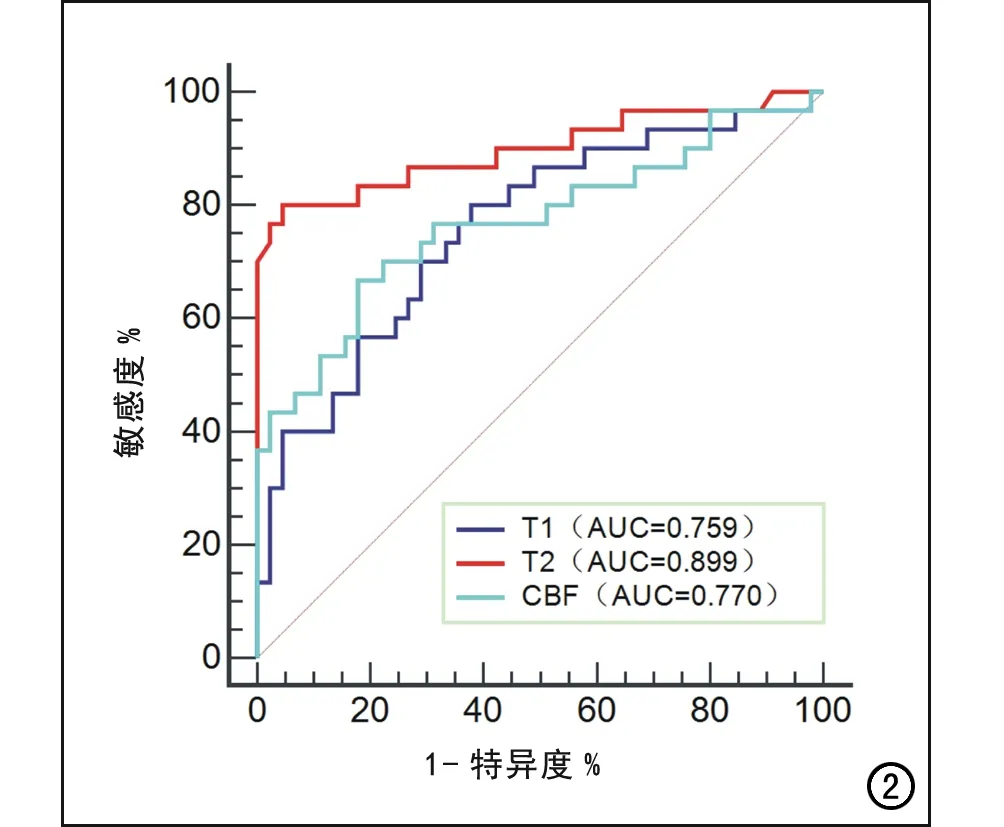
图2 T1、T2和CBF的ROC曲线图,显示T2的AUC最大。
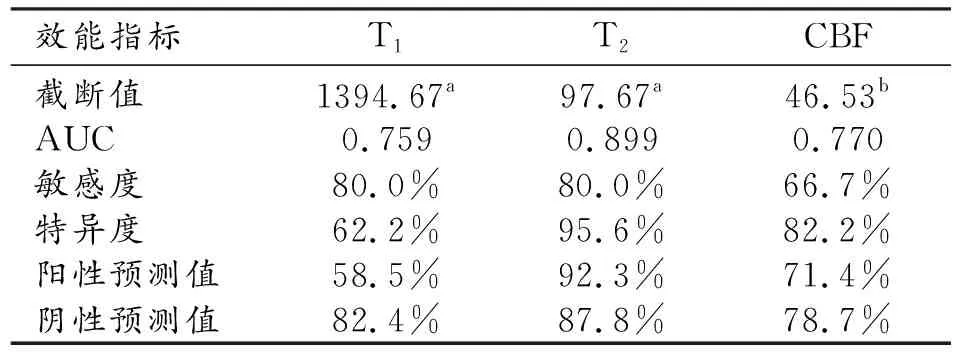
表3 SyMRI定量参数及CBF对MTLE-HS的诊断效能
讨 论
HS是MTLE最常见的病理改变,在临床上这类癫痫患者采用药物治疗时通常效果不佳,病情反复,为给患者带来极大的痛苦,也为临床治疗带来较大难题,手术切除致痫灶是目前最有效的治疗方式,因此,术前对HS进行精确检测对指导临床治疗具有重要意义。MRI作为目前检测HS的主要手段之一,在HS的诊断及指导临床制订个体化的手术方式等方面起着重要作用。近期GE公司研发的集成MRI技术中,MAGiC序列是一种多饱和、多延迟回波序列(multiple-delay multiple-echo,MDME),一次扫描可生成多项定量参数图谱(T1-、T2-和PD-mapping),可以定量反映组织的驰豫时间和质子密度。
本研究利用MAGiC序列对MTLE-HS患者的海马进行定量分析,相比之前通过视觉观察常规序列MR图像的定性评估,定量分析具有更高的检测效能。硬化海马的T2值升高是由于局部大量神经元丢失和胶质细胞增生所致,而集成MRI可以定量检测海马信号增高的程度,间接反映海马区的病理特征。T2值定量检测有助于发现轻度HS,在海马结构中,胶质细胞的反应性增生被认为是突触重组这种病理变化的标志,这些反应性增生的胶质细胞含有较多的胞浆和细胞内水分,可能会抵消部分神经细胞丢失造成的体积的轻度减小,有研究发现测量T2驰豫时间可以诊断HS的符合率达到70%~100%[16]。所以,对于MRI征象不明显的癫痫患者,利用定量技术分析HS的特征具有一定的临床应用价值[17]。T2信号增加是海马硬化的重要标志,水含量是直接影响组织T2值高低的重要因素,这与影响水稳态相关的分子变化密切相关,如水通道蛋白4(aquaporin 4,AQP4)和细胞外基质(extracellular matrix,ECM)内的蛋白聚糖成分。AQP4是星形胶质细胞表达的水通道蛋白,其为星形胶质细胞中的水运动提供了主要途径,AQP4通过增加细胞质膜水的通透性进而增加细胞运动过程中发生跨膜水通量,在癫痫反复发作下神经元神经元活性较高,细胞外间隙的水被面对神经管的星形胶质细胞膜吸收,导致在此区域中水的集聚,在MTLE-HS患者中,AQP4在星形胶质细胞中过度表达影响水稳态,以至于在海马区的水含量增多。硫酸软骨素蛋白多糖(chondroitin sulfate proteoglycans,CSPG)是脑ECM的主要成分,研究表明,细胞外CSPG的变化与脑内细胞外空间和组织内水分子的扩散有关,MTLE患者海马区的CSPG含量增加,可影响水分子的分布[18],导致局部T2值升高。
本研究结果显示硬化海马的T1驰豫时间同样升高。T1值与髓鞘成熟有关,硬化的海马组织内脱髓鞘和神经元变性是引起其T1值变化的主要原因[19]。Liao等[20]利用MRI指纹技术测量海马T1、T2信号的增高程度,研究结果显示其定量分析HS患者T1、T2值较常规MRI序列比较对HS的检出率提高了27.2%,但这种技术的检查时间较MAGiC技术,所测量的患侧海马T1[(1361±85)ms vs. (1353.37±99.41)ms]、T2[(135±15)ms vs. (103.78±7.74)ms]值均高于本研究结果,这可能是由于两种成像技术不同造成的。Gavin等[21]的研究中采用了自动测量技术来定量分析MTLE患者海马区的T2值,其测量的病侧海马的T2值为(127.7±8.18)ms,同样高于本研究结果,表明海马T2值的人工测量与自动测量之间存在一定的差异。本研究中各组间PD值的差异无统计学意义,表明PD值在HS的诊断方面无显著临床价值。
国内外诸多研究结果显示PET和SPECT可检测到HS患者海马的低代谢和低血流灌注改变[11,22]。但这两种检查技术均对人体有放射性损害,而3D-pCASL将血液氢质子作为内源性示踪剂,不会改变血液的生化特性,而且扫描时间短,不会对人体造成损害。既往有研究结果表明PET、SPECT与ASL测量的组织代谢和灌注参数之间具有很好的一致性[23]。Zhang等[11]利用ASL技术测量MTLE患者海马区的CBF值,研究结果显示HS患者海马血流灌注明显高于正常对照组,表明ASL这种易于测量脑血流灌注的功能成像技术,可作为MTLE患者海马硬化部位(定侧)的诊断工具。MTLE作为一种反复发作的神经系统疾病,在发作早期近侧颞叶可能会观察到脑血流灌注代偿性增高以满足神经元活动的营养需求,而HS患者,因癫痫长期反复发作,流向海马的血流量无法满足局部增加的能量需求,从而造成海马区域性缺血,表现为海马区CBF值减低[24-26]。
本研究中分析了集成MRI和3D-pCASL定量参数对MTLE-HS的诊断效能,ROC曲线分析结果显示T2的诊断效能(AUC=0.899)高于T1(AUC=0.759);当T2值的截断值为97.76ms时,相应的诊断敏感度、特异度、阳性和阴性预测值分别为80.0%、95.6%、92.3%和87.8%。
本研究存在一定的局限性:第一、样本量偏少,可能存在样本数据的偏倚,需在今后纳入更多的研究对象来减少抽样误差;第二、本研究中的样本数据缺乏足够的病理结果的证实,无法确保所有样本的MRI与病理结果的一致性,尚需在今后纳入更多的经病理证实的样本数据来进一步验证本研究结果。

