基于灌流浓缩培养的罗伊氏乳杆菌高密度发酵研究
李子财,李林,李光洲,王建清,辛维岗,张棋麟,王峰,林连兵*
1(昆明理工大学 生命科学与技术学院,云南 昆明,650500)2(云南省高校饲用抗生素替代技术工程研究中心,云南 昆明,650500)3(玉溪嘉和生物技术有限公司,云南 玉溪,653100)
罗伊氏乳杆菌(Lactobacillusreuteri)普遍存在于人和动物肠道中,是一种对宿主有益的共生菌[1],它可以通过代谢产生有机酸、双乙酰、H2O2、细菌素及类细菌素等物质[2-4],是一种具有较高生物开发价值的乳酸菌。目前罗伊氏乳杆菌被广泛应用于食品[5]、饲料[6]、抗菌剂[7]、新型材料前体[8-9]等领域,如瑞典BioGaia公司开发的一系列L.reuteri益生菌制剂,在全世界范围内销售,用于改善人和动物的健康水平;我国也于2003年批准其可用于保健食品、食品和婴幼儿食品等领域。由于罗伊氏乳杆菌自身特殊的生长特性,难以达到高密度发酵培养,导致其生产成本较高[10],如何提高罗伊氏乳杆菌的发酵效率成为亟待解决的问题。
在传统发酵培养模式中,多数通过调控优化培养过程中的pH、溶氧、温度和培养基组分等参数来提高菌株发酵的密度[11],但受限于培养过程中菌株发酵产物的不断累积,导致菌株生长受到抑制或者死亡[12]。灌流培养技术是利用中空纤维柱截流系统使得菌株产生的代谢物能够持续不断的排出,同时蠕动泵持续的补充新鲜培养基,实现培养基的置换以减轻乳酸和铵根离子等代谢产物对菌株生长的负面影响,并维持菌株的持续生长代谢。该技术具有生产成本低、培养时间短、产量和活性高等特点[13-15]。
近年来,灌流培养和灌流浓缩培养技术不断完善,已广泛应用于哺乳细胞的高密度培养,在较小规模培养下能实现较高的产量,例如,原来产品规模需要2 000 L,如选择灌流工艺可能只需要200 L就能实现目标[16]。目前国内已有药明生物、嘉和生物、复宏汉霖等公司将该工艺应用于细胞的发酵生产,该工艺发展应用前景广阔[17]。
有关罗伊氏乳杆菌高密度发酵培养的研究较少,潘海博等[18]以批培养的方式对培养基组分进行优化,活菌数达9.33×1010CFU/mL;王超[19]对培养参数进行优化,活菌数达4.4×1010CFU/mL,菌体干重(cell dry weight,CDW)13.7 g/L;KRAUTER等[20]用批补料培养的方式使得产量比批培养增加了1倍。目前灌流浓缩培养技术还未被引入到罗伊氏乳杆菌等相关益生菌的发酵培养。本文拟以罗伊氏乳杆菌DSM 17938为发酵菌株,比较批培养、批补料培养和灌流浓缩培养对罗伊氏乳杆菌发酵生物量的影响,探索罗伊氏乳杆菌高密度发酵技术。
1 材料和方法
1.1 材料与试剂
1.1.1 菌株
罗伊氏乳杆菌(Lactobacillusreuteri)DSM 17938,昆明理工大学生命科学与技术学院噬菌体与肠道微生物课题组保存。
1.1.2 试剂
D(+)-无水葡萄糖、胰蛋白胨(casein tryptone,CT)、牛肉浸粉(beef extract powder,BED)、酵母浸粉(yeast extract fermentation,YEF)、Tween-80、消泡剂、琼脂粉等,北京索莱宝科技有限公司;C2H3NaO2、MgSO4·7H2O、MnSO4·H2O、K2HPO4、NH2HPO4、NaOH,国药集团化学试剂有限公司;葡萄糖测定试剂盒,生工生物工程(上海)有限公司。
1.2 仪器与设备
EL3002型电子天平,梅特勒-托利多仪器(上海)有限公司;MLS-3750型高温高压灭菌锅,日本SANYO公司;ZHJH-C1115B型超净工作台,上海智诚分析仪器制造有限公司;DNP-9082BS型电热恒温培养箱,上海新苗医疗器械制造有限公司;pHS-25数显pH计,上海精密仪器有限公司;6500美国wisdom酶标仪,美国WAS公司;BLB10-20SJ自动发酵罐,上海百仑生物科技有限公司;BT600-2 J精密蠕动泵,保定兰格恒流泵有限公司;WA94510INV41LL型中空纤维柱,德国赛多利斯公司;Minispin小型高速离心机,上海心亮实业有限公司。
1.3 实验方法
1.3.1 菌株活化与培养
从-80 ℃冰箱中取1支冻存的罗伊氏乳杆菌甘油菌,用接种环挑取少量菌液于MRS固体培养基中划线,将平板置于37 ℃恒温培养箱中培养36 h,挑取单菌落,接种于2 mL MRS液体培养基中,在恒温37 ℃摇床中活化培养24 h,按5%接种量将活化后的菌液接种于摇瓶中,在恒温37 ℃摇床中扩大培养12 h,用于上罐培养的种子液。
1.3.2 发酵液活细胞计数
每2 h取样1次,将发酵的菌液摇匀后,取100 μL供试菌液于900 μL PBS缓冲液中,梯度稀释后取100 μL稀释液涂于MRS固体培养基上(3个平行样),放于37 ℃恒温培养箱中培养36 h,选择菌数为30~300的菌落平板计数,取平均值[21]。
1.3.3 菌体质量浓度的测定
取25 mL发酵液在12 000 r/min下离心10 min,弃上清液,PBS缓冲液悬浮洗涤3次,60 ℃烘干至恒重,称量计算菌体干重(g/L)。
1.3.4 发酵液中葡萄糖含量的测定
利用葡萄糖检测试剂盒(GOD-POD比色法)测定发酵液中的葡萄糖含量,取等体积混合试剂1和试剂2,分装成1 mL测试管,样品管加入10 μL待测样品,标准管加入10 μL葡萄糖标准液,对照管加入10 μL纯化水。37 ℃水浴10 min,调零后在505 nm波长下测定样品管和标准管的吸光度,按公式(1)计算葡萄糖质量浓度:
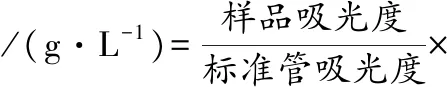
(1)
1.3.5 罗伊氏乳杆菌批培养生长曲线的绘制
将种子液以5%的接种量接种到装有15 L MRS液体培养基的发酵罐中,以批培养的方式发酵培养。每隔2 h取样,摇匀后取1 mL于1.5 mL离心管中,6 000 r/min离心10 min,去上清液用PBS缓冲液悬浮,测定菌液的OD600值,当菌液OD600值超过0.8时稀释一定的倍数,使稀释后OD600值维持在0.2~0.8,吸光度值乘以稀释倍数即为发酵液的OD600值。以培养时间为横坐标,发酵OD600值为纵坐标,绘制菌株生长曲线。
1.3.6 发酵培养
批培养过程如下:将上罐种子液以5%的接种量[19]接种到装有15 L MRS液体培养基的发酵罐中,将溶氧与通气关联,pH与碱泵关联,在恒pH 5.5[22]、溶氧15%[23]、恒温37 ℃[19],搅拌速率为120 r/min条件下有氧发酵培养,每隔2 h取样检测。
批补料培养过程如下:将上罐种子液以5%的接种量接种到装有8 L MRS液体培养基的发酵罐中,将溶氧与通气关联,pH与碱泵关联,在恒pH 5.5、溶氧15%、恒温37 ℃,搅拌速率120 r/min下有氧发酵培养,当菌株OD600达对数生长中期后,每隔2 h补加2×MRS培养基1 L,补加至15 L,每隔2 h取样检测。
灌流浓缩培养发酵示意图见图1,具体过程如下:将上罐种子液以5%的接种量接种到装有15 L MRS液体培养基的发酵罐中,将溶氧与通气关联,pH与碱泵关联,在恒pH 5.5、溶氧15%、恒温37 ℃,搅拌速率120 r/min下有氧发酵培养,当菌株发酵达对数生长中期后,启动中空纤维柱截流系统进行浓缩补料培养,灌流流速20 mL/min,循环流速为灌流流速的10倍,每隔2 h取样检测。
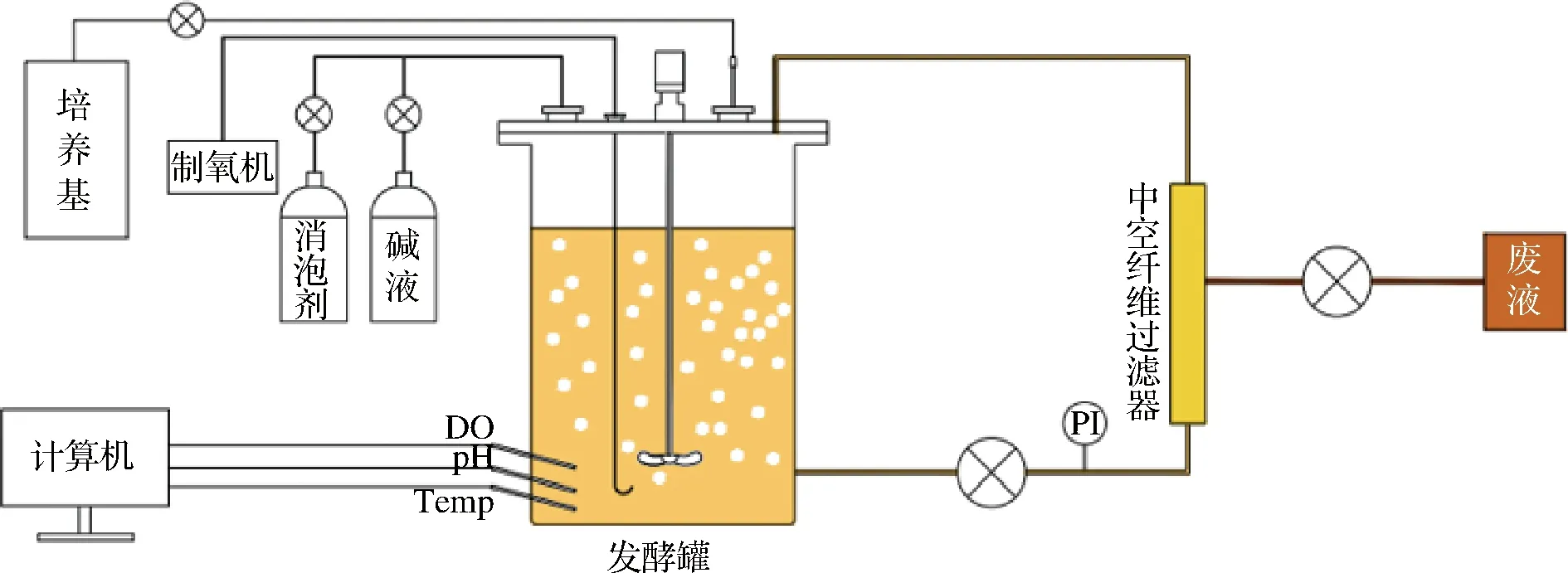
图1 灌流浓缩培养发酵示意图Fig.1 Fermentation diagram of concentrated fed-batch
1.3.7 灌流浓缩培养条件优化
为探究在不通气/通气和恒pH/不调pH下对罗伊氏乳杆菌高密度发酵的影响,设计4个方案,工艺参数如表1所示。每隔2 h取样检测,以发酵过程中活菌数和发酵结束时菌体干重为主要指标,确定最优的发酵条件。
灌流流速的优化:为了维持发酵过程中细胞生长代谢的稳定,使发酵产量和活菌数最大化,根据确定的培养条件,进一步对灌流流速进行优化,分别设计灌流流速为10、20、30、40、50 mL/min,每2 h取样检测,以发酵过程中活菌数和发酵结束时菌体干重为主要指标,确定最佳发酵灌流流速。
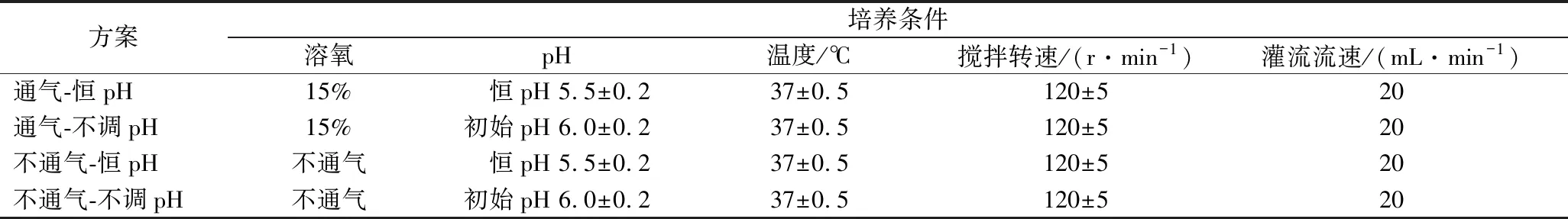
表1 培养条件的优化设计Table 1 Optimum design of culture conditions
1.3.8 数据统计与分析
采用Excel和Origin Pro8.5数据软件进行统计与分析,所有实验数据均为3次重复实验以平均值±标准差的形式表示。
2 结果与分析
2.1 罗伊氏乳杆菌批培养生长曲线
按照1.3.4方法,使用自动发酵罐进行发酵,对罗伊氏乳杆菌DSM 17938的生长曲线进行测定,每隔2 h测1次发酵液吸光度值OD600。绘制的菌株生长曲线如图2所示,0~2 h处于生长迟缓期,2~8 h步入对数生长期,OD600值急速增加,8~12 h进入生长稳定期,菌体密度达到最大值4.3×1010CFU/mL,12 h以后细胞进入衰亡期。根据菌株生长情况,确定罗伊氏乳杆菌DSM 17938在培养6 h时,可进行批补料培养和启动灌流浓缩培养。
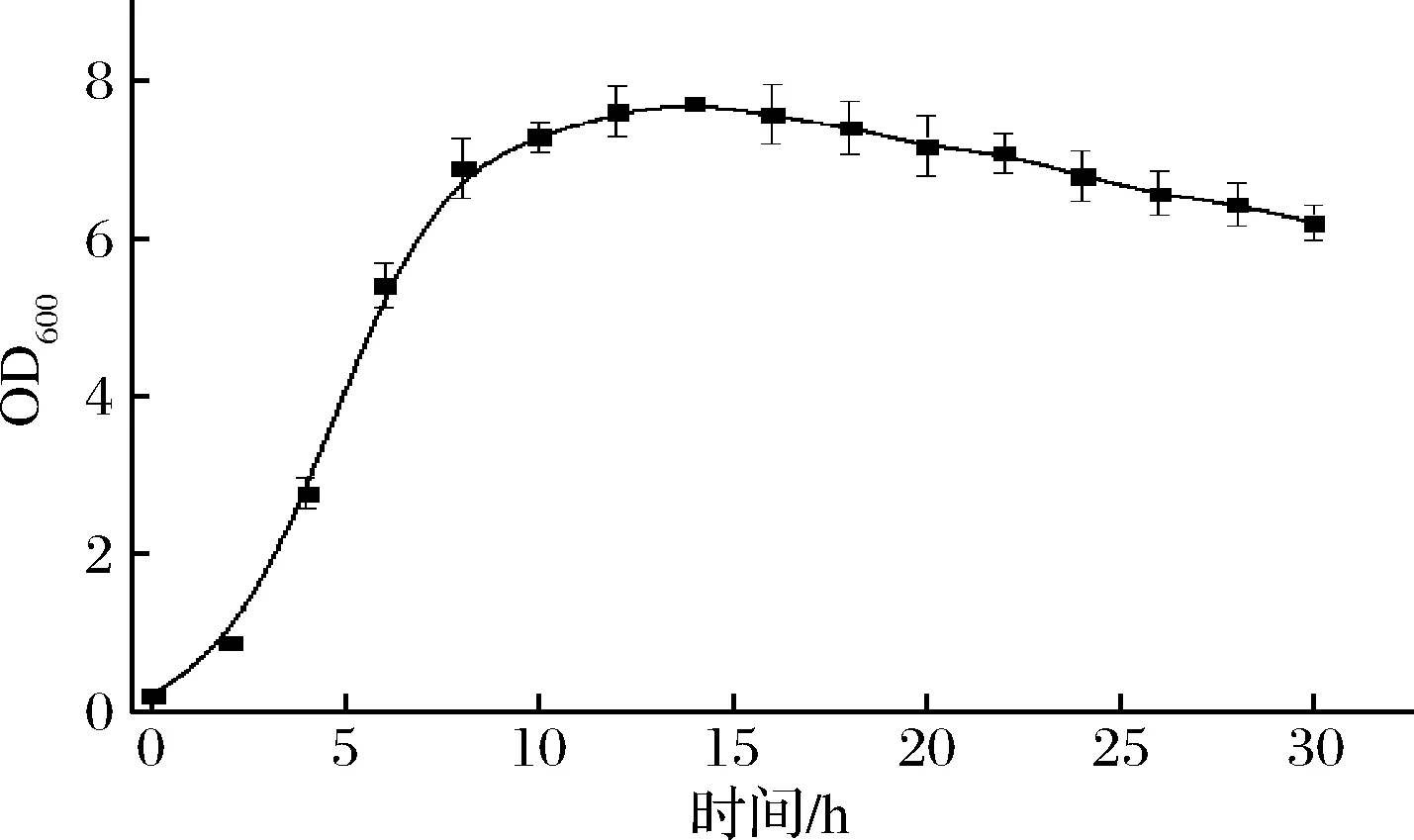
图2 罗伊氏乳杆菌DSM 17938的生长曲线Fig.2 Growth curve of L.reuteri DSM 17938
2.2 罗伊氏乳杆菌不同培养方式的效果比较
由图3-a可知,3种不同发酵方式下,活菌数呈现先增后减的趋势,在一段时间内3种培养方式的活菌数增加变化趋势不大,但随着发酵的进行,菌密度持续增加。灌流浓缩培养虽然延长了发酵的周期,但凸显出巨大优势,在第22 h时活菌数达2.98×1015CFU/mL,CDW为53.43 g/L,是批培养和批补料培养的5.3和3.6倍(图3-b)。通过监测发酵过程中碳源的消耗情况,发现灌流浓缩培养过程中可以持续维持较高的葡萄糖浓度,而较持续的葡萄糖补入适于乳酸菌的增殖。
上述批培养和批补料培养的实验结果与潘海博等[18]、王超[19]研究结果相近,造成这2种培养方式活菌数和产量较低的主要原因是:(1)菌株所需碳源氮源等主要营养物质不足;(2)发酵过程中乳酸、H2O2和CO2等代谢废物的不断积累,导致pH值影响带电物质的解离状态和结构,从而影响菌株利用营养成分和代谢产物的效率[24]。而灌流浓缩培养利用中空纤维柱截流装置,弥补了批培养和批补料培养的缺陷,实现了持续补偿新鲜培养基的同时置换出菌株的代谢废物,维持一个适宜的生长环境。综合考虑,后续研究以灌流浓缩培养方式为基础,对罗伊式乳杆菌进行高密度发酵的研究。
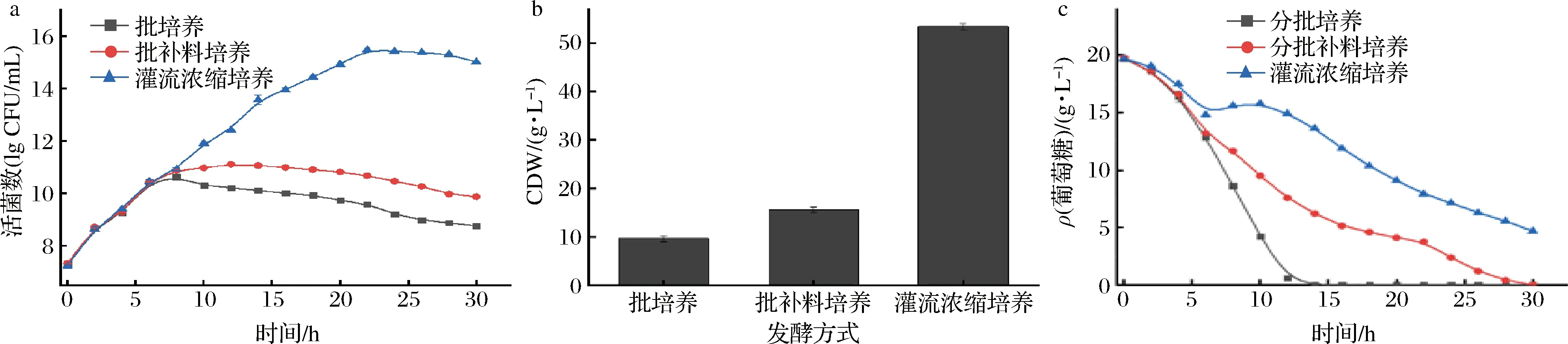
a-活菌数;b-菌体干重;c-葡萄糖含量图3 不同培养方式对罗伊氏乳杆菌发酵的影响Fig.3 Effects of different culture methods on fermentation of L.reuteri
2.3 罗伊氏乳杆菌灌流浓缩培养条件优化
罗伊氏乳杆菌属于兼性厌氧菌,具有较强的耐酸性,根据2.2中的研究结论,在灌流浓缩培养的基础上,按1.3.8的实验方法,通过监测发酵过程中活菌数和葡萄糖的消耗速率,确定培养的条件。
由图4-a可知,在通气发酵的前期活菌数增长速率明显高于不通气,随着发酵的进行恒pH时活菌数高于不调pH,在第22 h时通气-恒pH条件下活菌数高达2.98×1015CFU/mL,而在不通气-不调pH时活菌数仅为1.46×1013CFU/mL;图4-b通过监测发酵过程中碳源的消耗情况,发现在有氧时葡萄糖的消耗速率快于无氧时,恒pH时葡萄糖消耗速率要高于不调pH,也证明了通气和pH控制对菌株的生长增殖具有重要的作用。
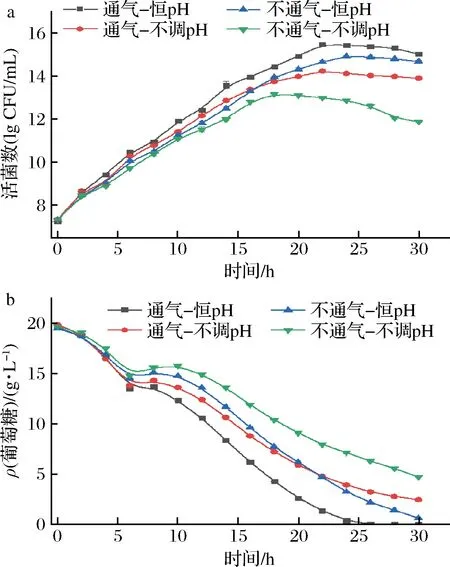
a-活菌数;b-葡萄糖质量浓度图4 不同培养条件对罗伊氏乳杆菌发酵的影响Fig.4 Effects of different culture conditions on fermentation of L.reuteri
SCHIRALDI等[11]研究乳酸菌生长代谢,发现在发酵过程中维持适量的溶氧有助于菌株的生长代谢,与本实验结论一致;不调pH时活菌数较低,主要是由于罗伊氏乳杆菌在代谢过程中产生大量的乳酸,随着乳酸的不断积累,导致pH值不断下降,抑制乳酸脱氢酶的活性,从而抑制糖代谢,影响菌体能量的获取,从而抑制了菌株的生长[25]。因此,在发酵过程中维持合适的溶氧和pH有助于菌株的生长和增殖。
2.4 罗伊氏乳杆菌灌流流速优化
灌流流速在灌流开发工艺过程中具有重要的指导价值,流速过低不足以供给菌株生长最低的营养需求,也不能及时带走代谢废物,导致菌株生长受限,活率下降;流速过高则培养基利用率低,成本高。由图5-a可知,随着灌流速度的增加,活菌数呈先增加后降低的趋势,灌流流速为40 mL/min时,活菌数最大达8.1×1015CFU/mL,菌体干重60.96 g/L;菌体OD600值(图5-b)和菌体干重(图5-d)则随流速的增加而缓慢的增加,但流速超过40 mL/min时,菌株活菌数在降低,葡萄糖浓度逐渐升高(图5-c),主要由于流速过大时中空纤维柱截流系统和高转速的蠕动泵产生的高剪切力造成了菌体死亡,将高剪切力的蠕动泵换为低剪切力蠕动泵时,可有效降低细胞死亡率,即在灌流培养过程中控制合适的流速具有重要作用。
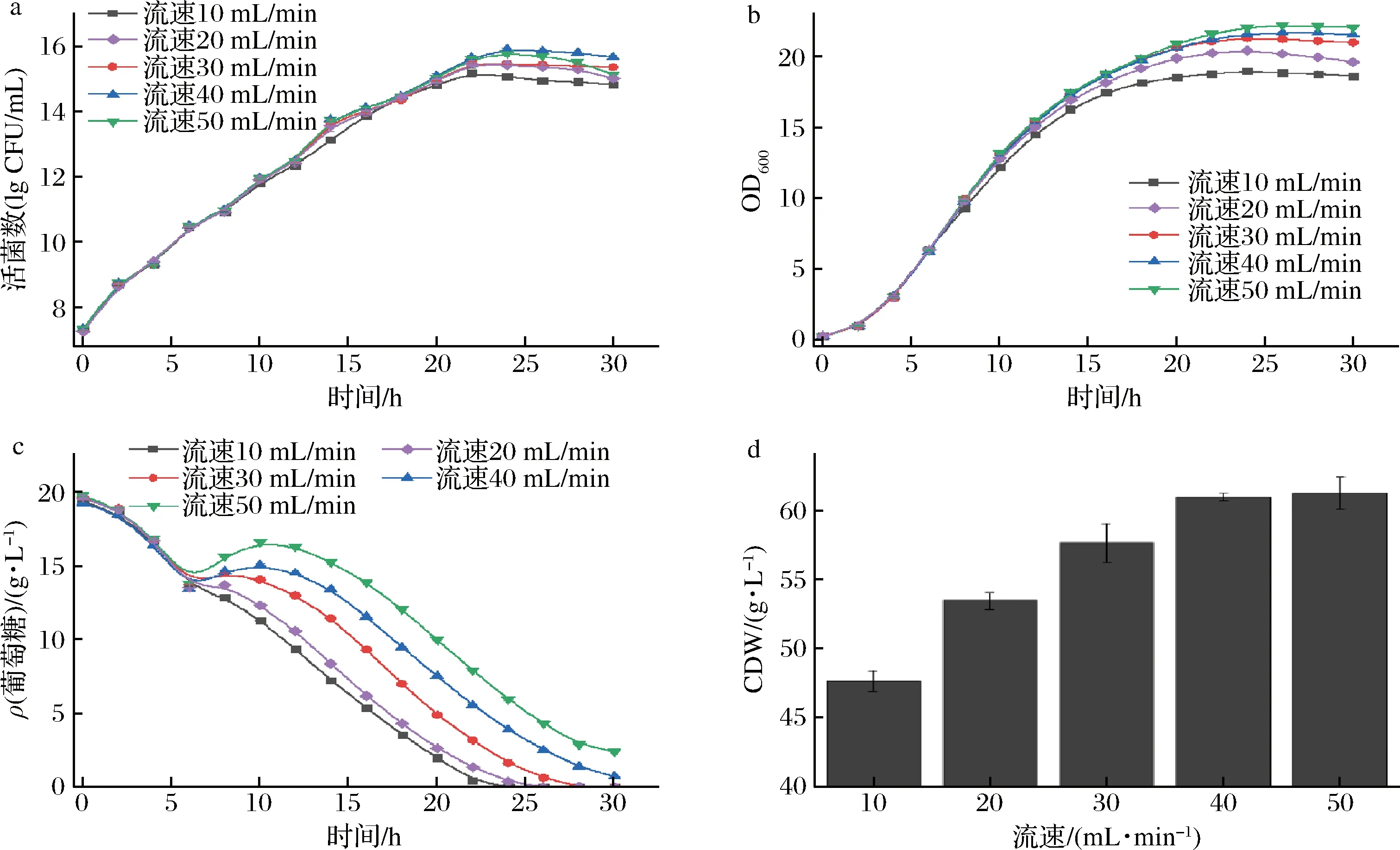
a-活菌数;b-菌株OD600值;c-葡萄糖质量浓度;d-菌体干重图5 不同灌流流速对罗伊氏乳杆菌发酵的影响Fig.5 Effects of different irrigation rates on fermentation of L.reuteri
3 结论与讨论
本研究利用3种不同培养方式对罗伊氏乳杆菌进行发酵,证明灌流浓缩培养在活菌数和产量上都凸显出巨大的发酵优势,通过对其发酵条件进行初步探索,确定最佳灌流发酵条件为:通气(氧含量恒定为15%)、恒pH为 5.5、流速为40 mL/min的最优条件下活菌数达到8.1×1015CFU/mL,菌体干重60.96 g/L,相对于未优化时提升了2.72和1.07倍。本研究在培养过程中采用恒流灌流培养模式,仍然无法实现培养基利用率最大化,后期研究可通过代谢流分析不同时段发酵液中营养物质的消耗量和代谢废物累积量,研究其糖酵解及其代谢机理,采取阶段性增加流速的方式灌流培养,以实现培养基利用率的最大化。在未来益生菌工业化的进程中,获取产量高、成本低廉和活率高的菌株是发酵工艺的最终目的。

