基于网络药理学研究黄精丸防治阿尔茨海默病的作用机制
李 莉 李 钰 杨绍杰
1.电子科技大学医学院附属妇女儿童医院·成都市妇女儿童中心医院药学部,四川成都 611731;2.西南医科大学,四川泸州 646000;3.成都市慢性病医院神经内科,四川成都 610017
阿尔茨海默病(Alzheimer’s disease,AD)是1906年首次由德国精神病学家和神经病学家Alzheimer Alois发现,并以其名字命名的一种慢性神经退行性疾病,是老年期痴呆最常见的一种类型,也是导致老年人失能的重要原因之一[1]。据Alzheimer’s Association报道,预计到2050年AD患者将接近1.14亿,每33秒就会新增一位AD患者[2]。目前AD可能的发病机制有β淀粉样蛋白毒性学说、tau蛋白过度磷酸化学说、胆碱能学说、氧化应激学说等[3]。然而没有任何一种假说能全面解释AD所有的病理特点,目前主要认为是多种因素共同作用的结果。而目前对于AD的药物研究方面,临床上主要使用西药治疗,如胆碱酯酶抑制剂、兴奋性氨基酸受体拮抗剂、脑蛋白水解物及其他缓解AD症状的药物[4]。这些药物虽然可使患者痴呆症状相对减轻,但引发的不良事件也较多。
近年来,应用中药提取物及其衍生药物治疗AD的研究日益增多。与西药相比,我国特有的中药具有治疗效果较好、毒副作用较低等优点。据杨晶莹等[5]的研究,古方黄精丸具有潜在防治AD作用。从黄精丸防治AD相关的试验与临床研究结果来分析,黄精丸与地黄饮子[6]、开心散[7]等中药复方相似,具有多层次、多靶点、多方向防治AD的特点,而有关黄精丸防治AD的相关研究还处在空白阶段,有关该复方的相关试验及临床研究报道极少,现有的相关研究尚未完全阐明其作用机制,并且由于中药成分的多样性和作用机制的多靶点、多通路,传统的研究方法很难实施。而近年兴起的网络药理学是基于网络观点,从系统水平分析药物作用机制、发现先导化合物或新适应证、识别新药靶点的一种新的研究角度,其与中医药整体调控机体的理念相吻合,同时也能大大降低后续试验研究的工作量[8]。因此本研究将网络药理学思路应用于黄精丸防治AD的作用机制探讨,旨在为后续的试验研究方向提供一定的信息支撑,并将经典中药古方发扬光大。
1 材料与方法
1.1 分析软件及数据库
主要包括中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)、DrugBank数 据 库、UniProt数 据 库、GeneCards数 据 库、OMIM数据库、String数据库、Venny 2.1、R 4.0.3、Cytoscape 3.8.1等软件。
1.2 黄精丸活性成分筛选及作用靶点预测
通 过TCMSP数 据 库[9](https://tcmsp-e.com/tcmsp.php)按照如下名称:黄精(Polygonati Rhizoma)和当归(Angelicae Sinensis Radix)检索黄精丸2味中药的化学成分,以口服生物利用度(oral bioavailability,OB)≥30%的,类药性(drug-like index,DL)≥0.18的原则筛选[10]。利用DrugBank数 据 库(https://www.drugbank.ca/releases/latest)和Uniprot数据库(http://www.uniprot.org/)预测筛选、收集活性成分的潜在靶点,标准化蛋白名称,得到黄精丸活性成分的潜在作用靶点。
1.3 疾病靶点及药物与疾病靶点交集预测
以“Alzheimer’s disease”为 关 键 词,检 索GeneCards数 据 库(https://www.GeneCardssorg/)、OMIM数据库(https://omim.org/),得到AD相关的疾病基因。删除疾病靶点中多余重复的靶点,得到AD相关靶点。用韦恩图(Venny 2.1)绘制活性成分靶点和AD靶点的交集。
1.4 蛋白质相互作用(PPI)网络的构建
将药物疾病共有靶点输入String数据库(https://string-db.org/cgi/input.pl)构建PPI网络,生物种类设定为“Homo sapiens”。以节点连接度值(degree)为指标,筛选核心蛋白质靶标,以R 4.0.3软件绘制度值排名前20的靶点柱状图。
1.5 构建成分-靶蛋白-信号通路网络
以筛选所得的黄精丸有效成分、AD靶点及靶点所属信号通路为基础,通过Cytoscape构建成分-靶蛋白-信号通路网络,运用Tools面板中的Network analysis计算网络参数。
1.6 GO(Gene ontology)富集分析
将黄精丸防治AD的靶点信息导入Metascape平台,选择物种信息为“Homo Sapiens”,进行GO注释分析,设置阈值P< 0.01,筛选出排名靠前的20个GO注释结果。
1.7 KEGG(Kyoto encyclopedia of gene and genomes)通路富集
将黄精丸药物和AD交集靶点进行KEGG通路富集分析,设置P< 0.05,利用String数据库,使用R 4.0.3软件,绘制气泡图。
2 结果
2.1 黄精丸有效成分及其靶点
通过TCMSP数据库检索黄精丸中黄精和当归的化学成分,获得黄精有效成分38个、当归有效成分95个,按照OB值和DL值筛选活性成分,选出黄精11个、当归2个,去重后获得黄精丸的活性成分12个,见表1,最终得到黄精丸活性成分潜在作用靶点蛋白265个。
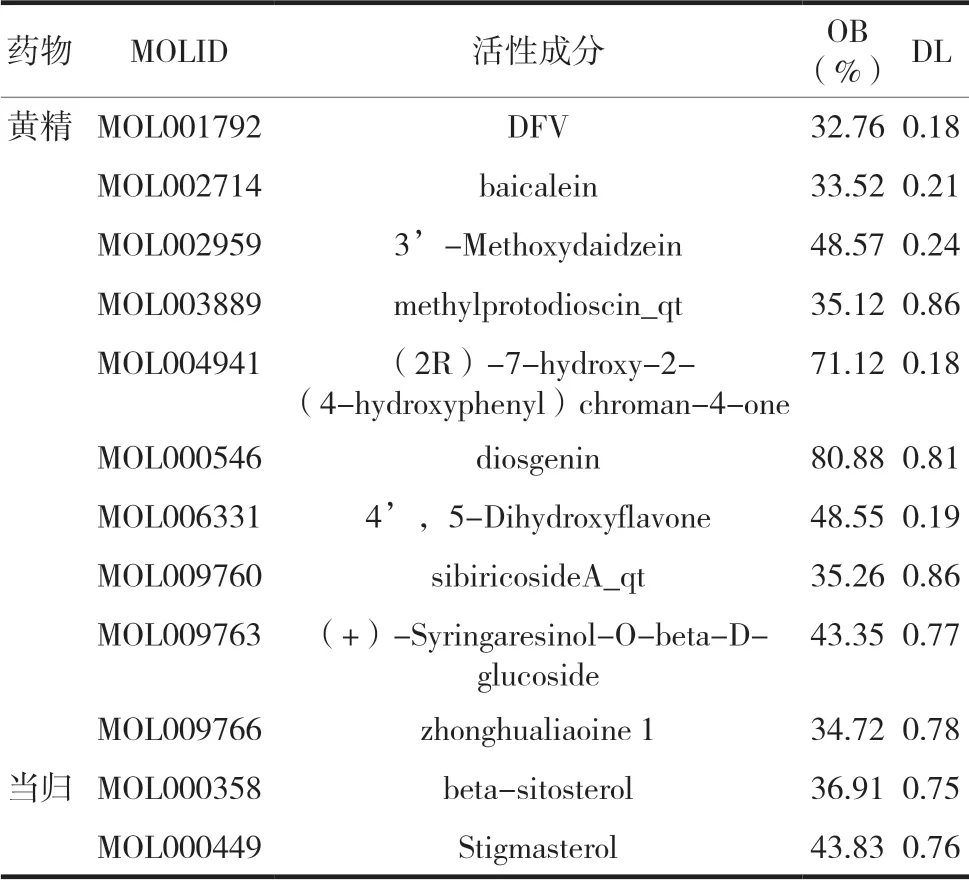
表1 黄精丸活性成分信息表
2.2 疾病靶点筛选
以“Alzheimer’s disease”为关键词在GeneCards数据库和OMIM数据库中筛选,去重后得到AD靶点基因1000个。
2.3 药物与疾病靶点交集
用韦恩图(Venny 2.1)绘制黄精丸活性成分靶点和AD靶点的交集,共92个,见图1。
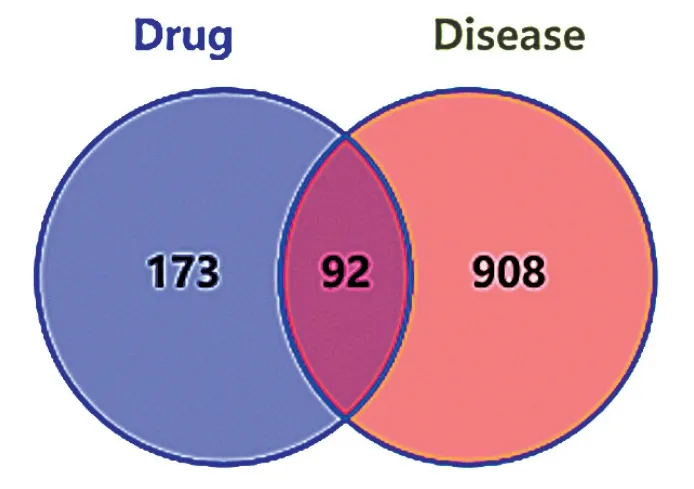
图1 AD与黄精丸活性成分靶点韦恩图
2.4 PPI网络构建分析
PPI网络中共92个节点、787条边,平均度值为17.1,见图2。根据其度值筛选出排名前20位的核心靶点,包括AKT1、TP53、VEGFA、SIRT1、EGFR等,见图3。
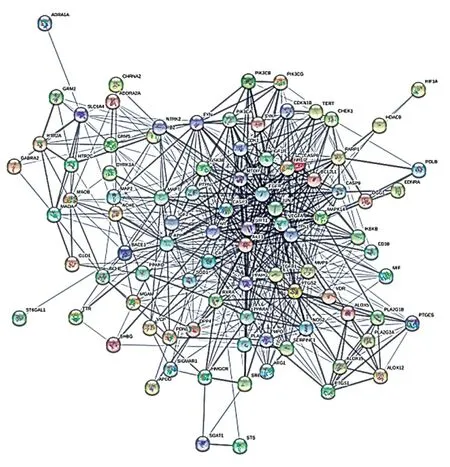
图2 黄精丸与AD共同靶点PPI网络图
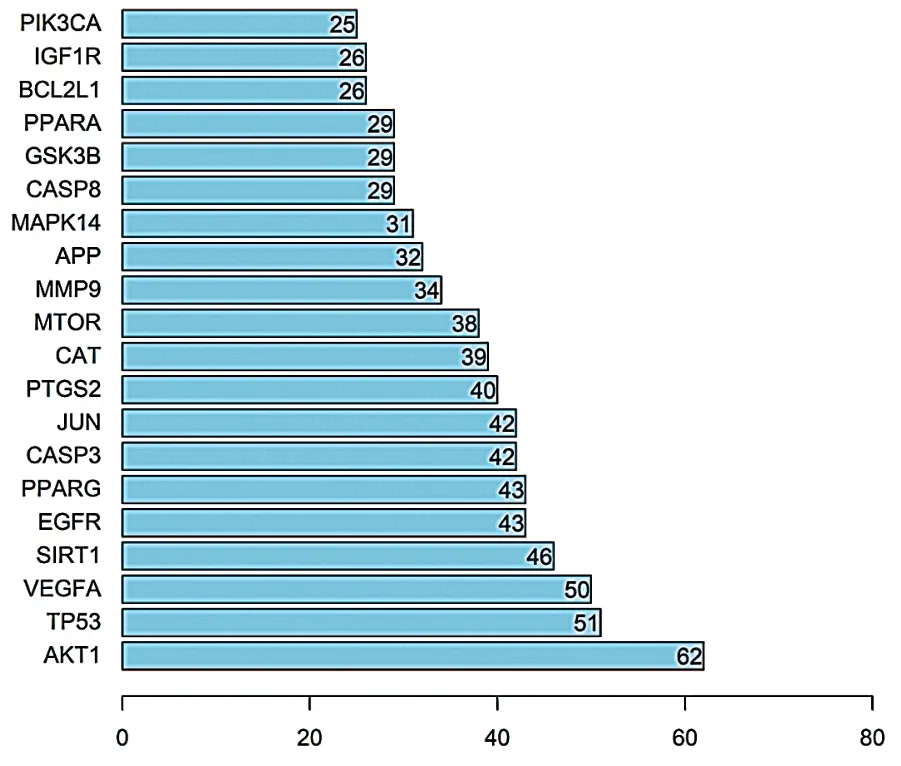
图3 黄精丸治疗AD的前20位核心靶点
2.5 药物-成分-靶点网络拓扑图
利用Cytoscape软件构建黄精丸药物-成分-靶点网络拓扑图(图4)。该网络图中包含130个节点、1252条边。在黄精丸防治AD作用网络图中,根据中心度,排名靠前的成分是 黄 芩 素(baicalein)、5,4’-二 羟 基 黄 酮(4’,5-Dihydroxyflavone)、甘 草 素(DFV)、3’-甲氧 基 大 豆 苷 元(3’-Methoxydaidzein)、β-谷甾醇(beta-sitosterol),度值排名靠前的靶点有PIK3CA、PIK3CB、EGFR、NOS2、MAPK3等。
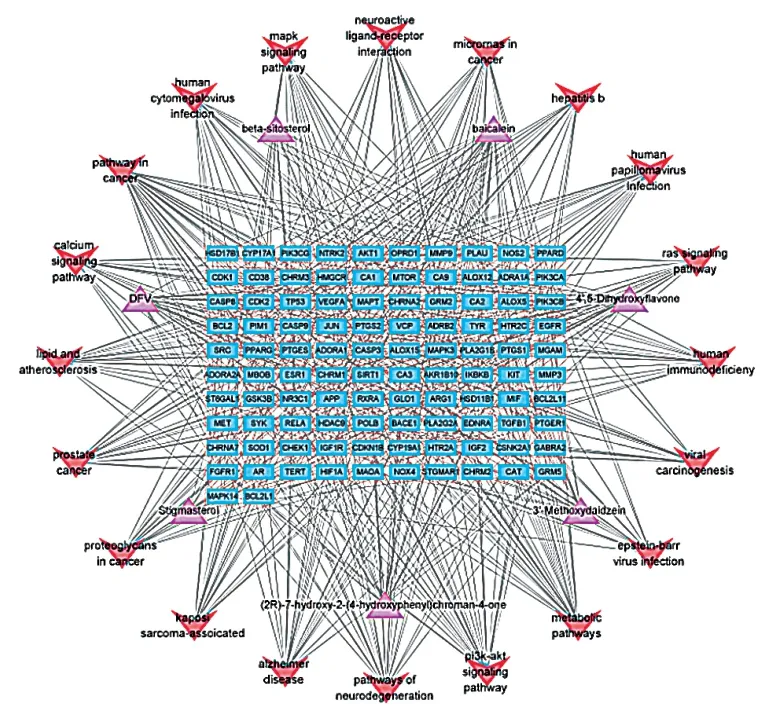
图4 药物-成分-靶点网络拓扑图
2.6 GO富集分析
GO注释分析通过共同的语义来描述基因生物学功能,GO注释结果见图5A~C。

图5 黄精丸治疗AD的潜在靶点GO富集分析
2.7 KEGG通路富集
总共富集到146条信号通路,选择排名前20的通路并以气泡图展示,见图6。排名靠前的主要有癌症信号通路、代谢通路、PI3K-Akt信号通路、神经退行性性变信号通路、AD等。
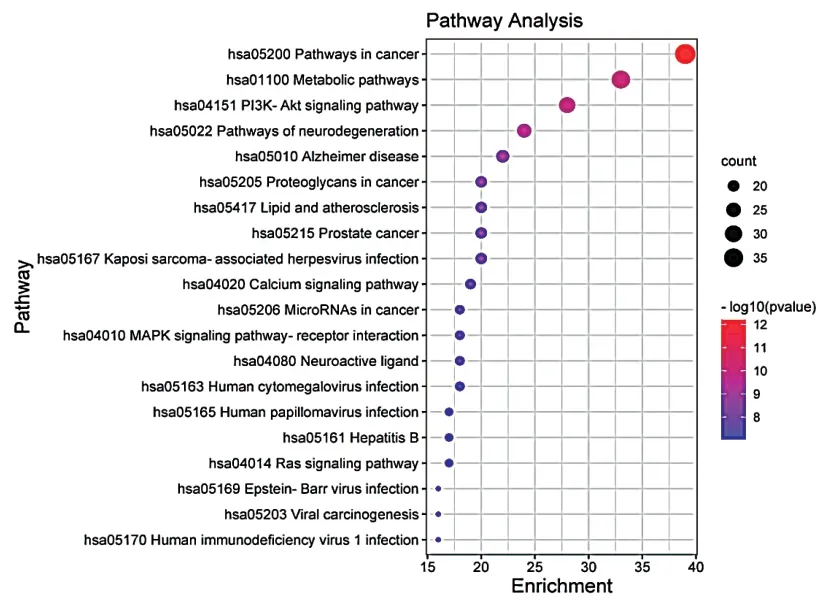
图6 KEGG通路富集分析气泡图
3 讨论
AD病灶在脑,在中医学中属于“健忘”“呆病”等范畴,与肾虚血瘀有关[11]。《伤寒论》提到“阳明病,其人喜忘者,必有蓄血”,《类证治裁》提到“若血瘀于内,则善忘如狂”[12]。AD属本虚标实之证,本虚为肾精亏虚、气血不足致脑髓失养,标实为血瘀络滞、痰浊互结则脑脉痹阻[13]。
黄精丸中黄精可补肾填精、益气养阴、健脾润肺[14],当归活血通络、补血和血、气畅血行[15],全方共奏补肾填精、活血通络之功。综上所述,黄精丸用于AD防治具有扎实的中医理论依据。黄精提取物可改善AD大鼠的学习记忆,降低海马tau蛋白磷酸化[16-17]。未小明等[18]也证实黄精对AD大鼠的行为认知、学习记忆能力等有明显改善作用。另有研究显示,黄精的主要成分黄精多糖可显著保护AD大鼠的海马神经元,并可减少细胞丢失,抗神经细胞凋亡[19]。当归性温,味甘、辛,归肝、心、脾经[20]。当归具有抗氧化、抗炎、抗衰老、抗AD及神经保护功能[21]。吴红彦团队发现当归提取物及有效组分(当归多糖、当归挥发油及阿魏酸)可提高脑组织胆碱能神经递质、抗自由基活性,从而改善AD大鼠、小鼠的学习记忆能力[22-23]。研究发现,当归水提取物可下调糖原合成酶激酶-3β(GSK-3β)酶活性,进而降低tau蛋白磷酸化水平[24]。此外,当归的有效成分藁本内酯[25-26]、阿魏酸对双侧颈总动脉闭塞导致的血管性痴呆(vascular dementia,VD)大鼠也具有良好的保护作用,均可显著改善VD大鼠的学习记忆,增强其认知能力[27]。但黄精丸防治AD的物质基础和作用机制尚未明确,有待深入研究。
本研究发现黄精丸7个活性成分参与AD的治疗,其中度值排名靠前的成分是黄芩素、5,4’-二羟基黄酮、甘草素、3’-甲氧基大豆苷元、β-谷甾醇)。研究发现,黄芩素能够抑制Aβ25-35损伤的PC12细胞的氧化应激,降低毒性反应,显示黄芩素具有改善认知功能和学习记忆的能力[28]。杜烨湘等[29]的研究显示,甘草素可有效抑制AD模型细胞的炎症反应,其机制可能与其能上调ERβ蛋白的表达有关。黄芩素、5,4’-二羟基黄酮、甘草素、3’-甲氧基大豆苷元均属于黄酮类成分。黄酮类成分是在自然界大量存在的一类具有广泛活性的中药化合物,可通过抑制胆碱酯酶活性、抑制氧化应激及清除自由基、修饰tau蛋白、减少Aβ形成、抑制炎症因子表达而有效阻断AD的疾病进展[30]。而β-谷甾醇也是黄芩的有效成分,具有抗氧化作用,并通过抑制体内补体系统的激活而发挥抗炎作用[31]。上述成分可能是黄精丸治疗AD的主要药效物质基础。
PPI蛋白相互作用分析结果显示,黄精丸治疗AD的核心靶点主要有AKT1、TP53、VEGFA、SIRT1、EGFR等;药物-成分-靶点网络拓扑图中PIK3CA、PIK3CB、EGFR、NOS2、MAPK3的度值相对较大。AKT1是一种丝/苏氨酸蛋白激酶,主要调控细胞的增殖和生长,参与细胞凋亡和葡萄糖代谢。TP53编码的蛋白质响应多种细胞应激,调节靶基因的表达,从而诱导细胞周期阻滞、凋亡、衰老、DNA修复或代谢改变。VEGFA是一种高度特异性的促血管内皮细胞生长因子,可促进血管内皮细胞迁移、血管新生,增加血管通透性及维护内皮细胞屏障功能。SIRT1是去乙酰化酶家族成员,通过激活过氧化物酶体增生物激活受体γ共激活剂-1α(PGC-1α)参与调节组蛋白去乙酰化酶与mtDNA结合活性,参与细胞糖脂代谢、DNA损伤修复、细胞周期控制,抑制细胞凋亡和延长细胞寿命[32]。表皮生长因子受体(EGFR)是一种跨膜糖蛋白,可诱导受体二聚和酪氨酸自磷酸化,从而导致细胞增殖,具有神经保护作用,其下调可能与AD有关[33]。PIK3CA是一个能够磷酸化磷酸肌醇环3’OH的脂质激酶家族。其负责协调多种细胞功能,包括增殖和存活。PIK3CB在真核细胞外膜受体的信号通路中起着重要作用,并因其催化亚基而得名。编码的蛋白是PI3Kbeta(PI3Kβ)的催化亚基。PI3KB已被证明是中性粒细胞激活途径的一部分,中性粒细胞在损伤或感染部位会结合免疫复合物。NOS2是一种活性自由基,在神经传递、抗菌和抗肿瘤等多个过程中发挥生物介质的作用。MAPK3基因编码MAP激酶,MAP激酶参与多种细胞过程,是tau蛋白激酶的一种[34],tau蛋白异常过度磷酸化是AD主要的发病机制之一,tau蛋白是脑内一种微管相关蛋白,受蛋白激酶(磷酸化)和蛋白磷酸酯酶(脱磷酸化)的调节,tau蛋白功能异常改变可能会导致神经元功能障碍和凋亡[35]。推测黄精丸可能通过降低MAPK的表达,从而减少tau蛋白的形成,减轻神经退行性变。
KEGG富集分析显示与黄精丸治疗AD相关的有癌症信号通路、代谢通路、PI3K-Akt信号通路、神经退行性性变信号通路、AD等。
本研究应用网络药理学的方法,结果显示黄精丸对AD的调控是通过多成分-多靶点-多途径的方式,为进一步研究提供了理论参考。后期可在药效学和细胞水平层面进行研究,以期进一步明确黄精丸防治AD的物质基础与作用机制。

