p53RFP对SW480细胞增殖、细胞周期及凋亡的影响
裴静娴,王月刚,程诚,刘城,吴平生
(1.广州医科大学附属第二医院心血管内科,广东 广州 510260;2.南方医科大学南方医院心血管内科,广东 广州 510515)
p53RFP是E3泛素连接酶家族成员之一[1],通过泛素蛋白酶途径降解细胞周期蛋白依赖性激酶抑制剂p21、促凋亡蛋白Bax及肿瘤抑制基因P63,在调节细胞周期、细胞增殖、分化及凋亡的过程中发挥重要作用[2,3]。研究显示其在表皮细胞、头颈部鳞状细胞癌细胞及子宫内膜癌细胞高表达,调节细胞的增殖和分化[3-4]。本课题组在前期构建了p53RFP表达载体pcDNA4-p53RFP[5],本研究以SW480细胞为研究对象,观察p53RFP过表达对SW480细胞增殖、细胞周期及凋亡的影响。
1 材料和方法
1.1 材料
SW480细胞由南方医科大学南方医院病理实验室保存,RPMI-1640培养基、0.05%胰酶+0.02%EDTA、不含EDTA0.05%胰酶均购自美国Gibco公司,胎牛血清购自美国Hyclone公司;逆转录试剂盒购自Takara、荧光定量PCR试剂盒购自 Roche公司、ECL发光试剂盒购自Millipore公司;小鼠抗p53RFP单克隆抗体购自Abnova公司;小鼠抗β-actin单克隆抗体、羊抗鼠辣根过氧化物酶标记二抗均购自Santa Cruz;CCK-8试剂盒购自日本Dojindo,细胞周期检测试剂盒、Annexin V-FITC/PI双染细胞凋亡检测试剂盒均购自江苏凯基公司。
1.2 方法
1.2.1细胞转染 SW480细胞以含5%胎牛血清的RPMI-1640培养基培养,待细胞达到70%~80%汇合后进行消化,细胞计数,以6×105细胞总数接种于60 mm培养皿。24 h后按照lipofetamine2000说明书操作,分别转染5 μg pcDNA4-p53RFP及pcDNA4空载质粒,空白组不做任何处理。转染 8 h后更换为新鲜培养基,37 ℃ 5%CO2培养箱继续培养。
1.2.2Western blot 检测p53RFP蛋白表达 SW480细胞转染48 h后提取细胞总蛋白,BCA法测定蛋白浓度。将蛋白与6×SDS加样缓冲液按5:1混合,100 ℃加热5 min,冰浴冷却,取40 μg总蛋白上样,行SDS-PAGE电泳,电转移至PVDF膜,依次5%脱脂牛奶封闭2~3 h,一抗(p53RFP 1∶500稀释;β-actin 1∶1 000稀释)孵育过夜,TBST洗膜10 min×3次,二抗(稀释比例为1∶10 000)室温孵育1 h,TBST 洗膜10 min×3次,ECL发光。
1.2.3CCK-8 检测p53RFP过表达对SW480 细胞增殖的影响 SW480细胞转染12 h后,消化为单细胞悬液,以每孔2000个细胞总数接种于96孔板,每组6个复孔。分别于转染后24 h、48 h、72 h、96 h,向培养孔加入10 μL CCK-8溶液,在培养箱中孵育3h,用酶标仪检测450 nm的吸光度值。
1.2.4p53RFP过表达对SW480细胞周期的影响 SW480细胞转染48 h后,消化细胞,离心(1 000 r/min,3 min)收集细胞;PBS洗涤细胞一次(离心2 000 r/min,5 min)收集并调整细胞浓度为1×106/mL;制备的单细胞悬液70%乙醇固定,4℃保存,染色前用PBS洗去固定液;加100 μL RNase A 37 ℃水浴30 min;再加入400 μL PI染色混匀,4 ℃避光30 min;流式细胞仪检测,记录激发波长488 nm 处红色荧光。
1.2.5Annexin V-FITC/PI双染检测p53RFP过表达对SW480细胞凋亡的影响 SW480细胞转染p53RFP表达载体或空载48 h后,用不含EDTA的胰酶消化收集细胞,PBS洗涤细胞二次(2 000 r/min离心5 min)收集细胞;加入500 μL的Binding Buffer悬浮细胞;加入5 μL Annexin V-FITC混匀后,加入5 μL PI,混匀;室温避光、反应5~15 min;流式细胞仪检测。
1.2.6荧光定量RT-PCR检测细胞周期相关蛋白的基因表达
SW480细胞转染后48 h提取细胞总RNA。以RNA为模板逆转录反应合成cDNA,应用荧光定量PCR试剂盒,行 Real-time PCR,反应条件:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 30 s,共40个循环,扩增CyclinB1、CyclinD1、p21 WAF1/CIP1、CDK1,β-actin 基因为内对照。引物序列见表1。

表1 荧光定量PCR引物序列
1.3 统计学分析
应用SPSS25.0软件进行统计学分析,计量资料以表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验;两组数据的比较采用独立样本t检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 Western blot 检测p53RFP蛋白表达
Western blot结果显示p53RFP转染组较空载转染组p53RFP蛋白表达水平明显上调。
2.2 p53RFP过表达对SW480细胞增殖的影响
CCK-8检测p53RFP转染后不同时间点的细胞增殖情况,结果见图2,转染后48 h、72 h、96 h,p53RFP转染组吸光度值显著低于空载组及空白对照组(P均<0.001)。提示p53RFP过表达显著抑制SW480细胞增殖。

1.空载转染组 2.p53RFP转染组
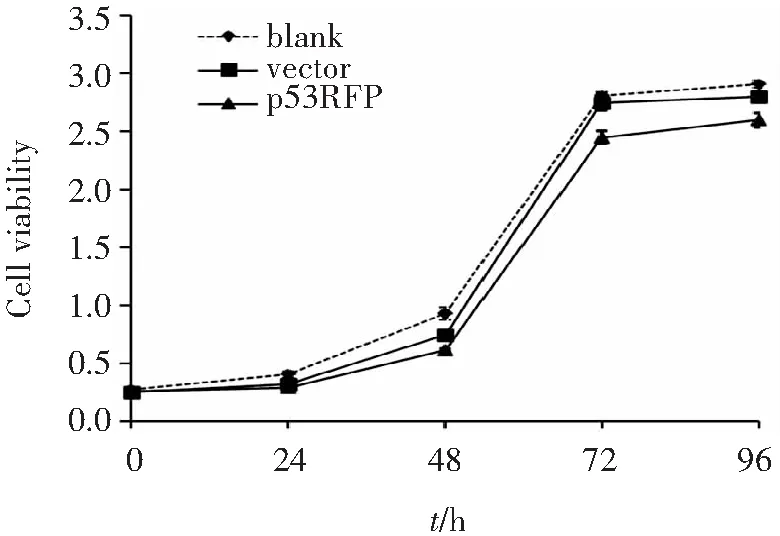
图2 不同处理组细胞生长曲线
2.3 p53RFP过表达对SW480细胞周期的影响
流式细胞仪检测SW480细胞转染48 h后细胞周期的变化,表2可见p53RFP转染组G1期细胞含量显著低于空白组及空载转染组(P均<0.05),而G2期细胞含量显著高于其他两组(P均<0.05)。
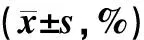
表2 不同组细胞周期
2.4 p53RFP过表达对SW480细胞凋亡的影响
流式细胞仪检测p53RFP转染SW480细胞48 h后对细胞凋亡的影响,见图4,结果显示p53RFP过表达组及空载转染组细胞凋亡率分别为(8.20±1.61)%、(3.11±0.45)%,差异具有统计学意义(P<0.05)。
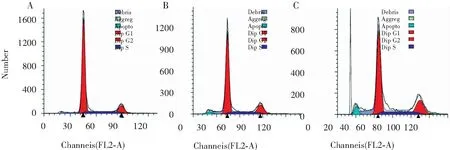
A.空白对照组;B.空载转染组;C.pcDNA-4-p53RFP转染组

图4 流式检测p53RFP对SW480细胞凋亡的影响
2.5 p53RFP过表达对细胞周期相关蛋白基因表达的影响
p53RFP过表达组p21 WAF1/CIP1mRNA表达水平显著高于空载转染组,差异具有统计学意义(P<0.05),而两组CyclinB1、CyclinD1、CDK1 mRNA表达水平无显著性差异(P均>0.05)。
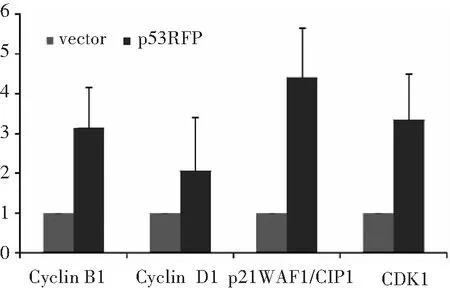
图5 p53RFP对细胞周期相关蛋白mRNA表达的影响
3 讨 论
p53RFP,也称为IBRDC2、PIR2/RNF144B[1,3],最初被鉴定为受p53转录调控的一个靶基因[2],后续研究发现其也受p53其他家族成员p63、p73的直接调控[3,6]。目前已经明确p53RFP基因编码的蛋白包含两个结构域,即位于氮端RING-IBR-RING结构域及碳端保守的跨膜结构域[1,7]。有研究表明含有环指结构域的蛋白在多种细胞生理活动中发挥重要功能,包括调控细胞凋亡、细胞周期、信号转导、蛋白与蛋白之间相互作用、抑制肿瘤等[2,8,9]。此外,大量研究还显示,RING结构域也是RING E3泛素连接酶所共有的特征性结构域,这类蛋白通常具有E3泛素连接酶活性或作为E3复合物的必需辅助因子,参与泛素化降解途径[10,11]。p53RFP同样被证实具有E3泛素连接酶活性[12]。
目前对p53RFP基因的认识尚不充分,在生物学功能方面的研究仍存在未知和争议。已有研究证明p53RFP具有调控细胞周期、诱导细胞凋亡的功能,且这些功能通过E3泛素连接酶介导[2,3]。然而,也有文献报道p53RFP诱导的细胞凋亡依赖于碳端跨膜结构域的功能,而非氮端的E3泛素连接酶[12]。我们的研究显示p53RFP过表达可抑制SW480细胞增殖、诱导细胞凋亡、介导G2期阻滞。与我们的研究结果一致的是,Huang 等研究表明p53RFP过表达可诱导HEK293及HCT116细胞凋亡[12]。然而,另一项研究显示在正常或应激条件下,p53RFP过表达本身对细胞周期或凋亡没有直接影响[6]。
此外,我们进一步检测了p53RFP过表达对细胞周期相关蛋白mRNA表达的影响,结果显示p53RFP过表达可使p21 WAF1/CIP1mRNA表达水平显著增加,而对CyclinB1、CyclinD1、CDK1 的mRNA表达并无显著影响。因此,我们推测p53RFP对SW480细胞周期的影响可能通过p21 WAF1/CIP1介导。与我们的研究结果不同的是,有文献报道p53RFP可能通过泛素化降解p21 WAF1/CIP1 调控细胞周期[2]。而p53RFP是否可以直接调控细胞周期相关蛋白、促凋亡因子的表达,目前尚无相关文献报道。因此,p53RFP调控SW480细胞活动的相关机制有待进一步研究。

