人脐带间充质干细胞及其外泌因子对白消安致雄性小鼠生殖损伤的保护作用
黄磊 ,马牧南 ,桑宇超 ,郭璇 ,傅松涛 ,,
1.山西医科大学生物化学与分子生物学教研室,山西 太原 030001;2.山西宾大干细胞科技有限公司,山西 太原 030001;3.山西省生物医药健康研究生教育创新中心,山西 太原 030001
男性不育症(male infertility)不是一种独立的疾病,而是由一种或多种疾病和因素导致的结果。近几年,男性因素占不育症的比例高达50%[1],精液检查主要表现为精子数量少、活力弱、畸形率高,甚则无精子等异常[2]。其中,无精子症占男性不育原因的20%,包括梗阻性和非梗阻性[3-4]。随着辅助生殖技术的发展,无精子症的生殖功能下降成为制约生育的瓶颈[5]。因此,探索更为安全有效的方式,如干细胞治疗,对治疗男性不育尤其是无精子症具有重要意义。
精子发生障碍可能与精原干细胞(spermatogonia stem cells,SSCS)的增殖、分化和减数分裂紊乱有关[6]。目前,干细胞及干细胞组织工程技术在帮助男性不育症患者恢复生育能力的应用研究方面进展较快[7]。间充质干细胞(mesenchymal stem cells,MSCs)是发育于早期的中胚层,其最初在骨髓中发现,因此有多向分化潜能,可分化为脂肪、骨、软骨等多种组织细胞,可作为理想的种子细胞用于衰老和病变引起的组织器官损伤修复[8]。在生殖领域,骨髓MSCS 移植可治疗雄性不育,将雄性转基因小鼠骨髓干细胞在体外用视黄酸诱导为原始生殖细胞,再移植到白消安(busulfan,BSF)致无精子症小鼠睾丸中,发现移植细胞增殖并分化为精原细胞,但无次级精母细胞及精子[9]。表明MSCS 在生殖治疗方面具有较好的应用前景,但MSCS 分泌因子对男性不育的作用尚未明确。
本研究主要探讨人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,HUMSCs)及其外泌因子(HUMSCs-CM)对小鼠生精损伤及无精子症的修复作用,同时探讨二者对精子发生有关细胞、细胞连接、生精细胞凋亡和减数分裂等机制的影响,为保护精子发生功能和治疗无精子症提供参考。
1 材料与方法
1.1 主要试剂 DMEM / F12 和青-链霉素购自美国Hyclone 公司;胎牛血清(FBS)和胰蛋白酶购自美国Gibco 公司;BSF 和二甲亚砜(DMSO)购自美国 Sigma公司;HUMSCs 成骨、成脂诱导分化培养试剂盒购自美国Cyagen 公司;小鼠抗人CD90-FITC、CD45-PE、CD29-APC、CD44-PE 购自美国 Becton,Dickinson 公司;苏木素、伊红、BCA 蛋白定量试剂盒购自中国Beyotime 公司;Trizol 购自美国 Invitrogen 公司;反转录试剂盒和qPCR 试剂盒购自中国TransGen Biotech 公司;SDS-PAGE 凝胶配制试剂盒购自中国Solarbio 公司;RIPA 裂解液购自中国博士德生物工程有限公司;N-钙黏蛋白(N-Cadherin)兔多克隆抗体、P-钙黏蛋白(P-Cadherin)兔多克隆抗体和GAPDH兔多克隆抗体购自中国Proteintech 公司;细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)兔单克隆抗体和HRP 标记的山羊抗兔IgG(H + L)购自英国Abcam 公司。
1.2 实验动物 SPF 级 BALB / c 小鼠,雄性,8 ~ 10周龄,体重22 ~25 g,购自山西医科大学动物实验中心,动物合格证号为:SCXK(晋)2015-0001。本实验均以科研为目的对小鼠进行养殖和使用,且按照山西医科大学实验动物福利伦理审查指南相关规定进行(山医大科[2019]9 号)。
1.3 主要试剂的配制 完全培养基:45 mL DMEM /F12 培养基中加入5 mL FBS 和0.5 mL 青-链霉素,混匀,置4 ℃冷藏保存;油红O 染液:100 mg 油红用异丙醇定容至20 mL,混匀溶解后,4 ℃避光保存;茜素红染液:200 mg 茜素红用双蒸水定容至20 mL,混匀溶解后,4 ℃避光保存;10 mg / mL BSF 试剂:将100 mg BSF 粉剂溶于10 mL DMSO,置37 ℃水浴箱溶解混匀,制成 10 mg / mL BSF 试剂,-20 ℃保存,使用前置37 ℃水浴箱溶解保温,防止DMSO 冷凝。
1.4 HUMSCs 的培养和鉴定 于山西医科大学附属第一医院采集新生儿脐带,将脐带组织中的动脉和静脉血管剥离,脐带基质剪成1 ~2 mm3组织块。将组织块铺在25 cm2培养瓶中,加入含10%胎牛血清、1%青霉素和链霉素的 DMEM / F12 培养基,置37 ℃,5% CO2饱和湿度的培养箱中培养,细胞爬出融合60%时,弃去组织块,待细胞融合90%时,加入1 mL 胰蛋白酶消化4 min,镜下观察细胞收缩并悬浮,即加入1 mL 胎牛血清终止消化,收集细胞悬液,1 000 × g 离心8 min,收获沉淀,加入完全培养基重悬[10]。将原代细胞1 ∶1 传代至新的培养瓶中,即为第1 代HUMSCs,每3 d 换液1 次,当细胞融合90%时胰酶消化,按 1 ∶2 传代,即为第 2 代、第 3 代,以此类推[11]。取第4 代HUMSCs,经流式细胞仪进行细胞表型鉴定,并重悬于200 μL PBS 中,通过流式细胞仪鉴定细胞表面抗原CD90、CD44、CD45、CD29的表达;同时进行成骨、成脂诱导分化试验,经茜素红和油红O 染色观察诱导成骨和成脂情况[12]。
1.5 HUMSCs-CM 的分离和制备 取第4 代HUMSCs,细胞生长融合至90%时,弃去原培养基,PBS 洗涤 3 次,添加无血清 F12 / DMEM 培养基培养 72 h,收集细胞上清液-条件培养基(CM)[13]。将 CM 600 × g离心5 min 去除细胞碎片和沉杂,上清经0.22 μm滤器过滤后,得到浓缩25 倍的HUMSCs-CM。用BCA试剂盒测定蛋白浓度,为0.60 mg / mL,分装,储存于-80 冰箱[14]。
1.6 BSF 造模及 HUMSCs/HUMSCs-CM 干预试验 取 BALB / c 小鼠 21 只,饲养 1 周适应环境,将小鼠随机分为实验组和对照组,每组3 只,实验组按40 mg / kg 一次腹腔注射 BSF 溶液 100 μL,注射 4周后造成生精损伤小鼠模型;对照组一次腹腔注射生理盐水100 μL[15]。在此基础上,将实验组随机分为 3 组:BSF 组(BSF 处理后第 2 天,经尾静脉注射生理盐水 200 μL 作为阳性对照组)、HUMSCs 组(BSF处理后,经尾静脉注射HUMSCs 200 μL 治疗)和HUMSCs-CM 组(BSF 处理后,经尾静脉注射HUMSCs +CM 200 μL 治疗);对照组在第2 天经尾静脉注射生理盐水200 μL 作为阴性对照。其中,HUMSCs 和HUMSCs-CM 组分别经尾静脉注射1×107HUMSCs+生理盐水 200 μL 和 HUMSCs + CM 200 μL。治疗频次为每周2 次,连续4 周,持续观察到第8 周末,脱臼处死所有小鼠,收集双侧睾丸,进行相关检测和组织学观察。
1.7 组织学观察 取小鼠一侧睾丸,经4%多聚甲醛固定,在不同浓度酒精中脱水,石蜡包埋,切片后进行苏木素-伊红染色,光镜下观察生精小管基底膜细胞分离情况和基底腔空泡形成情况[16]。
1.8 小鼠生精细胞减数分裂相关基因mRNA 表达水平的检测 采用实时荧光定量PCR(qPCR)法检测损伤和修复各组生精细胞周期相关基因mRNA的表达水平。用Trizol 试剂提取各组细胞总RNA,使用TransScript One-Step gDNA Removal and cDNA Synthesis 进行检测。SCP3 基因(GenBank ID:25561)上游引物序列:5′-GCTGGTAGAGGGAGCAGATG-3′,下游引物序列:5′-AGCCTTTGTGAACCAACACC-3′;STRA8 基因(GenBank ID:500079)上游引物序列:5′-GGTAGGGCTCTTCAACAA-3′,下游引物序列:5′-ACTTATCCAGGCTTTCTTC-3′;TNP2 基因(GenBank ID:24840)上游引物序列:5′-CCTTCCCACCACTCATCCC-3′,下游引物序列:5′-AGTCCGTTTCCGCCTCCT-3′;DDX4 基因(GenBank ID:310090)上游引物序列:5′-GGAGCCGGAGGAGAACAAG-3′,下游引物序列:5′-CTCGGTCAAGTTCAACATGACAG-3′;OCT4基因(GenBank ID:821613)上游引物序列:5′-GAGCAAAACCCGGAGGAGT-3′,下游引物序列:5′-TTCTCTTTCGGGCCTGCAC-3′。以 β-actin 基因(GenBank ID:81822)为内参,上游引物序列:5′-GCTGACCAAACTGCTAAATGACGA-3′,下游引物序列:5′-CAAAGTTGTCATGGATGACC-3′。qPCR 反应条件:94 ℃30 s;94 ℃ 5 s,60 ℃ 30 s,共 45个循环。绘制溶解曲线,采用2-△△CT法计算目的基因表达量。
1.9 小鼠睾丸组织中细胞黏附相关蛋白表达水平的检测 采用Western blot 法。用电子天平称量取出的小鼠睾丸。按RIPA 裂解液容积(mL)与小鼠睾丸重量(g)10 ∶1 比例加入,将组织进行匀浆裂解出等量的蛋白质(40 μg),经 10% SDS-PAGE 分离后转移至PVDF 膜上,用5%封闭蛋白干粉封闭1 h;加入兔抗小鼠ICAM-1 单克隆抗体、兔抗P-Cadherin、N-Cadherin 多克隆抗体(均 1 ∶1 000 稀释)、兔抗内参GAPDH 多克隆抗体(1 ∶5 000 稀释),4 ℃孵育过夜;PBS 缓冲液洗涤3 次,加入HRP 标记的山羊抗兔IgG(H + L)(1 ∶5 000 稀释),室温孵育 1 h,使用 ECL曝光。通过Image J 软件定量条带的相对强度。
1.10 统计学分析 利用SPSS 21.0 软件进行统计学分析,两组间数值变量资料的比较采用Student t检验(Student′s t test),组间比较采用曼-惠特尼 U 检验(Mann-Whitney U test),以 P < 0.05 为差异有统计学意义。
2 结 果
2.1 HUMSCs 的鉴定
2.1.1 形态与生长特征 倒置显微镜下观察可见,培养7 d 的贴壁脐带组织周围有细胞爬出,细胞呈多种形态,如三角形、梭形等;培养14 d,细胞集落样生长非常明显,融合度为70%;培养21 d,细胞融合度为90%,有大量梭形和不规则形态细胞。第3代细胞接种后生长迅速,镜下呈梭形,排列均匀紧密,呈漩涡状分布。见图1。

图1 HUMSCs 形态的显微镜观察(× 100)Fig.1 Microscopy of morphology of HUMSCs(× 100)
2.1.2 表型鉴定 流式细胞仪检测结果显示,第3代 HUMSCs 表面抗原 CD90、CD44、CD29 阳性率分别为 99.66%、97.40 和 94.47%,CD45 阳性率为0.10%。见图2。

图2 流式细胞仪分析HUMSCs 的表面标记物Fig.2 Flow cytometry of surface markers of HUMSCs
2.1.3 多重分化能力 HUMSCs 成骨诱导21 d 后,经茜素红染色可见红色颗粒物,表明HUMSCs 可分化为成骨细胞;HUMSCs 成脂诱导21 d 后,经油红O 染色可见大量油样的红色空泡,表明HUMSCs 可分化为成脂细胞。见图3。

图3 HUMSCs 成脂、成骨诱导分化(× 100)Fig.3 Osteogenic and adipogenic differentiations of HUMSCs(× 100)
2.2 BSF 造模对小鼠的影响
2.2.1 睾丸形态学改变 光镜下观察发现,经BSF处理4 周后,小鼠生精小管中近基底膜上的精原细胞和精母细胞有空泡形成,大量消失,仅在生精上皮基底膜上存在少量的精原细胞和睾丸支持细胞。生精上皮层次紊乱,出现“缺层”现象,生精小管管腔直径增加,精子和精原细胞减少。见图4。

图4 BSF 造模后小鼠睾丸生精小管结构观察Fig.4 Structure of seminiferous tubules in model mice induced by BSF
2.2.2 生精细胞减数分裂相关基因的表达水平qPCR 结果显示,实验组与对照组相比,减数分裂相关基因 STRA8、TNP2、SCP3、DDX4、OCT4 mRNA 表达水平均明显降低,且差异均有统计学意义(t 分别为 6.312、5.117、6.453、7.226 和 5.334,P 均 <0.01)。见图 5。
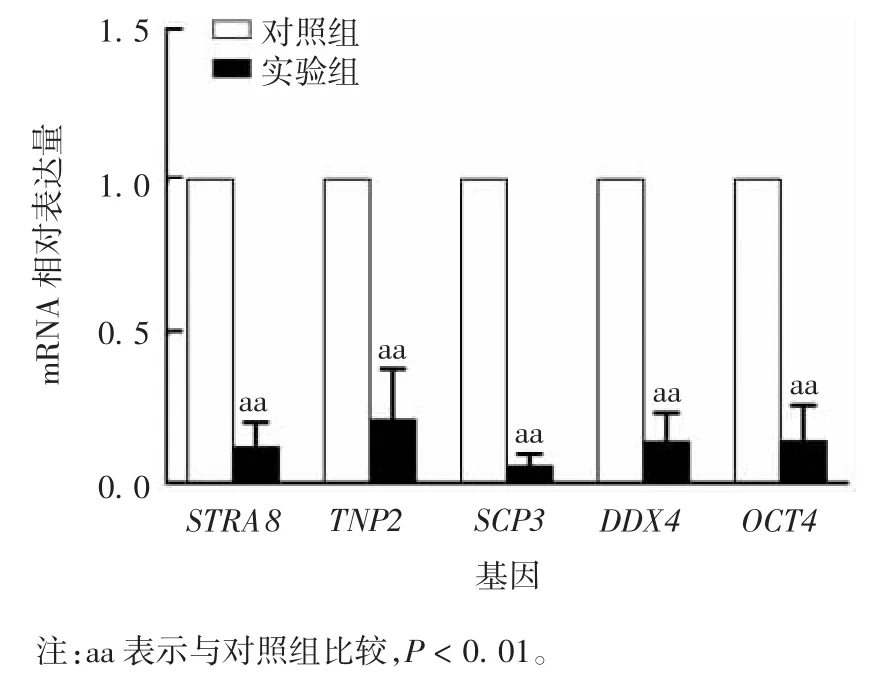
图5 BSF 造模后小鼠生精细胞减数分裂基因mRNA 表达情况Fig.5 Meiosis gene mRNA expression in spermatogenic cells of model mice induced with BSF
2.2.3 细胞黏附相关蛋白表达水平 Western blot分析显示,注射BSF 4 周后,小鼠睾丸组织中细胞黏附相关蛋白 N-Cadherin、P-Cadherin、ICAM-1 的表达水平明显低于对照组,且差异均有统计学意义(t 分别为 5.389、6.116 和 5.493,P 均 < 0.01)。见图 6和图7。
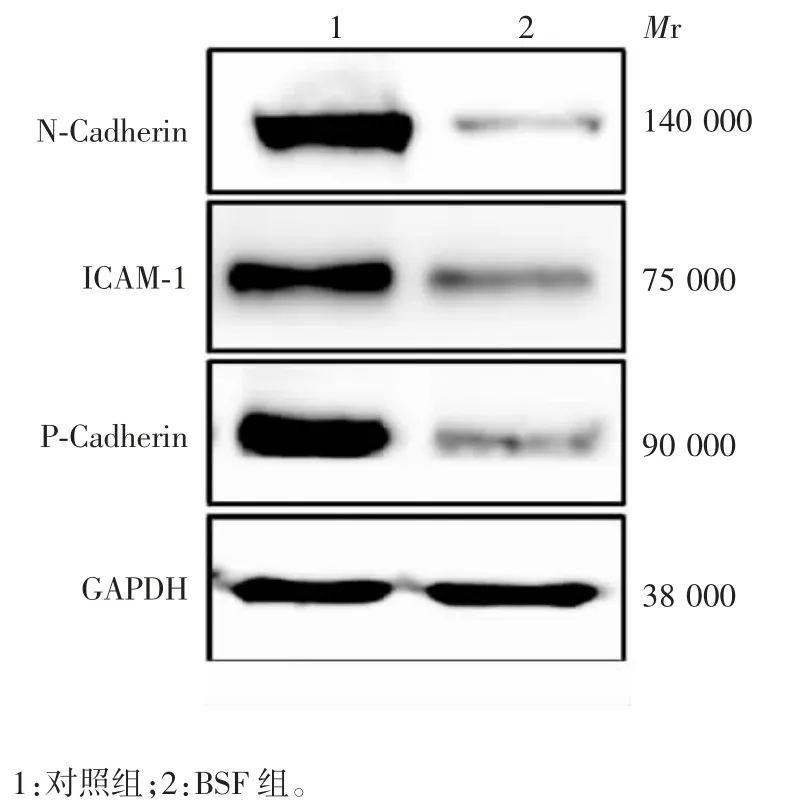
图6 Western blot 分析BSF 造模后小鼠睾丸组织中细胞黏附相关蛋白的表达水平Fig.6 Western blotting of expression levels of N-Cadherin,ICAM-1 and P-Cadherin in testicle tissue of model mice induced by BSF

图7 BSF 造模后小鼠睾丸组织中细胞黏附相关蛋白的表达水平Fig.7 Relative expression levels of N-Cadherin,P-Cadherin and ICAM-1 of testicle tissue of model mice induced by BSF
2.3 HUMSCs/HUMSCs-CM 对 BSF 致小鼠生精损伤模型的影响
2.3.1 对睾丸形态的影响 光镜下观察可见,HUMSCs / HUMSCs-CM 组与 BSF 组相比,生精小管基底膜空泡化和基底膜生精细胞分离情况均有所改善,生精小管管腔直径变小,精原细胞和精子增多;HUMSCs-CM 组改善情况比HUMSCs 组明显,主要表现为HUMSCs-CM 组曲精小管内仍可见精母细胞等生精细胞,而HUMSCs 组生精小管内生精细胞空泡化改善不明显。见图8。

图8 各组小鼠睾丸生精小管结构观察Fig.8 Testicular seminiferous tubule structure of mice in various groups
2.3.2 对小鼠生精细胞减数分裂相关基因表达水平的影响 qPCR 结果显示,BSF 处理 8 周后,HUMSCs-CM 组与 BSF 组比较,减数分裂基因 STRA8、TNP2、SCP3 mRNA 的表达水平均显著增加,且差异均有统计学意义(U 均为 0,P 均 < 0.01);HUMSCs-CM 组与HUMSCs 组比较,STRA8、TNP2、SCP3 基因 mRNA的表达水平均显著增加,且差异有统计学意义(U 均为 0,P 均 < 0.05);而 HUMSCs 组与 BSF 组比较,STRA8、TNP2、SCP3 基因 mRNA 的表达水平差异无统计学意义(U 分别为 1.0、2.5 和 2.0,P 分别为 0.123、0.316 和 0.197)。见图 9。

图9 各组小鼠 STRA8(A)、TNP2(B)、SCP3(C)基因 mRNA的表达水平Fig.9 Determination of expression levels of mRNA of STRA8(A),TNP2(B)and SCP3(C)in mice of various groups
2.3.3 对睾丸组织细胞黏附相关蛋白表达水平的影响 Western blot 分析显示,经BSF 处理8 周后,与BSF 组相比,HUMSCs-CM 组小鼠睾丸组织中PCadherin、N-Cadherin 和 ICAM-1 蛋白的表达水平均显著增加(U 均为 0,P 均 < 0.01);HUMSCs 组ICAM-1蛋白的表达水平显著增加(U=0,P < 0.05),P-Cadherin和N-Cadherin 蛋白的表达水平差异无统计学意义(U 分别为 1.5 和 2.5,P 分别为 0.135 和 0.231)。见图10 和图11。

图10 Western blot 分析各组小鼠睾丸组织中细胞黏附相关蛋白的表达水平Fig.10 Western blotting of expression levels of N-Cadherin,ICAM-1 and P-Cadherin in testicle tissue of mice in various groups
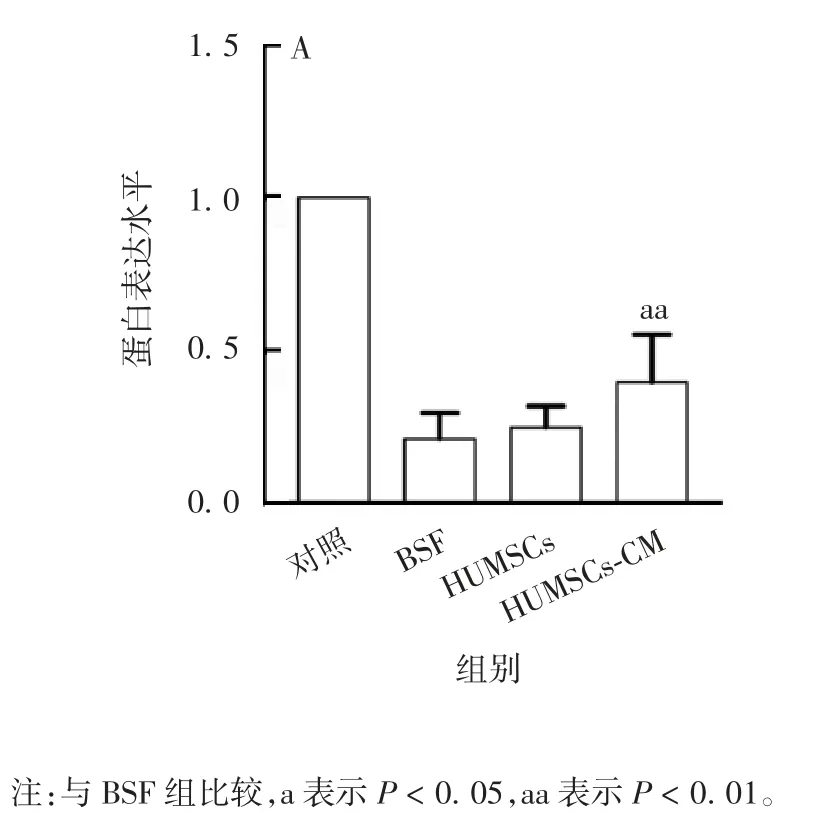
图11 各组小鼠睾丸组织中细胞黏附相关蛋白NCadherin(A)、P-Cadherin(B)、ICAM-1(C)的表达水平Fig.11 Relative protein expression levels of N-Cadherin(A),P-Cadherin(B),ICAM-1(C)in testicle tissue of mice in various groups
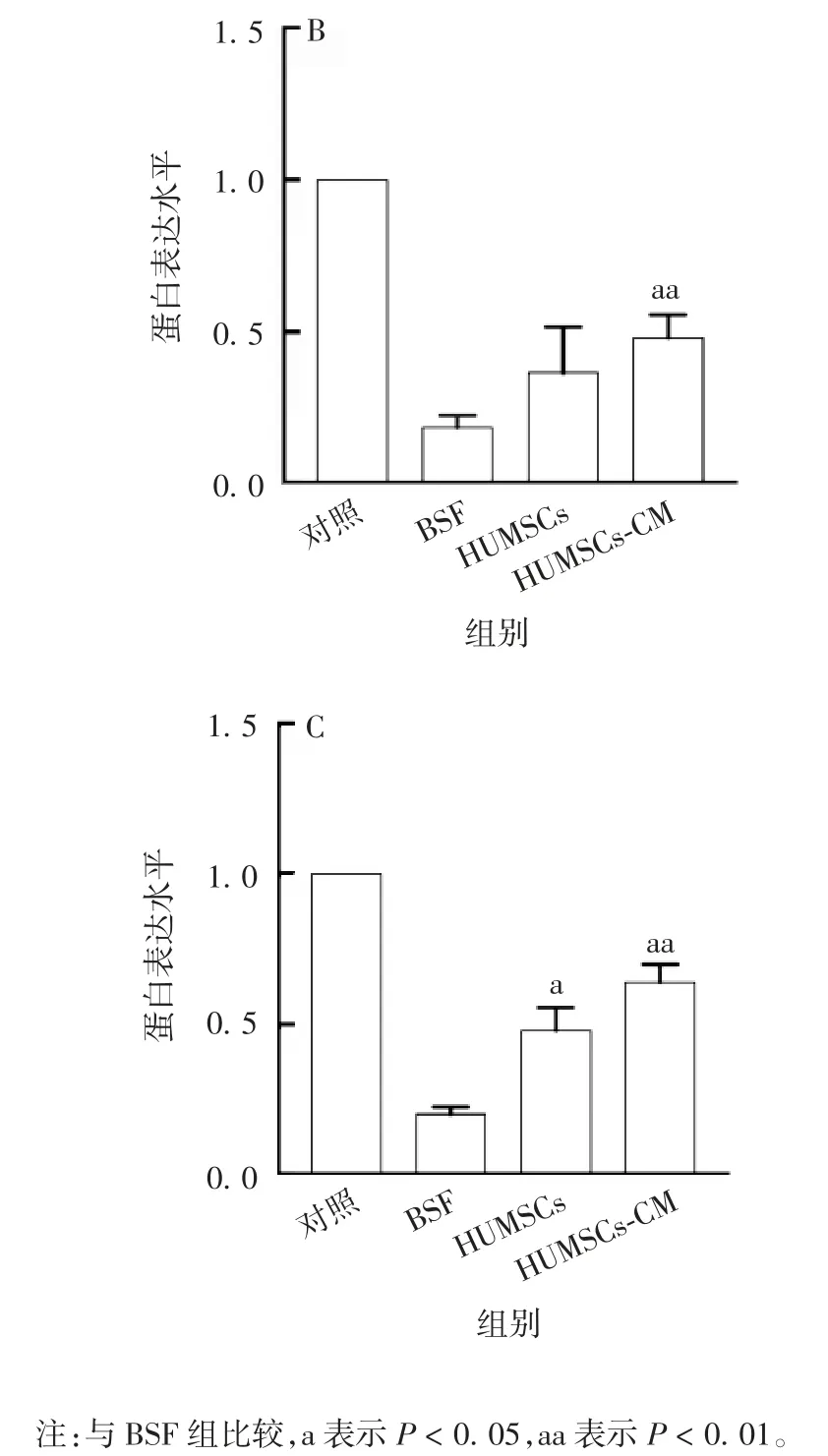
续图11 各组小鼠睾丸组织中细胞黏附相关蛋白NCadherin(A)、P-Cadherin(B)、ICAM-1(C)的表达水平Fig.11(Continued)Relative protein expression levels of N-Cadherin(A),P-Cadherin(B),ICAM-1(C)in testicle tissue of mice in various groups
3 讨 论
本研究结果证明,多次注射HUMSCs-CM 不仅可延缓BSF 对小鼠精子发生的损伤,还可对生精功能有保护作用。但不能完全阻止BSF 引起的生殖毒性作用。HUMSCs 产生的作用机制可能与其分泌因子有效阻止生殖细胞的凋亡,促进细胞黏附相关蛋白表达,为精子发生的微环境提供有利因素有关。
BSF 作为一种化疗药物可有效杀死肿瘤细胞,同时也可能对男性生殖系统造成不同程度的毒性作用,如精子活力与浓度降低、畸形精子率增加等[17],导致生育下降,严重者还可出现永久性少精子症或无精子症。
BSF 对生精损伤的毒性作用主要表现在以下两方面:第一方面,BSF 可使睾丸生精小管基底膜空泡化和生精细胞脱离基底膜,主要由于其抑制了ICAM-1、P-Cadherin、N-Cadherin 蛋白的表达,从而破坏了血睾屏障完整性,精子生成就会减少[18];第二方面,BSF 可通过 AKT 的 mTOR 和 p53 信号通路抑制小鼠生精细胞的自噬,从而促进生精细胞凋亡,精子生成减少[19]。
我们发现,注射BSF 4 周后,小鼠出现了生精小管空泡化和基底膜与生精细胞脱离,生精细胞减数分裂基因 STRA8、TNP2、SCP3、DDX4、OCT4 mRNA表达水平明显降低[20],细胞黏附相关蛋白ICAM-1、P-Cadherin、N-Cadherin 的表达也降低,破坏了生精上皮结构完整性,最终导致了小鼠生精障碍[21]。雄性BALB / c 小鼠腹腔注射BSF 后,破坏了血睾屏障完整性,促进了生精细胞的凋亡,从而导致精子生成减少。
目前,MSCs 以及MSCs 分泌因子已在生殖障碍疾病的应用研究中发挥作用[22]。研究表明,骨髓MSCs 分泌因子通过增强抗氧化能力减少生精细胞凋亡,从而改善精子运动能力[23]。LIU 等[24]研究报道,MSCs 分泌因子含有血管生成素,可调节异种移植卵巢组织的血管生成和卵泡存活能力。本研究通过尾部注射 HUMSCs-CM 和 HUMSCs,发现 HUMSCs及其外泌因子能增加生殖相关细胞之间的黏附,使ICAM-1、P-Cadherin、N-Cadherin 细胞相关黏附蛋白表达水平上调,保护了血睾屏障的完整性;同时也上调了生精细胞减数分裂基因STRA8、TNP2、SCP3 的水平,减少生精细胞凋亡,促进精子发生,且HUMSCs-CM 比HUMSCs 的作用更为显著。为改善化疗药BSF 对精子的损伤作用提供了实验依据,也为促进男性生殖能力的恢复提供了新的手段。
尽管如此,MSCs 及其分泌因子恢复生精功能的机制仍不明确。HUMSCs 分泌因子的提取主要经滤径0.22 μm 的滤器过滤后获得,因此,不能完全排除蛋白质的微囊泡存在。微囊泡是细胞分泌、具有膜结构的一种囊泡载体,其中含有蛋白质、mRNA、DNA 等物质,在不同细胞间进行信息传递[25],微囊泡直径很小,可快速抵达病灶部位。本研究提取的HUMSCs 分泌因子可能包含有生物活性的微囊泡结构,可进入生精小管损伤组织中发挥作用。本研究未进行检测微囊泡的试验,后续需进一步深入研究。

