细胞外囊泡在肝癌及胰腺癌诊断中的研究进展
细胞外囊泡(extracellular vesicles,EVs)是细胞主动分泌的一类具有磷脂双分子层结构的、纳米到微米级大小的膜囊泡总称,其种类多样,具有不同的理化性质和生化特征。几乎所有的细胞会分泌EVs,然而EVs一度被认为只是细胞向外运输排泄物质的一种途径,在很长的一段时间内,EVs并未引起人们的重视。近年来随着研究的深入,人们逐渐发现EVs可以作为遗传信息的传递者,携带和传递信号分子运输到相邻及远处的细胞,从而调节细胞的生理和病理状态
。肝癌和胰腺癌是常见的恶性肿瘤,由于缺乏早期典型的临床表现,很多患者错过了根治手术的时机
。EVs携带来源肿瘤细胞内特定的核酸、蛋白等分子物质,具有很强的肿瘤特异性,在肝癌和胰腺癌的发生和发展中扮演十分重要的角色,在早期诊断和治疗中具有巨大临床应用前景
。本文就EVs的种类和功能,分离、提纯和鉴定技术,以及在肝癌和胰腺癌中的诊断及预后中的研究进展作一概述。
1 EVs的概述及分类
EVs是一类包含由细胞释放的各种生物分子的脂质双层封闭结构,内含丰富的核酸、脂质、蛋白质等,参与细胞间的物质交换和信息交流,是细胞间通讯的主要形式。根据其来源、大小、生物特性和产生方式的不同,主要分为三类,分别为外泌体(exosomes)、微囊泡(micorovesicles,MVs)和凋亡小体(apoptotic bodies),其中起关键性作用的是外泌体
。
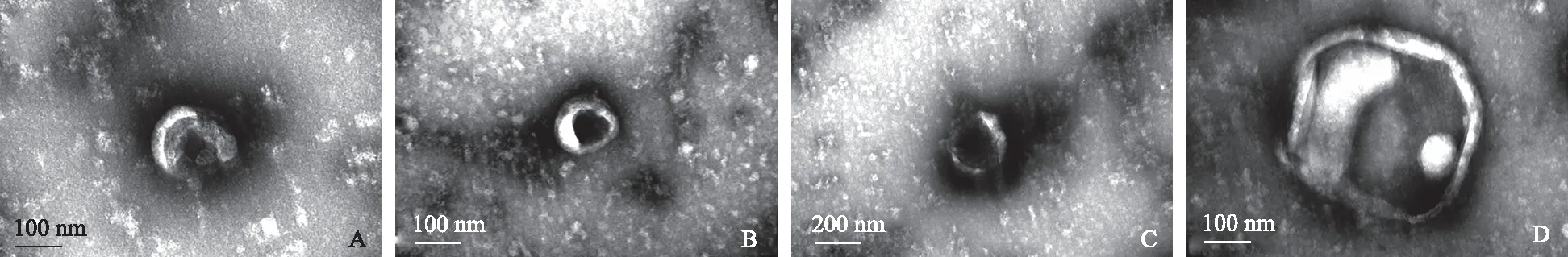
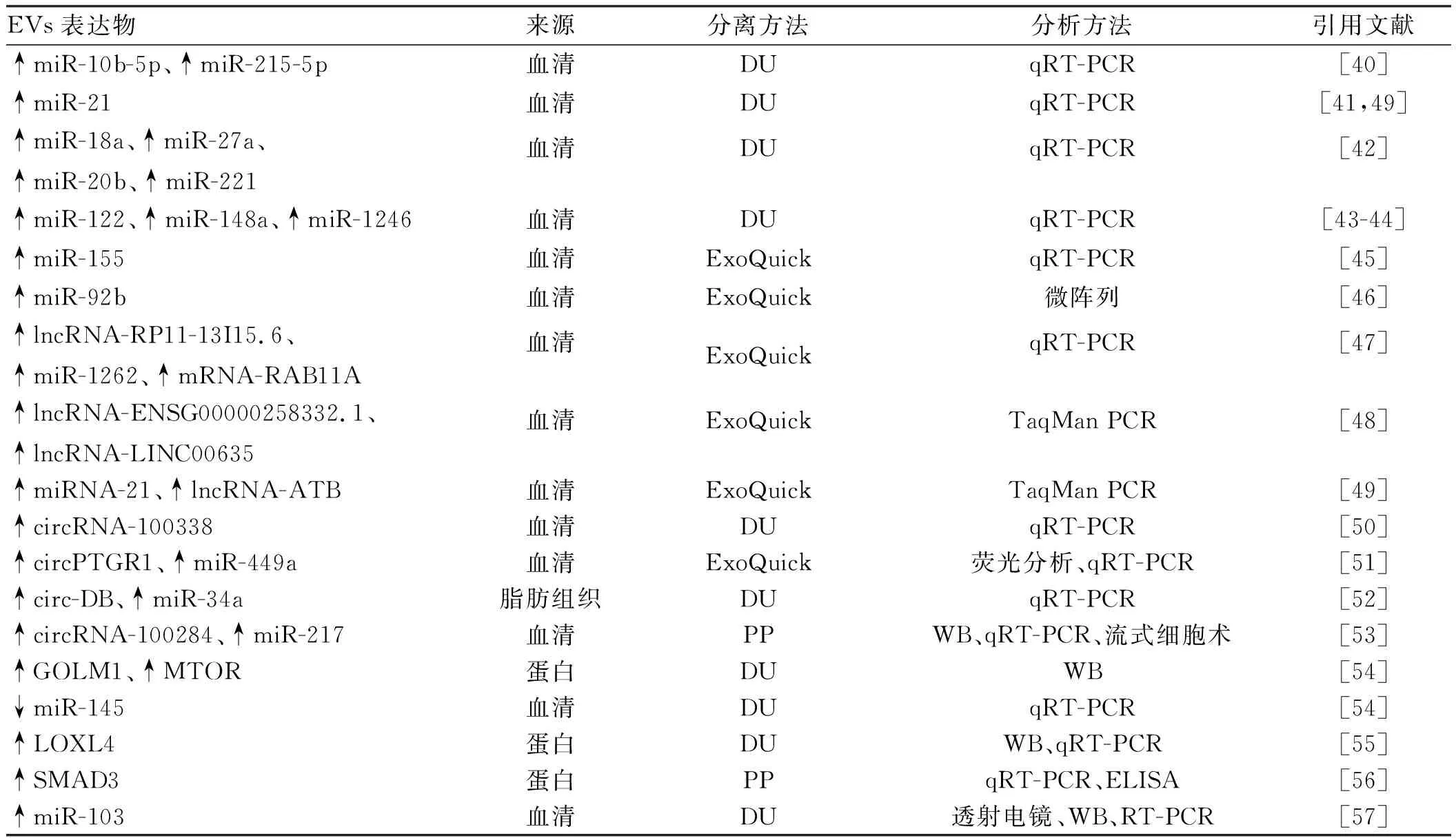
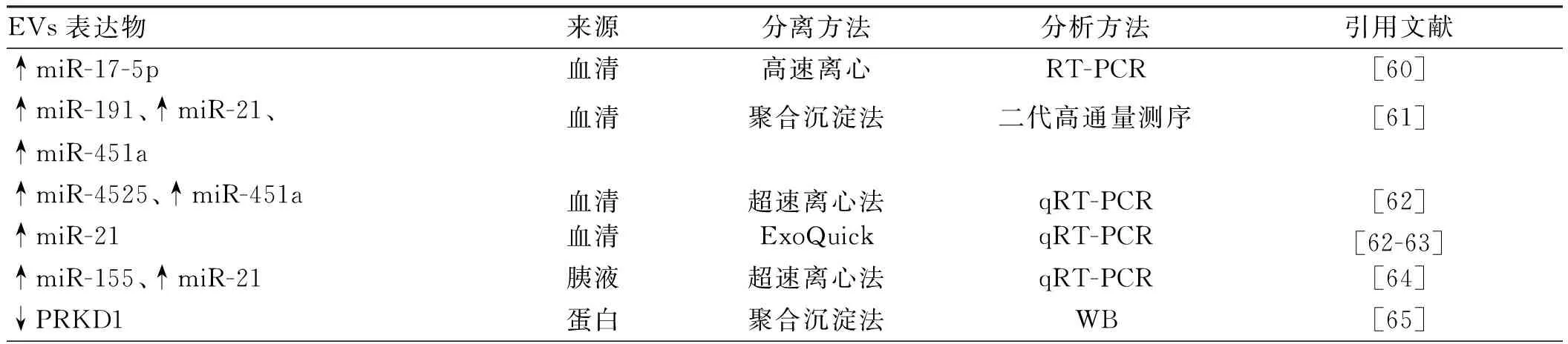
外泌体是由细胞内多囊泡体(multivesicular bodies,MVBs)与细胞膜融合形成的直径为40~100 nm的纳米囊泡,以外分泌的形式释放到细胞外环境中,在电镜下观察呈杯状或碟状结构。其形成经历内吞-MVBs形成-外泌体分泌3个阶段
。CD63、CD81、CD9是其标志物,CD63在几乎所有的外泌体中表达,CD81、CD9在部分外泌体中表达。MVs是由细胞膜向外出芽方式形成的直径为50~1 000 nm的异质性囊泡,其形成与细胞双层的磷脂不对称分布有关,膜联蛋白(Annexin)A1是其特殊的标志物,在癌细胞中,MVs的产生明显增多
。凋亡小体是细胞在凋亡过程中细胞骨架破裂时,质膜向外起泡,释放包膜的细胞碎片。这个过程包括凋亡细胞核染色质凝聚,经核碎片包裹进不同的膜囊泡中,囊泡脱落形成凋亡小体
(见表1、图1)。
3)春季低空切变和地面倒槽是引发暴雨最重要的影响系统。夏季各月的主要影响系统存在较大的差别,6月份最常见的天气系统配置是高空槽东移,中低层有切变或急流配合,地面有倒槽或低压存在,另外6月时东北冷涡与地面倒槽或低压的配合也是典型的系统配置,此时低空急流的强度在一定程度上影响着降水量的大小。7月的暴雨过程主要受到副高和台风的影响。8月份台风引起的暴雨天气过程频数明显增多。秋季的暴雨主要是秋台风导致。
下种按要求的穴距顺向摆放在沟中央,使有芽的一头朝同一方向。用茎段做种的,最好在3月1日开始用双膜先育苗,待有芽后播种,这样既可看清发芽位置又能适期播种。播种后覆土成垄,为了方便以后施肥浇水在垄顶开一条浅沟。

2 EVs组成、生物学功能与癌症的关系
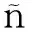
EVs富含多种生物活性物质,主要由蛋白质、核苷酸(DNA、mRNA、miRNA、lncRNA、circRNA等)和脂质(胆固醇、磷脂、磷脂酰乙醇胺等)组成。EVs表面有脂质双分子层包裹,使其能保护内容物免受体液中存在降解酶的影响
。
3 EVs的分离纯化技术与鉴定
随着市场经济的发展,评估行业已经成为一个十分重要的中介服务行业。为规范评估从业行为,遵循权利与义务对等的原则,本条明确规定了评估专业人员的法定义务,从而督促评估专业人员诚实守信、勤勉尽责,依法独立、客观、公正从事业务。

4 EVs的鉴定
超速离心法是目前最常用的EVs分离纯化方法,将体液中的EVs通过上述技术分离纯化后,分离得到的囊泡需要进行鉴定,通过电子显微镜检测,可以观察到其大小及形态特征,从而判定分离获得的囊泡是EVs。其中,扫描电子显微镜(scanning electron microscopy,SEM)
可以观察到EVs三维表面图像,常呈蝶形或茶托状形态。透射电子显微镜(transmission electron microscopy,TEM)
是使用最广泛的纳米显微成像技术,与扫描电镜相比,透射电镜具有更高的分辨率,最高可达到1 nm,能更清楚地观察到囊泡。冷冻显微镜(cryo-electron microscopy)
可以直接检测分析冰冻囊泡样本,与扫描及透射电镜相比,无需对囊泡样本进行固定、染色等前处理,在冰冻条件下对囊泡进行分析,避免了水或溶剂结晶对样本结果的破坏及囊泡样本干燥引起的结构变化。原子力显微镜(atomic force microscopy,AFM)
具有纳米级的横向和垂直分辨率,可以在水溶液中直接进行测量,产生三维图像。经电镜检测,证实离心后的囊泡颗粒为EVs,再进行纳米颗粒追踪分析(nanoparticle tracking analysis,NTA)
,测定囊泡样本中颗粒的粒径分布及浓度。如需检测EVs中蛋白质及其功能,可利用外泌体的蛋白标志物行免疫印迹法(Western blotting,WB)
、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)
、质谱分析
等。如需检测EVs中的RNA、miRNA、circRNA等核酸及其功能,可行高通量测序技术
、滴滴数字PCR(droplet digital PCR,ddPCR)
、qRT-PCR
、传统的流式细胞术(flow cytometry)
以及小颗粒流式细胞仪术(small particle flow cytometry)
等鉴定技术,其中,qRT-PCR技术多应用于临床(见表3)。

5 EVs在肝癌中的诊断价值
肝癌患者EVs内外泌体中lncRNA也大量富集,并与miRNA一同调节肝癌发生和发展,在HCC的诊断、预后、复发中具有重要意义。有研究收集60例HCC患者的血清,并与42例慢性丙型肝炎患者和18名健康受试者进行对照比较,发现HCC患者血清EVs中的lncRNA-RP11-513I15.6、miR-1262和mRNA-RAB11A三种RNA在HCC患者高表达,可区分HCC患者与慢性丙型肝炎患者和健康受试者,其中lncRNA-RP11-513I15.6、miR-1262可以靶向mRNA-RAB11A作用于HCC细胞
。杭州市第一人民医院徐红教授共招募301例受试者,包括HCC组(60例)、肝硬化组(85例)、慢性乙型肝炎组(96例)和健康受试者(60名)。收集了其中55例HCC患者、60例慢性乙型肝炎患者和60名健康受试者的血清作为独立队列,运用外泌体分离试剂盒分离血清外泌体和总RNA。采用TaqMan PCR检测lncRNA的相对水平,结果显示,HCC组的lncRNA-ENSG00000258332.1和lncRNA-LINC00635水平显著高于其他组。肝癌中较高的ENSG00000258332.1水平与门静脉肿瘤栓塞、淋巴结转移、TNM分期和总生存期均有关,提示血清EVs lncRNA-ENSG00000258332.1、lncRNA-LINC00635和AFP联合检测对HCC的诊断和预后具有重要价值,可作为其诊断标志物
。Lee等
一项研究纳入了79例HCC患者,使用ExoQuick外泌体提取试剂盒沉淀溶液从血清样本中提取外泌体。为了验证从血清中分离外泌体,进行了外泌体标记的免疫印迹和纳米颗粒的表征。循环外泌体miR-21和lncRNA-ATB均与TNM分期及T分期、门静脉血栓形成等其他预后因素有关。采用Cox回归检验的多因素分析发现,较高的miR-21和较高的lncRNA-ATB均是死亡率和疾病进展的独立预测因子,同时具有较大的肿瘤。当外泌体miR-21和lncRNA-ATB循环水平较高时,患者的总生存期和无进展生存期显著降低。因此,可以认为循环血液中外泌体miR-21和lncRNA-ATB是HCC新的预后标志物和治疗靶点。
随着RNA-seq技术的发展,鉴定出数以万计的EVs内外泌体含有circRNAs,这是一类非编码RNA,它们可以与miRNA和转录因子相互作用,调节基因表达。EVs中的circRNAs参与癌症的多种生物学功能,发挥重要的调控作用,在HCC疾病的发生和发展中同样具有重要意义。Huang等
研究发现,circRNA-100338在转移HCC细胞及其分泌的外泌体中均高表达。Transwell侵袭实验表明,外泌体circRNA-100338的过表达或下调可显著增强或降低HCC细胞的侵袭能力。随后,体外和体内实验表明,外泌体circRNA-100338影响HUVECs的增殖、血管生成、通透性和血管管腔形成能力,并影响肿瘤转移。接受根治性肝切除术的HCC患者血清中外泌体中circRNA-100338的持续高表达可能是肺转移和生存不良的危险指标。Wang等
发现,EVs circPTGR1亚型可以通过miR-449a-MET途径促进HCC转移。实验首先对来自非转移性HepG2、低转移性和高转移性细胞的外囊泡circRNA并行生物信息学、共表达分析和荧光素酶分析等功能检测,发现circPTGR1在HCC患者的EVs中上调,并影响预后。circPTGR1与MET竞争靶向miR-449a,敲低circPTGR1表达可抑制与HCC细胞的迁移和侵袭。较高的转移性HCC细胞可以通过携带circPTGR1的EVs赋予低转移性或无转移性的细胞这种潜能,从而增加这些细胞的迁移和侵袭能力。Zhang等
发现,脂肪分泌的circRNA可调节HCC的去泛素化,从而促进细胞生长。观察到EVs中circRNA去泛素化(circ-DB)在具有较高体脂比的肝癌患者中被上调。EVs-circ-DB通过抑制miR-34a和激活与去泛素化相关的USP7来促进HCC生长并减少DNA损伤。因此,脂肪EVs对HCC细胞的作用可以通过敲除circ-DB来逆转。通过抑制miR-34a和激活USP7/Cyclin A2信号通路,脂肪细胞分泌的EVs circRNA具有促进HCC肿瘤生长作用,并减少HCC细胞中DNA的损伤。circRNA_100284可被包含在由诱导细胞释放的EVs中,通过与miR-217相互作用来调节并影响正常HCC增殖,促进恶性转化
。EVs表面整合素种类决定转移靶器官的特异性。
原发性肝癌在我国常见恶性肿瘤中排第4位,在全世界排第5位,在肿瘤致死病因中我国排第2位,全世界排第2位
。肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌中主要的类型,占85%~90%,其主要的治疗手段是肝切除术。因缺乏早期典型的临床表现,很多HCC患者在确诊时已丧失根治性切除机会。甲胎蛋白(alpha fetoprotein,AFP)作为HCC的血清标志物是临床诊断HCC的重要方法,但其灵敏度相对较低,部分早期HCC患者无法通过AFP进行诊断
。介入栓塞、靶向治疗以及化疗等只能有限延长晚期HCC患者的生存期。早期诊断(肿瘤大小≤2 cm)的患者,经有效治疗后5年生存率超过70%,对于HCC患者,挖掘潜在的生物标志物一直是HCC诊疗领域的一个重要议题。目前亟需可靠的血清生物标志物来检测早期HCC,以改善HCC患者的预后。近年来,液体活组织检查已成为一种有前景的癌症生物学技术,使用液体活检肿瘤来源的循环基因分子可以通过最小创伤来达到活检诊断的目的,EVs是液体活检中最重要的组成部分之一,外泌体在EVs中占主导地位
。
此外,肝癌EVs外泌体中的膜蛋白也可联合miRNA调控肝癌的发生和发展,Gai等
发现,高尔基体膜蛋白1(Golgi membrane protein 1,GOLM1/GP73)是HCC的血清标志物。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通过刺激GOLM1的表达从而促进肝癌的发生。mTOR是miR-145负调控因子,miR-145通过靶向GOLM1基因的编码序列抑制GOLM1的表达。GOLM1与miR-145在人肝癌组织中呈负相关。富含GOLM1的EVs激活受体细胞的糖原合酶激酶-3β/基质金属蛋白酶(glycogen synthase kinase-3β/matrix metalloproteinase,GSK-3β/MMPs)信号轴,加速细胞增殖和迁移。相反,miR-145抑制肿瘤发生和转移。所以,mTOR/miR-145/GOLM1信号通路应该是HCC治疗的靶向信号通路。Li等
研究发现,赖氨酰氧化酶样蛋白4(lysyl oxidase like protein 4,LOXL4)在肝癌组织中普遍上调,与肝癌分化、血管浸润和肿瘤结节转移有关,LOXL4的过表达促进了体外HCC细胞的迁移和侵袭,提示预后不良。肝细胞来源的外泌体在肝细胞内转运LOXL4,并通过过氧化氢介导的机制激活依赖于胺氧化酶活性的FAK/Src通路,通过旁分泌机制将LOXL4转移到HUVECs,促进肝肿瘤血管生成。另一研究显示,HCC细胞可释放包含SMAD家族成员-3(SMAD3)蛋白和mRNA的EVs,并被转运到分离的HCC细胞,促进癌细胞增殖和肺转移瘤的形成。此外,研究还发现,HCC患者外周血EVs中存在丰富的SMAD3,其水平与疾病分期及原发肿瘤的SMAD3表达有关
,为HCC诊断以及转移检测血清标志物的研究提供了证据(见表4)。综上所述,EVs有可能成为诊断早期HCC及评价预后的生物学标志物,外泌体在其中发挥重要作用。
HCC患者EVs内外泌体中的miRNA水平与HCC的诊断和预后有关。Cho等
对28名健康人、60例慢性肝病患者和90例HCC患者的血清样本进行qRT-PCR分析验证癌细胞源性EVs中miRNA,发现miR-10b-5p和miR-215-5p过表达,与HCC患者的无病生存期有显著关系,是评估HCC预后的生物学标志物。Zhou等
发现,EVs中miR-21的富集与HCC患者的癌症相关纤维细胞活化程度和血管生成能力增高有关。HCC细胞具有将正常肝星状细胞转换为癌症相关成纤维细胞的强大能力。数据显示,HCC细胞分泌直接靶向PTEN的外泌体miR-21,从而导致肝星状细胞中PDK1/AKT信号通路被激活。活化的癌症相关成纤维细胞通过分泌血管生成细胞因子(包括VEGF、MMP2、MMP9、bFGF和TGF-β)进一步促进了癌症的发展。Huang等
收集了广州南方医院40例HCC患者血清,其中20例伴有肺转移,超速离心得到外泌体,通过高通量测序、PCR等研究方式,发现miR-18a、miR-27a、miR-20b、miR-221在HCC肺转移中高表达,可作为评估HCC预后的临床工具。一项肝癌和肝硬化患者血清中外泌体miRNA的研究发现,miR-122、miR-148a和miR-1246的血清外泌体水平在肝癌组明显高于肝硬化组和正常对照组,但与慢性肝炎组比较,差异无统计学意义,与AFP联合可以提高诊断准确性,可以用于早期HCC和肝硬化的鉴别
。另一项研究表明,经动脉化疗栓塞术治疗的HCC患者,外泌体血清中miR-122含量比治疗前降低,提示miR-122的升高与HCC有关
。Matsuura等
将来自人HCC细胞系的EVs在缺氧或常氧条件下培养24 h,使用ExoQuick-TC分离,并与人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)共同培养以评估血管生成活性。实验结果显示,低氧下的EVs显著增强了HUVECs的成管能力。细胞和EVs中miR-155在缺氧条件下均显著上调。敲低HCC细胞中miR-155抑制了内皮细胞在低氧条件下EVs对成管能力的促进作用,而HCC血浆中EVs miR-155的高表达与早期复发显著相关,这些均提示HCC EVs外miR-155可能影响HCC细胞的血管生成活性,并与肝癌的复发有关。Nakano等
在大鼠HCC实验中通过微阵列分析显示,miR-92b是HCC EVs中高度表达的微核糖核酸之一。miR-92b的过表达通过EVs miR-92b的活性释放增强了HCC细胞系的迁移能力。肝癌衍生的EVs miR-92b转移到NK细胞中,导致CD69和NK细胞介导的细胞毒性下调。此外,在HCC患者行肝移植前血清EVs中miR-92b高表达,在肝移植术后HCC复发患者中,miR-92b的表达水平维持在较高水平。这些均提示EVs中的miR-92b可以预测移植后HCC复发的风险。
现假设函数ψ(t),满足平方可积的条件,同时ψ(t)∈L2(R),对ψ(t)进行傅里叶变换获取傅里叶变换结果φ(ω),若φ(ω)满足如下所示的允许性条件:
考虑到EVs在疾病病理生理过程中的关键信使作用,新的EVs分离方法和分析平台正在积极开发,以解决EVs在疾病进展中的作用。基于EVs的密度、亲和力和大小,已经开发了各种分离EVs的技术。差速超速离心法(differential ultracentrifugation,DU)是最经典的、也是人们常用的EVs分离方法,被视为EVs提取的“金标准”。该方法最常见的实施方式是差速离心,先低速离心去除细胞及碎片,再通过超速离心使EVs形成沉淀,得到纯度更高的EVs。DU的缺点是需要配备高速离心机,操作复杂、耗时2~18 h,反复的高速离心会压迫EVs甚至致其损坏破裂,造成EVs损失和质量降低。该方法难以处理大批量样本或应用到临床检测中
。聚合沉淀法(polymer precipitation,PP)主要以商业化ExoQuick沉淀试剂盒和Total Exosome分离试剂盒为代表
,优点是得到的EVs量多,操作简单,所需要的标本量小,不需要超速离心机,可以应用于临床,缺点是EVs纯度不及DU
。尺寸排阻色谱法(size-exclusion chromatography,SEC)
获得的微粒比DU少,但纯度较高。其他方法还有切向流超滤法(tangential flow ultrafiltration,TFU)
、免疫亲和捕获法(immunoaffinity capture,ICP)
、微流控(microfluidics)芯片分离法
等,总结如表2所示。
6 EVs在胰腺癌中的诊断价值
胰腺癌是一种高度致命的癌症,在我国肿瘤的致死率排名第4位,由于缺乏典型的临床症状和解剖位置,癌胚抗原CEA、血清CA19-9缺乏特异性
,诊断十分困难,确诊已经是晚期,化疗及放疗治疗肿瘤易出现耐药,早期出现播散,这些均是导致高死亡率的因素
。因此,发现生物标志物对早期胰腺癌的检测及预后具有重要意义。有研究提示,EVs在胰腺癌中富集,容易在患者的体液中检测到,它们中的蛋白质和RNA在正常人、炎症性疾病、良性胰腺肿瘤和恶性胰腺癌中存在差异,可用于疾病的诊断。胰腺癌患者EVs中外泌体占主导地位,外泌体miRNA水平与其临床病理特征及预后有联系
。
胰腺癌患者血清EVs中外泌体miR-17-5p水平高于非胰腺癌患者和健康参与者。高表达的miR-17-5p提示胰腺癌患者出现晚期肿瘤转移
。Goto等
发现了EVs外泌体中miR-191、miR-21、miR-451a在胰腺癌患者和胰腺导管内乳头状黏液性瘤(intraductal papillary mucinous neoplasm,IPMN)患者中的表达显著高于对照组。这三种EVs miRNA的水平可作为胰腺癌和IPMN患者的早期诊断和进展标志物,效果优于循环miRNA。Kawamura等
的研究中,来自胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)门静脉血中miR-4525、miR-451a和miR-21显著上调,可能是胰腺癌患者复发和生存期较差生物标志物。Pu等
收集了36例胰腺癌患者和65名健康对照者血浆中EVs,通过阳离子脂质体纳米颗粒生物芯片分析外泌体中miR-21的表达水平,发现胰腺癌患者中的ex-miR-21表达水平明显高于对照组,ex-miR-21能够区分早期胰腺癌患者和健康对照者,可以作为早期诊断胰腺癌的生物学标志物。Nakamura等
通过内镜逆行胰管造影术收集了27例胰腺癌患者和8例慢性胰腺炎患者的胰液,通过超速离心法提取外泌体,定量比较了两组患者中EVs miR-21和miR-155的相对水平。实验结果提示,与胰腺炎患者相比,胰腺癌患者EVs miR-21和miR-155的相对水平显著更高。
胰腺癌患者EVs外泌体中蛋白表达水平也与胰腺癌有联系,Armacki等
通过小鼠动物实验发现,蛋白激酶D1(protein kinase D1,PRKD1)抑制PDAC细胞运动,且表达失调。他们分析了来自人类胰腺组织芯片的数据,与非肿瘤胰腺组织相比,人PDAC的PRKD1水平降低。PRKD1的缺失导致胰腺癌细胞系中皮层蛋白的磷酸化减少,质膜上f-肌动蛋白增加和EVs释放增加,这些释放的EVs促进了小鼠移植瘤和胰腺肿瘤向肺的转移。Shin等
研究发现,胰腺癌细胞膜EVs分泌物中存在碱性磷酸酶胎盘样2(alkaline phosphatase placental like 2,ALPPL2)蛋白,这种与生殖细胞相关的碱性磷酸酶家族蛋白可通过GPI锚定蛋白存在于细胞膜上,经常见于生殖细胞癌症患者和怀孕女性的血清中。许多GPI锚定蛋白作为外泌体和MVs的一部分,以膜结合的形式从细胞中释放出来,胰腺癌患者比健康者释放增多,提示ALPPL2可作为胰腺癌的诊断标志物
。Kimura等
发现,其在PDAC EVs外泌体中细胞骨架相关蛋白4(cytoskeleton associated protein 4,CKAP4)升高,可能是PDAC早期诊断的潜在生物标志物。CKAP4是一种新发现的Dickkopf1(DKK1)受体。PDAC细胞来源的EVs可通过DKK1依赖性内吞途径调节CKAP4分泌。PDAC患者血清中EVs CKAP4水平显著高于健康对照组,术后患者血清中也基本检测不到。ZIP4是一种在多种癌症中存在差异表达的蛋白,并与包括胰腺癌在内的癌症进展密切相关。通过来自胰腺癌患者、良性胰腺疾病患者、胆道疾病患者和健康受试者的临床血液样本蛋白组学分析,胰腺癌患者中的EVs外泌体ZIP4表达最高,能显著促进胰腺癌的生长,提示EVs中的ZIP4可作为一种新的胰腺癌诊断生物标志物
。一项前瞻性研究提示,Glypican 1蛋白(Glypican 1 protein,GPC1)在未行手术治疗的PDAC患者血清中EVs中表达阳性,与无癌症史对照患者进行比较,胰腺癌组GPC1阳性率明显高于对照组
。Jiang等
发现,在放疗后的胰腺癌患者残留的肿瘤EVs通过传递miR-194-5p,诱导细胞G
/S期阻滞,并促进DNA损伤反应,释放大量的PGE2,促进残留的肿瘤细胞增殖,并协调再种群级联,调控E2F3的表达,减轻放疗对癌细胞HMGA2的侵害作用。在放疗后复发的患者中,癌细胞EVs中的miR-194-5p、PGE2和HMGA2与正常组织相比,明显升高。以上研究发现,EVs外泌体有望成为胰腺癌早期诊断和预后生物标志物(见表5)。
改革开放以来,中国高等教育发展取得了巨大成就,已经建成世界规模最大的高等教育体系,并拥有一批高水平的大学,奠定了高教强国“中国模式”的客观基础,但是,高教强国“中国模式”要得到世界范围的认同并对世界高等教育发展产生重要影响,还面临许多现实的困境。
7 总结和展望
以上研究表明,EVs中的外泌体作为肝癌和胰腺癌早期诊断及预后的生物学标志物有关键性的作用,并具有以下优势:(1)EVs粒径较小,通透性强,容易到达肝癌和胰腺癌患者体液中,浓度较高,易于检出,取样创伤性小,可对肿瘤患者实施全程实时监控;(2)EVs能够直接反映肿瘤来源组织细胞的代谢状态和生物学特性,能够携带肿瘤来源组织细胞内特定核酸、蛋白质、脂类物质,特异性极强;(3)EVs的脂质双分子层结构可保护其中携带的DNA、RNA和蛋白质分子免受降解。血浆EVs中miRNA在不同的储存条件下具有较好的稳定性,4 ℃下保存96 h或-80 ℃长时间保存的情况下,其RNA丰度未发生明显变化
,稳定性强,适合作为分子标志物应用于临床;(4)许多肝癌和胰腺癌患者体液蛋白质和核酸已经被证实为前瞻性的诊断生物标志物,通过EVs富集可提高检测效能;(5)EVs是大分子信息物质的载体,在机体细胞信息交流、信号转导过程中发挥着重要的生理作用;(6)EVs还含有丰富的内容物,包含丰富的核酸分子、无创性及检测迅速等优势,使EVs有望成为应用前景广阔的新型循环生物标志物,用于临床疾病的辅助诊断。
随着EVs检测技术的不断完善,EVs内容物及功能的研究越发成熟,疾病相关EVs生物标志物被大量发现,但至今尚无EVs分子标志物进入广泛临床应用阶段。EVs标志物的临床应用仍有很多问题需要解决:(1)尽管近年来EVs纯化方法快速发展,但针对临床标本,目前只局限于应用外泌体提取试剂盒和qRT-PCR方法提取和鉴定外泌体,仍无快速、简便、稳定、高回收率、可操作性强的EVs纯化方法,这严重制约了EVs的临床应用;(2)目前尚未制定统一的EVs标本保存、纯化及后续鉴定方法、详细的操作规范和标准的质量控制方法;(3)由于几乎体内所有细胞均可以分泌EVs,筛选组织特异性的EVs标志物或分离鉴定病变组织特异性来源的EVs具有重要意义,但此方面标志物研究仍较为欠缺。(4)EVs分子的细胞内分选机制仍未完全阐明。EVs标志物研究方兴未艾,大量问题仍有待探索。相信随着EVs基础研究和纯化检测技术的发展,EVs将会更广泛应用于临床诊疗,在不久的将来,EVs将会替代传统的肿瘤标志物,将疾病诊断水平提升到一个新境界。
[1]Cocozza F, Grisard E, Martin-Jaular L, et al. SnapShot: extracellular vesicles [J]. Cell, 2020, 182(1): 262-262.e1. DOI: 10.1016/j.cell.2020.04.054.
[2]杨启, 吕新远, 万春. 原发性肝癌的超声特征及联合AFP、CEA的诊断价值[J]. 中国现代普通外科进展, 2021, 24(1): 61-63. DOI: 10.3969/j.issn.1009-9905.2021.01.015.
[3]van Manen L, Groen JV, Putter H, et al. Elevated CEA and CA19-9 serum levels independently predict advanced pancreatic cancer at diagnosis [J]. Biomarkers, 2020, 25(2): 186-193. DOI: 10.1080/1354750X.2020.1725786.
[4]Maacha S, Bhat AA, Jimenez L, et al. Extracellular vesicles-mediated intercellular communication: roles in the tumor microenvironment and anti-cancer drug resistance [J]. Mol Cancer, 2019, 18(1): 55. DOI: 10.1186/s12943-019-0965-7.
[5]Pegtel DM, Gould SJ. Exosomes [J]. Annu Rev Biochem, 2019, 88: 487-514. DOI: 10.1146/annurev-biochem-013118-111902.
[6]Jeppesen DK, Fenix AM, Franklin JL, et al. Reassessment of exosome composition [J]. Cell, 2019, 177(2): 428-445.e18. DOI: 10.1016/j.cell.2019.02.029.
[7]O′Brien K, Breyne K, Ughetto S, et al. RNA delivery by extracellular vesicles in mammalian cells and its applications [J]. Nat Rev Mol Cell Biol, 2020, 21(10): 585-606. DOI: 10.1038/s41580-020-0251-y.
[8]Mashouri L, Yousefi H, Aref AR, et al. Exosomes: composition, biogenesis, and mechanisms in cancer metastasis and drug resistance [J]. Mol Cancer, 2019, 18(1): 75. DOI: 10.1186/s12943-019-0991-5.
[9]Kalluri R, LeBleu VS. The biology, function, and biomedical applications of exosomes [J]. Science, 2020, 367(6478): eaau6977. DOI: 10.1126/science.aau6977.
[10]Xu R, Rai A, Chen M, et al. Extracellular vesicles in cancer-implications for future improvements in cancer care [J]. Nat Rev Clin Oncol, 2018, 15(10): 617-638. DOI: 10.1038/s41571-018-0036-9.
[11]Gill S, Catchpole R, Forterre P. Extracellular membrane vesicles in the three domains of life and beyond [J]. FEMS Microbiol Rev, 2019, 43(3): 273-303. DOI: 10.1093/femsre/fuy042.
[12]Ji Q, Zhou L, Sui H, et al. Primary tumors release ITGBL1-rich extracellular vesicles to promote distal metastatic tumor growth through fibroblast-niche formation [J]. Nat Commun, 2020, 11(1): 1211. DOI: 10.1038/s41467-020-14869-x.

[14]Keklikoglou I, Cianciaruso C, GüçE, et al. Chemotherapy elicits pro-metastatic extracellular vesicles in breast cancer models [J]. Nat Cell Biol, 2019, 21(2): 190-202. DOI: 10.1038/s41556-018-0256-3.
[15]Théry C, Gho YS, Quesenberry P. Journal of extracellular vesicles: the seven year itch! [J]. J Extracell Vesicles, 2019, 8(1): 1654729. DOI: 10.1080/20013078.2019.1654729.
[16]Gemoll T, Rozanova S, Röder C, et al. Protein profiling of serum extracellular vesicles reveals qualitative and quantitative differences after differential ultracentrifugation and ExoQuickTM isolation [J]. J Clin Med, 2020, 9(5): 1429. DOI: 10.3390/jcm9051429.
[17]Tian Y, Gong M, Hu Y, et al. Quality and efficiency assessment of six extracellular vesicle isolation methods by nano-flow cytometry [J]. J Extracell Vesicles, 2020, 9(1): 1697028. DOI: 10.1080/20013078.2019.1697028.
[18]Monguió-Tortajada M, Gálvez-Montón C, Bayes-Genis A, et al. Extracellular vesicle isolation methods: rising impact of size-exclusion chromatography [J]. Cell Mol Life Sci, 2019, 76(12): 2369-2382. DOI: 10.1007/s00018-019-03071-y.
[19]Royo F, Théry C, Falcón-Pérez JM, et al. Methods for separation and characterization of extracellular vesicles: results of a worldwide survey performed by the ISEV rigor and standardization subcommittee [J]. Cells, 2020, 9(9): 1955. DOI: 10.3390/cells9091955.
[20]Gurunathan S, Kang MH, Jeyaraj M, et al. Review of the isolation, characterization, biological function, and multifarious therapeutic approaches of exosomes [J]. Cells, 2019, 8(4): 307. DOI: 10.3390/cells8040307.
[21]Sundaram PM, Casadei L, Lopez G, et al. Multi-layer micro-nanofluidic device for isolation and capture of extracellular vesicles derived from liposarcoma cell conditioned media [J]. J Microelectromech Syst, 2020, 29(5): 776-782. DOI: 10.1109/jmems.2020.3006786.
[22]Riordon J, Sovilj D, Sanner S, et al. Deep learning with microfluidics for biotechnology [J]. Trends Biotechnol, 2019, 37(3): 310-324. DOI: 10.1016/j.tibtech.2018.08.005.
[23]Mary B, Jayandharan GR. Visualization of retinal morphology in rd12 mice by scanning electron microscopy [J]. Hum Gene Ther, 2019, 30(8): 921-922. DOI: 10.1089/hum.2019.116.
[24]Schorb M, Haberbosch I, Hagen WJH, et al. Software tools for automated transmission electron microscopy [J]. Nat Methods, 2019, 16(6): 471-477. DOI: 10.1038/s41592-019-0396-9.
[25]Luque D, Castón JR. Cryo-electron microscopy for the study of virus assembly [J]. Nat Chem Biol, 2020, 16(3): 231-239. DOI: 10.1038/s41589-020-0477-1.
[26]Skliar M, Chernyshev VS. Imaging of extracellular vesicles by atomic force microscopy [J]. J Vis Exp, 2019, (151). DOI: 10.3791/59254.
[27]Fafián-Labora J, Morente-López M, Sánchez-Dopico MJ, et al. Influence of mesenchymal stem cell-derived extracellular vesicles in vitro and their role in ageing [J]. Stem Cell Res Ther, 2020, 11(1): 13. DOI: 10.1186/s13287-019-1534-0.
[28]Zhang Y, Naguro I, Herr AE. In situ single-cell western blot on adherent cell culture [J]. Angew Chem Int Ed Engl, 2019, 58(39): 13929-13934. DOI: 10.1002/anie.201906920.
[30]Sansa M, Defoort M, Brenac A, et al. Optomechanical mass spectrometry [J]. Nat Commun, 2020, 11(1): 3781. DOI: 10.1038/s41467-020-17592-9.
[31]Wang D, Hao C, Zhang L, et al. Exosomal miR-125a-5p derived from silica-exposed macrophages induces fibroblast transdifferentiation [J]. Ecotoxicol Environ Saf, 2020, 192: 110253. DOI: 10.1016/j.ecoenv.2020.110253.
[32]Yan D, Pomicter AD, O′Hare T, et al. ddeeper than deep: can ddPCR predict successful imatinib cessation? [J]. Clin Cancer Res, 2019, 25(22): 6561-6563. DOI: 10.1158/1078-0432.CCR-19-2270.
[33]Han M, Gu Y, Lu P, et al. Exosome-mediated lncRNA AFAP1-AS1 promotes trastuzumab resistance through binding with AUF1 and activating ERBB2 translation [J]. Mol Cancer, 2020, 19(1): 26. DOI: 10.1186/s12943-020-1145-5.
[34]Delmonte OM, Fleisher TA. Flow cytometry: surface markers and beyond [J]. J Allergy Clin Immunol, 2019, 143(2): 528-537. DOI: 10.1016/j.jaci.2018.08.011.
[35]Görgens A, Bremer M, Ferrer-Tur R, et al. Optimisation of imaging flow cytometry for the analysis of single extracellular vesicles by using fluorescence-tagged vesicles as biological reference material [J]. J Extracell Vesicles, 2019, 8(1): 1587567. DOI: 10.1080/20013078.2019.1587567.
[36]Nguyen MA, Karunakaran D, Geoffrion M, et al. Extracellular vesicles secreted by atherogenic macrophages transfer microRNA to inhibit cell migration [J]. Arterioscler Thromb Vasc Biol, 2018, 38(1): 49-63. DOI: 10.1161/ATVBAHA.117.309795.
[37]Wei W, Zeng H, Zheng R, et al. Cancer registration in China and its role in cancer prevention and control [J]. Lancet Oncol, 2020, 21(7): e342-e349. DOI: 10.1016/S1470-2045(20)30073-5.
[38]Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020 [J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI: 10.3322/caac.21590.
[39]Pantel K, Alix-Panabières C. Liquid biopsy and minimal residual disease-latest advances and implications for cure [J]. Nat Rev Clin Oncol, 2019, 16(7): 409-424. DOI: 10.1038/s41571-019-0187-3.
[40]Cho HJ, Eun JW, Baek GO, et al. Serum exosomal microRNA, miR-10b-5p, as a potential diagnostic biomarker for early-stage HCC [J]. J Clin Med, 2020, 9(1): 281. DOI: 10.3390/jcm9010281.
[41]Zhou Y, Ren H, Dai B, et al. HCC-derived exosomal miRNA-21 contributes to tumor progression by converting hepatocyte stellate cells to cancer-associated fibroblasts [J]. J Exp Clin Cancer Res, 2018, 37(1): 324. DOI: 10.1186/s13046-018-0965-2.
[42]Huang C, Tang S, Shen D, et al. Circulating plasma exosomal miRNA profiles serve as potential metastasis-related biomarkers for HCC [J]. Oncol Lett, 2021, 21(2): 168. DOI: 10.3892/ol.2021.12429.
[43]Wang Y, Zhang C, Zhang P, et al. Serum exosomal microRNAs combined with alpha-fetoprotein as diagnostic markers of HCC [J]. Cancer Med, 2018, 7(5): 1670-1679. DOI: 10.1002/cam4.1390.
[44]Suehiro T, Miyaaki H, Kanda Y, et al. Serum exosomal microRNA-122 and microRNA-21 as predictive biomarkers in transarterial chemoembolization-treated hepatocellular carcinoma patients [J]. Oncol Lett, 2018, 16(3): 3267-3273. DOI: 10.3892/ol.2018.8991.
[45]Matsuura Y, Wada H, Eguchi H, et al. Exosomal miR-155 derived from hepatocellular carcinoma cells under hypoxia promotes angiogenesis in endothelial cells [J]. Dig Dis Sci, 2019, 64(3): 792-802. DOI: 10.1007/s10620-018-5380-1.
[46]Nakano T, Chen IH, Wang CC, et al. Circulating exosomal miR-92b: its role for cancer immunoediting and clinical value for prediction of posttransplant hepatocellular carcinoma recurrence [J]. Am J Transplant, 2019, 19(12): 3250-3262. DOI: 10.1111/ajt.15490.
[47]Abd El Gwad A, Matboli M, El-Tawdi A, et al. Role of exosomal competing endogenous RNA in patients with hepatocellular carcinoma [J]. J Cell Biochem, 2018, 119(10): 8600-8610. DOI: 10.1002/jcb.27109.
[48]Xu H, Chen Y, Dong X, et al. Serum exosomal long noncoding RNAs ENSG00000258332.1 and LINC00635 for the diagnosis and prognosis of hepatocellular carcinoma [J]. Cancer Epidemiol Biomarkers Prev, 2018, 27(6): 710-716. DOI: 10.1158/1055-9965.Epi-17-0770.
[49]Lee YR, Kim G, Tak WY, et al. Circulating exosomal noncoding RNAs as prognostic biomarkers in human hepatocellular carcinoma [J]. Int J Cancer, 2019, 144(6): 1444-1452. DOI: 10.1002/ijc.31931.
[50]Huang XY, Huang ZL, Huang J, et al. Exosomal circRNA-100338 promotes hepatocellular carcinoma metastasis via enhancing invasiveness and angiogenesis [J]. J Exp Clin Cancer Res, 2020, 39(1): 20. DOI: 10.1186/s13046-020-1529-9.
[51]Wang G, Liu W, Zou Y, et al. Three isoforms of exosomal circPTGR1 promote hepatocellular carcinoma metastasis via the miR449a-MET pathway [J]. EBioMedicine, 2019, 40: 432-445. DOI: 10.1016/j.ebiom.2018.12.062.
[52]Zhang H, Deng T, Ge S, et al. Exosome circRNA secreted from adipocytes promotes the growth of hepatocellular carcinoma by targeting deubiquitination-related USP7 [J]. Oncogene, 2019, 38(15): 2844-2859. DOI: 10.1038/s41388-018-0619-z.
[53]Dai X, Chen C, Yang Q, et al. Exosomal circRNA_100284 from arsenite-transformed cells, via microRNA-217 regulation of EZH2, is involved in the malignant transformation of human hepatic cells by accelerating the cell cycle and promoting cell proliferation [J]. Cell Death Dis, 2018, 9(5): 454. DOI: 10.1038/s41419-018-0485-1.
[54]Gai X, Tang B, Liu F, et al. mTOR/miR-145-regulated exosomal GOLM1 promotes hepatocellular carcinoma through augmented GSK-3β/MMPs [J]. J Genet Genomics, 2019, 46(5): 235-245. DOI: 10.1016/j.jgg.2019.03.013.
[55]Li R, Wang Y, Zhang X, et al. Exosome-mediated secretion of LOXL4 promotes hepatocellular carcinoma cell invasion and metastasis [J]. Mol Cancer, 2019, 18(1): 18. DOI: 10.1186/s12943-019-0948-8.
[56]Fu Q, Zhang Q, Lou Y, et al. Correction: primary tumor-derived exosomes facilitate metastasis by regulating adhesion of circulating tumor cells via SMAD3 in liver cancer [J]. Oncogene, 2019, 38(28): 5740-5741. DOI: 10.1038/s41388-019-0830-6.
[57]Fang JH, Zhang ZJ, Shang LR, et al. Hepatoma cell-secreted exosomal microRNA-103 increases vascular permeability and promotes metastasis by targeting junction proteins [J]. Hepatology, 2018, 68(4): 1459-1475. DOI: 10.1002/hep.29920.
[58]Zeng S, Pöttler M, Lan B, et al. Chemoresistance in pancreatic cancer [J]. Int J Mol Sci, 2019, 20(18): 4504. DOI: 10.3390/ijms20184504.
[59]Yee NS, Zhang S, He HZ, et al. Extracellular vesicles as potential biomarkers for early detection and diagnosis of pancreatic cancer [J]. Biomedicines, 2020, 8(12): 581. DOI: 10.3390/biomedicines8120581.
[60]Que R, Ding G, Chen J, et al. Analysis of serum exosomal microRNAs and clinicopathologic features of patients with pancreatic adenocarcinoma [J]. World J Surg Oncol, 2013, 11: 219. DOI: 10.1186/1477-7819-11-219.
[61]Goto T, Fujiya M, Konishi H, et al. An elevated expression of serum exosomal microRNA-191, -21, -451a of pancreatic neoplasm is considered to be efficient diagnostic marker [J]. BMC Cancer, 2018, 18(1): 116. DOI: 10.1186/s12885-018-4006-5.
[62]Kawamura S, Iinuma H, Wada K, et al. Exosome-encapsulated microRNA-4525, microRNA-451a and microRNA-21 in portal vein blood is a high-sensitive liquid biomarker for the selection of high-risk pancreatic ductal adenocarcinoma patients [J]. J Hepatobiliary Pancreat Sci, 2019, 26(2): 63-72. DOI: 10.1002/jhbp.601.
[63]Pu X, Ding G, Wu M, et al. Elevated expression of exosomal microRNA-21 as a potential biomarker for the early diagnosis of pancreatic cancer using a tethered cationic lipoplex nanoparticle biochip [J]. Oncol Lett, 2020, 19(3): 2062-2070. DOI: 10.3892/ol.2020.11302.
[64]Nakamura S, Sadakari Y, Ohtsuka T, et al. Pancreatic juice exosomal microRNAs as biomarkers for detection of pancreatic ductal adenocarcinoma [J]. Ann Surg Oncol, 2019, 26(7): 2104-2111. DOI: 10.1245/s10434-019-07269-z.
[65]Armacki M, Polaschek S, Waldenmaier M, et al. Protein kinase D1, reduced in human pancreatic tumors, increases secretion of small extracellular vesicles from cancer cells that promote metastasis to lung in mice [J]. Gastroenterology, 2020, 159(3): 1019-1035.e1022. DOI: 10.1053/j.gastro.2020.05.052.
[66]Shin HS, Jung SB, Park S, et al. ALPPL2 is a potential diagnostic biomarker for pancreatic cancer-derived extracellular vesicles [J]. Mol Ther Methods Clin Dev, 2019, 15: 204-210. DOI: 10.1016/j.omtm.2019.08.016.
[67]Kimura H, Yamamoto H, Harada T, et al. CKAP4, a DKK1 receptor, is a biomarker in exosomes derived from pancreatic cancer and a molecular target for therapy [J]. Clin Cancer Res, 2019, 25(6): 1936-1947. DOI: 10.1158/1078-0432.CCR-18-2124.
[68]Jin H, Liu P, Wu Y, et al. Exosomal zinc transporter ZIP4 promotes cancer growth and is a novel diagnostic biomarker for pancreatic cancer [J]. Cancer Sci, 2018, 109(9): 2946-2956. DOI: 10.1111/cas.13737.
[69]Buscail E, Chauvet A, Quincy P, et al. CD63-GPC1-positive exosomes coupled with CA19-9 offer good diagnostic potential for resectable pancreatic ductal adenocarcinoma [J]. Transl Oncol, 2019, 12(11): 1395-1403. DOI: 10.1016/j.tranon.2019.07.009.
[70]Jiang MJ, Chen YY, Dai JJ, et al. Dying tumor cell-derived exosomal miR-194-5p potentiates survival and repopulation of tumor repopulating cells upon radiotherapy in pancreatic cancer [J]. Mol Cancer, 2020, 19(1): 68. DOI: 10.1186/s12943-020-01178-6.
[71]Qin B, Zhang Q, Hu XM, et al. How does temperature play a role in the storage of extracellular vesicles? [J]. J Cell Physiol, 2020, 235(11): 7663-7680. DOI: 10.1002/jcp.29700.

