DNA感受器在鱼类先天免疫中的功能
吴初新,徐小文
(1.豫章师范学院 小学教育学院,南昌 330103;2.南昌大学 生命科学学院,南昌 330031)
先天免疫系统是机体抵抗病原微生物入侵的第一道防线。早在20世纪60年代人们就已经发现,核酸在免疫应答中发挥重要的作用,但对核酸如何触发先天免疫应答却知之甚少[1]。随着众多模式识别受体(PRR)逐渐被发现,病毒等微生物的核酸被认为是胞内最主要的病原相关分子模式(PAMP),核酸触发先天免疫应答的机制逐渐被揭示,如Toll样受体(TLRs)中的TLR3、TLR7/8能分别识别dsRNA和ssRNA,RIG-I样受体(RLRs)中的视黄酸诱导基因I (RIG-I)和黑色素瘤分化相关基因5(MDA5)则能够识别胞浆中的病毒dsRNA分子。除了RNA模式识别受体,人们还发现存在诸多DNA识别受体(即DNA感受器),如TLR9、DNA依赖的干扰素调节因子激活物(DAI)、黑色素瘤缺乏因子2(AIM2)、γ干扰素诱导蛋白16(IFI16)、DEAD-box RNA解旋酶41(DDX41)、干扰素刺激基因(STING)、cGAMP合成酶(cGAS)、RNA聚合酶Ⅲ(RNAP Ⅲ)等。病原微生物的DNA可以被宿主细胞或靶细胞内DNA感受器所感知,也可以通过RNAP Ⅲ转录成RNA并被RNA识别受体所侦测,然后经一系列信号转导,最终诱导I型干扰素(IFN)、炎症因子等细胞因子的表达[2-3]。
鱼类具有保守的先天免疫防御机制[4]。近年来,有关鱼类DNA感受器的研究也有了长足的进展,包括TLR9/TLR21、STING、cGAS、DDX41以及鱼类特有的包含Z-DNA结合结构域的蛋白激酶(PKZ)等逐一被发现(图1),它们在启动鱼类先天免疫中的作用机制既有类似于哺乳类的方面,也有其自身独特之处。本文就鱼类DNA感受器的结构、DNA识别机制、激活的信号通路及其诱导产生I型IFN或炎症因子的分子机制等方面进行综述,以期为后续深入研究提供参考。
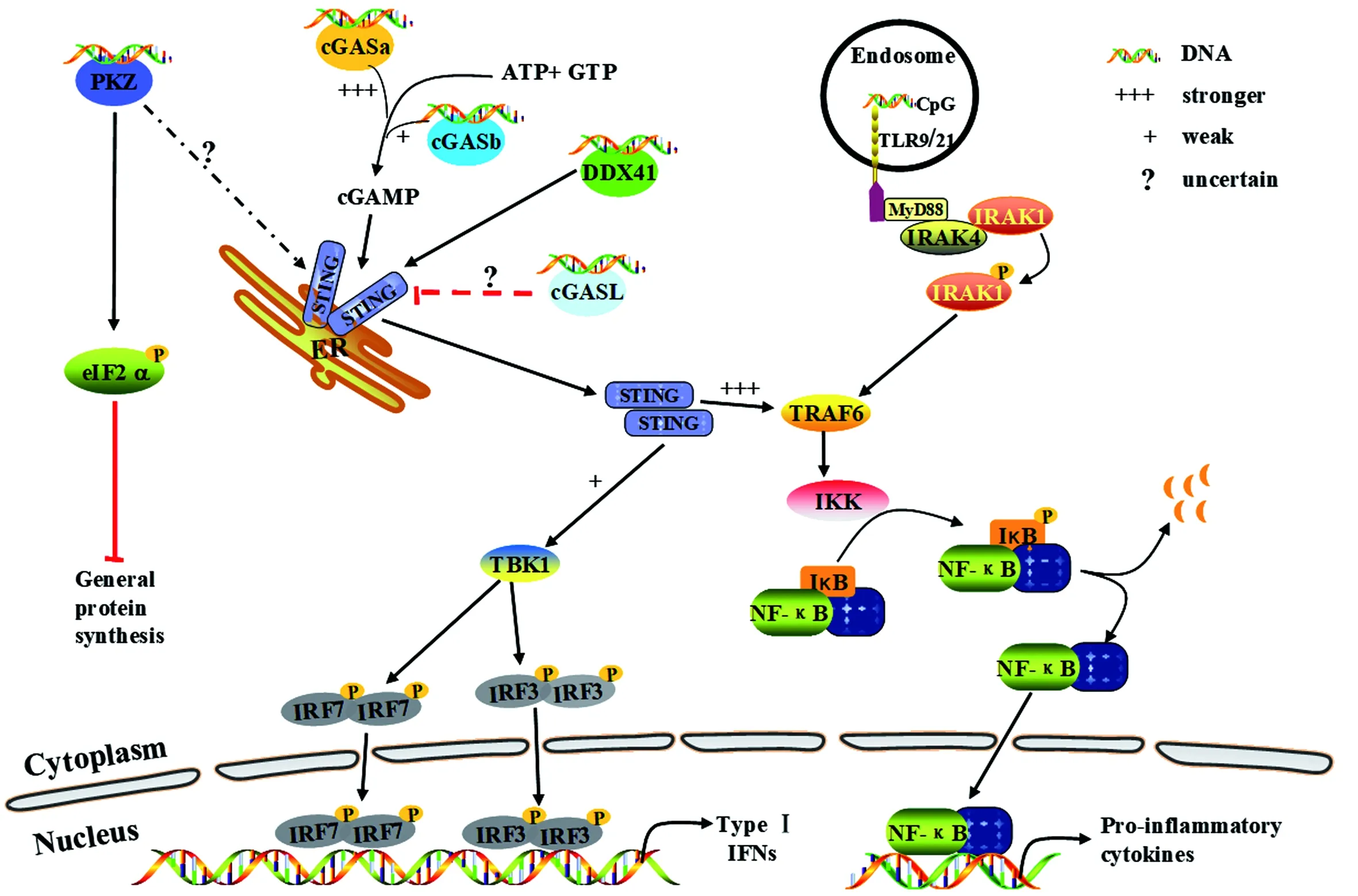
胞内DNA感受器识别DNA后而被激活,然后经一系列信号转导,最终诱导I型IFN、炎症因子等细胞因子的表达。红色箭头表示抑制或负调控作用,虚线和“?”表示不确定,“+++”和“+”分别表示作用的强和弱。图1 鱼类DNA感受器及其参与信号通路Figure 1 DNA sensors and their signaling pathways in fish
1 TLR9/TLR21
1.1 TLR9
TLR9是最早被鉴定的DNA感受器。哺乳类TLR9是一种I型跨膜蛋白,由胞外区(ECD)、跨膜区(TMD)和胞内区(ICD)等3个功能域组成。TLR9胞外区由26个富含亮氨酸的重复序列区(LRRs)组成,形成马鞍状结构,其LRR14与LRR15间含一个重要的Z-loop。LRR结构域能够识别病原体非甲基化CpG序列。TLR9的胞外域只有在发生寡聚化后才能发挥其正常功能。胞内区的TIR结构域则高度保守,存在于所有的TLRs和IL-1受体(IL-1R)中,在信号转导中起着核心作用[3,5]。
TLR9为胞内非甲基化CpG DNA的特异性感受器[6]。TLR9与DNA的直接相互作用需要低pH值条件和蛋白水解切割,这能促使TLR9的构象发生变化、进而二聚化激活。另外,CpG激活TLR9存在序列差异,如激活小鼠免疫细胞的最佳序列为GACGTT,而激活人的最佳序列为GTCGTT[5,7]。静息状态下,TLR9以非活化形式定位于内质网,当存在CpG DNA时,TLR9被运输到内体。非甲基化的CpG经内吞作用进入内体并与TLR9发生作用,从而触发髓样细胞分化因子88(MyD88)依赖的TLR信号,最终导致干扰素调节因子(IRF7)和核转录因子κB(NF-κB)的激活,诱导I型IFN和炎性细胞因子如白细胞介素1β(IL-1β)的表达,从而引起细胞的抗病毒作用或炎症反应[3,8]。
鱼类同样存在TLR9,已在斑马鱼[9]、鲤[10]、虹鳟[11]、大黄鱼[12]、牙鲆[13]和大西洋鲑[14]等硬骨鱼类中克隆和鉴定了TLR9基因。鱼类TLR9基因在不同组织和发育阶段具有广泛的表达,CpG寡核苷酸(CpG-ODNs)刺激后其在皮肤、鳃、头肾和脾脏等的表达上调明显[15]。鱼类与哺乳类的TLR9基因存在着明显差异。哺乳类TLR9基因中,只含有单个内含子,而硬骨鱼TLR9基因的内含子数量从0到4个不等。具有两个内含子的鱼类TLR9基因在其第二个内含子中经历内含子保留型可变剪接,导致除了全长TLR9A外,还有一个C端截短的TLR9B。TLR9B的TIR截短,可能影响TIR-TIR二聚化并抑制下游信号通路[8]。结构上,鱼类TLR9也由胞外区、跨膜区和胞内区组成,其胞外域中亦具有一个Z-loop,但鱼类的要比哺乳类的更长,且其长度在不同鱼类差异很大,这可能与TLR9在不同物种的功能活性存在很大差异有关[15]。
类似于哺乳类,鱼类TLR9在静息状态下主要分布于内质网上,应激后能够从内质网往内体转移[8,16]。鱼类TLR9响应病原体的未甲基化CpG序列,从而激活机体抗菌、抗病毒免疫反应。CpG-ODN的核苷酸长度决定其免疫刺激活性。长度为16~17个核苷酸的 CpG-ODN 免疫刺激作用小于20~22个核苷酸的,短于13个核苷酸的 CpG-ODN 则失去免疫刺激特性,超过30个核苷酸长便很少研究[15]。
同时,鱼类TLR9可能具有保守的识别和结合DNA序列的特性。首先,鱼类TLR9通过一种不依赖CpG但依赖pH的机制与合成寡核苷酸相互作用。其次,TLR9能够广泛识别具有不同CpG基序的CpG-ODNs,特别是具有GACGTT或AACGTT的CpG-ODN。若在鱼体内注射CpG-ODNs,则可在其肾脏和肠道中诱导IL-1、TNFb和IFN-γ等一系列细胞因子,表明CpG-ODNs能激活先天免疫系统。再次,在细胞中过表达TLR9能够激活其IRF3、IRF7信号和上调抗病毒蛋白ISG15和Mx1的表达。这些结果表明,鱼类TLR9也享有类似于哺乳类TLR9的信号通路[17]。当然,这需要更多的研究予以证实。
1.2 TLR21
TLR21是一种广泛存在于鱼类、两栖类和鸟类中的,但至今未在哺乳动物中发现的TLR。目前,已在斑马鱼[16]、鲤[18]、斜带石斑鱼[19]、大菱鲆[20]和大西洋鳕[21]等鱼类中克隆获得了TLR21基因。研究发现,鱼类TLR21基因具有类似于TLR9的表达谱,主要在脾脏等免疫相关组织中高表达[15-16,22]。结构上,鱼类TLR21的胞外域中缺少Z-loop,其LRR14与LRR15间的序列高度保守,暗示TLR21在不同鱼类中的功能相似[15,17]。
类似于TLR9,鱼类TLR21主要分布于内质网中[16],是识别CpG-DNA的另一种受体。与TLR9不同的是,斑马鱼TLR21能够优先识别含有GTCGTT特征基序的CpG-ODN (CpG-2006 和CpG-2007),从而激活下游信号通路,最终诱导IFN-γ、TNF-β和IL-1等的产生。另外,斑马鱼TLR9和TLR21同时被激活比TLR9单独被激活在诱导产生细胞因子方面更有效,且能更好地保护鱼体免受细菌的致命感染,表明TLR9和TLR21协同介导了CpG-ODN对斑马鱼的免疫刺激作用[16]。虽然如此,鱼类TLR21识别不同配体的确切的分子机制及其生理功能还有待进一步探索。
2 STING
STING有4个不同的名称:MPYS[23]、STING[24]、MITA[25]和ERIS[26],分别来自不同的研究小组。人的STING蛋白由1个短的N端胞质片段、4个定位于内质网膜的跨膜(TM)结构域、1个胞质配体结合域(LBD)和1个C端尾部(CTT)组成。LBD和CTT位于胞质中,分别负责结合环二核苷酸(CDN)和招募TANK结合激酶1(TBK1)等下游信号分子[27]。静息状态下,STING以二聚体形式定位于内质网膜和线粒体外膜上,处于抑制状态。当环鸟苷酸-腺苷酸(cGAMP)结合至经二聚化形成的V型口袋后,STING的构象随之发生变化。接着,活化的STING能够同时招募胞质中的TBK1和IRF3,进而磷酸化激活IRF3[28]。另一方面,活化的STING也能够激活IKK,继而磷酸化激活NF-κB。活化的IRF3和NF-κB入核,诱导I型IFN的产生和相关炎症因子的表达[29]。此外,STING还能直接结合细菌环状二核苷酸,如 3′3′-cGAMP、c-di-GMP 和 c-di-AMP,独立于cGAS活化TBK1和IRF3,诱导IFN的表达[30]。除此之外,在结合cGAMP后,STING还能通过不依赖于TBK1及干扰素诱导的机制激活细胞自噬[31]。因此,STING在先天免疫反应中具有广泛的作用[27,30]。
在共享经济的服务下,供应者和劳动者不再是企业被雇佣的人员,他们也可以通过为需求者提供服务来创造自身的品牌,比如小猪短租,房东通过提供房源也能形成自己独特的品牌。
较之于哺乳类,有关鱼类STING的研究较晚且较为浅显。目前,已在斑马鱼[32-33]、草鱼[34]、石斑鱼[35]等多种鱼类中克隆获得了STING基因,并且发现它在各种组织中具有广泛表达。草鱼STING基因包含7个外显子和6个内含子,比人的STING少了一个内含子,这可能有利于对外界应激作出快速反应[34]。鱼类STING的N端TM结构域呈现多样性,如草鱼的有3个TM结构域[34],石斑鱼的则包含4个TM结构域[35]。在哺乳类,STING的TM结构域不但对其定位和二聚化必不可少[26],而且在其与MAVS相互作用以激活IRF3和诱导IFN的过程中也起着重要作用[25]。由于在序列上与哺乳动物的高度不保守,鱼类STING的TM结构域是否也发挥着同样的作用仍不清楚。
类似于哺乳类,鱼类STING主要定位于内质网上[33,35],也能够响应DNA病毒。在斑马鱼,以单纯疱疹病毒1(HSV-1)感染斑马鱼的不同发育阶段,能够诱导I型IFN和干扰素刺激基因(ISGs)的表达。有意思的是,斑马鱼cGAS对STING信号传导无关紧要,而DHX9和DDX41在此过程中却必不可少[32]。这一点与哺乳类大相径庭,其中所蕴含的分子机制有待于进一步的探究。事实上,STING既相对保守又逐步演化。一方面,在细菌“防御岛”内就发现存在功能性STING的同源物,能够选择性响应由邻近cGAS/DncV样核苷酸转移酶合成的c-di-GMP[36]。另一方面,STING依赖性的IRF3和NF-kB信号激活因物种不同而不同。与哺乳类STING能够显著激活下游IRF3-IFN信号不同,斑马鱼STING能够显著激活下游NF-κB信号,而IRF3-IFN信号较弱,其原因是斑马鱼STING的CTT能够招募信号分子TRAF6[37]。
3 cGAS
有研究发现cGAMP能够作为第二信使活化STING,随后cGAMP合成酶cGAS便被鉴定[38-39]。结构上,cGAS由1个无序的N端结构域和1个C端催化结构域(CCD)组成。cGAS的CCD具有NTase家族特有的双叶折叠结构,两叶间的大裂口构成其底物结合位点[27]。cGAS能够非序列依赖性地识别dsDNA的磷酸-脱氧核糖骨架。接着,cGAS 形成二聚体,其中R150和R192这2个位点插入到DNA双螺旋结构的空隙中,使得cGAS与dsDNA形成2∶2的cGAS-DNA复合体。结合dsDNA后,cGAS的构象便由非活化状态转变为活化状态,催化AMP、GMP形成2′-3′cGAMP[40]。另外,只有当dsDNA的长度超过16 bp时,DNA才能跨越cGAS二聚体的2个DNA结合位点[27]。最新研究发现,cGAS并不主要存在于细胞质中,细胞核中也存在大量cGAS分子[41-42],其中有多方面的机制抑制其活性[43-48]。
作为胞内重要的DNA感受器,cGAS主要依赖cGAS-STING通路发挥其抗病毒等功能[39]。当然,其具体的分子机制有待更深入地了解。最近发现,在病毒感染后,乙酰转移酶KAT5能够介导cGAS的乙酰化,导致cGAS对病毒DNA的亲和力增强,大大促进机体的抗病毒反应[49]。
有关鱼类cGAS的研究不多,只是在斑马鱼[32,50]、大黄鱼[51]、草鱼[52]和青鳉[53]等少数鱼类中有些报道。类似于鱼类STING基因,鱼类cGAS在各种组织中具有组成型表达。在刺激隐核虫和细菌感染下,鱼类cGAS的mRNA水平会显著上调,暗示鱼类cGAS可能参与了机体免疫防御过程[51,53]。
最新研究发现,斑马鱼存在两个cGAS同源分子(DrcGASa和DrcGASb),两者具有与哺乳类cGAS类似的总体结构和保守的功能性结构域或残基。较之于DrcGASb,DrcGASa在催化合成2′3′-cGAMP和诱导IFN反应中具有更强的功能活性,表明DrcGASa优先参与STING依赖的Ⅰ型IFN和NF-κB信号通路。另外,DrcGASa参与了IgZ介导的鳃相关淋巴组织黏膜免疫,DrcGASb则不能[50]。然而,之前有研究表明,虽然斑马鱼STING对感受HSV-1的反应必不可少,但cGAS(即DrcGASa)的敲除对HSV-1感染诱导的Ⅰ型IFN、ISG15和viperin没有产生明显的影响,暗示STING的信号激活并不是来自于cGAS的传递[32]。这两种结果不同的原因可能在于刺激使用的DNA来源的不同。另外,在有些鱼类还发现存在cGAS-like基因,其编码的cGASL蛋白的N-端具有NTase结构域,C-端含有跨膜区,这与cGAS很不相同。功能上,cGASL也与cGAS不一样,如草鱼cGASL能够负调控IFN的产生[52]。这些结果均表明,由于其处于演化特殊阶段,鱼类cGAS的功能具有多样性。
目前证据表明,在早期后生动物cGAS-STING信号通路的作用可能不是参与胞质DNA激活的先天免疫反应,其功能及其作用机制经历了从早期后生动物到现代脊椎动物的演化转变,如无脊椎动物的cGAS同源物就不能作为DNA感受器[54]。在演化过程中,cGAS从能够同时催化合成3′3′-cGAMP和2′3′-cGAMP,到斑马鱼cGAS只能够催化合成2′3′-cGAMP。这种转变能更强激活STING,有利于Ⅰ型IFN的诱导[50,54]。
4 DDX41
识别配体后,DDX41便能结合STING,STING随后促进TBK1和IRF3的磷酸化,最终诱导Ⅰ型IFN的产生[55]。最近研究发现,DDX41能够通过磷酸化IRF3诱导IFNβ的表达,最终抑制乙肝病毒HBV的复制[58]。除此之外,DDX41还具有抑制肿瘤细胞生长和调节癌症免疫等多方面的生物学功能[56,59]。
鱼类DDX41的研究不太深入。目前,已在斑马鱼[60]、牙鲆[61]、石斑鱼[62]、尼罗罗非鱼[63]和草鱼[64]等克隆获得了DDX41。这些鱼类的DDX41大小相似,约614个氨基酸。系统分析表明,DDX41在不同物种间高度保守,意味着鱼类DDX41也可能具有与哺乳类DDX41类似的结构和功能。DDX41基因在鱼类各组织中均有组成型表达,而在病毒感染下其表达量会显著升高[62],表明鱼类DDX41在免疫调控过程中有着重要的作用。
静息状态下,鱼类DDX41可能主要位于细胞核中,在DNA或病毒刺激后被招募到细胞质中[60,62]。类似于哺乳类,鱼类DDX41能够作为IFN和NF-κB信号通路的触发器。在c-di-GMP刺激下,过表达牙鲆DDX41能够激活细胞抗病毒状态[61]。斑马鱼DDX41通过其DEAD结构域参与STING-STAT6介导的趋化因子20(CCL20)的产生,敲除DDX41或STING/STAT6会显著降低嗜水气单胞菌或爱德华氏菌感染的斑马鱼的存活率[60]。尼罗罗非鱼DDX41能够显著提高经poly(dA∶dT)处理后的细胞中斑马鱼IFN1和IFN3启动子的活性[63]。此外,过表达DDX41会抑制SGIV和RGNNV在GS细胞中的复制,并上调抗病毒和炎症因子的表达[62]。这些结果表明,DDX41参与了鱼类I型IFN相关的抗病毒和炎症反应。虽然如此,有关鱼类DDX41功能及其机制的研究还相当粗浅。作为胞质DNA感受器,鱼类DDX41如何识别DNA或DNA病毒?其作用的主要信号途径?这些都值得深入探讨。
5 鱼类PKZ
PKZ基因最早是在紫外灭活的草鱼出血病病毒(GCRV)感染的鲫囊胚细胞(CAB)中克隆获得[65],随后,在斑马鱼[66]、大西洋鲑[67]、稀有鮈鲫[68]和草鱼[69]等相继克隆获得。PKZ在各组织中的本底表达较低,病毒刺激后其mRNA水平会显著升高。同样的,在DNA的刺激下,PKZ在细胞中的表达也会显著上调[70]。目前发现,PKZ是位于胞质中的、鱼类特有的一种蛋白激酶。
尽管PKZ大小与双链RNA依赖性蛋白激酶(PKR)相仿,约为513氨基酸残基,其C端11催化亚区也与PKR的最为相似,但PKZ在IV和V催化亚区之间有一个长的激酶插入序列(约85个残基),而PKR的插入序列很短(约10~34个残基)。尤为特别的是,PKZ的N端有两个Z-DNA结合域(Zα1和Zα2),而不是PKR中典型的dsRNA结合域(dsRBDs)。另外,在斑马鱼、鲫鱼或草鱼的基因组中,PKR和PKZ基因都是头尾相联呈串联方式排列的[71-72]。草鱼基因组中PKZ和PKR之间的基因间区(IGR)长度很短,只有561 bp,这与斑马鱼和鲫鱼的均不同。而且,该IGR的核苷酸序列与鲫鱼PKZ启动子的部分序列显示99.8%(560/561)的一致性。目前尚不清楚IGR的长短差异是否与PKZ基因在不同物种中表达、调控的强度和反应快慢有关[73]。
一方面,类似于PKR,鱼类PKZ在其C端具有11个eIF2α激酶催化亚区,属于eIF2α激酶家族新成员,具有典型的eIF2α激酶活性,并且能够作为抗病毒因子参与先天免疫反应[73]。另一方面,类似于ADAR1,其N端包含两个Zα结构域,与Z-DNA或Z-RNA具有高亲和力,且可以识别B-DNA或B-RNA并将其转变为Z-型构象[66-67,74-76]。其中,Zα1和Zα2具有不同的功能,Zα1能够比Zα2更加有效地将B-DNA转变成Z型构象。同样的,PKZ的Zα1结构域也包含9个对Z-DNA识别和结合起关键作用的位点[75-76]。因此,有理由推断PKZ是胞质Z-DNA/RNA的一种新的感受器,并因此而触发鱼类的先天免疫应答[70-71]。由于DAI在鱼类基因组中尚未发现,作为Z-DNA识别受体的PKZ或许是一种补偿因子,起到细胞内DNA感受器的作用,触发先天性抗病毒免疫反应。当然,这里还存在许多需要解决的问题,包括PKZ识别DNA的方式、PKZ与相关底物之间的关系、以及PKZ引发的先天免疫反应的生物学意义等。
6 结语
随着众多DNA识别受体或感受器的发现,病毒或病菌DNA触发先天免疫应答的机制便逐渐被解析。类似于哺乳类,近年来在鱼类中也发现存在一些DNA感受器,初步研究表明这些DNA感受器能够感知病原微生物所释放的DNA,从而参与机体先天免疫反应(图1)。同时,由于其特殊的演化地位,鱼类所具有的DNA感受器与哺乳类的又有所不同,有些还是鱼类所特有的。虽然如此,有关鱼类DNA感受器的研究大部分都是跟随哺乳类进行的,较为粗浅,还有很多问题值得深入探索。比如,这些鱼类DNA感受器是否冗余,它们在反应时效上存在哪些差异?它们所识别的病原微生物DNA是否具有特异性?这些都有待进一步的研究。

