一株好氧反硝化细菌的筛选鉴定及其脱氮特性
朱红旭,杨本芹,高 媛,翟红阳,赵艳卿
(昆明理工大学 环境科学与工程学院,昆明 650500)
氮素是导致水体污染的重要污染物之一,会引起水质恶化,水体富营养化,进而导致水生动物中毒死亡。因此,氮素的治理工作日益受到重视,生物脱氮技术受到关注[1]。生物脱氮法以其安全、高效、经济等特点被认为是最具有发展前景的污水脱氮方法,传统生化脱氮要经过好氧硝化和厌氧反硝化两个过程,首先通过好氧硝化菌作用把氨氮转变为硝氮,继而在厌氧环境下通过反硝化菌作用把硝氮转变为氮气从而达到氮素的去除[2]。
20世纪80年代,Robertson等[3]报道了好氧反硝化菌(Paracoccussp.)的存在,此后,越来越多种类的好氧反硝化菌从不同的环境中被分离出来。目前已知的好氧反硝化菌主要为假单胞菌(Pseudomonas)、不动杆菌(Acinetobacter)、产碱菌(Alcaligenes)、芽孢杆菌(Bacillus)、代尔夫特菌(Delftia)和盐单胞菌(Halomonas)等[4-11]。Bell等[12]阐明了好氧反硝化菌的反硝化机理,证明好氧反硝化的发生主要归因于细胞内存在的好氧反硝化作用酶体系,使好氧反硝化菌能够在有氧的环境中将硝氮和亚硝氮还原为氮气。这些理论基础为本研究筛选和分离高效反硝化能力的好氧反硝化菌株提供了思路。好氧反硝化菌的脱氮工艺与传统生物脱氮工艺相比,既缩短了工艺流程,又加快了反硝化效率。但是,目前大多数好氧反硝化菌的脱氮过程受环境限制,导致反硝化过程不稳定且效率不高,硝氮去除效率多数仅达到1~10 mg/L[13-14]。因此有必要优化好氧反硝化菌的生存环境以提高其反硝化能力。
研究旨在从湿地植物的根际土壤中分离筛选出高效好氧反硝化菌,对其进行16S rDNA分子鉴定和反硝化功能基因的鉴定。同时,为了得到菌株的最适反硝化条件,对菌株的生长环境条件(碳源、温度、初始pH值和碳氮比)进行优化,并探究其反硝化能力。旨在为后续投加好氧反硝化菌强化含氮污水的处理提供基础。
1 材料与方法
1.1 材料
1.1.1 菌株来源与培养基制备
选取滇池湿地植物根际土壤作为研究所筛选的反硝化菌的来源,保存于4 ℃冰箱。培养基的制备:筛选分离培养基[15]:醋酸钠2 g,胰蛋白胨15 g,酵母浸膏3 g,葡萄糖1 g,NaCl 6 g,KNO31.5 g;脱氮培养基(Denitrification medium,DM):CH3COONa 2.83 g,KH2PO40.40 g,KNO31.0~4.0 g,Tris-HCl溶液12.0 mL,MgCl20.20 g,CaCl20.09 g,微量元素[8]2.0 mL。上述两种培养基的固体培养基需再加入20 g琼脂粉,加蒸馏水定容至1 L,pH值为7.0±0.5。
1.1.2 菌株的分离与筛选
取1 mL根际土壤上清液,加入DM液体培养基中,于30 ℃,160 r/min条件下进行多次富集培养,直到观察到培养液表面有气体快速产生。之后取100 μL菌液接种到筛选分离固体培养基上,于30 ℃下倒置孵育36 h,之后进行多次平板划线培养,分离出的单菌落于-80 ℃储藏备用。将分离出的单个菌株接种至DM液体培养基中,于30 ℃、160 r/min条件下振荡培养72 h,每12 h取样并测定硝氮和亚硝氮含量,保留脱氮能力强的菌株。
1.2 方法
1.2.1 菌株的形态分析
用平板划线法和扫描电镜(Scanning electron microscope,SEM)观察菌株的形态结构,用稀释涂布记录菌株生物量。SEM观察:将菌株在LB培养基中扩大培养36 h,取1.5 mL菌液,于6 000 r/min离心5 min,倒掉上清液。加入2 mL在4 ℃下预冷的2.5%戊二醛溶液,固定24 h,之后通过扫描电镜(日立SU 8010,日本)观察菌株细胞形态。
1.2.2 菌株的PCR扩增
将菌株接种于LB液体培养基,30 ℃振荡培养36 h,用DNA试剂盒SK 8255(上海生工生物工程有限公司)提取50 μL菌株悬液DNA。以基因组DNA为模板,扩增16S rDNA和反硝化基因(napA和nirK),PCR引物见表1。16S rDNA的PCR反应体系:模板DNA 2 μL,10 × buffer 5 μL,dNTP混合物2 μL,正向引物(10 μmol/L)2 μL,反向引物(10 μmol/L)2 μL,Taq酶0.5 μL。反硝化基因的PCR反应体系:模板DNA(10~30 ng/μL)10 μL,PCR混合物25 μL,正向引物(10 μmol/L)2 μL,反向引物(10 μmol/L)2 μL,无酶水11 μL。系统发育分析:16S rDNA的PCR产物由上海生工生物科技有限公司测序,测序结果通过Blast软件与GenBank中已提交的模式菌株的16S rDNA基因序列进行同源性比较,通过BIOEDIT软件进行多重序列比对分析,利用MEGA 6.0软件,以Neighbor-joining法构建系统发育树。

表1 PCR(聚合酶链式反应)引物列表Table 1 PCR(polymerase chain reaction) primer list
1.3 反硝化能力的优化
预先将菌株接种至筛选分离液体培养基上活化,于30 ℃,160 r/min条件下振荡培养36 h。培养完成后取50 mL菌液在8 000 r/min,4 ℃下离心5 min,舍弃上清液,用无菌水清洗3次后重悬菌液,该菌株的OD600为1.0±0.05,之后按培养液体积比的5%分别接种菌液于含不同成分的200 mL的DM液体培养基中,进行菌株培养环境因子的优化以提高菌株的反硝化能力。其中,碳源设置:葡萄糖、乙酸钠、柠檬酸钠、酒石酸钾钠、蛋白胨、乙醇;温度设置:10 ℃、15 ℃、20 ℃、30 ℃和40 ℃;pH值设置:5.0、6.0、7.0、8.0、9.0和10.0;C/N比(摩尔比)设置:1、3、5、7、10和15。其反硝化能力通过在培养过程中每12 h取菌液10 mL,测定生物量(OD600)、硝氮、亚硝氮、总氮(TN)、总有机碳(TOC)和pH值。
通过分光光度计测定菌液的吸光度OD600确定细胞密度(Lambda 25,分光光度计,美国);硝氮、亚硝氮和总氮通过水和废水监测分析方法测定[18];TOC和pH分别用TOC分析仪测定(日本岛津公司)和pH计测定(PHS-3C 上海仪电科学仪器股份有限公司)。
1.4 分析方法及计算
图形的绘制使用Origin8.6(Origin Lab Corp,Northampton,美国)。
硝氮和总氮的去除率计算方法:(C0-C1)/C0×100%。去除效率计算方法:(C0-C1)/t×100%。其中,C0和C1分别为硝氮和总氮的初始浓度和最终浓度;t为反应时间。
2 结果与分析
2.1 菌株的筛选
分离得到41株菌株,分别编号为RC-1~RC-41。经过脱氮分析后选取菌株RC-15为本研究中筛选出的高效反硝化菌株。
对于金棺中这个人,他是生是死,实在引不起青樱过多的悲喜。他,不过是自己夫君的父亲,王朝的先帝,甚至,遗弃了自己表姑母的男人。
2.2 菌株的形态与反硝化基因
菌株RC-15的形态特征为圆形、黄色、菌落较小,表面光滑湿润,边缘整齐,紧贴在培养基表面,易挑取[图1(a)]。且该菌株为杆状细菌,其长度约为0.5 μm,宽度约为0.1 μm,无鞭毛和芽孢[图1(b)]。通过稀释涂布法得知该菌株在对数增长期的菌落数为1.715×1011CFU(Colony-Forming Unit),表明菌株生长状态良好,生物活性高。
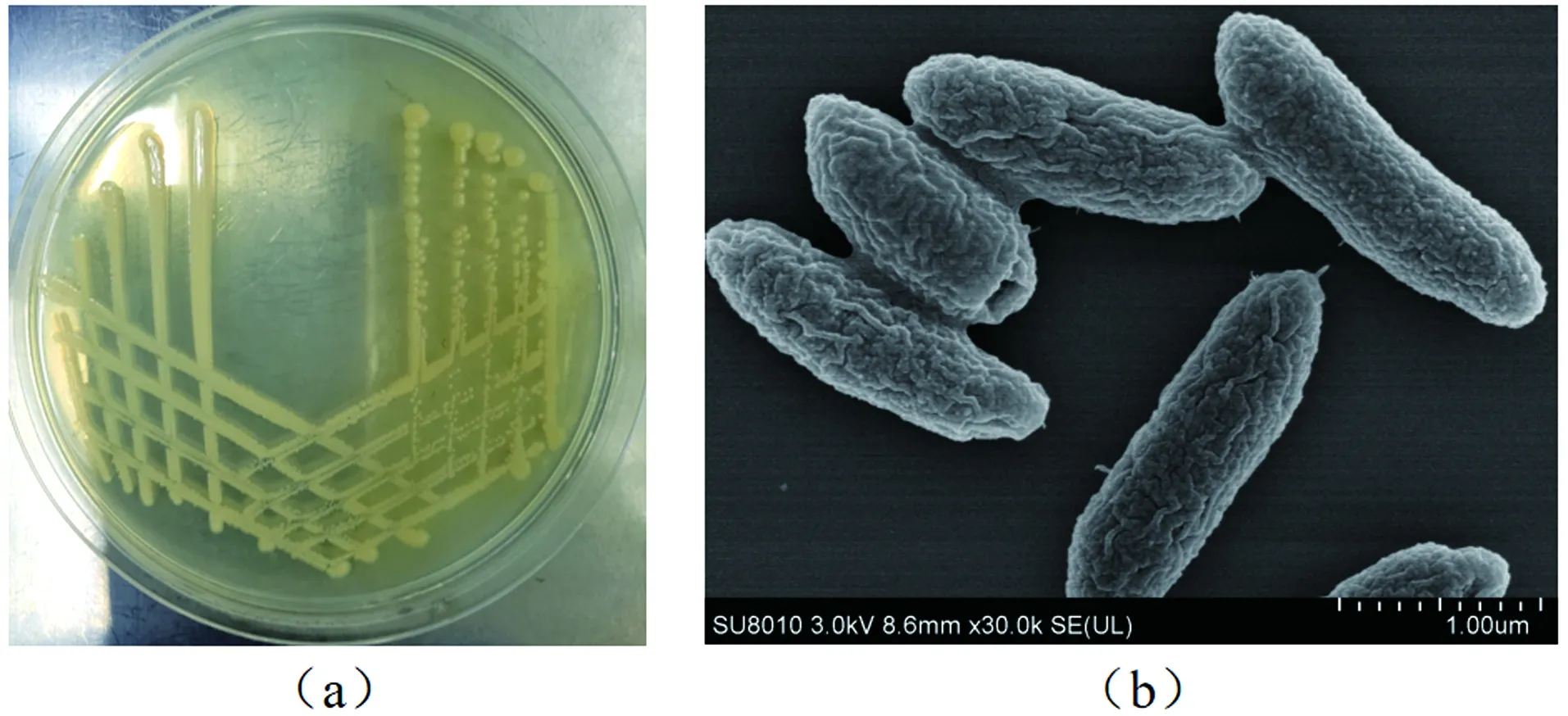
图1 菌株RC-15的培养皿照片(a)和扫描电镜(SEM)照片(b)Figure 1 Petri dish photos (a) and scanning electron microscope (SEM) photos (b) of strain RC-15
将测得的菌株RC-15的16S rDNA序列在NCBInucleotide数据库中进行比对,发现菌株RC-15与豚鼠气单胞菌(Aeromonascaviae)的同源性为99.93%。采用MEGA4.1软件进行多重序列比对后,基于K-2-P(Kimura-2-parameter)模型构建邻接法(N-J 法)系统发育树,Bootstrap自展检测1 000,构建出的系统发育树如图2所示,菌株RC-15与豚鼠气单胞菌(Aeromonascaviae)的亲缘关系最为相近,推测菌株RC-15属于气单胞菌属(Aeromonassp.),为豚鼠气单胞菌(Aeromonascaviae)。

图2 利用Neighbor-Joining构建的16 SrDNA系统发育进化树Figure 2 Phylogenetic tree drawn from neighbor-joining analysis based on the 16 SrDNA sequence alignment
生物脱氮是将硝氮转化为一氧化氮、一氧化二氮或氮气的过程,为了阐明菌株RC-15的脱氮途径,研究选择2个潜在的反硝化酶基因(napA、nirK)进行PCR扩增。在反硝化过程中不同酶的催化作用也不同[19]。由图3可知,该菌株成功扩增出napA和nirK的基因产物。napA基因是在好氧条件下参与硝酸盐呼吸和反硝化作用的关键基因,其转录表达后可产生硝酸还原酶,napA的表达也常被认为是好氧反硝化细菌鉴定的功能标记[20-21]。因此,该菌株napA基因的成功表达说明该菌株可产生硝酸还原酶,具有将硝氮转化为亚硝氮的能力,菌株RC-15的napA基因扩增在Aeromonassp.HN-02中也有报道[22]。此外,nirK基因是编码亚硝酸还原酶的基因[21]。该菌株成功扩增出nirK基因的产物,说明该菌株可产生亚硝酸还原酶,具有转化亚硝氮的能力。综上所述,菌株RC-15功能基因的扩增表明该菌株可产生2个关键酶(硝酸还原酶、亚硝酸还原酶),进一步说明该菌株具有好氧反硝化的能力。
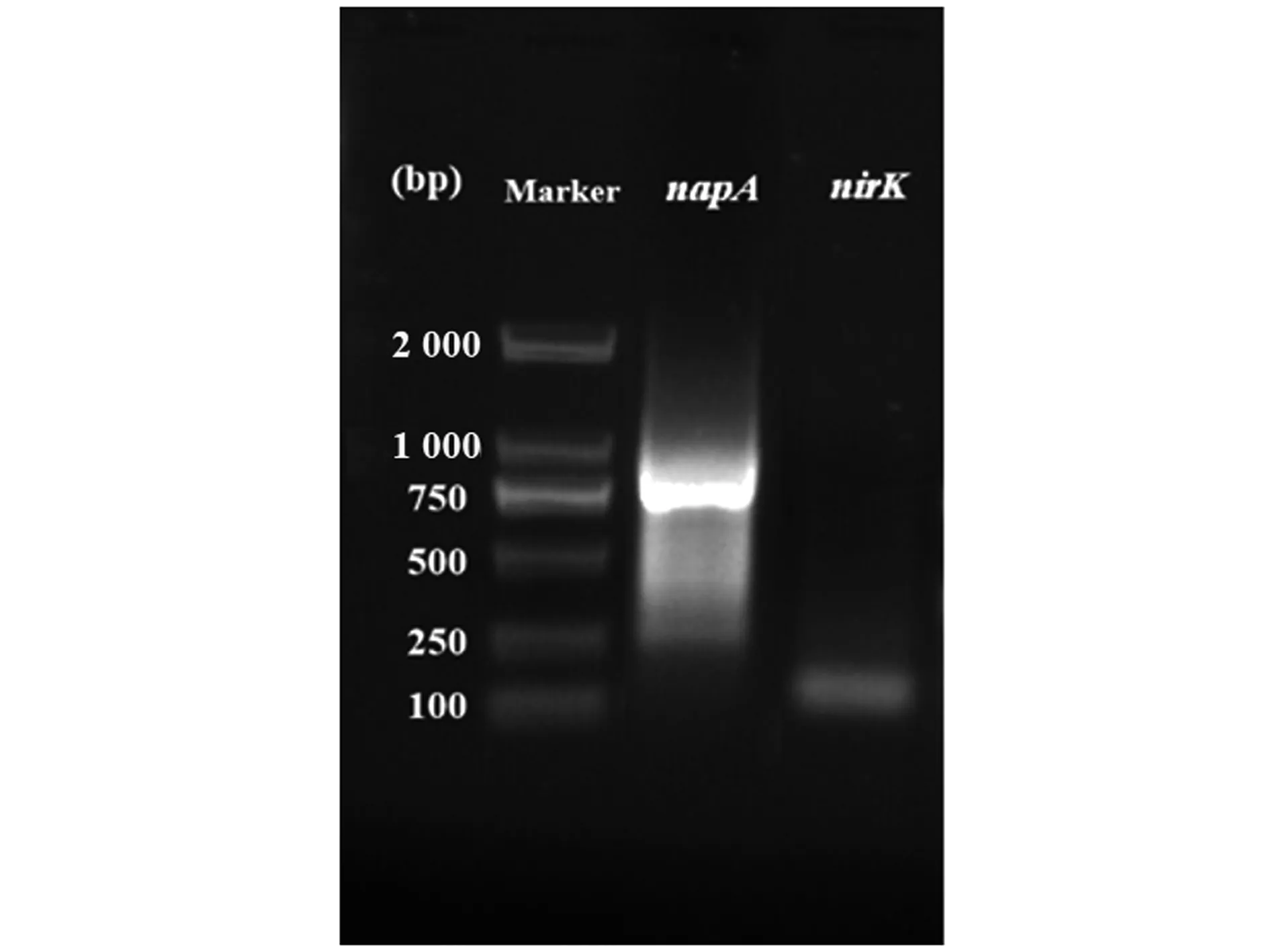
Marker:DL 2000。图3 气单胞菌RC-15的反硝化基因扩增Figure 3 The amplification of denitrification genes of Aeromonas strain RC-15
2.3 菌株RC-15的培养条件探究
2.3.1 碳源
碳源是为微生物提供能量的必要元素,不同碳源在微生物代谢中地位不同。探究菌株RC-15在不同碳源环境下的脱氮能力。图4显示:培养72 h后,与其余4种碳源相比在以蛋白胨为碳源时菌株的OD值(生物量)最大,其次是乙酸钠,说明在乙酸钠和蛋白胨两种碳源条件下菌株的生长状态较好。同时,随着OD值的增加,该菌株的反硝化速率也增加,以蛋白胨和乙酸钠为碳源时硝氮的去除率分别达到99.80%和99.06%,且亚硝氮的积累量最少,说明该菌株在这两种碳源培养条件下反硝化能力最强。因此得出菌株RC-15最优碳源为乙酸钠和蛋白胨。
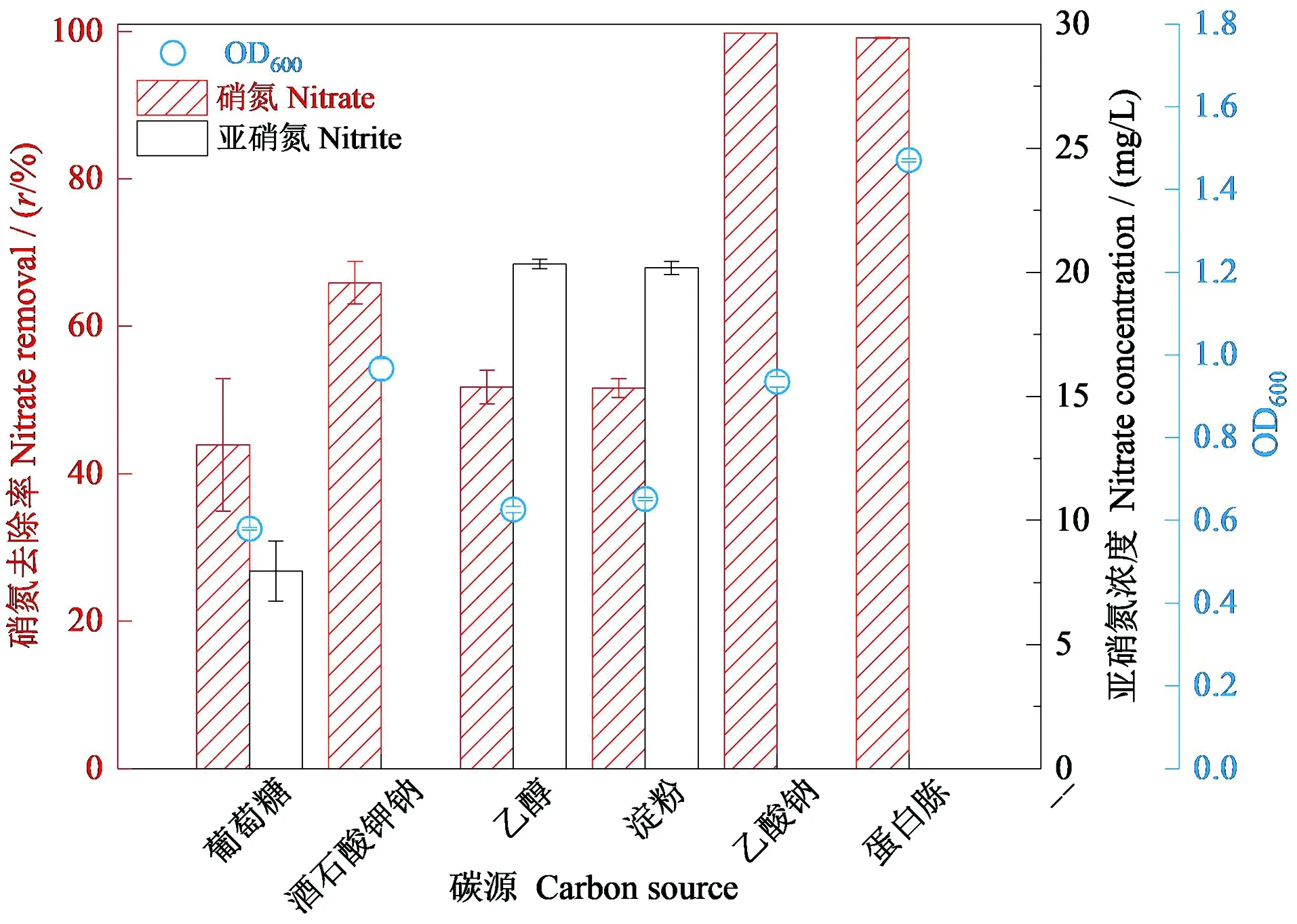
图4 72 h时菌株RC-15生长量(OD600)、硝氮浓度和亚硝氮浓度变化Figure 4 The growth of strain RC-15 (OD600) and variation of nitrate and nitrite concentration during 72 h cultivation
2.3.2 温度
菌株RC-15在不同温度条件下的生长情况和反硝化能力如图5所示,培养72 h后,对比不同温度条件下该菌株的脱氮能力,发现其在30 ℃下OD值最大、硝氮的去除率最高且亚硝氮积累量最低,说明其在30 ℃条件下脱氮能力最强。同时发现低温(10 ℃和15 ℃)条件对OD值有明显的抑制,说明该菌株对环境温度非常敏感且低温下该菌株的生长较差。但是,该菌株在低温下72 h时硝氮的去除率分别为27.44%和42.89%,说明其在低温下也能进行脱氮,为低温条件下处理硝酸盐废水提供了保障。综上所述,菌株RC-15适宜的环境温度为30 ℃,且能在低温下(10 ℃和15 ℃)完成反硝化过程。
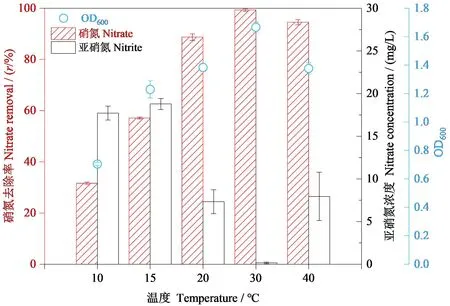
图5 72 h时菌株RC-15生长量(OD600)、硝氮浓度、亚硝氮浓度的变化Figure 5 The growth of strain RC-15 (OD600) and variation of nitrate and nitrite concentration during 72 h cultivation
2.3.3 pH值

图6 72 h时菌株RC-15生长量(OD600)、硝氮浓度、亚硝氮浓度和pH值变化Figure 6 The growth of strain RC-15 (OD600) and variation of nitrate and nitrite concentration and pH values during 72 h cultivation
2.3.4 碳氮比
碳氮比是影响反硝化脱氮的重要指标[25]。图7显示,当碳氮比为5、7、10和15时,菌株的OD值和硝氮去除率均明显提升,仅有少量亚硝氮积累,均有TOC的剩余。当碳氮比为7时,该菌株的反硝化能力最强,说明碳源充足时菌株的生长能力和反硝化能力都显著增强。

图7 不同碳氮比对菌株RC-15生长量(OD600)、硝氮浓度、亚硝氮浓度和总有机碳(TOC)浓度的影响Figure 7 Different C/N ratio on growth (OD600) andnitrate concentration and nitrite and total organic carbon (TOC) concen- tration ofstrain RC-15 influence
在低碳源条件下(碳氮比为1和3),该菌株的OD值和硝氮的去除率都不理想,且都有明显的亚硝氮积累。同时发现在低碳源条件下72 h时培养环境的TOC剩余浓度极低,几乎被菌株消耗殆尽。说明在低碳源条件下,菌株的生物量和脱氮效率都会受到明显抑制。综上所述,碳氮比为7时,菌株RC-15反硝化能力最强,且在碳氮比较低的环境中也能进行反硝化过程。
2.3.5 菌株RC-15最优脱氮性能
探究菌株RC-15在上述最优条件(乙酸钠、30 ℃、初始pH值为8.0和碳氮比为7)下的生长情况和反硝化能力。图8显示,菌株的反硝化能力与上述实验相比得到了明显提升,但是,菌株的OD值与先前实验相比增长缓慢,结合该菌株培养环境中的亚硝氮浓度分析其原因,发现在12~36 h培养环境中有大量亚硝氮积累,且亚硝氮积累量均超过50 mg/L。有研究表明,高浓度亚硝酸盐(50 mg/L)会抑制细菌的生长[25]。
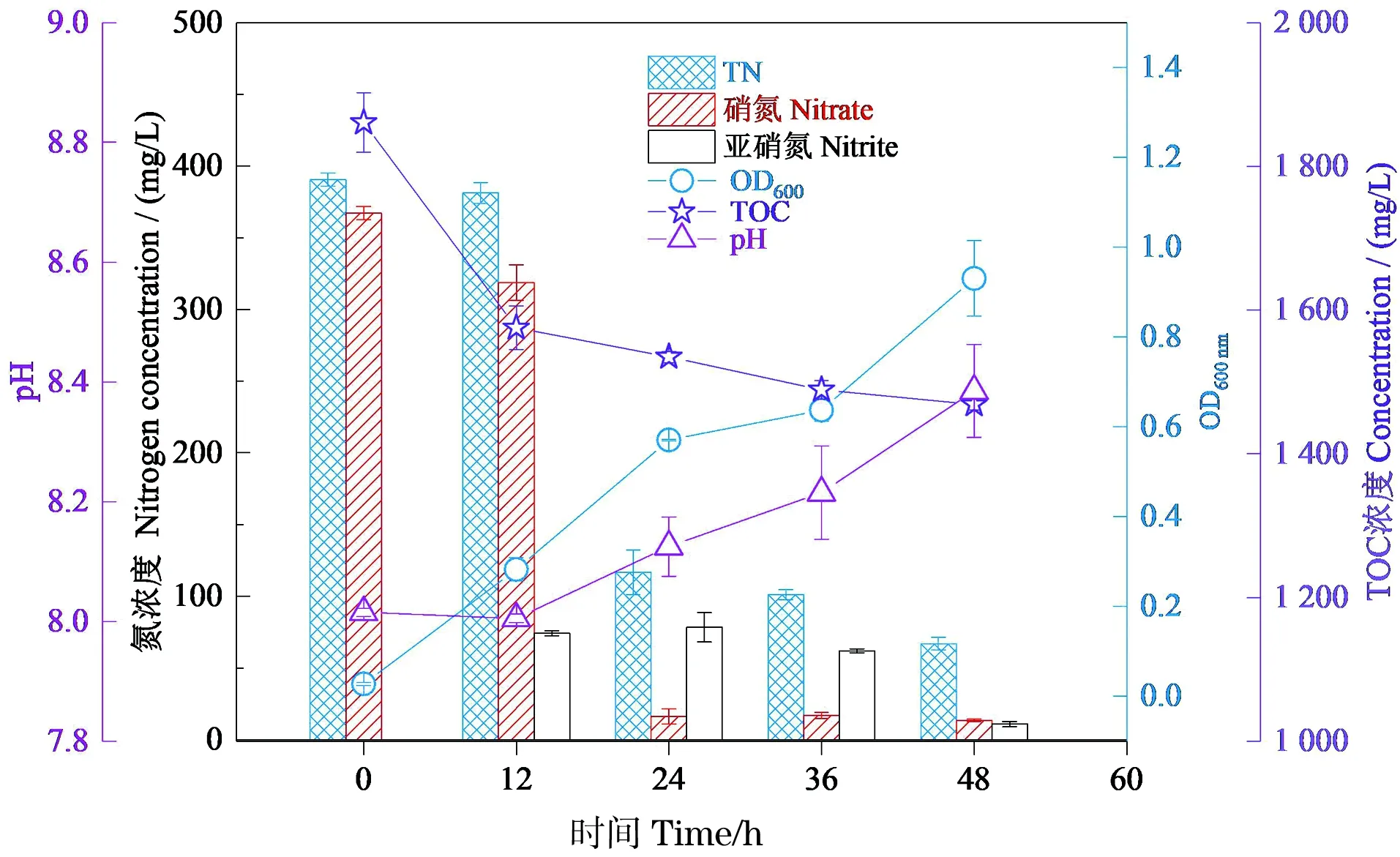
图8 48 h时菌株RC-15生长量(OD600)、硝氮浓度、亚硝氮浓度、总氮(TN)浓度、总有机碳(TOC)浓度和pH值的变化Figure 8 The growth of strain RC-15 (OD600) and variation of nitrate and nitrite and total organic(TN) carbon (TOC) concen-tration and pH during 72 h cultivation
结合培养环境的硝氮和总氮去除率分析培养环境中亚硝氮浓度明显增多的原因,发现24 h时培养环境硝氮的去除率达到95.57%,对应的去除速率达到14.62 mg/(L·h),48 h时菌株的硝氮和总氮的去除率分别达到96.31%和82.84%。所以推测其培养环境中亚硝氮浓度明显增多的原因是该菌株的硝氮去除效果显著增加。此外,通过对比该菌株培养环境不同时刻的pH值,发现48 h时的pH值与初始pH值相比有明显的增长,说明该菌株在反硝化过程中会导致培养环境pH值升高。在48 h内培养环境的TOC浓度共消耗392.38 mg/L,且在起初的12 h内消耗了285.83 mg/L,消耗碳源较多,说明该菌株需要利用大量碳源来维持自身的生长。
通过对菌株生长的环境因子进行优化后菌株对硝氮和总氮的去除效果良好,24 h时硝氮的去除率达到95.57%,对应的硝氮去除速率达到14.62 mg/(L·h),其硝氮的去除速率与筛选时[4.09 mg/(L·h)]相比提升显著。
3 讨论
目前,利用反硝化菌进行脱氮的工艺已经成为污水处理的热门工艺,反硝化机理研究的报道也越来越多,但是,大多数学者对好氧反硝化菌的脱氮特性的微观研究并不多。研究从植物根际土壤中筛选分离出好氧反硝化菌株RC-15,对其进行微观形态观察并鉴定为豚鼠气单胞菌(Aeromonascaviae)。PCR测序得到反硝化基因napA、nirK,确定该菌株的好氧反硝化能力。此外,对norB和nosZ基因也进行了扩增,但未得到产物。norB和nosZ基因是常见的反硝化基因,负责编码一氧化氮还原酶和一氧化二氮还原酶[19]。通过对比菌株RC-15与其他菌株的功能基因,发现其不同的反硝化菌对应的功能基因也不同,Xia等[20]和陈茂霞等[22]鉴定出Acinetobactersp.ND7菌株和Aeromonassp.HN-02菌株具有napA基因;Su等[19]鉴定出Comamonassp.YSF15菌株具有nirS基因,可以看出不同反硝化菌株的功能酶基因也不同。虽然研究未得到norB和nosZ的基因产物,但是否能认定该菌株不会产生这两种反硝化酶(一氧化氮还原酶和一氧化二氮还原酶)。据报道,nirS基因具有催化硝氮转化为氮气的能力[20];P450nor等也属于反硝化酶基因[26]。故此,可能还存在其他反硝化酶基因未被鉴定出,且脱氮能力与其功能基因表达的强弱有关,生物脱氮的最终目的应致力于将氮元素转化为对环境无害的氮气,其机理还有待进一步研究。
在宏观层面,大多数反硝化菌的脱氮过程受环境限制,导致反硝化过程不稳定且效率不高,研究通过单因素摇瓶试验发现菌株RC-15可以在低温环境、弱酸性环境和低碳氮比条件下进行脱氮。当碳源为乙酸钠,温度为30 ℃、初始pH值为8.0、碳氮比为7时,菌株的生长和脱氮能力较好,24 h时硝氮的去除率达到95.57%,对应的硝氮的去除速率达到14.62 mg/(L·h)。将菌株RC-15的脱氮能力与相关反硝化菌的脱氮能力[2,13-14,22,27]对比发现:该菌株的脱氮能力超过了以往的大多数菌株,具有良好的脱氮工艺应用前景,且该菌株是从当地实际废水中提取的土著优势菌株,为后续利用高效反硝化菌株强化实际污水中的脱氮研究提供新型菌源。

