酶解辅助-超声提取紫花地丁总黄酮研究*
蒋 纯,刘书帆,何晶晶,郑立文,吴晓妹,蒋亚超
(1 南华大学附属南华医院,湖南 衡阳 421002;2 湘南学院,湖南 郴州 423099)
紫花地丁(Viola yedoensis)味苦、辛,性寒,为堇菜科堇菜属植物紫花地丁的干燥带根全草,主要功效为清热解毒、凉血消肿[1]。国内外研究表明紫花地丁主要成分为黄酮类化合物,已分离出几十种个黄酮苷类成分,具有具有抗菌、抗炎、免疫调节、抗病毒、抗氧化、抗肿瘤等多种药理活性[2-5]。工业上黄酮类化合物以回流提取和超声提取为主,其中酶解辅助-超声提取法即可保证提取率,同时催化反应条件温和,更有利于黄酮类化合物稳定[6],因此酶解辅助-超声提取紫花地丁总黄酮工艺研究具有实际研究价值。
1 仪器与材料
UV-1280紫外可见分光光度计,日本岛津;ATX124电子分析天平,日本岛津;KM-600DE超声清洗器,昆山美美超声仪器有限公司。
亚硝酸钠,无水乙醇,氢氧化钠,硝酸铝等均为分析纯。紫花地丁为湖南省郴州4月采摘,经湘南学院药学院蒋亚超主管药师鉴定为正品;芦丁标准品(LC220726),纯度≥98%(HPLC),购自合肥博美生物科技有限公司;纤维酶(10万U/g)和果胶酶(5万U/g)均购自山东隆科特酶制剂有限公司。
2 实验方法
2.1 溶液的配置
2.1.1 酶溶液的配制
精密称取含纤维酶、果胶酶各0.5 g放入100 mL容量瓶中,加蒸馏水40 mL溶解后,用无水乙醇定容至刻度线,即得纤维酶、果胶酶各5 mg/mL的60%乙醇溶液。
2.1.2 供试品的制备
取新鲜紫花地丁,50 ℃烘箱干燥,粉碎机打粉。精密称定紫花地丁粉末5 g,置于锥形瓶中,加入60%乙醇40 mL和混合酶溶液10 mL,pH值调至3.5,催化反应10 min,在35 ℃条件下超声提取20 min,60%乙醇补足减失重量,滤纸过滤,即得含量为0.1 g/ mL供试品,取续滤液1.5 mL,按标准曲线法测量吸光度。
2.2 标准曲线的建立
精密称量芦丁标准品18.2 mg于50 mL容量瓶中,60%乙醇稀释、定容至刻度,得0.364 mg/ mL芦丁标准品。精密吸取芦丁标准品溶液 1,2,3,4,5,6 mL分别置于25 m L容量瓶中,加入5%亚硝酸钠溶液 1.0 mL,摇匀,放置5 min,再加入10%硝酸铝溶液1.0 mL,摇匀,放置5 min,再加入4%的氢氧化钠溶液10.0 mL,加入60%乙醇至刻度,摇匀,静置 15 min。随行试剂为空白,λ=501 nm处测定吸光度,以含量为纵坐标,以吸光度A为横坐标,作芦丁总黄酮标准曲线,得回归方程为:Y=87.533X-4.8611; R2=0.9991。如图1所示。
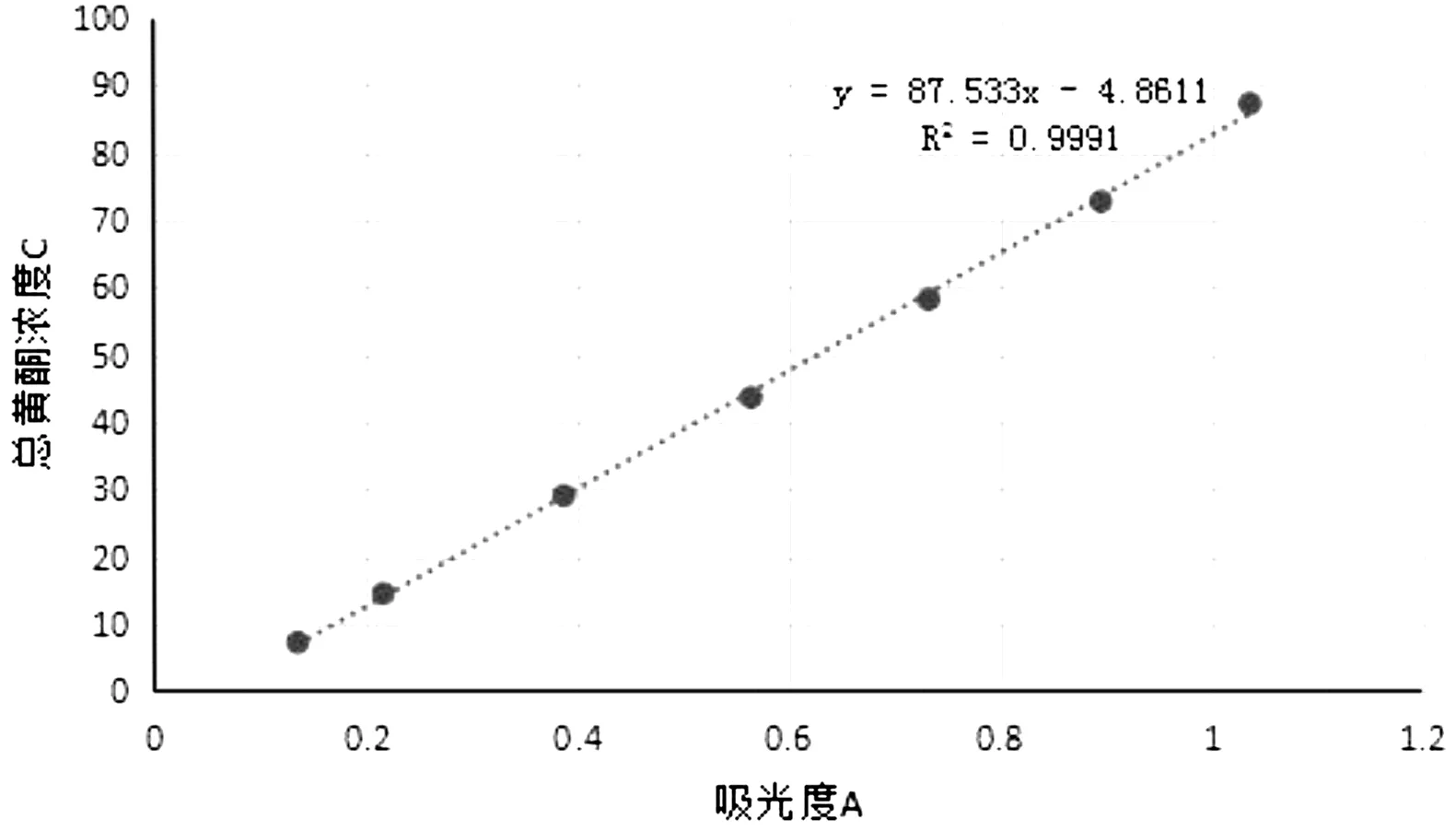
图1 紫花地丁总黄酮标准曲线Fig.1 Standard curve of total flavones of Rhoditin
2.3 酶解辅助超声法研究
精密称取2份紫花地丁粉末5 g,分别置于250 mL具塞锥形瓶中,一份加酶溶液10 mL,另一份不加酶溶液,其他步骤按2.1.2,2.2进行提取、显色测量吸光度。得酶解辅助超声提取比单纯超声提取率高89.4%;详见表1所示。
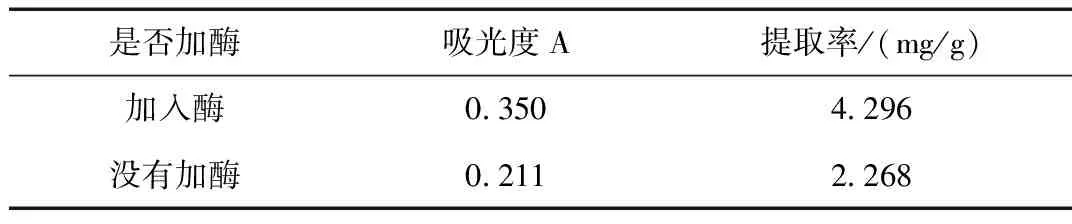
表1 酶解辅助超声法结果Table 1 Results of enzymolysis assisted ultrasound method
2.4 单因素考察
2.4.1 单因素考察pH的影响
精密称取5份紫花地丁粉末5 g,置于250 mL具塞锥形瓶中,pH值分别调至2.5、3.5、4.5、5.5、6.5,其他步骤按2.1.2,2.2进行提取、显色测量吸光度。
2.4.2 提取温度
精密称取5份紫花地丁粉末5 g,置于250 mL具塞锥形瓶中,超声温度分别调至35、40、45、50 、55 ℃,其他步骤按2.1.2,2.2进行提取、显色测量吸光度。
2.4.3 提取时间
精密称取5份紫花地丁粉末5 g,置于250 mL具塞锥形瓶中,超声提取时间分别为10、20、30、40、50 min,其他步骤按2.1.2,2.2进行提取、显色测量吸光度。
2.4.4 乙醇浓度
精密称取5份紫花地丁粉末5 g,置于250 mL具塞锥形瓶中,提取乙醇浓度分别为40%、50%、60%、70%、80%,其他步骤按2.1.2,2.2进行提取、显色测量吸光度。
2.4.5 液料比
精密称取5份紫花地丁粉末5 g,置于250 mL具塞锥形瓶中,料液比分别用1:5,1:10,1:15,1:20,1:25,其他步骤按2.1.2,2.2进行提取、显色测量吸光度。
2.4.6 酶用量
精密称取5份紫花地丁粉末5 g,置于250 mL具塞锥形瓶中,酶用量分别用5 mL,10 mL,15 mL,20 mL,25 mL,用60%乙醇溶液补至总液量为50 mL,其他步骤按2.1.2,2.2进行提取、显色测量吸光度。
2.5 正交设计实验
根据单因素实验结果综合考虑,设定乙醇浓度、酶用量、料液比、超声次数为正交考察因素。采用L9(34)正交表设计,以总黄酮为考察指标,得到最佳紫花地丁总黄酮提取工艺,见表2所示。
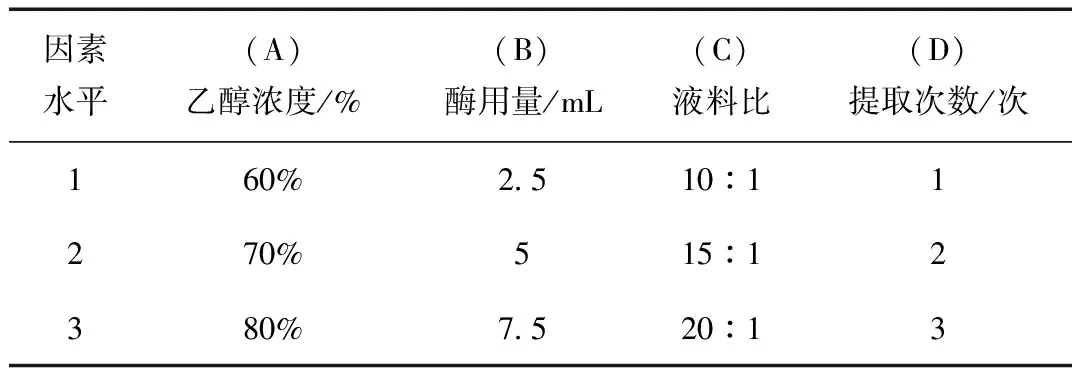
表2 正交因素试验水平Table 2 Test level of orthogonal factors
2.6 验证实验
采用正交试验优化出的最佳提取方法,提取三次样品,按照标准曲线显色方法,定吸光度,通过标准曲线计算含量。
3 实验结果
3.1 单因素实验结果
3.1.1 pH结果显示
在pH=2.5时,总黄酮提取率最高,但在实验过程中出现溶液浓稠,紫花地丁变黄,不利于工业生产,所以pH定在3.5最适合提取,详见图2所示。
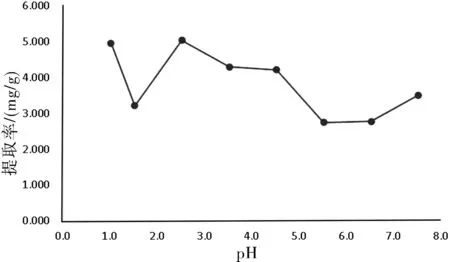
图2 pH对提取的影响Fig.2 Influence of pH on extraction
3.1.2 提取温度结果显示
温度对紫花地丁总黄酮影响为先高后低再高,考虑温度为35 ℃最适合酶的活性,温度高于50 ℃后酶活性被抑制,但热提取影响较大。综合工业成本与黄酮分解影响,35 ℃最适合紫花地丁提取,详见图3所示。
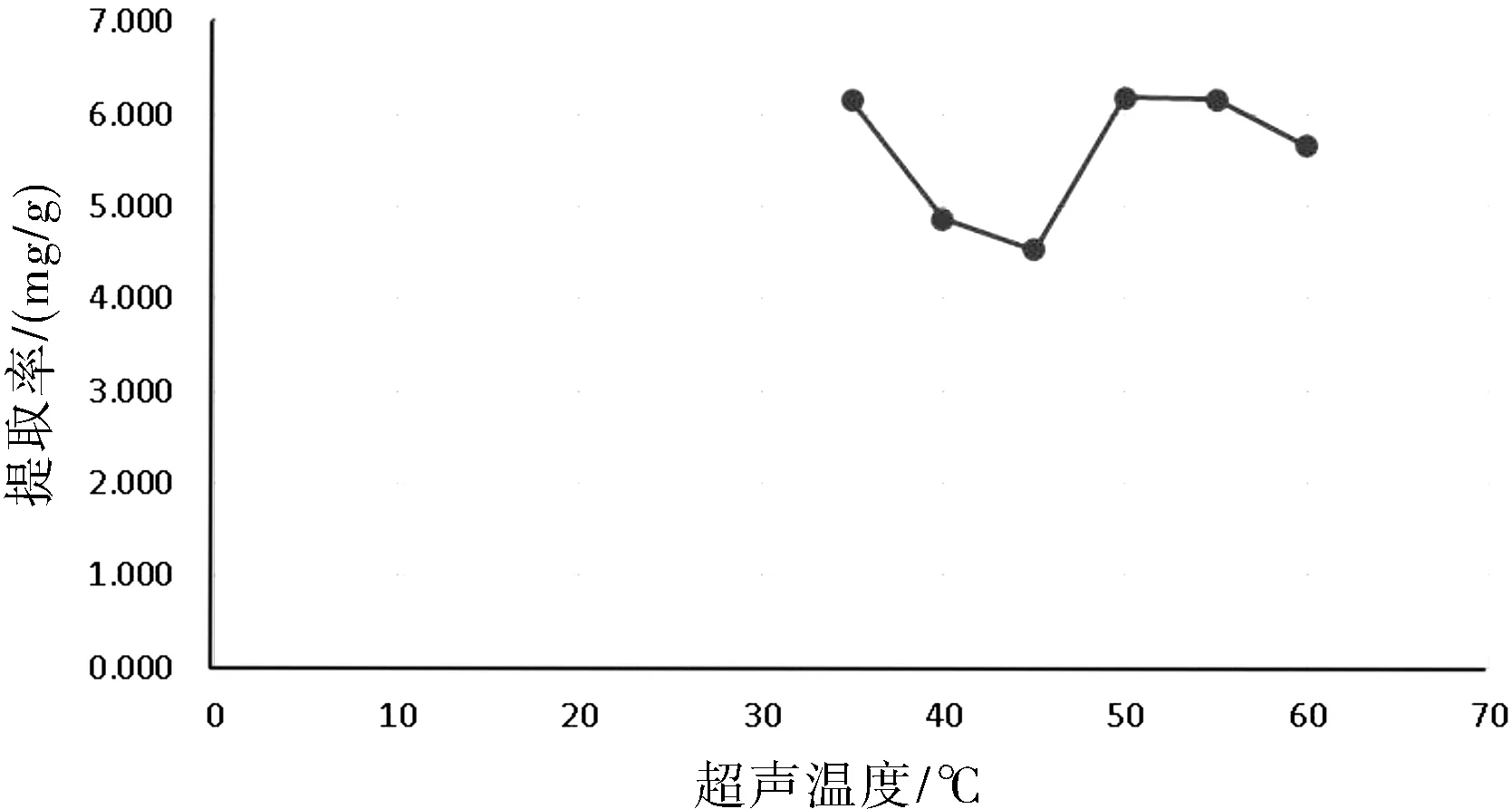
图3 超声温度对提取的影响Fig.3 Influence of ultrasonic temperature on extraction
3.1.3 提取时间结果显示
时间越长,总黄酮提取率越高,但相差不大,且后续考虑提取次数因素,所以提取时间定为20 min,详见图4所示。
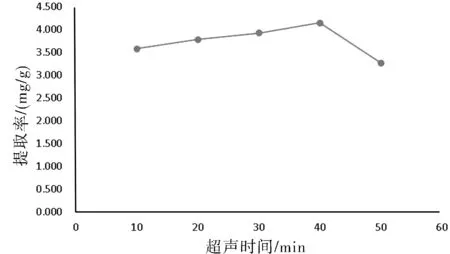
图4 超声时间对提取的影响Fig.4 Influence of ultrasonic time on extraction
3.1.4 醇浓度结果显示
60%乙醇浓度总黄酮提取率最高,70%,80%相对较高,详见图5所示。
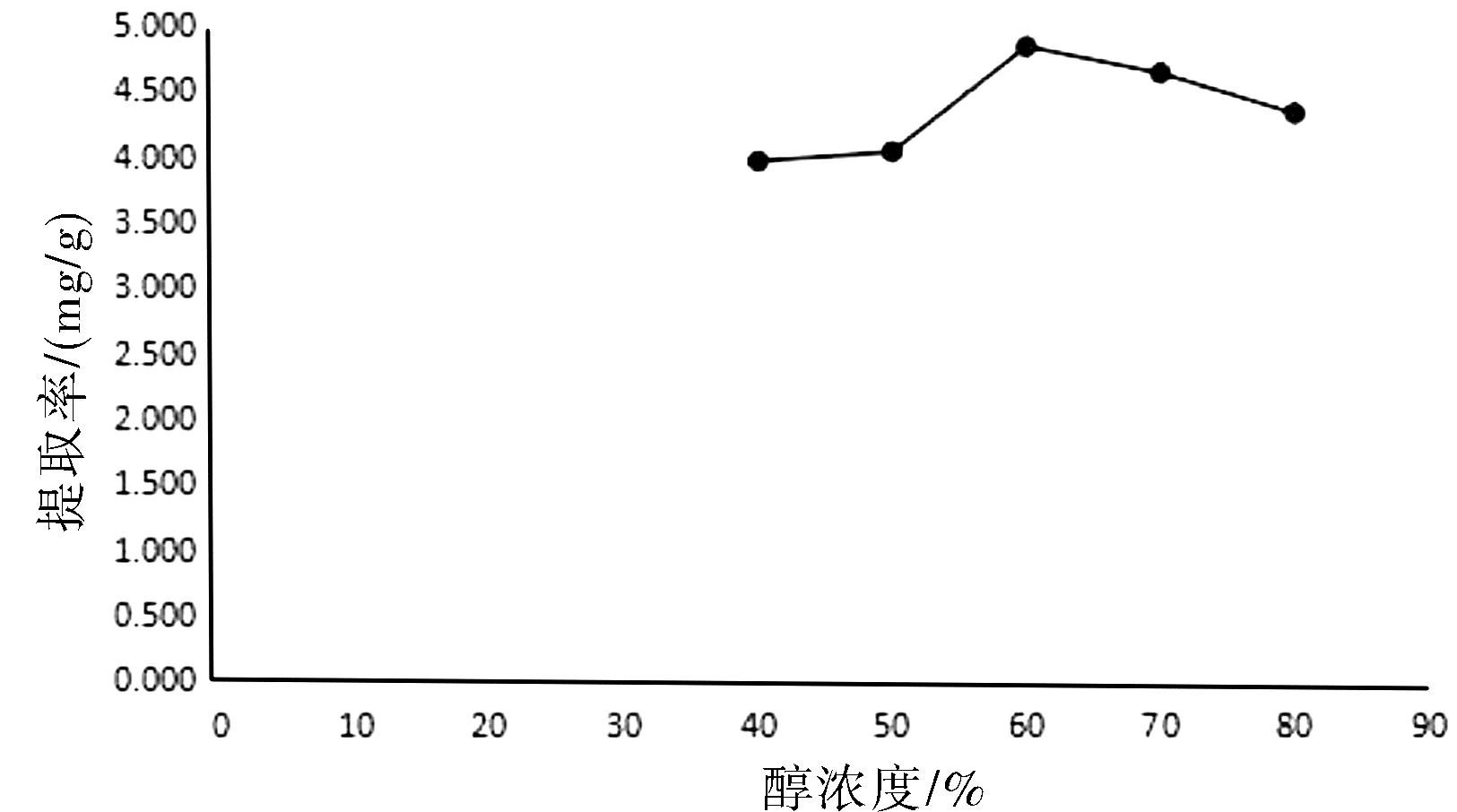
图5 醇浓度对提取的影响Fig.5 Influence of alcohol concentration on extraction
3.1.5 料液比结果显示
紫花地丁总黄酮提取率与液料比程正相关性,在20倍最高,详见图6所示。
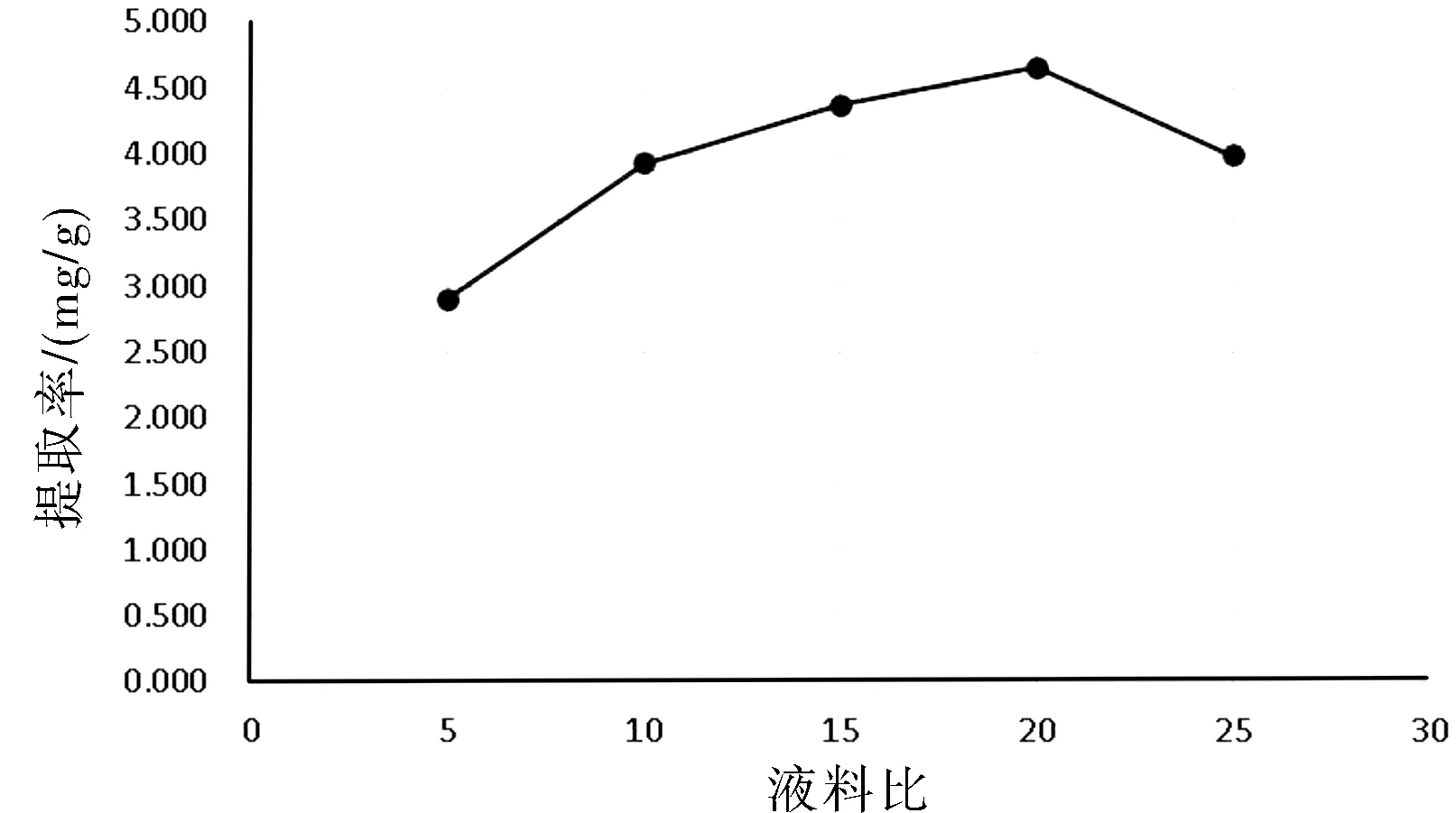
图6 液料比对提取的影响Fig.6 Influence of liquid to material ratio on extraction
3.1.6 酶用量结果显示
紫花地丁总黄酮在5 mL酶用量最高,且10 mL,15 mL,20 mL结果影响不大,证明在5 mL用量下能达到辅助超声效果。详见图7所示。
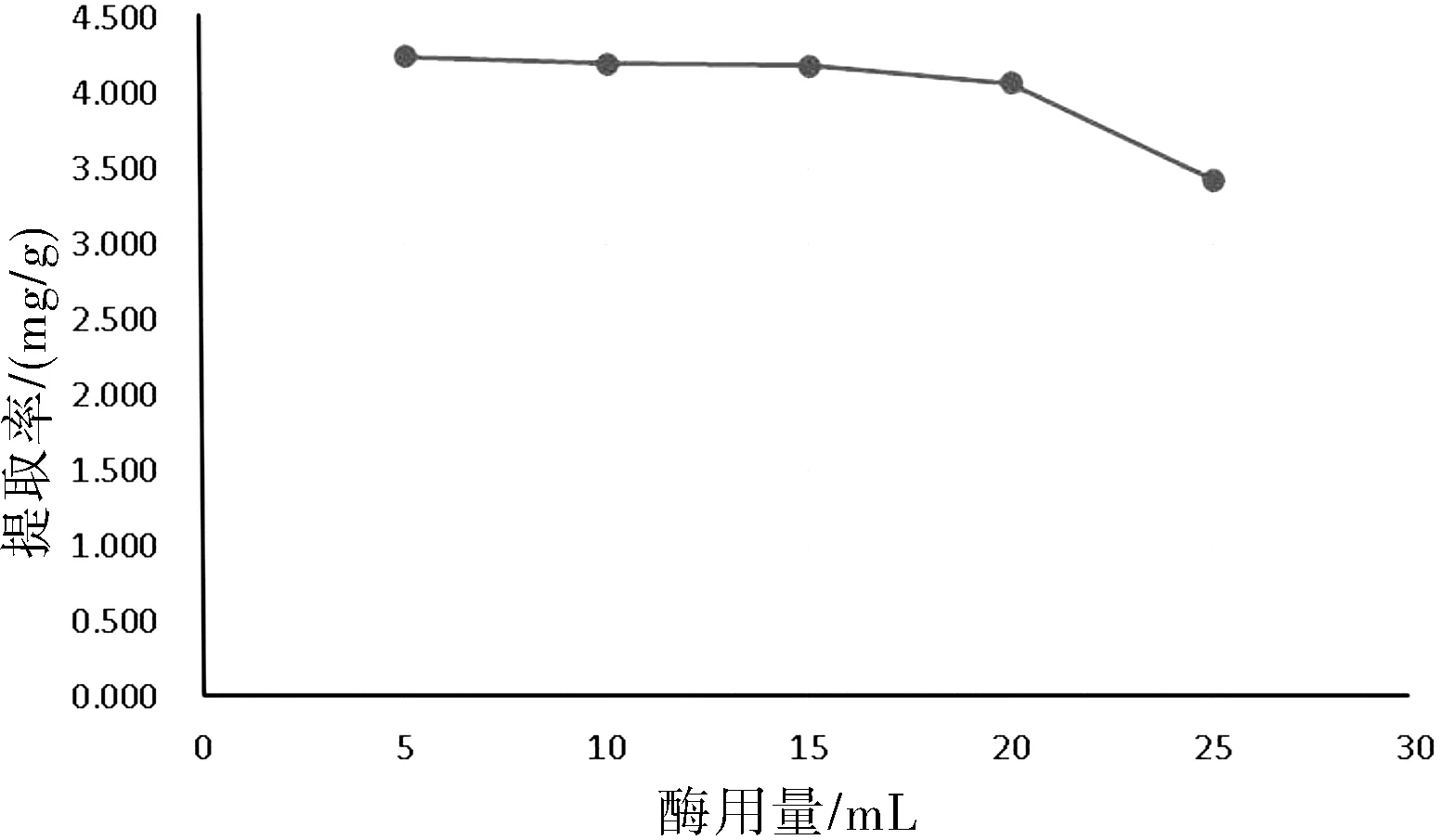
图7 酶用量对提取的影响Fig.7 Influence of enzyme dosage on extraction
3.2 正交实验结果
紫花地丁总黄酮正交设计提取结果详见表3所示。直观分析四个影响因素大小顺序为D>B>A>C;其中A3>A2>A1;B1>B2>B3;C3>C1>C2;D3>D2>D1;方差分析结果显示:提取次数(D)有**显著性,为显著因素;因此综合分析得到紫花地丁总黄酮酶解超声提取方案应为D3B1A3C3,即80%乙醇,酶用量2.5 mL,料液比1:10,提取3次。
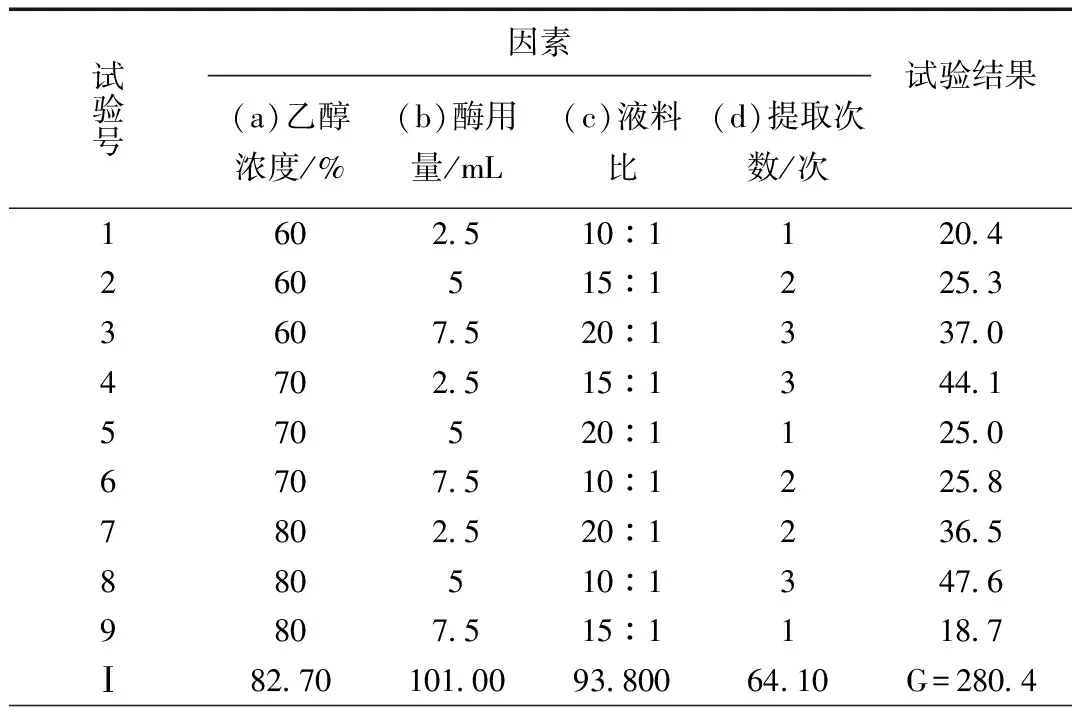
表3 紫花地丁总黄酮正交实验结果Table 3 Results of orthogonal experiment of total flavonoids of Rhoditin
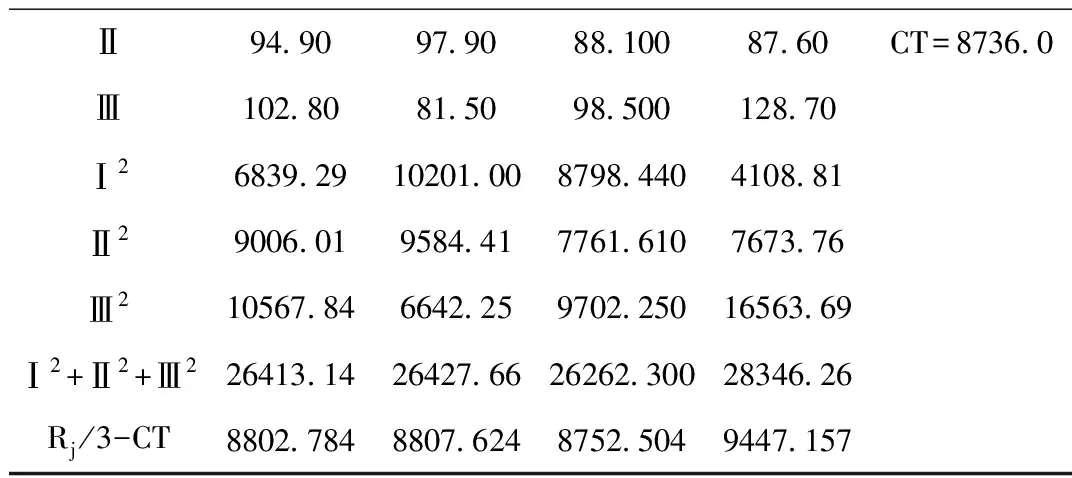
续表3
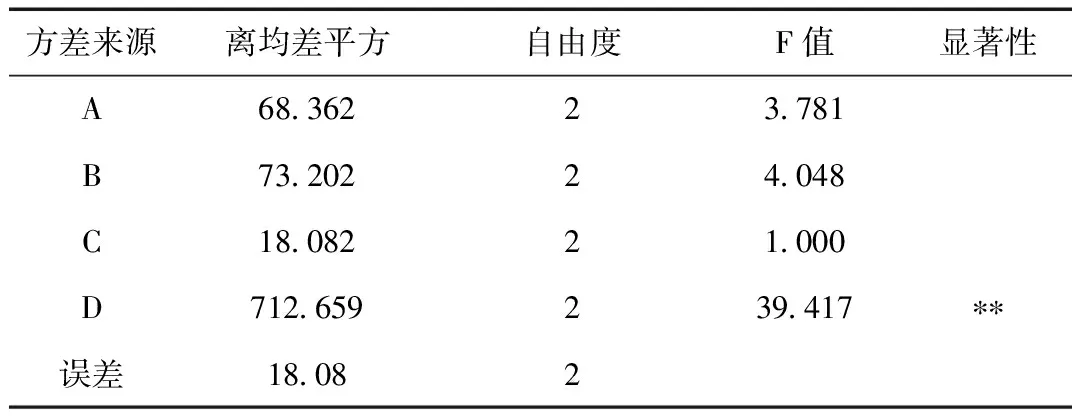
表4 总黄酮显著性检验Table 4 Significance test of total flavonoids
3.3 验证性试验结果
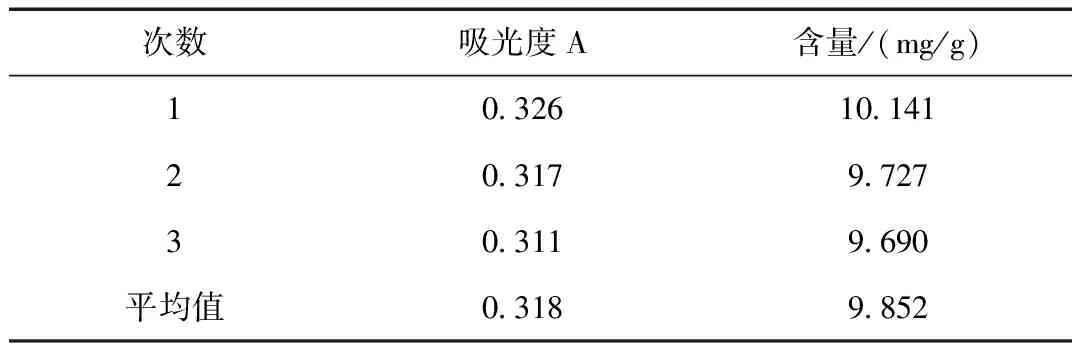
表5 验证实验结果Table 5 Verifies the experimental results
采用正交试验优化出的最佳提取方法,平行提取三次样品,按照标准曲线显色方法,λ=501 nm处测定吸光度,计算总黄酮含量,得紫花地丁总黄酮提取率为9.852 mg/g,均高于正交实验9次结果。
4 结 论
紫花地丁总黄酮的酶解-辅助超声提取法,初次提取率比普通超声提取法提高89.4%,证明酶解-辅助超声提取紫花地丁总黄酮的科学性。其中单因素考察实验证明醇浓度、酶用量、液料比、提取次数对该方法影响较大,通过四因素三水平正交实验优选得出:最佳酶解-辅助超声提取紫花地丁总黄酮工艺为:80%乙醇,酶用量2.5 mL,料液比1:20,提取3次;该工艺重现性好,提取率高,适合紫花地丁总黄酮提取。

