雨生红球藻虾青素纳米颗粒的制备及稳定性研究
袁巧月,吴 梵,王孝治,赵 轩,,崔 莉,罗海波,陶明煊,刘 琛,,郭宇星,
(1.南京师范大学食品与制药工程学院,江苏南京 210023;2.江苏省农业科学院农产品加工研究所,江苏南京 210014)
虾青素(3,3’-二羟基-4,4’-二酮-β,β’胡萝卜素,astaxanthin)是一种类胡萝卜素[1],属于萜烯类不饱和化合物,是在自然界有机体中发现的抗氧化能力极强的物质[2]。雨生红球藻(Haematococcus pluvialis)是一种新资源食品,被公认为天然虾青素最好的生物来源,受到人们越来越多的关注[3]。然而其具有较厚的细胞壁,对机械和化学物质都具有极强的抵抗力,阻碍了虾青素的提取,因此常采用生物酶法对雨生红球藻进行破壁处理来提取虾青素[4]。蜗牛酶作为一种包含果胶酶、纤维素酶、淀粉酶、蛋白酶等多种酶的混合酶,可用于酵母和雨生红球藻的破壁研究[5]。
虾青素具有极强的抗氧化性,在光和热等条件下不稳定且不溶于水,为了提高虾青素在食品中的稳定性和生物利用度,常通过乳液[6]、脂质体[7]、微囊化[8]和纳米颗粒[9]等技术对虾青素进行包埋处理。食品级蛋白质因其具有天然来源、无毒且高营养价值的特点,在提高脂溶性活性物质的生物利用度方面得到广泛的应用,如玉米醇溶蛋白[10]、β-乳球蛋白[11]、酪蛋白[12]等。乳脂肪球膜的各组分具有两亲性,可用来作为天然的乳化剂,主要成分为特异性膜蛋白和磷脂,其中蛋白质含量在25%~70%,主要的乳脂肪球膜蛋白包括有嗜乳脂蛋白、黏液素、黄嘌呤氧化还原酶、乳凝集素等[13]。然而,由单一蛋白质制成的纳米颗粒封装通常不稳定,在胃肠消化中会被蛋白酶降解,破坏纳米颗粒结构,因此蛋白质基通常需要涂上一层其他化合物,以提高稳定性和封装效率,大多情况下会与多糖复合以达到更佳效果[14]。阿拉伯胶作为一种两亲性多糖[15],是一种携带羧基的弱聚电解质,可以通过静电相互作用与带正电的粒子交联,因其较高的溶解性和较低的黏度,易与大分子间粘合,故常被用作食品乳化剂和稳定剂。乳脂肪球膜蛋白的分子量为48~225 kDa,高于β-乳球蛋白和酪蛋白,高分子量蛋白质比低分子量蛋白质具有更高的覆盖率,这可以提高运载体系的稳定性[16]。此外,乳脂肪球膜被认为是制备富含β-胡萝卜素的O/W 乳液的理想材料[17]。
基于此,本研究通过蜗牛酶对雨生红球藻进行酶解破壁提取虾青素,并以富含乳脂肪球膜的乳清蛋白粉与阿拉伯胶制备虾青素纳米颗粒,选择最佳的pH、蛋白与阿拉伯胶质量比以及虾青素添加浓度;通过虾青素纳米颗粒的傅里叶红外光谱分析和贮藏稳定性,探究该纳米颗粒的性质,为虾青素在食品、药品等领域的应用提供一定的参考价值。
1 材料与方法
1.1 材料与仪器
虾青素标准品 Sigma 公司;雨生红球藻粉(虾青素含量4%)昆明白鸥微藻技术有限公司;蜗牛酶(含有纤维素酶、果胶酶、蛋白酶等20 多种酶)生工生物工程(上海)股份有限公司;无水乙醇 南京化学试剂股份有限公司;乳清蛋白粉(富含乳脂肪球膜)美国Hilmar 公司;阿拉伯胶 上海麦克林生化科技有限公司;所有试剂均为分析纯。
Zetasizer Nano-ZS 纳米粒度及电位仪 英国马尔文公司;GL-22M 型高速冷冻离心机 上海赵迪生物科技有限公司;MCFD5005 型真空冷冻干燥机上海优浦科学仪器有限公司;电热恒温水浴锅 上海新苗医疗器械有限公司;Nexus 670 型傅里叶变换红外光谱 美国尼高力公司。
1.2 实验方法
1.2.1 雨生红球藻虾青素的酶法提取工艺 参考张晔等[18]和Duan 等[19]的方法,稍加修改。按2%(w/v)称取一定量雨生红球藻粉至0.2 mol/L 乙酸-乙酸钠缓冲溶液中,调节pH 至6.0,加入0.4 mg/mL 的蜗牛酶于35 ℃下酶解反应4 h,结束后进行75 ℃灭酶处理5 min[20],取酶解后的残渣按0.5%(w/v)加入无水乙醇,在50 ℃水浴锅中提取1 h,收集上清液,重复操作直至上清液澄清,用0.45 μm 针头式过滤器过滤备用[21]。
1.2.2 虾青素纳米颗粒的制备
1.2.2.1 pH 的选择 参照Liu 等[22]的方法,将蛋白粉溶于超纯水制备1 mg/mL 的溶液,500 r/min 于25 ℃搅拌30 min 后,用1.0 mol/L 的HCl 调节pH 至4,继续搅拌60 min。加入阿拉伯胶使得体系终浓度为1.5 mg/mL,以500 r/min 搅拌60 min。将体系的pH 调至2~7 之间(2、2.5、3、3.5、4、4.5、5、6、7)[23],继续搅拌2 h,置于4 ℃冰箱过夜,以确保充分水化。使用马尔文Nano-ZS 电位及纳米粒度分析仪在25 ℃测定各体系的Zeta 电位值[24]。
在固定壁材总浓度为0.15%,蛋白与阿拉伯胶质量比为2:1,虾青素添加浓度为60 μmol/L 的情况下,调节体系的pH 至2.5、3.0、3.5、4.0 和4.5,继续搅拌2 h。参考Huang 等[25]的方法,取36 mg 虾青素冻干品溶于360 μL 食品级乙醇中,得到0.1 g/mL的虾青素-乙醇母液,将其分散到上述各体系以获得虾青素终浓度为60 μmol/L 的分散体,涡旋5 min 后避光搅拌60 min,测定包封率。
1.2.2.2 壁材比例的选择 在固定壁材总浓度为0.15%,pH 为4.0,虾青素添加量为60 μmol/L 的情况下,参照牛付阁[26]的方法,考察不同的蛋白与阿拉伯胶质量比(1:4、1:2、1:1、2:1 和4:1)对虾青素包埋效果的影响。
1.2.2.3 虾青素浓度的选择 在固定壁材总浓度为0.15%,pH 为4.0,蛋白与阿拉伯胶质量比为2:1 的情况下,考察虾青素的不同添加量(20、40、60、80 和100 μmol/L)对虾青素包埋效果的影响[22,25]。
1.2.2.4 虾青素包封率的测定 根据Hu 等[27]的方法,稍作修改。将1.0 mL 纳米颗粒与1.0 mL 无水乙醇混合后,以10000 ×g 离心10 min,收集上清液,重复操作至上清液呈无色。其中,游离虾青素含量是指上清液中未结合的虾青素含量,将收集的上清液合并,用紫外可见分光光度计于476 nm 处测量吸光度,并根据标准曲线回归方程(y=0.1051x+0.1038,R2=0.9963)计算虾青素的含量。包封率按下列公式计算。

1.2.3 雨生红球藻虾青素纳米颗粒的性质研究
1.2.3.1 傅里叶红外光谱 根据Zhang 等[28]的方法,稍作修改。取1 mg 虾青素纳米颗粒冻干品放置于玛瑙研钵中,加入100 mg 的干燥溴化钾粉末,均匀研磨后,压制成透明的样品片,累计扫描32 次,仪器分辨率为4 cm-1,光谱扫描范围为4000~500 cm-1。
1.2.3.2 贮藏稳定性 在已优化的条件下制备虾青素纳米分散体,将其放置于4、25 和37 ℃环境下避光保存[29],分别在0、5、10 和15 d 时测量其粒径、Zeta 电位、虾青素保留率和DPPH 清除能力。
1.2.3.3 粒径和Zeta 电位的测定 按照方法1.2.2.1进行。
1.2.3.4 虾青素保留率的测定 参照谢灏婷[30]的方法,稍作修改。取1 mL 纳米颗粒溶液置于离心管中,加入5 mL 无水乙醇,旋涡振荡器振荡60 s,以充分萃取颗粒内的虾青素,振荡结束后10000×g 离心10 min,收集上清液,重复操作至上清液呈无色,在476 nm 处测量吸光度。虾青素保留率按下列公式计算。
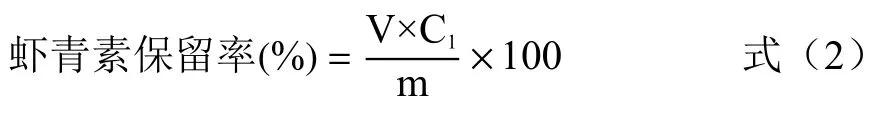
式中:V 表示上清液合并后的体积,mL;C1表示虾青素浓度,μg/mL;m 表示所用的虾青素质量,mg。
1.2.3.5 DPPH 自由基清除能力的测定 实验组为200 μL 虾青素纳米颗粒与800 μL 的0.2 mmol/L DPPH 混合,暗处反应30 min 后于517 nm 测定吸光值;空白对照组为无水乙醇溶液代替DPPH,对照组为200 μL 无水乙醇与800 μL DPPH 混合测定的吸光值[31]。
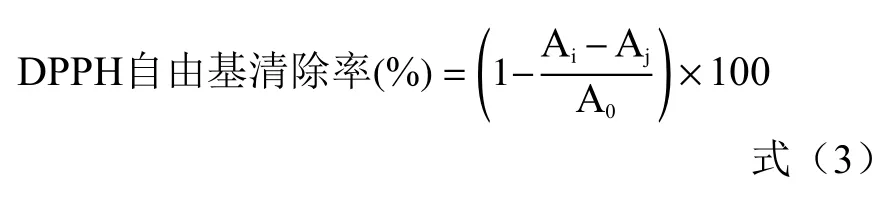
式中:Ai表示实验组吸光值;Aj表示空白组吸光值;A0表示对照组吸光值。
1.3 数据处理
采用SPSS 26 软件对实验数据进行ANOVA和Duncan 分析,通过Origin 8.0、Design Eepert 8.0.6和Graphpad 8.0 做图,实验结果以平均值±标准差表示。
2 结果与分析
2.1 雨生红球藻虾青素纳米颗粒制备工艺研究
2.1.1 纳米颗粒pH 的选择 通过考察体系的Zeta电位,分析蛋白质和多糖复合凝聚的作用力。如图1所示,当pH 从7.0 降至2.0 时,蛋白质的电位值从-32.03±0.09 mV 增加到+17.27± 0.14 mV,当pH 小于4.5 时,蛋白质所带电荷由负转正。单一的阿拉伯胶溶液也表现出相似的趋势,在降到pH2.1 时开始由负转正,这可能是因为pH 在低于阿拉伯胶侧链基团的解离常数时,侧链上的羧基基团被质子化而带有部分正电荷[26]。当蛋白与阿拉伯胶带相反电荷时,两者之间才有可能发生复凝聚反应,随着溶液pH 降低,蛋白多糖复合体系的电位值持续变大,经静电相互作用而发生复合凝聚。因此,制备虾青素纳米颗粒的最佳pH 范围应在2.5~4.5 之间。
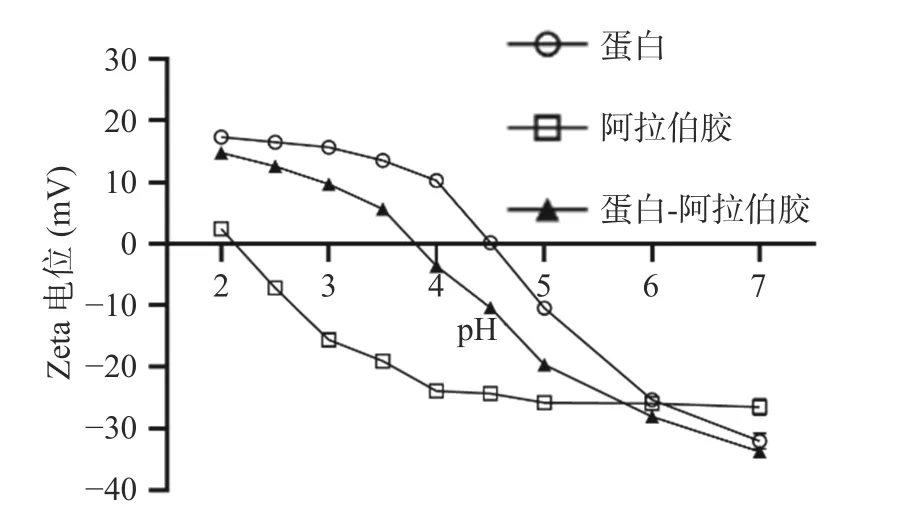
图1 蛋白、阿拉伯胶及复合体系的Zeta 电位随pH变化的情况Fig.1 Variation of Zeta potential of proteins,gum arabic and composite systems with pH
如图2 所示,不同pH 条件下的虾青素纳米颗粒包封率不同,在pH 为2.5~4.0 之间,包封率随pH 的增加而增加,这是因为阿拉伯胶带有较多的负电荷,蛋白的正电荷减少,两者能够很好地交联,当pH 为4.0 时,虾青素包封率高达92.93%±0.19%。随着pH继续增加至4.5 时,蛋白到达等电点,与带负电荷的阿拉伯胶交联程度不够,因而包封率降低。周庆新等[32]在探究pH 对虾青素酯包埋率的影响时,也确定pH4.0 为制备虾青素酯微胶囊的最佳条件。本文的研究结果与暴莎莎[33]在研究不同pH 对南极磷虾油微胶囊的形成和产率影响类似。所以,pH4.0 为虾青素纳米颗粒的最佳制备条件。
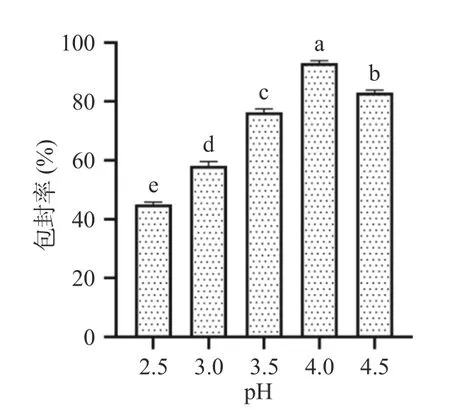
图2 不同pH 对虾青素包封率的影响Fig.2 Effect of different pH values on the encapsulation rate of astaxanthin
2.1.2 纳米颗粒壁材比例的选择 由图3 可看出,蛋白与阿拉伯胶的配比对虾青素包封率存在较大影响。从数据上来看,当蛋白与阿拉伯胶质量比从1:4增加至2:1 时,虾青素包封率由74.61%±0.25%增至92.93%±0.19%,而继续增加蛋白用量时,包封率开始呈现负相关,下降至81.40%±0.92%。这种变化是体系中阿拉伯胶的数量减少,阿拉伯胶糖链被蛋白饱和吸附,从而导致虾青素包封率降低。谢灏婷[30]发现了增大薏米醇溶蛋白与阿拉伯胶配比,虾青素包封率先增大后减小,这与本文的研究类似。所以最佳的蛋白与阿拉伯胶配比为2:1。
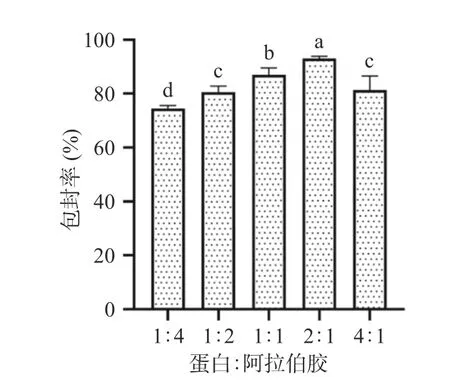
图3 不同蛋白与阿拉伯胶质量比对虾青素包封率的影响Fig.3 Effect of protein to gum arabic mass ratios values on the encapsulation rate of astaxanthin
2.1.3 纳米颗粒虾青素浓度的选择 由图4 可知,当固定其他因素不变,随着虾青素的投入量增加,包封率先增大后减小。当虾青素浓度为20 μmol/L 增加至60 μmol/L 时,包封率从64.87%±0.22%增加至92.93%±0.19%,而当继续增加虾青素投入量时,蛋白与阿拉伯胶分子和虾青素的结合已经饱和,超过了一定的负荷,降低了虾青素的包封率。胡方斌[34]在研究虾青素浓度对虾青素PLGA 纳米粒制备的影响时,也发现了虾青素浓度与包封率大小先成正相关而后呈负相关。因此,本文选择60 μmol/L 的浓度制备虾青素纳米颗粒。综上,虾青素纳米颗粒的最佳制备条件是:pH 为4.0,乳清蛋白与阿拉伯胶质量比为2:1,虾青素添加浓度为60 μmol/L。
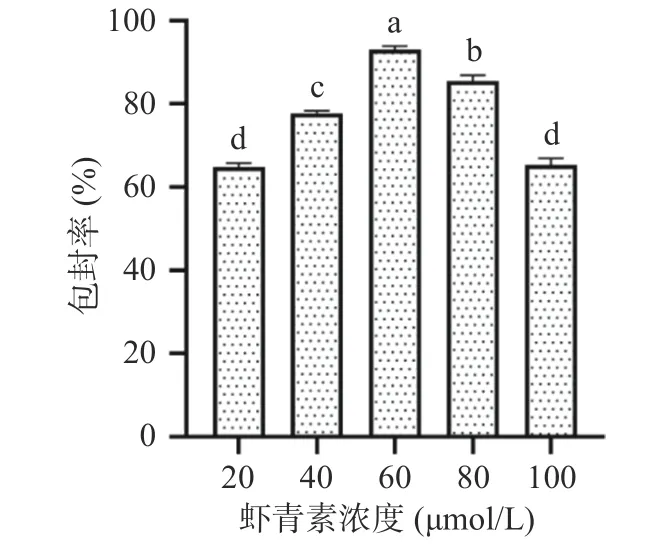
图4 不同虾青素浓度对虾青素包封率的影响Fig.4 Effect of different astaxanthin concentrations on the encapsulation rate of astaxanthin
2.2 雨生红球藻虾青素纳米颗粒的性质研究
2.2.1 雨生红球藻虾青素纳米颗粒的性质 在2.1的最佳条件下制备的虾青素纳米颗粒,粒径为265.71±0.55 nm,电位为-13.44±0.14 mV,包封率高达92.93%±0.19%。如图5 所示,虾青素在水中的溶解性得到明显改善。

图5 虾青素纳米颗粒在水中的溶解Fig.5 Dissolution of astaxanthin nanoparticles in water
2.2.2 傅里叶红外光谱分析 虾青素的FTIR 透射光谱及其特征峰与先前文献的报道基本一致[35]。由图6 可知,虾青素有以下特征峰[34,36]:O-H 伸缩振动吸收峰(3434 cm-1)、-CH3伸缩振动峰(2922 cm-1)、C=O 伸缩振动峰(1648 cm-1)、C=C 伸缩振动峰(1551 cm-1)和C-H 疏水性伸缩振动峰(976 cm-1)。虾青素与壁材混合制备虾青素纳米颗粒后,虾青素在976 cm-1处的吸收峰没有显现出来,而在3434、2922、1648 和1551 cm-1处的吸收峰发生了转移,表明虾青素在被包埋后O-H、-CH3、C=O 和C=C 的伸缩振动受到了限制,虾青素与壁材之间通过氢键和疏水作用相互结合,并有效包封在此基质中。樊永康[36]在研究糖基化酪蛋白包封槲皮素时也发现了类似的结果。
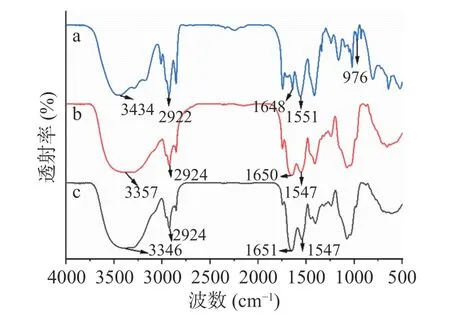
图6 虾青素(a)、壁材(b)和虾青素纳米颗粒(c)的FTIR 光谱图Fig.6 FTIR spectrum of astaxanthin (a),wall material (b) and astaxanthin nanoparticles (c)
2.2.3 虾青素纳米颗粒的贮藏稳定性 如图7A 所示,新鲜制备的虾青素纳米颗粒的粒径为265.71±0.55 nm,在贮藏15 d 内,体系的平均粒径随贮藏时间的延长而增大。15 d 时,4、25 和37 ℃条件下贮藏的纳米颗粒粒径分别为:283.82±0.51、291.68±0.78和301.14±0.69 nm,差异显著(P<0.05)。体系粒径在37 ℃贮藏条件下增幅最大,为13.1%,这可能是因为较高温度下颗粒碰撞几率增大而导致的体系平均粒径增加。在4 ℃条件下,虾青素纳米颗粒表现出更好的贮藏稳定性,粒径增幅仅为6.1%。Hou 等[37]的研究也证实了乳清蛋白基人参皂苷Rg3 纳米乳液在贮藏期间内粒径变大,以4 ℃贮藏温度增幅最小。
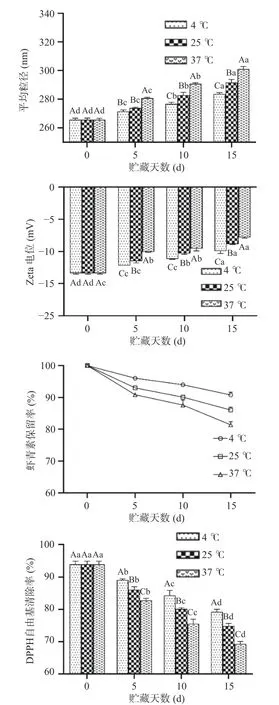
图7 虾青素纳米颗粒贮藏期间的粒径(A)、Zeta 电位(B)、虾青素保留率(C)和DPPH 自由基清除率(D)Fig.7 Particle size (A),Zeta potential (B),astaxanthin retention (C) and DPPH free radical clearance (D) of astaxanthin nanoparticles during storage
如图7B 所示,新鲜制备的虾青素纳米颗粒的电位为-13.44±0.14 mV,在贮藏15 d 内,体系的电位绝对值随贮藏时间的延长而降低,表明贮藏期间内体系静电荷减少,这可能是由于阿拉伯胶少量脱落导致的[30]。如图7C 所示,虾青素保留率随贮藏时间的延长而降低,但在15 d 内,4、25 和37 ℃不同的温度下,虾青素保留率均在80%以上,表明壁材对虾青素具有较好的包封作用,其中,以4 ℃的保留率最高,为90.78%±0.25%,这与Boonlao 等[29]在研究不同温度下虾青素乳液中虾青素保留率的结果类似。由图7D 可知,虾青素纳米颗粒的DPPH 自由基清除能力随贮藏时间的延长而降低,这是由于贮藏期间内虾青素发生降解,保留率降低,进而导致体系的抗氧化能力减弱,4、25 和37 ℃条件下贮藏15 d 时,体系的DPPH 自由基清除能力分别为79.31%±0.18%、74.82%±0.20%和69.34%±0.21%。综上可见,在15 d的贮藏期内,虾青素纳米颗粒能够保持均匀分散,温度越高引起的粒径增幅越大,Zeta 电位的绝对值降低越快,进而导致虾青素保留率降低,体系的DPPH自由基清除能力降低。而4 ℃低温贮藏对纳米颗粒的粒径、电位、虾青素保留率及DPPH 自由基清除能力影响最小,能够更好地保证虾青素纳米颗粒的稳定。
3 结论
本实验利用蜗牛酶水解提取雨生红球藻虾青素,并使用富含乳脂肪球膜的乳清蛋白粉与阿拉伯胶共同制备虾青素纳米颗粒,通过对pH、蛋白与阿拉伯胶质量比以及虾青素添加浓度的选择,获得稳定性强的虾青素纳米颗粒,包封率高达92.93%±0.19%。经傅里叶红外光谱分析表明虾青素与壁材之间通过氢键和疏水作用相互结合,且虾青素有效地包封在壁材内。在4 ℃条件下贮藏15 d,虾青素保留率高达90.78%±0.25%。因此,基于富含乳脂肪球膜的乳清蛋白与阿拉伯胶制备的雨生红球藻虾青素纳米颗粒有助于改善虾青素的稳定性,有助于虾青素在水中溶解,并进一步拓展虾青素在食品、医药和化妆品等领域中的应用。

